- ホーム >
- 政策について >
- 分野別の政策一覧 >
- 健康・医療 >
- 健康 >
- 感染症情報 >
- 新型コロナウイルス感染症について >
- 新型コロナワクチンについて >
- 新型コロナワクチンQ&A【2024年3月時点】
新型コロナワクチンQ&A
【2024年3月時点】
カテゴリー
- オミクロン株対応ワクチン
- 乳幼児接種
(生後6か月~5歳) - 追加接種
- 小児接種
(5~11歳) - ワクチンの仕組み
- ワクチンの効果
- ワクチンの安全性と副反応
- 私は接種できますか?
- 接種の見通し
- 接種を受ける方法
- 接種の対象など
- 接種後の生活
- その他
- これは本当ですか?
- アーカイブ
本ページは、令和6年(2024年)3月31日までの新型コロナウイルス感染症に係るよくある質問を参考としてまとめたページです。令和6年(2024年)4月1日以降は、新型コロナウイルス感染症に係る接種は定期接種に位置づけられていますので、最新の情報については「新型コロナワクチンQ&A」をごらんください。
オミクロン株対応ワクチン【2024年3月時点】
- 初回(1回目・2回目)接種や小児(5~11歳)、乳幼児(生後6か月~5歳)の接種でもオミクロン株対応1価ワクチンが使用できるのですか。
- なぜ、オミクロン株対応1価ワクチンの接種が必要なのですか。
- オミクロン株対応1価ワクチンとは、どのようなワクチンですか。
- オミクロン株対応1価ワクチンの接種にはどのような効果がありますか。
- 令和5年(2023年)秋以降の接種では、ワクチンの種類は変わるのですか。
- オミクロン株対応1価ワクチンの接種は、どのような人が対象になりますか。
- 海外ではオミクロン株対応ワクチンの接種が行われているのでしょうか。
- 新型コロナワクチンの接種を受ける場合、令和4年(2022年)度に配布された接種券は、令和5年(2023年)度の接種でも使えますか。
- オミクロン株対応1価ワクチンにはどのような副反応がありますか。
- オミクロン株対応ワクチンは、インフルエンザワクチンなどほかのワクチンと同時に接種できるのですか。
- オミクロン株対応1価ワクチンの接種が始まってからも、従来ワクチン(1価)による接種はできるのですか。
- オミクロン株対応1価ワクチン(XBB.1.5)は、EG.5.1系統に対して効果がありますか。
乳幼児接種(生後6か月~5歳)【2024年3月時点】
- なぜ、乳幼児(生後6か月~5歳)の接種が必要なのですか。
- 乳幼児(生後6か月~5歳)の接種では、どのような効果がありますか。
- 乳幼児で接種する量や回数、接種間隔は、成人や小児(5~11歳)と同じですか。
- 乳幼児(生後6か月~5歳)の接種にはどのような副反応がありますか。
- 乳幼児(生後6か月~5歳)がワクチン接種後に発熱しました。対応は小児(5~11歳)や成人の場合と同じでよいのでしょうか。
- 乳幼児(生後6か月~5歳)の接種時に必要なものはありますか。
- 海外では乳幼児(生後6か月~5歳)の接種が行われていますか。
- 初回接種の規定の回数を終える前に、対象年齢を超えて誕生日を迎えました。どうしたらよいでしょうか。
- 乳幼児(生後6か月~5歳)の接種に向けて、保護者が気を付けることはありますか。
- 接種した当日や翌日は、幼稚園や幼保連携型認定こども園を休んでも大丈夫でしょうか。
- 接種後に子ども(生後6か月~5歳)が副反応等で体調を崩した場合、保護者は仕事を休んでも大丈夫でしょうか。
- ワクチンの接種会場は小児(5~11歳)、あるいは成人と同じでしょうか。
- 乳幼児(生後6か月~5歳)の接種には「努力義務」は適用されているのでしょうか。
- 乳幼児(生後6か月~5歳)の接種について、インフルエンザワクチンなどほかのワクチンと同時に打つことはできるのでしょうか。
追加接種【2024年3月時点】
- 現在、追加接種としてどのようなワクチンを受けられるのですか。どれを接種するのがよいのですか。
- 追加接種は、前回の接種からどのくらい間隔をあけたら受けることができますか。
- 追加接種では、どのワクチンが使用されますか。これまでの接種とは異なるワクチンを使用(交互接種)しても大丈夫でしょうか。
- 追加接種は無料で受けられますか。
- 初回(1回目・2回目)接種を海外で受けました。日本で追加接種は受けられますか。
- 引っ越しをしました。接種券は現在住んでいる自治体から送付されますか。
- 初回(1回目・2回目)接種がまだ受けられていません。いつまでワクチン接種を受けることができるのですか。
小児接種(5~11歳)【2024年3月時点】
- なぜ、小児(5~11歳)の追加(3回目)接種が必要なのですか。
- なぜ、小児(5~11歳)の接種が必要なのですか。
- 小児(5~11歳)の接種では、どのような効果がありますか。
- 小児で接種する量や回数、接種間隔は成人と同じですか。
- 小児(5~11歳)の接種にはどのような副反応がありますか。
- 子どもがワクチン接種後に発熱しました。対応は成人の場合と同じでよいでしょうか。
- 小児の接種時に必要なものはありますか。
- 海外では小児(5~11歳)の接種が行われていますか。
- 1回目の接種後、2回目の接種前に12歳の誕生日がきました。どうしたらよいでしょうか。
- 小児(5~11歳)の接種に向けて、保護者が気を付けることはありますか。
- 接種した当日や翌日は学校(幼稚園を含む)等を休んでも大丈夫でしょうか。
- 接種後に子どもが副反応等で体調を崩した場合、保護者は仕事を休んでも大丈夫でしょうか。
- 基礎疾患がある子どもに接種して大丈夫でしょうか。
- ワクチンの接種会場は成人と同じでしょうか。
- 小児(5~11歳)の接種に「努力義務」は適用されているのでしょうか。
ワクチンの仕組み【2024年3月時点】
- 予防接種とは何ですか。
- ワクチンにはどのようなものがあるのですか。
- 集団免疫とは何ですか。
- 筋肉注射とはどのような注射でしょうか。痛いのでしょうか。
- mRNA(メッセンジャーRNA)ワクチンやウイルスベクターワクチンは新しい仕組みのワクチンということですが、どこが既存のワクチンと違うのですか。
- 組換えタンパクワクチンとはどのようなワクチンですか。
ワクチンの効果【2024年3月時点】
- 日本で接種が進められている新型コロナワクチンにはどのような効果がありますか。
- 年齢によって、ワクチンの効果や副反応に違いはありますか。
- 基礎疾患(持病)の有無によって、ワクチンの効果や副反応に違いはありますか。
- ワクチン接種後に新型コロナウイルスに感染することはありますか。
- 変異株の新型コロナウイルスにも効果はありますか。
- 妊娠中にワクチンを接種した場合、生まれてくる新生児に免疫はつきますか。
ワクチンの安全性と副反応【2024年3月時点】
- ワクチンの安全性の確保のため、どのような取り組みをしていますか(審査の厳格性など)。
- これまでに認められている副反応にはどのようなものがありますか。
- 副反応は1回目の接種後より2回目の接種後の方が強いと言われるのはどうしてですか。
- ワクチンを受けた後の発熱や痛みに対し、市販の解熱鎮痛薬を飲んでもよいですか。
- ワクチンを接種して1週間くらい経ってから、腕にかゆみや痛み、腫れや熱感、赤みが出てきました。どうすればよいですか。
- ワクチン接種後に脇のリンパ節が腫れました。注意すべきことはありますか。
- アレルギー反応が心配されている、ポリエチレングリコール(PEG)やポリソルベートが含まれる医薬品にはどのようなものがありますか。
- アナフィラキシーではどのような症状が出ますか。治療法はありますか。
- 接種後の「失神」や、その原因ともいわれる「血管迷走神経反射」とは何ですか。
- ワクチン接種後にくも膜下出血や急性大動脈解離が起きたと聞いたのですが、ワクチンとの関連はあるのでしょうか。
- ワクチン接種後に血栓症が起きると聞いたのですが大丈夫でしょうか。
- ワクチンを接種すると心筋炎や心膜炎になる人がいるというのは本当ですか。
- ワクチン接種後に遷延する症状(いわゆる後遺症)が生じるのでしょうか。
- ワクチンを受けた後に熱が出たら、どうすればよいですか。
- 高齢者で一番多い副反応は何でしょうか。
- ワクチン接種後の副反応はどこに相談したらよいですか。
- 副反応による健康被害が起きた場合の補償はどうなっていますか。
- 接種後に起きた症状とワクチンとの因果関係の考え方について、副反応疑い報告制度と健康被害救済制度では、どうなっていますか。
私は接種できますか?【2024年3月時点】
- ワクチンを接種することができないのはどのような人ですか。
- ワクチンを接種するのに注意が必要なのはどのような人ですか。
- 私は基礎疾患(持病)を持っていますが、ワクチンを接種することはできますか。
- 海外では、アレルギーのある人は接種を受けていますか。アレルギーのある人は副反応が起きやすいのですか。
- 過去にアレルギー反応やアナフィラキシーを起こしたことがあり、今回も起こすのではないかと心配なのですが、接種を受けても大丈夫でしょうか。
- 私は過去に蜂に刺されたことがありますが、ワクチンを接種することはできますか。
- 薬を飲んでいる人はワクチンを接種することはできますか。
- 新型コロナウイルスに感染したことのある人は、ワクチンを接種することはできますか。
- 寝たきり(在宅介護)の人もワクチン接種は可能ですか。
接種の見通し【2024年3月時点】
接種を受ける方法【2024年3月時点】
- 新型コロナワクチンとインフルエンザワクチンの同時接種を受ける場合、2つのワクチンの間に、15分や30分といった間隔を空ける必要はありますか?
- 接種までの流れはどうなりますか。
- 接種費用はかかるのですか。
- 令和6年(2024年)4月以降の新型コロナワクチンの接種は有料となるのですか。
- 令和6年(2024年)3月31日までに新型コロナワクチンの初回接種を完了できない場合はどうなりますか。
- 住民票所在地以外での接種や、県外にある通院中の医療機関での接種は可能ですか。
- 住所が変更となり、住民票所在地が変更となった場合、接種券の再発行は可能でしょうか。
- 接種券に有効期限はありますか。ワクチン接種を一度見送りましたが、後日、接種を受けたいと考えています。
- 接種を受ける際の本人確認書類は、写し(コピー)でも可能ですか。
- 予診票の書き方が分からないときはどうすればよいですか。
- 接種するワクチンは選べますか。
- 1回目と2回目で異なる新型コロナワクチンを接種しても問題ないでしょうか。
- 「基礎疾患を有する者」に当てはまることを証明するために、診断書は必要ですか。
- 未成年の接種の場合、親の同意書は必要ですか。
- 認知症などで本人に接種意思を確認することができない場合、家族にて同意書を書いてもらってもよいですか。
- 2回目の接種は、1回目の接種と同じ施設で受ける必要はありますか。
- 1回目の接種後、2回目の接種を受ける前に住民票を異動させた場合、2回目の接種はどのようにすればよいですか。
- 新型コロナワクチンとそれ以外のワクチンは、同時に接種することはできますか。
接種の対象など【2024年3月時点】
接種後の生活【2024年3月時点】
- ワクチン接種後、生活上で注意することはありますか。
- ワクチンを接種した日は、車を運転できますか。
- ワクチンを接種した日は、お風呂に入れますか。
- ワクチンの接種前後に飲酒をしても問題ないでしょうか。
- ワクチンを接種した翌日は仕事を休んでも大丈夫でしょうか。
- ワクチンを接種した後も、マスクは必要ですか。
- 接種後に発熱した状態で人と会った場合、周りの人を感染させてしまうことはありますか。
- ワクチンを接種したことにより、効果が出たか(抗体ができたか)を確認するため、抗体検査を受ける必要はありますか。
- ワクチン接種後に献血をしても問題ないでしょうか。
その他【2024年3月時点】
- 今回のワクチン接種の「努力義務」とは何ですか。
- ワクチンについて相談したいとき、どこに相談すればよいですか。
- SNSやニュースでコロナワクチンが危険と取り上げられていて不安です。どの情報を信じたらいいのでしょうか。
- 新型コロナワクチンについて多言語対応の資料はありますか。
- ワクチンを接種する前にすでに免疫で守られている可能性はありますか。
- 免疫力はワクチン接種以外でも上げられますか。
- ワクチン接種の証明書は発行されますか。
- 接種済証に貼られたワクチンのシールで、ワクチンの「最終有効年月日」が接種日より前の日付になっていますが問題ないですか。
これは本当ですか?【2024年3月時点】
- mRNA(メッセンジャーRNA)ワクチンはワクチンとして遺伝情報を人体に投与するということで、将来の身体への異変や将来持つ予定の子どもへの影響を懸念しています。
- 新型コロナワクチンの接種が原因で多くの方が亡くなっているというのは本当ですか。
- ワクチンを接種することで不妊になるというのは本当ですか。
- 私は妊娠中・授乳中・妊娠を計画中ですが、ワクチンを接種することができますか。
- 新型コロナワクチン接種により月経への影響が生じるのは本当ですか。
- ワクチン接種で新型コロナウイルスに感染することはありますか。
- ワクチンを接種した人が変異株に感染すると重症化しやすい(抗体依存性感染増強(ADE)になりやすい)のは本当ですか。
- 通常の臨床試験(治験)のプロセスが省略されているのは本当ですか。
- 新型コロナワクチンの臨床試験(治験)が終わっていないというのは本当ですか。
- 新型コロナワクチンの動物実験で全ての動物が死んだというのは本当ですか。
アーカイブ
- 1・2回目の接種後、3回目の接種前に12歳の誕生日を迎えました。どうしたらよいでしょうか。※最終更新日:2023年11月1日
- 接種済証に貼られたワクチンのシールで、ワクチンの「最終有効年月日」が接種日より前の日付になっていますが問題ないですか。※最終更新日:2023年9月25日
- なぜ、オミクロン株対応2価ワクチンの接種が必要なのですか。※最終更新日:2023年9月20日
- オミクロン株対応2価ワクチンとは、どのようなワクチンですか。※最終更新日:2023年9月20日
- オミクロン株対応2価ワクチンの接種にはどのような効果がありますか。※最終更新日:2023年9月20日
- BA.1対応型ワクチンとBA.4-5対応型ワクチンは、どちらのほうが効果がありますか。どちらを接種したほうがよいのですか。※最終更新日:2023年9月20日
- 令和5年春開始接種で用いられているオミクロン株対応2価ワクチンは、現在流行しているXBB系統に対して効果がありますか。※最終更新日:2023年9月20日
- オミクロン株対応2価ワクチンの接種は、どのような人が対象になりますか。※最終更新日:2023年9月20日
- 初回接種にオミクロン株対応2価ワクチンを使用できるのですか。※最終更新日:2023年9月20日
- なぜ乳幼児(生後6か月~4歳)用のワクチンは、成人や小児(5~11歳)と違い、3回の接種で1セットになっているのですか。※最終更新日:2023年9月20日
- 従来ワクチン(1価)による追加(3回目)接種では、どのような副反応がありますか。2回目より重いのでしょうか。※最終更新日:2023年9月20日
- ファイザー社のワクチンは、通常、1回目から3週間後に2回目を接種することになっていますが、どのくらいずれても大丈夫ですか。※最終更新日:2023年9月20日
- オミクロン株対応2価ワクチンが追加接種のみで、初回(1・2回目)接種として使用されないのはなぜですか。※最終更新日:2023年8月7日
- 新たな変異株(XBB、BQ.1.1など)が出現したと報道されていますが、これらの変異株も含めて、BA.1対応型ワクチンとBA.4-5対応型ワクチンは効果がありますか。※最終更新日:2023年7月4日
- 従来ワクチン(1価)による追加(4回目)接種には、どのような効果がありますか。※最終更新日:2023年3月31日
- 従来ワクチン(1価)による追加(3回目)接種には、どのような効果がありますか。※最終更新日:2023年3月31日
- 海外在住者が日本でワクチン接種を受けるにはどうしたらよいでしょうか。※最終更新日:2023年3月31日
- 何歳になれば、従来ワクチン(1価)による追加(3回目)接種を受けられますか。※最終更新日:2023年2月9日
- モデルナ社のワクチンは、通常、1回目から4週間後に2回目を接種することになっていますが、どのくらいずれても大丈夫ですか。※最終更新日:2023年2月9日
- なぜ、従来の1価ワクチンによる追加(4回目)接種が必要とされたのですか。 ※最終更新日:2022年12月1日
- 従来ワクチン(1価)による追加(4回目)接種は、3回目接種からどのくらい間隔をあけたら接種できますか。 ※最終更新日:2022年11月30日
- 従来ワクチン(1価)による追加(3回目)接種は、どのような人が対象になりますか。 ※最終更新日:2022年11月30日
- どの会社のワクチンが一番効果がありますか。 ※最終更新日:2022年11月18日
- 従来ワクチン(1価)による追加(4回目)接種は、どのような人が対象になりますか。 ※最終更新日:2022年10月21日
- なぜ、従来ワクチン(1価)による追加(3回目)接種が必要とされたのですか。 ※最終更新日:2022年10月21日
- 従来ワクチン(1価)による接種について、オミクロン株にも追加(3回目)接種の効果はありますか。 ※最終更新日:2022年10月21日
- 追加(3回目)接種はどのようにしたら受けられますか。 ※最終更新日:2022年10月21日
- 海外ではどのような人に追加(4回目)接種が行われていますか。 ※最終更新日:2022年10月14日
- 海外ではどのくらい、従来ワクチン(1価)による追加(3回目)接種が行われているのでしょうか。 ※最終更新日:2022年10月14日
- ファイザー社のワクチンと、モデルナ社のワクチンの安全性には違いがありますか。 ※最終更新日:2022年10月14日
- 追加(4回目)接種はどのようにしたら受けられますか。 ※最終更新日:2022年6月21日
- 海外への留学を予定している人は、ワクチンを優先的に接種できますか。 ※最終更新日:2021年10月31日
- 私は65歳以上ですが、ワクチンを接種することができますか。 ※最終更新日:2021年8月3日
Q&A
オミクロン株対応ワクチン
【2024年3月時点】初回(1回目・2回目)接種や小児(5~11歳)、乳幼児(生後6か月~5歳)の接種でもオミクロン株対応1価ワクチンが使用できるのですか。
現時点(令和5年(2023年)12月4日)では、初回接種や小児接種、乳幼児接種のいずれでも使用可能です。
令和5年の秋冬(令和5年9月20日~令和6年3月31日)の接種で使用するワクチンについては、国内外の流行状況や今後の開発状況を踏まえ、よりオミクロンXBB.1系統の株に対応したワクチンを選択することとし、薬事申請されたオミクロンXBB.1.5対応1価ワクチンの使用を基本としていました。(※1)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種と追加接種が、令和5年9月1日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年9月20日から使用が可能となっています。
また、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による6歳以上を対象とした追加接種及び生後6か月以上を対象とした初回接種が、それぞれ令和5年9月12日及び同年10月24日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月25日及び同年11月1日から使用が可能となっています。
また、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)による12歳以上を対象とした追加接種が、令和5年11月28日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年12月4日から使用が可能となっています。
国としては、今後のワクチン開発や薬事承認の状況に応じて、引き続き審議会(※2)で議論を行い、順次使用可能とすることを検討していきます。
*モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日をもって終了しました。
(参考資料)
※1:新型コロナワクチンの接種について(第47回厚生科学審議会予防接種・ワクチン分科会資料)
※2:厚生科学審議会予防接種・ワクチン分科会
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】なぜ、オミクロン株対応1価ワクチンの接種が必要なのですか。
WHOの声明や日本での流行状況等を踏まえ、重症化を予防する目的で、重症化リスクが高い者を接種対象とし、それ以外の者には接種機会を提供し、オミクロン株対応1価ワクチンが使用されています。
WHO(世界保健機関)は新型コロナワクチンの利用に関する指針において、高齢者等に対しては更なる追加接種を推奨する一方、健康な乳幼児、小児、成人等に対しては推奨せず、健康な乳幼児と小児に対しては、初回接種を含め、疾病負荷等を踏まえ各国において検討すべきとしています。
日本におけるオミクロン株の流行状況について、年齢別の重症化率や致死率は令和4年1~8月において、高齢者では高い一方、それ以下の世代では低い状況にあります。
以上から、令和5年秋開始接種は重症者を減らす目的で、高齢者など重症化リスクが高い者を接種の対象としつつ、その他の全ての者には接種の機会を提供することとされ、オミクロン株対応1価ワクチン(XBB.1.5)を使用することとされています。
オミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能と確認されていることを踏まえ、非臨床試験における接種により、オミクロン株XBB.1.5に対する中和抗体の産生が認められたことから、一定の有効性が期待されています。またオミクロン株対応1価ワクチン(XBB.1.5)の安全性についても、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられています。以上から、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種と追加接種、及びモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による6歳以上を対象とした追加接種について、それぞれ令和5年(2023年)9月1日及び同年9月12日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月20日及び同年9月25日より接種が開始されています。
また、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、単一の年齢層の臨床試験の結果は既に承認されている製剤の他の年齢層にも外挿が可能とされていることを踏まえ、オミクロン株対応1価ワクチンの臨床試験における追加接種により、オミクロン株亜系統に対する中和抗体の産生が確認されたことから、初回接種でも免疫応答と有効性が期待できるとされ、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種が令和5年10月24日に薬事承認されました。その後、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年11月1日より接種が開始されています。
また、第一三共社の新型コロナワクチンについて、オミクロン株対応2価ワクチン(従来株/BA.4-5)の臨床試験において中和抗体価の上昇により有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能であることが確認されていることを踏まえ、オミクロン株対応1価ワクチンの非臨床試験における追加接種により免疫応答が確認されたこと等から、有効性が期待できると考えられています。また、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.4-5)の安全性について、これまで実施された臨床試験における副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、オミクロン株対応1価ワクチンの安全性についても上記の製剤と基本的には同様であり、特段の懸念はないものと考えられています。以上から、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)による12歳以上を対象とした追加接種について、令和5年11月28日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年12月4日より接種が開始されています。
なお、オミクロン株対応1価ワクチンについて、乳幼児(生後6か月~5歳)用はこちら、小児(5~11歳)用はこちらをご覧ください。
※モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日をもって終了しました。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
PMDAの審査報告書(第一三共社のオミクロン株対応1価ワクチン)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】オミクロン株対応1価ワクチンとは、どのようなワクチンですか。
オミクロン株対応1価ワクチンは、mRNA(メッセンジャーRNA)ワクチンの一つで、オミクロン株に由来する成分を含む「1価ワクチン」です。現在の流行株であるオミクロンXBB系統に対して、これまでのオミクロン株対応2価ワクチンより高い中和抗体価を誘導すること等が報告されており、重症化予防効果等の向上が期待されています。
オミクロン株対応1価ワクチン(XBB.1.5)は、mRNA(メッセンジャーRNA)ワクチンの一つであり、オミクロン株1種類のスパイクタンパク質の設計図となるmRNAを成分として含む「1価ワクチン」です。流行している株により適合した成分を含むことで、従来のワクチン(従来株のmRNAのみを成分として含む「1価ワクチン」)やこれまでのオミクロン株対応2価ワクチン(従来株/BA.1又は従来株/BA.4-5の2種類を成分として含む2価ワクチン)と比較して、より高い中和抗体価の誘導や予防効果の向上が期待されています。
オミクロン株対応1価ワクチン(XBB.1.5)は、非臨床試験等においてXBB.1.5に対してこれまでのオミクロン株対応2価ワクチンよりも高い中和抗体価を誘導することや、オミクロン株対応1価ワクチン(XBB.1.5)の接種で得られる中和抗体は、現在流行の中心であるオミクロンXBB系統の亜系統であるオミクロンEG.5.1に対してもXBB.1.5と同程度に効果があることが報告されています。これらのことから、現在の流行株であるオミクロンXBB系統に対して、重症化予防効果はもとより、発症予防効果の向上も期待されています。
令和5年(2023年)12月4日現在、オミクロン株対応1価ワクチン(XBB.1.5)は、以下の方に対して接種することが可能となっています。
- ファイザー社の1価ワクチン:初回(1・2回目)接種(*)が未了である又は完了した、生後6か月以上のすべての方
- モデルナ社の1価ワクチン: 初回(1・2回目)接種(*)が未了である生後6か月以上のすべての方、初回(1・2回目)接種(*)を終えた6歳以上のすべての方
- 第一三共社の1価ワクチン:初回(1・2回目)接種(*)を終えた12歳以上のすべての方
(*)ファイザー社の1価ワクチンによる乳幼児(生後6か月~4歳)への初回接種は、3回で1セットです。
※追加接種の場合は、前回の接種から3か月以上の間隔をあける必要があります。
各ワクチンの有効性についてはこちらを、安全性についてはこちらをご覧ください。
(参考資料)
令和5年秋冬に用いるワクチンについて(第47回厚生科学審議会予防接種・ワクチン分科会資料)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナウイルス(SARS-CoV-2)の変異株EG.5.1系統について(国立感染症研究所)
【2024年3月時点】オミクロン株対応1価ワクチンの接種にはどのような効果がありますか。
オミクロン株対応1価ワクチンの接種により、現在の流行株であるオミクロンXBB系統に対して、これまでのオミクロン株対応2価ワクチンよりも高い中和抗体価を誘導することが報告されており、重症化予防効果等の向上が期待されています。
ファイザー社及びモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能と確認されていることを踏まえ、非臨床試験におけるオミクロン株対応1価ワクチン(XBB.1.5)の接種により、オミクロン株XBB.1.5に対する中和抗体の産生が認められたことから、一定の有効性が期待されています。
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)については、マウスを用いた非臨床試験において、初回接種を行い接種後1か月後にXBB.1.5に対する中和抗体の産生が認められ、また、従来型の1価ワクチン(従来株)による初回接種の後に追加接種を1回行い、接種後1か月後にXBB.1.5に対する中和抗体の産生が認められたことから、令和5年(2023年)9月1日に薬事承認されました。その後、厚生労働省の審議会で議論した結果、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種と追加接種が予防接種法上の特例臨時接種に位置づけられ、いずれも令和5年9月20日より接種が開始されています。
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)については、マウスを用いた非臨床試験において、従来型の1価ワクチン(従来株)による初回接種の後に追加接種を1回行い、接種後2週間後にXBB.1.5に対する中和抗体の産生が認められたことから、令和5年9月12日に薬事承認されました。また、従来型の1価ワクチン(従来株)を3回接種し、その後オミクロン株対応2価ワクチン(従来株/BA.4-5)を1回接種した18歳以上の者を対象に、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の追加接種を1回行い、接種14日後にオミクロン株亜系統に対し高い中和抗体の上昇が認められたことから、単一の年齢層の臨床試験の結果は既に承認されている製剤の他の年齢層にも外挿が可能とされていることを踏まえ、初回接種でも免疫応答と有効性が期待できるとされ、同年10月24日に薬事承認されました。
その後、厚生労働省の審議会で議論した結果、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による6歳以上を対象とした追加接種及び生後6か月以上を対象とした初回接種が予防接種法上の特例臨時接種に位置づけられ、それぞれ令和5年9月25日及び同年11月1日より接種が開始されています。
第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)については、ファイザー社の従来型1価ワクチン(従来株)の初回接種後に同ワクチン又は同社のオミクロン株対応2価ワクチン(従来株/BA.4-5)を追加接種した12歳以上の者を対象に、第一三共社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の追加接種を1回行い、接種28日後にオミクロン株亜系統に対し中和抗体の上昇が認められたこと、マウスを用いた非臨床試験において、第一三共社の従来型1価ワクチン(従来株)による初回接種の後に同社のオミクロン株対応1価ワクチン(XBB.1.5)追加接種を1回行い、接種後2週間後にXBB.1.5に対する中和抗体の産生が認められたこと等から、有効性が期待できると考えられ、令和5年11月28日に薬事承認されました。
その後、厚生労働省の審議会で議論した結果、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)による12歳以上を対象とした追加接種が予防接種法上の特例臨時接種に位置づけられ、令和5年12月4日より接種が開始されています。
なおオミクロン株対応1価ワクチン(XBB.1.5)は、XBB.1.5に対してこれまでのオミクロン株対応2価ワクチンよりも高い中和抗体価を誘導することや、オミクロン株対応1価ワクチン(XBB.1.5)の接種で得られる中和抗体は、現在流行の中心であるオミクロンXBB系統の亜系統であるオミクロンEG.5.1に対してもXBB.1.5と同程度に効果があることが報告されており、現在の流行株であるオミクロンXBB系統に対して、重症化予防効果はもとより発症予防効果の向上が期待されています。
また、オミクロン株対応1価ワクチンについて、乳幼児(生後6か月~5歳)用はこちら、小児(5~11歳)用はこちらをご覧ください。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
PMDAの審査報告書(第一三共社のオミクロン株対応1価ワクチン)
令和5年秋冬に用いるワクチンについて(第47回厚生科学審議会予防接種・ワクチン分科会資料)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナウイルス(SARS-CoV-2)の変異株EG.5.1系統について(国立感染症研究所)
【2024年3月時点】令和5年(2023年)秋以降の接種では、ワクチンの種類は変わるのですか。
令和5年9月20日から、生後6か月以上の全ての方を対象としたオミクロン株対応1価ワクチン(XBB.1.5)による接種が行われています。
現在(令和5年7月時点)開発中のXBB.1.5対応1価ワクチンは、非臨床試験(マウスを用いた試験)において、XBB.1.5に対して現行2価ワクチンよりも高い中和抗体価を誘導することが報告されています。
今後のワクチン接種については、オミクロンXBB.1系統の株に対応したワクチンを用いることで、より高い中和抗体価の上昇等が期待されることから、重症化予防効果はもとより、発症予防効果の向上が期待されると考えられています。
こうした科学的知見をもとに、厚生労働省の審議会で議論した結果、令和5年秋以降の接種では、国内外の流行状況や今後の開発状況を踏まえて、よりオミクロンXBB.1系統の株に対応したワクチンを選択することとし、薬事申請されたオミクロンXBB.1.5対応1価ワクチンの使用を基本にしていました。
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種と追加接種が令和5年9月1日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年9月20日から使用が可能となっています。
また、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による6歳以上を対象とした追加接種及び生後6か月以上を対象とした初回接種が、それぞれ令和5年9月12日及び同年10月24日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月25日及び同年11月1日から使用が可能となっています。
また、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)による12歳以上を対象とした追加接種が、令和5年11月28日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、同年12月4日から使用が可能となっています。
(参考資料)
令和5年秋冬に用いるワクチンについて(第47回厚生科学審議会予防接種・ワクチン分科会資料1-2))
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
【2024年3月時点】オミクロン株対応1価ワクチンの接種は、どのような人が対象になりますか。
令和5年(2023年)9月20日以降、初回接種と追加接種のいずれも、生後6か月以上の全ての方が接種対象となっています。
WHO(世界保健機関)は新型コロナワクチンの利用に関する指針において、高齢者等に対しては更なる追加接種を推奨する一方、健康な乳幼児、小児、成人等に対しては推奨せず、健康な乳幼児と小児に対しては、初回接種を含め、疾病負荷等を踏まえ各国において検討すべきとしています。
日本におけるオミクロン株の流行状況について、年齢別の重症化率や致死率は令和4年1~8月において、高齢者では高い一方、それ以下の世代では低い状況にあります。
以上から、令和5年秋開始接種は重症者を減らす目的で、高齢者など重症化リスクが高い者を接種の対象としつつ、その他の全ての者には接種の機会を提供することとされ、オミクロン株対応1価ワクチン(XBB.1.5)を使用することとされています。
令和5年9月20日以降、オミクロン株対応1価ワクチン(XBB.1.5)の接種は、生後6か月以上の全ての方を対象に、以下のとおり実施しています。
- 初回(1・2回目)(*)接種を終えた方は、これまでに接種した新型コロナワクチンの種類にかかわらず、最後の接種から3か月以上の間隔を空けて、1人1回受けていただくことができます(令和5年秋開始接種)。
- 初回(1・2回目)(*)接種が未了である方も、受けていただくことができます(初回接種)。
(*)ファイザー社の1価ワクチンによる乳幼児(生後6か月~4歳)への初回接種は、3回で1セットです。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
5~11歳の子どもへの接種(小児接種)についてのお知らせ(厚生労働省HP)
生後6か月~4歳の子どもへの接種(乳幼児接種)についてのお知らせ(厚生労働省HP)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】海外ではオミクロン株対応ワクチンの接種が行われているのでしょうか。
2023年秋冬の接種に用いるワクチンについて、海外ではいくつかの国でオミクロン株対応1価ワクチン(XBB.1系統)の接種が承認され、接種が開始されています。
2024年2月時点で、WHO(世界保健機構)、EMA(欧州医薬品庁)、FDA(米国食品医薬品局)から2023年秋冬に用いるワクチンについての推奨が発表されており、米国、英国、カナダ等において、我が国で接種を行うオミクロン株対応1価ワクチン(XBB.1.5)と同様のワクチンの接種が開始されています。
(参考資料)
諸外国の状況について[830KB](第55回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】新型コロナワクチンの接種を受ける場合、令和4年(2022年)度に配布された接種券は、令和5年(2023年)度の接種でも使えますか。
これまでに配布された接種券が引き続き有効に使えるかどうかは、市町村によって取扱いが異なるため、お住まいの市町村の案内に従ってください。
これまでに配布された接種券が引き続き有効に使えるかどうかは、市町村によって取扱いが異なるため、お住まいの市町村の案内に従ってください。令和5年度も新型コロナワクチン(※)の接種を受ける場合には接種券が必要となりますので、接種当日は、お手持ちの接種券等一式と本人確認書類(マイナンバーカード、運転免許証、健康保険証等)を接種会場までご持参ください。
(※)オミクロン株対応ワクチンの接種対象者については、こちらをご覧ください。
(注)引っ越しで住所が変更となった方は、下記もご覧ください。
【2024年3月時点】オミクロン株対応1価ワクチンにはどのような副反応がありますか。
安全性は既承認の製剤と同様であり、主な副反応として、注射した部分の痛み、頭痛、疲労、発熱等がありますが、現時点で重大な懸念は認められないとされています。
オミクロン株対応1価ワクチン(XBB.1.5)の安全性については、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられることから、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上を対象とした初回接種と追加接種が令和5年(2023年)9月1日に薬事承認され、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による6歳以上を対象とした追加接種及び生後6か月以上を対象とした初回接種が、それぞれ同年9月12日及び同年10月24日に薬事承認されています。
また、既承認の製剤であるファイザー社及びモデルナ社の従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)については、主な副反応として、注射した部分の痛み、頭痛、疲労、発熱等がありますが、現時点で重大な懸念は認められないことが薬事承認審査で確認されています。
また、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)の安全性についても、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.4-5)の安全性について、これまで実施された臨床試験における副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、上記の製剤と基本的には同様であり、主な副反応として、注射した部分の痛み、頭痛、疲労、発熱等がありますが、特段の懸念はないものと考えられています。
オミクロン株対応1価ワクチンについて、乳幼児(6か月~5歳)用はこちら、小児(5~11歳)用はこちらをご覧ください。
厚生労働省が実施している接種後の健康状況に係る調査において、令和6年(2024年)1月26日の中間報告によれば、スパイクタンパク質に対する抗体価は全体として、令和5年秋開始接種としてファイザー社とモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の接種前では、それぞれ13,157U/mLと12,052U/mL、追加接種1か月後では、それぞれ27,240U/mLと30,537U/mLでした。また、ヌクレオカプシドタンパク質に対する抗体の陰性者と陽性者では違いが認められました。安全性については、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)では発熱(37.5℃以上)が16.5%、接種部位の痛みが87.5%の方にみられ、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)では発熱(37.5℃以上)が39.9%、接種部位の痛みが93.4%の方にみられました。今後も新たな知見が得られ次第、速やかにお知らせしていきます。
<参考>
ファイザー社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1)については、主な副反応として、注射した部分の痛み、頭痛、関節や筋肉の痛み、疲労、寒気、発熱等がありますが、ほとんどが軽度又は中等度で回復性が認められること、本ワクチンの追加接種に係る安全性プロファイルは、従来の1価ワクチンによる追加接種とおおむね同様であり、現時点で重大な懸念は認められないことが、薬事承認審査で確認されています。
モデルナ社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1)については、主な副反応として、注射した部分の痛み、頭痛、関節や筋肉の痛み、疲労、寒気、発熱等がありますが、ほとんどが軽度又は中等度で回復性が認められること、本ワクチンの追加接種に係る安全性プロファイルは、従来の1価ワクチンによる追加接種と比較して明確な差異はなく、現時点で重大な懸念は認められないことが、薬事承認審査で確認されています。
一方、ファイザー社とモデルナ社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.4-5)については、いずれも既に承認されていたオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1)と同じ株系統(同じ株の、ひとつながりに位置するもの)を用いていることを踏まえ、安全性に影響を及ぼす可能性は低いと考えられることが、薬事承認審査で確認されています。
さらに、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又は従来株/BA.4-5)による初回接種について、追加接種後の有害事象の発現状況等、これまでに得られている臨床試験成績や製造販売後の安全性情報から、2価ワクチンの安全性プロファイルはこれまでに確認されているものと同様と考えられ、現時点で新たな懸念は認められておらず、2価ワクチンの安全性は許容可能であることが、薬事承認審査で確認されています。
小児(5~11歳)用のオミクロン株対応2価ワクチンについては、こちらをご覧ください。
厚生労働省が実施している接種後の健康状況に係る調査において、令和6年1月26日の中間報告によれば、スパイクタンパク質(従来株)に対する幾何平均抗体価は全体として、令和5年秋開始接種としてファイザー社とモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の接種前では、それぞれ12,287U/mLと11,563U/mL、追加接種後1か月後では、それぞれ23,492U/mLと29,769U/mL、追加接種後3か月後では、それぞれ18.227U/mLと20,426U/mL、追加接種後6か月後では、それぞれ14,633U/mLと18,131U/mLでした。また、ヌクレオカプシドタンパク質に対する抗体の陰性者と陽性者では違いが認められました。
安全性については、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)では発熱(37.5℃以上)が15.2%、接種部位の痛みが84.8%の方にみられ、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)では発熱(37.5℃以上)が32.3%、接種部位の痛みが87.5%の方にみられました。今後も新たな知見が得られ次第、速やかにお知らせしていきます。
本ワクチンは、新しい種類のワクチンのため、これまでに明らかになっていない症状が出る可能性があります。接種後に気になる症状がみられた場合は、接種医、あるいは、身近な医療機関にご相談ください。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
PMDAの審査報告書(第一三共社のオミクロン株対応1価ワクチン)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1))
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[872KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[959KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(初回免疫等))
オミクロン株対応2価ワクチンの追加接種後の健康状況調査
オミクロン株対応1価ワクチンの追加接種後の健康状況調査
【2024年3月時点】オミクロン株対応ワクチンは、インフルエンザワクチンなどほかのワクチンと同時に接種できるのですか。
オミクロン株対応ワクチンは、インフルエンザワクチンとの同時接種が可能です。また、それぞれのワクチンを別の日に接種する場合の接種間隔についても制限はありません。ただし、インフルエンザワクチン以外のワクチンは、オミクロン株対応ワクチンと同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
オミクロン株対応ワクチンは、従来の新型コロナワクチンと同様に、インフルエンザワクチンとの同時接種が可能です。また、それぞれのワクチンを別の日に接種する場合の接種間隔についても制限はありません。
ただし、インフルエンザワクチン以外のワクチンは、オミクロン株対応ワクチンと同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
なお、創傷時の破傷風トキソイド等、緊急性を要するものに関しては、例外として2週間を空けずに接種することが可能です。
(例)10月1日に新型コロナワクチンを接種した場合、他のワクチンを接種できるのは、10月15日(2週間後の同じ曜日の日)以降になります。インフルエンザワクチンは、10月1日に同時接種が可能なほか、10月3日や10月7日に接種することも可能です。
【2024年3月時点】オミクロン株対応1価ワクチンの接種が始まってからも、従来ワクチン(1価)による接種はできるのですか。
従来ワクチン(1価)による接種は終了しました。現時点では、オミクロン株対応1価ワクチンの接種が可能です。
現時点(令和5年(2023年)12月26日)では、新型コロナワクチンの接種については、ファイザー社、モデルナ社又は第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)の接種が可能です(*)(初回接種、令和5年秋開始接種)。
(*)モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
なお、オミクロン株対応1価ワクチンの接種対象者については、こちらをご覧ください。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】オミクロン株対応1価ワクチン(XBB.1.5)は、EG.5.1系統に対して効果がありますか。
EG.5.1系統とXBB.1系統の違いはわずかであり、有効性が期待できると考えられます。
EG.5.1系統は、XBB系統の一種であるXBB.1.9.2系統の亜系統です。国立感染症研究所が実施したウイルスの評価(※1)によると、オミクロン株対応1価ワクチン(XBB.1.5)の接種で得られる中和抗体は、EG.5.1に対してもXBB.1.5と同程度に効果があることが確認されています(※2)。また、EG.5.1系統とXBB.1系統の抗原性(免疫反応を引き起こす性質)の差を調べた複数の報告において、確認できた差はわずかとされています。
これらの知見から、オミクロン株対応1価ワクチン(XBB.1.5)はEG.5.1系統に対しても、有効性が期待できると考えられます。
(参考資料)
※1: 新型コロナウイルス (SARS-CoV-2) の変異株EG.5.1系統について(国立感染症研究所)
※2: medRxiv. 2023; September(Safety and Immunogenicity of XBB.1.5-Containing mRNA Vaccines)
乳幼児接種(生後6か月~5歳)
【2024年3月時点】なぜ、乳幼児(生後6か月~5歳)の接種が必要なのですか。
乳幼児においても重症例が確認されており、基礎疾患がない乳幼児でも死亡する例があります。有効性や安全性、感染状況を踏まえて、検討した結果、乳幼児を対象にワクチン接種を進めることが適当とされています。
乳幼児(生後6か月~5歳)の新型コロナウイルス感染症において、重症例の割合は少ないものの、オミクロン株の流行に伴い新規感染者が増加する中で、重症に至る症例数が増加傾向にあることが報告されてきました。また、基礎疾患がない乳幼児でも死亡する例があります。
現在の新型コロナウイルス感染症のまん延状況やワクチンに関する有効性や安全性のエビデンスも踏まえ、乳幼児への接種の機会を提供することが望ましいと考えられることから、厚生労働省の審議会で議論された結果、予防接種法に基づく接種に位置づけ、乳幼児を対象にワクチン接種を進めることが適当とされています。
乳幼児(生後6か月~5歳)の接種における有効性についてはこちら、安全性についてはこちらをご参照ください。
(参考資料)
乳幼児(生後6か月~4歳)に対する新型コロナワクチンの有効性、安全性等[1.2MB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
生後6か月以上5歳未満の小児への新型コロナワクチン接種に対する考え方(日本小児科学会)
生後6か月~17歳の小児への新型コロナワクチン接種に対する考え方 (日本小児科学会)
生後6か月~17歳の小児への新型コロナワクチン令和5年度秋冬接種に対する考え方 (日本小児科学会)
【2024年3月時点】乳幼児(生後6か月~5歳)の接種では、どのような効果がありますか。
ファイザー社のオミクロン株対応1価ワクチンは、生後6か月~4歳の乳幼児においても、現在の流行株であるオミクロンXBB系統に対して、中和抗体価の上昇が確認され、重症化予防効果等の向上が期待されています。モデルナ社のワクチンも生後6か月~5歳の乳幼児において、同様の効果が期待されています。
令和5年(2023年)11月1日現在、乳幼児を対象に使用できるワクチンは、生後6か月~4歳を対象とした初回接種及び追加接種におけるファイザー社のオミクロン株対応1価ワクチン、生後6か月~5歳を対象とした初回接種におけるモデルナ社のオミクロン株対応1価ワクチンです。日本ではそれぞれ令和5年9月1日及び同年10月24日に薬事承認され、その後、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月20日及び同年11月1日から使用が可能となっています。
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能と確認されていることを踏まえ、非臨床試験におけるオミクロン株対応1価ワクチン(XBB.1.5)の接種により、オミクロン株XBB.1.5に対する中和抗体の産生が認められたことから、一定の有効性が期待されています。
マウスを用いた非臨床試験等において、初回接種を行い接種後1か月後にXBB.1.5に対する中和抗体の産生が認められ、また、従来型の1価ワクチン(従来株)による初回接種の後に追加接種を1回行い、接種後1か月後にXBB.1.5に対する中和抗体の産生が認められています。また、XBB.1.5に対してこれまでのオミクロン株対応2価ワクチンよりも高い中和抗体価を誘導することや、オミクロン株対応1価ワクチン(XBB.1.5)の接種で得られる中和抗体は、現在流行の中心であるオミクロンXBB系統の亜系統であるオミクロンEG.5.1に対してもXBB.1.5と同程度に効果があることが報告されており、現在の流行株であるオミクロンXBB系統に対して、重症化予防効果はもとより発症予防効果の向上が期待されています。
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、単一の年齢層の臨床試験の結果は既に承認されている製剤の他の年齢層にも外挿が可能とされていることを踏まえ、オミクロン株対応1価ワクチンの臨床試験における追加接種により、オミクロン株亜系統に対する中和抗体の産生が確認されたことから、初回接種でも免疫応答と有効性が期待できるとされています。
今後も、新たな知見が得られ次第、速やかにお知らせしてまいります。
<参考>
ファイザー社の従来ワクチン(1価、従来株)について、米国をはじめとした海外の複数の国々で生後6か月~1歳及び2~4歳を対象に実施された臨床試験の結果によると、3回目の接種から1か月後の血清中の新型コロナウイルスに対する中和抗体価(ウイルスの感染力または毒素の活性を中和できる抗体の数値)や抗体応答率(抗体価がベースライン値(1回目接種前)から4倍以上に上昇した被験者の数)は、別の臨床試験で有効性が確認されている16~25歳におけるワクチン接種後の中和抗体価や抗体応答率と比較して、事前に設定した免疫ブリッジング(*1)に係る成功基準(*2)を満たすことが示されています。すなわち、生後6か月から4歳でも、16~25歳と同程度に抗体価が上昇し、有効性が期待できるとされています。
(*1)新型コロナワクチンを新たに開発するための手法の一つ。すでに承認されている新型コロナワクチンを比較対照として、免疫原性(抗体の産生や細胞性免疫を誘導する性質)の指標に基づき、有効性を評価する手法。
(*2)中和抗体価の幾何平均比の両側95%信頼区間の下限値が0.67を下回り点推定値は0.8以上、及び抗体応答率の差の両側95%信頼区間の下限値が-10%を上回る。
また、中和抗体価の確認後に行われた解析において、新型コロナウイルスに感染歴のない人を対象に、3回目接種後7日以降の発症予防効果を確認したところ、73.2%であったことが報告されています。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナウイルス(SARS-CoV-2)の変異株EG.5.1系統について(国立感染症研究所)
PMDAの審査報告書(ファイザー社のワクチン(生後6か月~4歳用))
乳幼児(生後6か月~4歳)に対する新型コロナワクチンの有効性、安全性等[1012KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】乳幼児で接種する量や回数、接種間隔は、成人や小児(5~11歳)と同じですか。
乳幼児で接種する有効成分の1回あたりの量は、他の年代で接種する量より少なく設定されています。初回接種の回数と間隔は、製剤によって他の年代と同じものと異なるものがあります。追加接種は他の年代と同じであり、前回の接種から3か月経過した後に1回接種します。
乳幼児を対象として接種するワクチンは、生後6か月~4歳用のファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)、又は生後6か月~5歳の用量でモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)を使用します。
- 乳幼児(生後6か月~4歳)でファイザー社のワクチンを使用する場合
初回接種の回数は他の年代と異なり3回で1セットになっています。1回3μg(0.2mL)を、2回目は通常3週間の間隔で、3回目は2回目の接種から少なくとも8週間経過した後に、接種することとされています。追加接種の回数と間隔は他の年代と同じであり、前回の接種から少なくとも3か月経過した後に、1回3μg(0.2mL)を接種することとされています。生後6か月~4歳で接種する有効成分の1回あたりの量は、5~11歳で接種する量の30%、12歳以上で接種する量の10%になります。
接種間隔については、2回目の接種は一番早くて1回目接種の19日後から接種が可能であること、3週間を超えた場合はできる限り速やかに2回目を接種すること、3回目の接種は一番早くて2回目接種の56日後から接種が可能であること、8週間を超えた場合はできる限り速やかに3回目を接種することをお願いしています。
用量については、6か月~1歳を対象とした臨床試験では3μg、2歳~4歳を対象とした臨床試験では3μg、10μgを投与して検討が行われました。その結果、3μgの投与量でも、高い中和抗体価と安全性・忍容性が確認されたため、この用量で投与することとされました。
また、用法については、2回目接種後の免疫原性(抗体の産生や細胞性免疫を誘導する性質)を評価した結果から、2~4歳では事前に定めた基準を満たさず、オミクロン株に対する発症予防効果を担保するため、3回目接種が必要と判断されています。
なお、生後6か月~4歳用のワクチンは、5~11歳、12歳以上で使用するワクチンとは別製剤です。接種会場では、その他の年代用のワクチンとの間違い接種が起こらないよう、様々な工夫をお願いしています。
- 乳幼児(生後6か月~5歳)でモデルナ社のワクチンを使用する場合
初回接種の回数は他の年代と同じ2回で1セットになっています。1回25μg(0.25mL)を、2回目は通常4週間の間隔を空けて接種することとされています。生後6か月~5歳で接種する有効成分の1回あたりの量は、6~11歳で初回に接種する量の50%、12歳以上で初回に接種する量の25%になります。
接種間隔については、2回目の接種は一番早くて1回目接種の21日後から接種が可能であること、4週間を超えた場合はできる限り速やかに2回目を接種することをお願いしています。
用量については、生後6か月~1歳を対象とした臨床試験では25μg、2歳~5歳を対象とした臨床試験では25μg、50μgを投与して検討が行われました。その結果、25μgの投与量でも、免疫応答は有効性が期待でき安全性は許容可能であることが確認されたため、この用量で投与することとされました。用法については、有効成分によらず同一であることを踏まえ、同じ回数と間隔で(4週間の間隔で2回)接種することと設定されています。
(参考資料)
PMDAの審査報告書(ファイザー社のワクチン(生後6か月~4歳用))
乳幼児(生後6か月~4歳)に対する新型コロナワクチンの有効性、安全性等[1.1MB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
ファイザー社ワクチンの添付文書(PMDAのHP)
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
モデルナ社ワクチンの添付文書(PMDAのHP)
【2024年3月時点】乳幼児(生後6か月~5歳)の接種にはどのような副反応がありますか。
安全性は既承認の製剤と同様であり、接種部位の痛みや疲労、発熱、頭痛等、様々な症状が確認されていますが、ほとんどが軽度または中等度であり回復していることなど、現時点で得られている情報からは、安全性に重大な懸念は認められていないと判断されています。
令和5年(2023年)11月1日現在、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月~4歳を対象とした初回接種と追加接種、及びモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月~5歳を対象とした初回接種の使用が可能となっています。その安全性については、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられ、それぞれ令和5年9月1日及び同年10月24日に薬事承認されています。
また、既承認の製剤であるファイザー社及びモデルナ社の従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)については、主な副反応として、注射した部分の痛み、頭痛、疲労、発熱等がありますが、現時点で重大な懸念は認められないことが薬事承認審査で確認されています。
<参考>
ファイザー社のワクチン(1価、従来株)は、生後6か月~4歳の接種において、接種部位の痛みや疲労、発熱、頭痛等、様々な症状が臨床試験で確認されていますが、ほとんどが軽度または中等度であり回復していることや、実薬群とプラセボ(生理食塩水)群とで大きな差はなかったこと等、現時点で得られている情報から、安全性に重大な懸念は認められていないと判断されています。
生後6~23か月の被験者において、注射部位の圧痛は接種当日(中央値)に発現し、持続期間は1 日(中央値)であり、その他の全身反応は接種翌日~4.5 日(中央値)に発現し、持続期間は1~2 日(中央値)と報告されています。また、2~4歳の被験者において、注射部位の疼痛は接種当日(中央値)に発現し、持続期間は1日(中央値)であり、その他の全身反応は接種翌日~5日(中央値)に発現し、持続期間は1~2.5日(中央値)と報告されています。
他の年代とは異なり、自ら症状を訴えることができない生後6か月~1歳では易刺激性(機嫌が悪い)や食欲減退、傾眠傾向等が報告されていますが、プラセボ(生理食塩水)群とは大きな差がなかったと報告されています。
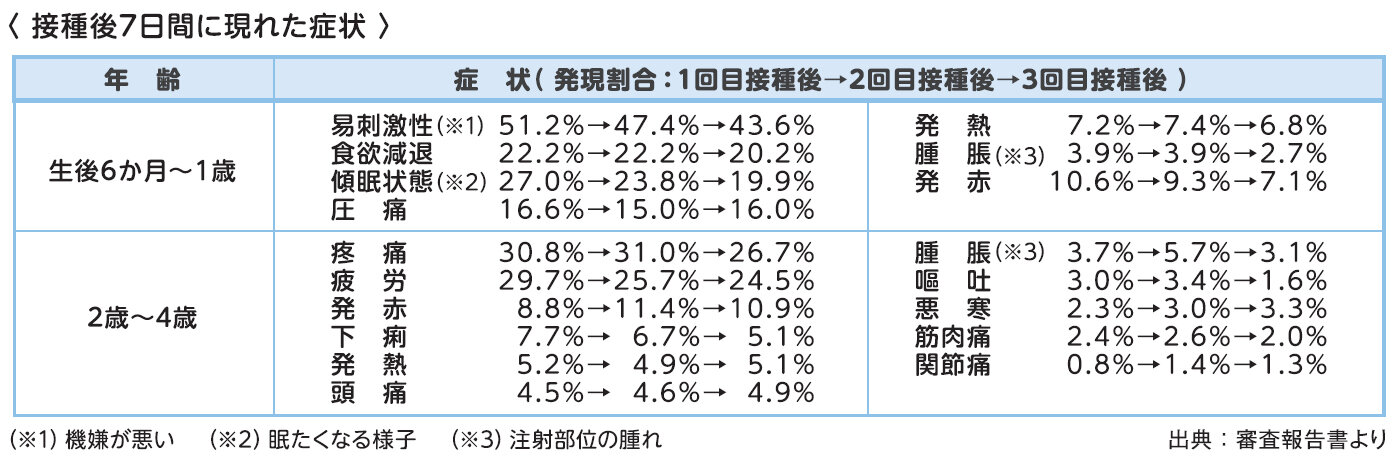
※厚生労働省リーフレット「新型コロナワクチン接種についてのお知らせ(生後6か月~4歳のお子様の保護者の方へ)」より抜粋
厚生労働省では、接種後の副反応を疑う事例を収集し、専門家による評価を行うとともに、接種後の健康状況に係る調査を実施しています。
同調査の令和5年10月27日の中間報告によれば、ファイザー社ワクチン(6か月~4歳用)の接種によるスパイクタンパク質(従来株)に対する幾何平均抗体価について、接種前では14U/mL、初回接種後(3回で1セット)1か月後では9,977U/mL、3か月後では3,975U/mLでした。安全性については、1~3回目接種後、一部の方に発熱や局所の疼痛等がみられました。接種後の体温変化を時系列で検討したところ、接種数日後にみられた偶発的な発熱、乳児期に感染しやすい感染症に罹患した事例など、ワクチン接種とは直接関係しない事象が発熱の発現率に影響している可能性があるとされています。今後も新たな知見が得られ次第、速やかにお知らせしていきます。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
ファイザー社ワクチンの添付文書(PMDAのHP)
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
モデルナ社ワクチンの添付文書(PMDAのHP)
PMDAの審査報告書(ファイザー社のワクチン(生後6か月~4歳用))
乳幼児(生後6か月~4歳)に対する新型コロナワクチンの有効性、安全性等[1012KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの初回接種後の健康状況調査
【2024年3月時点】乳幼児(生後6か月~5歳)がワクチン接種後に発熱しました。対応は小児(5~11歳)や成人の場合と同じでよいのでしょうか。
小児(5~11歳)、成人の場合と同様です。ワクチン接種後の発熱に対しては、都道府県の相談窓口や、身近な医療機関にご相談ください。
厚生労働省では、各都道府県に対し、新型コロナワクチン接種後の副反応に係る相談窓口等の設置と、専門的な医療機関を円滑に受診できる体制の確保をお願いしています。乳幼児、小児に対しては、保護者からの相談も受け付けていますので、都道府県の相談窓口をご活用ください。または、身近な医療機関にご相談ください。
なお、副反応を疑う症状に対する診療体制の構築については、こちらでも解説しています。
(参考資料)
新型コロナウイルスワクチン接種後の副反応を疑う症状に対する診療体制の構築について(厚生労働省)
【2024年3月時点】乳幼児(生後6か月~5歳)の接種時に必要なものはありますか。
乳幼児(生後6か月~5歳)のワクチン接種では、原則、保護者の同伴が必要となります。また、接種履歴は母子健康手帳で管理しているため、特にこの年代の方は、接種当日は可能な限り、母子健康手帳の持参をお願いします。
生後6か月~4歳を対象としたファイザー社のワクチン接種、生後6か月~5歳を対象としたモデルナ社のワクチン接種では、原則、保護者の同伴が必要となります。予診票に保護者の署名が必要となり、署名がなければワクチンの接種はできません。また、未就学児の子どもの接種履歴は母子健康手帳で管理しているため、特にこの年代の方は、接種当日は可能な限り、母子健康手帳の持参をお願いします。この他、送付された接種券等一式と本人確認書類(マイナンバーカード、健康保険証等)を忘れずにお持ちください。
【2024年3月時点】海外では乳幼児(生後6か月~5歳)の接種が行われていますか。
2023年秋冬の接種に用いるワクチンについて、海外ではいくつかの国でオミクロン株対応1価ワクチン(XBB.1系統)の接種が承認され、接種が開始されています。
2024年2月時点で、WHO(世界保健機構)、EMA(欧州医薬品庁)、FDA(米国食品医薬品局)から2023年秋冬に用いるワクチンについての推奨が発表されており、米国、英国、カナダ等において、我が国で接種を行うオミクロン株対応1価ワクチン(XBB.1.5)と同様のワクチンの接種が開始されています。
(参考資料)
諸外国の状況について[830KB](第55回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】初回接種の規定の回数を終える前に、対象年齢を超えて誕生日を迎えました。どうしたらよいでしょうか。
初回接種の途中で対象年齢を超えて誕生日を迎えた場合も、原則として同じワクチンを接種します。
初回接種の規定の回数を終える前に途中で対象年齢を超えて誕生日を迎えた場合であっても、原則として同じワクチンを接種する必要があります。生後6か月~4歳を対象としたファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の初回接種は合計3回で1セットであり、途中で5歳の誕生日を迎えた場合も、3回目までの接種は同じ生後6か月~4歳用のワクチンを接種します。生後6か月~5歳を対象としたモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の初回接種は合計2回で1セットであり、途中で6歳の誕生日を迎えた場合も、2回目までの接種は生後6か月~5歳の用量で同じワクチンを接種します。
【2024年3月時点】乳幼児(生後6か月~5歳)の接種に向けて、保護者が気を付けることはありますか。
ワクチン接種後数日以内は、様々な症状に注意しながら過ごす必要があります。また、ワクチンの効果は100%ではないことから、手指の消毒等、効果的な感染対策の継続をお願いします。幼稚園や保育園等では、接種を受けるまたは受けないことによって、差別やいじめなどが起きることのないようお願いします。
ワクチン接種後数日以内は、接種部位の痛みや倦怠感、頭痛、発熱等の症状がみられることが多いため、このような症状に注意しながら過ごす必要があります。また、他の年齢層において、ごく稀ですが、接種後に軽症の心筋炎や心膜炎を発症した例が報告されています。接種後4日程度の間に、お子様に、胸の痛みを訴える、ドキドキすると訴える、息苦しそうにしている、むくんでいる等の症状がみられる、または、食欲や活気がない等普段と違う様子が続くようであれば、速やかに医療機関を受診し、ワクチンを接種したことを伝えてください。
また、ワクチンの効果は100%ではありません。ワクチン接種後も、引き続き、石けんによる手洗いや、手指消毒用アルコールによる消毒の励行、こまめな換気など、効果的な感染対策の継続をお願いします。
生後6か月~5歳の子どものワクチン接種についても、発症予防効果など接種のメリットが、副反応などのデメリットよりも大きいことを確認して、皆さまに接種の機会を提供しています。しかし、接種を望まない方に接種を強制することはなく、受ける方の同意なく接種が行われることもありません。また、医学的観点から接種をできない方もいます。幼稚園や保育園等においても、接種を受けるまたは受けないことによって、差別やいじめなどが起きることのないようお願いします。
【2024年3月時点】接種した当日や翌日は、幼稚園や幼保連携型認定こども園を休んでも大丈夫でしょうか。
ワクチン接種や、その後の副反応等で幼稚園等を休む場合は、欠席としないなど柔軟な取扱いが可能とされています。出欠の取扱いについては、まずは、子どもが通う幼稚園にご相談ください。
幼稚園等に通う子どもがワクチン接種を受ける場合、例えば、接種の期日や場所の選択が困難であり、かつ、接種場所までの移動に長時間を要する場合等に、指導要録の備考欄等にその旨を記載することで、欠席としないなどの柔軟な取扱いをすることを可能としています。
また、副反応であるか否かに関わらず、接種後、子どもに発熱等の風邪の症状がみられたときには、幼稚園(*)は、学校保健安全法第19条の規定に基づく出席停止の措置を取ることができます。また、これらの症状以外の症状がみられた場合にも、子どもやその保護者から状況を伺い、適切に判断いただくよう、お願いしています。
(*)幼保連携型認定こども園についても、同条の規定を準用することとされています。
幼稚園等の出欠の取扱いについては、こうしたことも踏まえて、まずは、子どもが通う幼稚園等にご相談ください。
また、新型コロナワクチン接種に関することについては、お住まいの市区町村の相談窓口にご相談ください。
(参考資料)
新型コロナウイルス感染症に係る予防接種の幼児児童生徒に対する実施についての学校等における考え方及び留意点等について(文部科学省・内閣府・厚生労働省)
【2024年3月時点】接種後に子ども(生後6か月~5歳)が副反応等で体調を崩した場合、保護者は仕事を休んでも大丈夫でしょうか。
企業によっては、このような場合に活用できる休暇制度を設けている場合があります。小学校就学前であれば、育児・介護休業法における子の看護休暇の取得を申し出ることも考えられます。また、年次有給休暇の利用目的は限定されていません。子どもへのワクチン接種等のため仕事を休む必要があると考えられる場合は、あらかじめ、職場によく相談しておくことをお勧めします。
乳幼児(生後6か月~5歳)のワクチン接種では、保護者の同伴が必要とされており、また、接種後の副反応等で子どもが体調を崩した場合の看病などで、労働者でもある保護者が急に仕事を休まざるを得ない場合も生じ得ます。
企業によっては、「ファミリーサポート休暇」など、このような場合にも活用できる休暇制度を設けている場合があります。接種対象の子どもが小学校就学前である場合は、育児・介護休業法における子の看護休暇の取得を、事業主に申し出ることが考えられます。
また、年次有給休暇の利用目的は限定されていませんので、このような場合にも取得することが可能です。
子どもへのワクチン接種を希望する労働者が安心してワクチン接種に臨めるような環境整備が企業にも望まれます。
子どもへのワクチン接種等のため仕事を休む必要があると考えられる場合は、あらかじめ、職場によく相談しておくことをお勧めします。
(参考資料)
新型コロナウイルスに関するQ&A(企業の方向け)(厚生労働省)
【2024年3月時点】ワクチンの接種会場は小児(5~11歳)、あるいは成人と同じでしょうか。
会場によって取り扱うワクチンは異なります。自治体からのお知らせ等をよくお読みいただき、接種可能な会場をお探しの上、ご予約をお願いします。
会場によって取り扱うワクチンが異なります。乳幼児(生後6か月~5歳)へのワクチン接種のみを実施する会場もあれば、小児(5~11歳)、12歳以上の接種を同時に実施する会場もあります。自治体からのお知らせ等をよくお読みいただき、接種可能な会場をお探しの上、ご予約をお願いします。
「コロナワクチンナビ」(*)の接種会場一覧 にも、生後6か月~4歳を対象としたファイザー社のワクチン、生後6か月~5歳を対象としたモデルナ社のワクチンを取り扱う医療機関情報を掲載しています。
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】乳幼児(生後6か月~5歳)の接種には「努力義務」は適用されているのでしょうか。
令和5年秋冬の接種目的が重症化予防とされていることから、重症化リスクが高い方にのみ努力義務の規定が適用されています。ただし、接種は強制ではなく、保護者の判断に基づいて受けていただくようお願いいたします。
新型コロナワクチンの接種については、新型コロナウイルス感染症の緊急のまん延予防のために実施する趣旨に鑑み、予防接種法上の「接種勧奨」及び「努力義務」の規定は原則として適用されることとなっていました。
令和4年(2022年)10月現在、オミクロン株の流行にともない、小児の感染者数も増加傾向にあり、重症例や死亡例の割合は低いものの、重症者数が増加傾向にあることが報告されています。このような中、乳幼児(生後6か月~4歳)接種のエビデンスとして、
- オミクロン株流行下において、3回目接種後7日以降における発症予防効果は73.2%であることが報告され、日本において薬事承認されている
- ワクチン接種後の有害事象のほとんどは軽度または中等度であり、回復するものである
などがあり、厚生労働省の審議会で議論された結果、乳幼児の接種についても努力義務の規定を適用することが妥当であるとされています。
なお、令和5年(2023年)9月20日以降に行う追加接種については、
- WHO(世界保健機関)は新型コロナワクチンの利用に関する指針において、高齢者等に対しては更なる追加接種を推奨する一方、健康な乳幼児、小児、成人等に対しては推奨せず、健康な乳幼児と小児に対しては、初回接種を含め、疾病負荷等を踏まえ各国において検討すべきとしていること
- 日本におけるオミクロン株の流行状況について、年齢別の重症化率や致死率は令和4年1~8月において、高齢者では高い一方、それ以下の世代では低い状況にあること
を踏まえ、重症者を減らすという接種の目的のもと、重症化リスクが高い者を接種の対象としつつ、その他の全ての者には接種の機会を提供することとしています。
公的関与(接種勧奨及び努力義務)の規定については、令和5年5月8日以降、追加接種では高齢者など重症化リスクの高い方、初回接種では接種可能な全ての年齢の方に適用されていましたが、令和5年秋冬の接種の目的が重症化予防とされていることから、同年9月20日以降、初回接種と追加接種のいずれも重症化リスクの高い者にのみ当該規定が適用されることとなります。
ただし、接種は強制ではなく、保護者の判断に基づいて受けていただくようお願いいたします。努力義務についてはこちらをご覧ください。
(参考資料)
乳幼児(生後6か月~4歳)に対する新型コロナワクチンの接種、公的関与の規定の適用[854KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
2023年度の接種における公的関与の規定の適用[545KB](第44回及び第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】乳幼児(生後6か月~5歳)の接種について、インフルエンザワクチンなどほかのワクチンと同時に打つことはできるのでしょうか。
他の年代と同様、インフルエンザワクチンとの同時接種は可能です。インフルエンザワクチン以外のワクチンは、新型コロナワクチンと同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
他の年代と同様に、乳幼児についてもインフルエンザワクチンとの同時接種が可能であり、どのような間隔でも接種できます。インフルエンザワクチン以外のワクチンは同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
(例)4月1日に新型コロナワクチンを接種した場合、他のワクチンを接種できるのは、4月15日(2週間後の同じ曜日の日)以降になります。
詳しくは、身近な医療機関の小児科医などにご相談いただきながら、計画的な接種をご検討ください。
追加接種
【2024年3月時点】現在、追加接種としてどのようなワクチンを受けられるのですか。どれを接種するのがよいのですか。
これから追加接種を行う場合には、ファイザー社、モデルナ社又は第一三共社のオミクロン株対応1価ワクチンを接種することとなります。
令和5年(2023年)12月26日現在、初回(1・2回目)接種を終えた生後6か月以上の全ての方を対象に、ファイザー社(生後6か月以上)、モデルナ社(6歳以上)又は第一三共社(12歳以上)のオミクロン株対応1価ワクチン(XBB.1.5)による追加接種を実施しています。従来のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)を上回る効果が期待されています。
これまでに接種した新型コロナワクチンの種類にかかわらず、最後の接種から3か月以上の間隔を空けて、1人1回受けていただくことができます(令和5年秋開始接種)。
【追加接種として受けられるワクチン】(令和5年12月26日現在)
<オミクロン株対応1価ワクチン>
- ファイザー社の12歳以上用1価ワクチン(XBB.1.5)(12歳以上)
- モデルナ社の1価ワクチン(XBB.1.5)(6歳以上)
- ファイザー社の5~11歳用1価ワクチン(XBB.1.5)(5~11歳)
- ファイザー社の6か月~4歳用1価ワクチン(XBB.1.5)(生後6か月~4歳)
- 第一三共社の1価ワクチン(XBB.1.5)(12歳以上)
上記のいずれも前回の接種から3か月以上の間隔をあける必要があります。詳しくはこちらをご覧ください。
なお、ファイザー社及びモデルナ社の従来ワクチン(1価)による追加接種は令和5年3月31日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】追加接種は、前回の接種からどのくらい間隔をあけたら受けることができますか。
前回の接種完了から追加接種が可能となるまでの間隔は、3か月以上です。
予防接種法に基づく3回目以降の接種までの間隔については、ファイザー社ワクチン(オミクロン株対応1価、12歳以上用、5~11歳用、6か月~4歳用)、モデルナ社ワクチン(オミクロン株対応1価、6歳以上用)及び第一三共社ワクチン(オミクロン株対応1価、12歳以上用)(※)は、いずれも前回の接種完了から3か月以上経過すれば、追加接種が可能となっています。
(※)ファイザー社及びモデルナ社の従来ワクチン(1価)による追加接種は令和5年(2023年)3月31日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社ワクチン(ノババックス)による接種は同年12月25日をもって終了しました。
オミクロン株対応1価ワクチンについては、こちらをご参照ください。
なお、令和5年9月20日からは、オミクロン株対応1価ワクチン(XBB.1.5)の接種が開始されており、初回接種を終了した生後6か月以上の全ての方は、同ワクチンの接種を受けていただくことになります。詳しくはこちらをご覧ください。
(参考資料)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
オミクロン株に対する新型コロナワクチンの有効性等[1.5MB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの接種について(第39回厚生科学審議会予防接種・ワクチン分科会資料)
オミクロン株対応2価ワクチンの接種間隔短縮について(第39回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児に対する接種(接種対象者、接種間隔等)について[700KB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】追加接種では、どのワクチンが使用されますか。これまでの接種とは異なるワクチンを使用(交互接種)しても大丈夫でしょうか。
追加接種に使用するワクチンは、それまでに用いたワクチンの種類に関わらず、対象年齢に応じたワクチンを接種することができます。
令和5年(2023年)12月26日現在、追加接種においては、それまでに用いたワクチンの種類に関わらず、12歳以上の方はファイザー社、モデルナ社及び第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)、6~11歳の方はモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)、生後6か月~11歳の方はファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)を接種することができます(*)。
(*)ファイザー社及びモデルナ社の従来ワクチン(1価)による追加接種は令和5年3月31日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
なお、諸外国でも、追加接種でそれまでと異なるワクチンの使用(交互接種)を認めている国は、米国を始め複数あります。
初回接種でファイザー社又はアストラゼネカ社のワクチンを受けた30歳以上の人を対象に、3回目接種でファイザー社、モデルナ社(注)、アストラゼネカ社、又はノババックス社のワクチンを受けた時の抗体価を比較した英国での調査結果によると、日本で薬事承認されている接種間隔と異なることに留意する必要があるものの、いずれのワクチンにおいても、対照群(髄膜炎菌のワクチンを接種)と比較して、接種から28日後の抗体価が有意に上昇するとともに、副反応は全てのワクチンの組み合わせで同様であり許容される旨、報告されています(※)。
(注)モデルナ社のワクチンは、日本において追加接種では50μgを接種することで薬事承認されていますが、この研究では100μgを接種しています。
日本においても、新型コロナワクチンの3回目接種を受けた人を対象に接種後の健康状況に係る調査を実施しており、初回接種と3回目接種で同種接種又は交互接種した時の、接種前後の抗スパイクタンパク質抗体価の推移や、一定期間内にみられた症状等を調査しています。
令和4年(2022年)11月11日の中間報告によると、初回接種でファイザー社のワクチンを接種した人が3回目にファイザー社又はモデルナ社のワクチンを接種した場合、初回接種でモデルナ社のワクチンを接種した人が3回目にファイザー社又はモデルナ社のワクチンを接種した場合、いずれの場合でも接種から1か月後にはスパイクタンパク質に対する抗体価が顕著に上昇し、接種から3か月後と6か月後には抗体価は低下するものの、3回目接種前と比較すると高い値であることが確認されています。
いずれの場合でも安全性については、3回目接種後では接種部位の痛み等が多くの方にみられ、発熱は接種翌日の発現頻度が最も高く、接種3日後にはほぼ消失していました。
<3回目接種前の抗体価との比較>
| 初回接種 | 3回目接種 | 1か月後 | 3か月後 | 6か月後 |
|---|---|---|---|---|
| ファイザー社 | ファイザー社 | 約49.3倍 | 約25.9倍 | 約16.2倍 |
| ファイザー社 | モデルナ社 | 約64.2倍 | 約32.6倍 | 約19.2倍 |
| モデルナ社 | ファイザー社 | 約15.5倍 | 約7.9倍 | 約7.2倍 |
| モデルナ社 | モデルナ社 | 約15.8倍 | 約8.1倍 | 約6.5倍 |
また、令和6年(2024年)1月26日の中間報告によると、4回目以降に武田社(ノババックス)のワクチンを接種した場合、スパイクタンパク質に対する幾何平均抗体価は、全体として接種前は7.817U/mL、接種1か月後で12,558U/mL、接種3か月後で9,460U/mL、接種6か月後で6,867U/mLでした。また、ヌクレオカプシドタンパク質に対する抗体の陰性者と陽性者では違いが認められました。安全性については、発熱(37.5℃以上)が5.9%、接種部位の痛みが65.3%の方にみられました。
新型コロナワクチンの4回目接種を受けた人も対象に接種後の健康状況に係る調査を実施しており、4回目接種で同種接種又は交互接種した時の、接種前後の抗スパイクタンパク質抗体価の推移や、一定期間内にみられた症状等を調査しています。令和5年3月10日の中間報告によると、4回目にファイザー社又はモデルナ社のワクチンを接種した場合、4回目接種前と比較した4回目接種後のスパイクタンパク質(従来株)に対する幾何平均抗体価は、接種1か月後で約4.4倍、3か月後で約2.8倍、6か月後で約2.1倍となり、接種1か月後には顕著に上昇し3か月後と6か月後には低下するものの、4回目接種前と比較すると高い値であることが確認されています。また、4回目にファイザー社又はモデルナ社のワクチンを接種した場合、オミクロン株BA.4-5に対する幾何平均中和抗体価(ウイルスの感染力又は毒素の活性を中和できる抗体の数値)は4回目接種前で8.5倍、4回目接種1か月後で40.8倍、3か月後で24.5倍でした。
安全性については、4回目接種後では接種部位の痛み等が多くの方にみられ、発熱は接種翌日の発現頻度が最も高く、接種3日後にはほぼ消失していました。
なお、それぞれの調査において、調査対象者の数、年齢分布、性別の分布及び追加接種の間隔が異なることから、それぞれの調査結果について、直接の比較は難しいことに留意が必要です。
このように、ファイザー社、モデルナ社、又は武田社(ノババックス)の従来ワクチン(1価)の3回目以降の接種を行った場合については、いずれも顕著な抗体価の上昇が確認されるとともに、安全面についても、上記のとおり知見が得られています。今後も、新たな知見が集積され次第、速やかにお知らせしていきます。
(参考資料)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
追加接種における交互接種、組み合わせに関する諸外国の状況[1.6MB](第27回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの追加(3回目)接種後の健康状況調査(厚生労働省)
新型コロナワクチンの追加(4回目以降)接種後の健康状況調査(厚生労働省)
※:Lancet. 2021;S0140-6736(21)02717-3
(Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2 in the UK (COV-BOOST): a blinded, multicentre, randomised, controlled, phase 2 trial)
【2024年3月時点】追加接種は無料で受けられますか。
初回(1回目・2回目)接種と同様、無料で接種いただけます。
初回接種と同様、追加接種においても、全額公費で実施するため、必要な接種については、無料で接種いただけます。接種が受けられる期間は令和6年(2024年)3月31日までです。
【2024年3月時点】初回(1回目・2回目)接種を海外で受けました。日本で追加接種は受けられますか。
日本で薬事承認されている新型コロナワクチンを海外で接種した場合、日本で追加接種を受けることは可能です。
日本で薬事承認されている新型コロナワクチンを海外で接種した場合、日本で追加接種を受けることは可能です。(※1)
上記の取扱いとすることができる新型コロナワクチンは以下のとおりです。
- 初回接種:ファイザー社(1価、2価)(5~11歳用及び6か月~4歳用を含む)(※2)、モデルナ社(1価)(※2)、アストラゼネカ社(※2)、武田社(ノババックス)(※2)、ヤンセンファーマ社(※1)のワクチン
- 追加接種:ファイザー社(1価、2価)(5~11歳用及び6か月~4歳用を含む)(※2)、モデルナ社(1価、2価)(※2)、第一三共社(1価)、武田社(ノババックス)(※2)、ヤンセンファーマ社(※1)のワクチン
(※1)ヤンセンファーマ社のワクチンにおける初回接種の接種回数は1回です。日本では令和5年(2023年)6月30日で薬事承認を整理されましたが、海外で1回接種が完了している場合、日本では2回目接種が完了しているものとみなし、海外で2回接種が完了している場合、日本では3回目接種が完了しているものとみなします。
(※2)日本ではアストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。
(注)下表の右欄に記載されている海外製のワクチンは、左欄に記載されている日本で薬事承認されているワクチンと同一のものとして取り扱います。
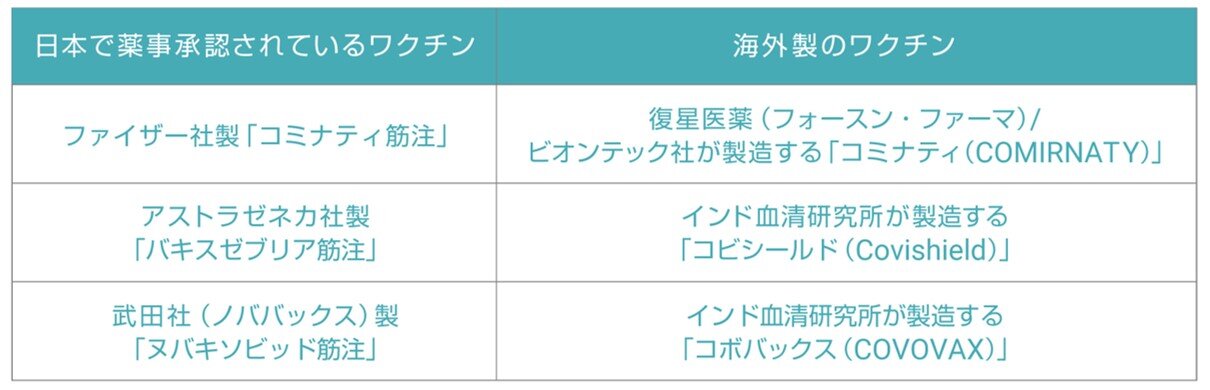
なお、日本で薬事承認されていない新型コロナワクチンを海外で接種した場合も、接種を受ける本人や保護者が希望する場合、日本でのワクチン接種は可能です。その場合、日本では未接種となるため、1回目の接種券を使用することになります。
【2024年3月時点】引っ越しをしました。接種券は現在住んでいる自治体から送付されますか。
住民票所在地が変更となった場合、接種券を取得するためには、申請が必要になります。(一部の市区町村では、申請なしで送付される場合もあります。)お住まいの市区町村にお問い合わせいただくか、コロナワクチンナビで接種券の発行申請を行ってください。
他の自治体へ引っ越す等、住民票所在地が変更となった場合、接種券を取得するためには、申請が必要になります。(一部の市区町村では、申請なしで送付される場合もあります。)お住まいの市区町村にお問い合わせいただくか、コロナワクチンナビ(*)で接種券の発行申請を行ってください。なお、コロナワクチンナビでの申請を受け付けていない市区町村もあります。
なお、接種券がお住まいの自治体から送付されないケースとしては、下記が想定されます。
- 他の市区町村へ引っ越す等、住民票所在地が変更となった場合
- 海外在留邦人の方で、成田空港又は羽田空港にて接種を受けた場合
- 在日米軍従業員接種で接種を受けた場合
- 製薬メーカーの臨床試験(治験)等において接種を受けた場合
- 海外で接種を受けた場合 等
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】初回(1回目・2回目)接種がまだ受けられていません。いつまでワクチン接種を受けることができるのですか。
接種が受けられる期間は、現在、令和3年(2021年)2月17日から令和6年(2024年)3月31日までとなっています。接種が可能な会場をご確認のうえ、お早めの予約をご検討ください。
接種が受けられる期間は、現在、令和3年2月17日から令和6年3月31日までとなっています。
なお、令和5年(2023年)9月20日から、初回接種としてオミクロン株対応1価ワクチン(XBB.1.5)が、生後6か月以上の全ての方に、使用されています。まだ接種を終えていない方は、お早めの予約をご検討ください。
初回(1回目・2回目)接種についての具体的なお知らせは、こちらをご確認ください。
小児接種(5~11歳)
【2024年3月時点】なぜ、小児(5~11歳)の追加(3回目)接種が必要なのですか。
オミクロン株の流行下で小児の重症者数が増加傾向にあること、初回(1回目・2回目)接種による発症予防効果が時間の経過とともに低下することから、小児への3回目接種が推奨されています。
令和4年(2022年)9月現在、オミクロン株の流行にともない、小児の感染者数も増加傾向にあり、重症例や死亡例の割合は低いものの、重症者数が増加傾向にあることが報告されています。
米国の報告によれば、オミクロン株流行下において、5~15歳への初回接種による発症予防効果は時間の経過とともに低下する一方、12~15歳への追加接種により発症予防効果が回復する(※1)ほか、3回目接種後の局所反応と全身反応の頻度は、2回目接種と比較して有意差がなかった(※2)、とされています。
ファイザー社の従来ワクチン(1価)の小児(5~11歳)への3回目接種についても、日本では、臨床試験における中和抗体価(ウイルスの感染力または毒素の活性を中和できる抗体の数値)の上昇等の有効性及び有害事象等の発生頻度等の安全性についての成績をもとに薬事承認されており、厚生労働省の審議会で議論された結果、有効性・安全性に関する知見等を踏まえ、予防接種法上の特例臨時接種に位置づけることとされました。
また、ファイザー社の5~11歳用オミクロン株対応2価ワクチン(従来株/BA.4-5)の小児(5~11歳)への追加接種についても、他の年齢層(12歳以上)への12歳以上用BA.4-5対応型2価ワクチンの追加接種による試験成績や、従来ワクチン(1価)の追加接種によるこれまでの知見等から一定の有効性が期待でき、有害事象の発現傾向が従来ワクチン(1価)と概ね同様であることや、海外での安全性情報に特段の懸念が認められないことから安全性が許容できると考えられ、薬事承認されており、2023年度以降の接種方針に関する議論や、ワクチンの有効性及び安全性に関する知見等を踏まえ、厚生労働省の審議会で議論された結果、予防接種法上の特例臨時接種に位置づけることとされました。モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の小児(6~11歳)への追加接種についても、他の年齢層(18歳以上)への2価ワクチンの追加接種による試験成績や、6~11歳への従来型1価ワクチンの追加接種による試験成績、これまでの知見等から、一定の有効性が期待でき、18歳以上において2価ワクチンの追加接種時の安全性は、1価ワクチン(従来株)の追加接種時の安全性と明確な差が認められないこと、6~11歳における1価ワクチン(従来株)の接種時の安全性の試験成績、また、製造販売後に新たな安全性の懸念は報告されていないこと等から、6~11歳における2価ワクチンの追加接種時の安全性は忍容可能とされ、薬事承認されています。その後、厚生労働省の審議会で議論された結果、予防接種法上の特例臨時接種に位置づけることとされました。
なお、オミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能と確認されていることを踏まえ、非臨床試験における接種により、オミクロン株XBB.1.5に対する中和抗体の産生が認められたことから、一定の有効性が期待されています。またオミクロン株対応1価ワクチン(XBB.1.5)の安全性についても、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられています。以上から、ファイザー社及びモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)について、それぞれ令和5年(2023年)9月1日及び同年9月12日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月20日及び同年9月25日より接種が開始されています。
*ファイザー社及びモデルナ社の従来ワクチン(1価)による追加接種は令和5年3月31日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日をもって終了しました。
(参考資料)
5~11歳の小児に対する追加接種について[1.5MB](第36回 厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
小児用のオミクロン株対応2価ワクチンについて[2.9MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:JAMA, 2022; 327(22):2210-2219
(Association of Prior BNT162b2 COVID-19 Vaccination With Symptomatic SARS-CoV-2 Infection in Children and Adolescents During Omicron Predominance.)
※2:MMWR Morb, 2022; 71:1047 1051
(Safety Monitoring of Pfizer BioNTech COVID 19 Vaccine Booster Doses Among Children Aged 5 11 Years.)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】なぜ、小児(5~11歳)の接種が必要なのですか。
小児においても中等症や重症例が確認されており、特に基礎疾患を有する等、重症化するリスクが高い小児には接種を行うことが望ましいとされています。また、今後様々な変異株が流行することも想定されるため、小児を対象にワクチン接種を進めることとされました。
小児(5~11歳)の新型コロナウイルス感染症において、中等症や重症例の割合は少ないものの、オミクロン株の流行に伴い新規感染者が増加する中で、重症に至る症例数が増加傾向にあること、感染者全体に占める小児の割合が増えていることが報告されています。
また、基礎疾患がある小児では、新型コロナウイルスに感染することで重症化するリスクが高くなると言われています。
今後、様々な変異株が流行することも想定されること、特に重症化リスクの高い基礎疾患を有する5~11歳の小児に対して接種を行うことが望ましいと考えられることから、厚生労働省の審議会で議論された結果、予防接種法に基づく接種に位置づけ、小児を対象にワクチン接種を進めることとされました。
5~11歳への接種における有効性についてはこちら、安全性についてはこちらをご参照ください。
(参考資料)
新型コロナワクチン接種についてのお知らせ(5歳から11歳のお子様と保護者の方へ)
小児(5~11歳)に対する新型コロナワクチンの有効性、安全性等[1.7MB](第29回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
5~17歳の小児への新型コロナワクチン接種に対する考え方(日本小児科学会)
新型コロナウイルス関連情報(日本小児科学会)
5歳から11歳のお子様への追加接種(リーフレット)
生後6か月~17歳の小児への新型コロナワクチン接種に対する考え方 (日本小児科学会)
生後6か月~17歳の小児への新型コロナワクチン令和5年度秋冬接種に対する考え方 (日本小児科学会)
【2024年3月時点】小児(5~11歳)の接種では、どのような効果がありますか。
ファイザー社のワクチンは、5~11歳の小児においても、現在の流行株であるオミクロンXBB系統に対して、中和抗体価の上昇が確認され、重症化予防効果等の向上が期待されています。モデルナ社のワクチンも6~11歳の小児において、同様の効果が期待されています。
令和5年(2023年)11月1日現在、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)が5~11歳を対象として、初回(1回目・2回目)と追加接種(3回目以降)に使用でき、日本では令和5年9月1日に薬事承認されています。また、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)も6~11歳を対象として、追加接種(3回目以降)及び初回(1・2回目)接種に使用でき、日本ではそれぞれ令和5年9月12日及び同年10月24日に薬事承認されています。
<オミクロン株対応1価ワクチン>
オミクロン株対応1価ワクチン(XBB.1.5)について、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能と確認されていることを踏まえ、非臨床試験における接種により、オミクロン株XBB.1.5に対する中和抗体の産生が認められたことから、一定の有効性が期待されています。またオミクロン株対応1価ワクチン(XBB.1.5)の安全性についても、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられています。以上から、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)による初回接種と追加接種、及びモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による追加接種について、それぞれ令和5年9月1日及び同年9月12日に薬事承認され、厚生労働省の審議会で議論した結果、予防接種法上の特例臨時接種に位置づけられ、それぞれ同年9月20日及び同年9月25日より接種が開始されています。
また、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の臨床試験において中和抗体価の上昇がみられ有効性が確認されていること、単一の年齢層の臨床試験の結果は既に承認されている製剤の他の年齢層にも外挿が可能とされていることを踏まえ、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の臨床試験における追加接種により、オミクロン株亜系統に対する中和抗体の産生が確認されたことから、初回接種でも免疫応答と有効性が期待できるとされ、令和5年10月24日に薬事承認され、同年11月1日より初回接種が開始されています。
なお、オミクロン株対応1価ワクチン(XBB.1.5)は、非臨床試験等においてXBB.1.5に対してこれまでのオミクロン株対応2価ワクチンよりも高い中和抗体価を誘導することや、オミクロン株対応1価ワクチン(XBB.1.5)の接種で得られる中和抗体は、現在流行の中心であるオミクロンXBB系統の亜系統であるオミクロンEG.5.1に対してもXBB.1.5と同程度に効果があることが報告されており、現在の流行株であるオミクロンXBB系統に対して、重症化予防効果はもとより、発症予防効果の向上も期待されています。
今後も、新たな知見が得られ次第、速やかにお知らせしてまいります。
<参考>
<従来ワクチン(1価)>
米国で5~11歳を対象に実施された臨床試験の結果によると、2回目の接種から1か月後の血清中の新型コロナウイルスに対する中和抗体価(ウイルスの感染力または毒素の活性を中和できる抗体の数値)や抗体応答率(抗体価がベースライン値(1回目接種前)から4倍以上に上昇した被験者の数)は、別の臨床試験で有効性が確認されている16~25歳におけるワクチン接種後の中和抗体価や抗体応答率と比較して非劣性(劣っていないこと)が示されています。すなわち、5~11歳でも、16~25歳と同程度に抗体価が上昇し、有効性が評価できるとされています(※1)。
また、中和抗体価の確認後に行われた解析において、新型コロナウイルスに感染歴の無い人を対象に、2回目接種後7日以降の発症予防効果を確認したところ、90.7%であったことが報告されています(※1)。
なお、これらのデータはオミクロン株が流行する前のものであることに留意する必要があります。
オミクロン株に対しては、現時点で得られている米国での研究結果によると、ファイザー社のワクチンにおける感染予防効果は、5~11歳では2回接種後14~82日後で31%、12~15歳では2回接種後14~149日後で59%という報告があり、一定の効果が期待されています(※2)。また、成人では、オミクロン株に対する発症予防効果や入院予防効果等が確認されており、5~11歳に対しても、同様の効果が期待されています。米国でオミクロン株流行期に5~18歳を対象に実施された研究では、ファイザー社のワクチンを2回接種完了後の入院予防効果は5~11歳で68%、12~18歳で40%であったと報告されています(※3)。
なお、シンガポールでオミクロン株流行期の5~11歳を対象に実施された研究では、ファイザー社ワクチンを2回接種した後の感染予防効果は36.8%、入院予防効果は82.7%であったと報告されています(※4)。
5~11歳の3回目接種については、海外で実施されたファイザー社ワクチンの臨床試験の結果によると、感染歴のない集団において、3回目接種から1か月後の従来株(変異前の株)に対する中和抗体価は、2回目接種から1か月後と比較して約2.2倍の上昇が認められ、さらに、3回目接種から1か月後のオミクロン株に対する中和抗体価は、2回目接種から1か月後と比較して約22倍の上昇が認められました。
また、オミクロン株流行期における他の年齢層での3回目接種による発症予防効果が報告されており(※5)、5~11歳の日本人小児に対しても、一定の有効性が期待できると判断されています。日本では令和4年(2022年)8月30日に5~11歳の3回目接種に係る薬事承認がなされています。
<オミクロン株対応2価ワクチン>
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の小児(5~11歳)への追加接種についても、他の年齢層(12歳以上)へのBA.4-5対応2価ワクチンの追加接種による試験成績や、従来型1価ワクチンの追加接種によるこれまでの知見等から一定の有効性が期待でき、有害事象の発現傾向が従来型1価ワクチンと概ね同様であることや、海外での安全性情報に特段の懸念が認められないことから安全性は許容できると考えられ、令和5年2月28日に薬事承認がなされています。
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の小児(6~11歳)への追加接種についても、他の年齢層(18歳以上)への2価ワクチンの追加接種による試験成績や、6~11歳への従来型1価ワクチンの追加接種による試験成績、これまでの知見等から、一定の有効性が期待でき、18歳以上において2価ワクチンの追加接種時の安全性は、1価ワクチン(従来株)の追加接種時の安全性と明確な差が認められないこと、6~11歳における1価ワクチン(従来株)の接種時の安全性の試験成績、また、製造販売後に新たな安全性の懸念は報告されていないこと等から、6~11歳における2価ワクチンの追加接種時の安全性は忍容可能とされ、令和5年8月2日に薬事承認がなされています。
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による小児(5~11歳)への初回接種について、他の年齢層(18歳以上)へのBA.4-5対応2価ワクチンの4回目接種による中和抗体の誘導や、非臨床試験での初回接種による起源株とオミクロン株亜系統に対する中和抗体の誘導等から、一定の有効性が期待できるとされ、追加接種後の有害事象の発現状況等、これまでに得られている臨床試験成績や製造販売後の安全性情報から、2価ワクチンの安全性プロファイルはこれまでに確認されているものと同様と考えられ、現時点で新たな懸念は認められておらず安全性は許容可能とされ、令和5年8月2日に薬事承認がなされています。
*モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、ファイザー社の従来ワクチン(1価)による接種は同年9月19日をもって終了しました。また、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日をもって終了しました。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナウイルス(SARS-CoV-2)の変異株EG.5.1系統について(国立感染症研究所)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用))
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(初回免疫等))
小児(5~11歳)に対する新型コロナワクチンの有効性、安全性等[1.7MB](第29回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの5~15歳におけるオミクロン株に対する感染予防効果等[1.2MB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
参考:小児(5-11歳)におけるオミクロン株に対する新型コロナワクチンの感染・入院予防効果[1.9MB](第36回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児用のオミクロン株対応2価ワクチンについて[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:N Engl J Med. 2021; Nov
(Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age)
※2:CDC:Morbidity and Mortality Weekly Report (MMWR)
(Effectiveness of 2-Dose BNT162b2 (Pfizer BioNTech) mRNA Vaccine in Preventing SARS-CoV-2 Infection Among Children Aged 5-11 Years and Adolescents Aged 12-15 Years - PROTECT Cohort, July 2021-February 2022)
※3:N Engl J Med 2022; 386:1899-1909
(BNT162b2 Protection against the Omicron Variant in Children and Adolescents)
※4:N Engl J Med 2022; 387:525-532
(Effectiveness of BNT162b2 Vaccine against Omicron in Children 5 to 11 Years of Age)
※5:JAMA 2022; 327(22):2210-2219
(Association of Prior BNT162b2 COVID-19 Vaccination With Symptomatic SARS-CoV-2 Infection in Children and Adolescents During Omicron Predominance)
【2024年3月時点】小児で接種する量や回数、接種間隔は成人と同じですか。
小児で接種する有効成分の量は、12歳以上で接種する量より少なく設定されています。小児での接種回数と接種間隔は、12歳以上での接種と同様に設定されています。
小児接種において令和5年(2023年)9月19日までは、従来ワクチン(1価)やオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)が使用されていましたが、同年9月20日以降はオミクロン株対応1価ワクチン(XBB.1.5)が使用されており、5~11歳用のファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)、又は6~11歳の用量でモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)を接種します。
- ファイザー社のワクチンを使用する場合
5~11歳では、初回接種で1回10μg(0.2mL)を、通常、3週間の間隔で2回接種します。12歳以上の接種では、1回30μg(0.3mL)を、通常、3週間の間隔で2回接種することとされていますので、5~11歳で接種する有効成分の量は、12歳以上で接種する量の3分の1になります。なお、1回目と2回目の接種間隔は12歳以上の場合と同じであり、2回目の接種は一番早くて1回目接種の19日後から接種が可能であること、3週間を超えた場合はできる限り速やかに2回目を接種することをお願いしています。追加接種での接種間隔は、前回の接種から3か月以上あけることとなっています。
5~11歳を対象とした臨床試験では、10μg、20μg又は30μgを投与して用量の検討が行われました。その結果、10μgの投与量でも、十分な中和抗体価の上昇と90.7%の発症予防効果が確認され、安全性や忍容性が許容可能と判断されたため、この用量で投与することとされました。
5歳と11歳では体格差が大きいことが考えられますが、年齢層毎のサブグループ(5~6歳、7~8歳、9~11歳)における中和抗体価の上昇度合いや、接種後の様々な症状の発現頻度は、グループ間で概ね同等であったことが報告されています。
ファイザー社の5~11歳用のワクチンは、12歳以上で使用するワクチンとは別製剤です。これは、小児専用の製剤として濃度が調整されており(12歳以上の製剤の半分)、一回量を正確に採取することができるようになっているためです。接種会場では、12歳以上用のワクチンとの間違い接種が起こらないよう、様々な工夫をお願いしています。
- モデルナ社のワクチンを使用する場合
6~11歳では、初回接種で1回50μg(0.5mL)を、通常、4週間の間隔で2回接種します。12歳以上の初回接種では、1回100μg(1.0mL)を、通常、4週間の間隔で2回接種することとされていますので、6~11歳で接種する有効成分の量は、12歳以上で接種する量の2分の1になります。なお、1回目と2回目の接種間隔は12歳以上の場合と同じであり、2回目の接種は一番早くて1回目接種の21日後から接種が可能であること、4週間を超えた場合はできる限り速やかに2回目を接種することをお願いしています。追加接種での接種間隔は、前回の接種から3か月以上あけることとなっています。
従来ワクチン(1価)やオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)による接種は、令和5年9月19日をもって終了しました。令和5年9月20日からは、ファイザー社のオミクロン株対応1価ワクチン(XBB1.5)が小児(5~11歳)を対象として初回接種と追加接種で使用され、同年9月25日及び同年11月1日からは、モデルナ社のオミクロン株対応1価ワクチン(XBB1.5)が小児(6~11歳)を対象としてそれぞれ追加接種及び初回接種で使用されています。接種する有効成分の量、回数や間隔は、オミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)と同様に設定されています。
(参考資料)
小児(5~11歳)に対する新型コロナワクチンの免疫原性、安全性[670KB](第29回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用))
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
N Engl J Med. 2021; Nov
(Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age)
ファイザー社ワクチンの添付文書(PMDAのHP)
モデルナ社ワクチンの添付文書(PMDAのHP)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】小児(5~11歳)の接種にはどのような副反応がありますか。
安全性は既承認の製剤と同様であり、接種部位の痛みや倦怠感、頭痛、発熱等、様々な症状が確認されていますが、ほとんどが軽度又は中等度であり回復していることなど、現時点で得られている情報からは、安全性に重大な懸念は認められていないと判断されています。
令和5年(2023年)11月1日現在、5~11歳を対象としたファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)、6~11歳を対象としたモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の使用が可能となっています。その安全性については、従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)の安全性について、これまで実施された臨床試験におけるデータや接種後の副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、既承認の製剤と基本的には同様であり、特段の懸念はないものと考えられ、ファイザー社ワクチンによる初回接種と追加接種が令和5年9月1日に、モデルナ社ワクチンによる追加接種(6歳以上)及び初回接種(生後6か月以上)がそれぞれ同年9月12日及び同年10月24日に薬事承認されています。
また、既承認の製剤であるファイザー社及びモデルナ社の従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)については、主な副反応として、注射した部分の痛み、頭痛、疲労、発熱等がありますが、現時点で重大な懸念は認められないことが薬事承認審査で確認されています。
<参考>
ファイザー社のワクチンは、従来ワクチン(1価)について5~11歳の接種においても、12歳以上の方と同様、接種部位の痛みや倦怠感、頭痛、発熱等、様々な症状が臨床試験で確認されていますが、ほとんどが軽度又は中等度であり回復していることなど、現時点で得られている情報からは、安全性に重大な懸念は認められていないと判断されています。また、1回目接種時、2回目接種時いずれも、症状がみられたのは、局所反応が接種後1~2日、持続期間(中央値)は1~2日であり、全身反応が接種後2~4日、持続期間(中央値)は1~2日と報告されています。

臨床試験では、12歳以上と同様、2回目接種時の方が1回目接種時より発現頻度が高かった症状も多く、また、接種後1か月間では、頻度は低いものの、リンパ節症(リンパ節の腫れや痛み等)も報告(0.9%)されています。ただし、リンパ節症については、12歳以上においても発現している症状であること、例えばファイザー社の追加接種に係る臨床試験においても、ほとんどの場合が軽度であり、発現後短期間で症状が治まっていることが確認されています。
また、ファイザー社が5~11歳を対象に実施した追加接種に係る臨床試験においても、リンパ節の腫れは2回目よりも3回目で多く(2%程度)報告されていますが、症状はほとんどが軽度又は中等度であり、接種から約1週間で回復することが確認されています。
なお、米国で実施された、ワクチン接種後の様々な症状に関する解析結果によると、5~11歳の男性においても、2回目接種時に心筋炎が報告されています。しかし、その報告頻度は12~15歳及び16~17歳の男性と比較して低かったことが確認されています(※1)。日本におけるワクチン接種後の心筋炎の疑い報告の状況についてはこちらをご覧ください。
米国CDCのデータによると、5~11歳における2回目接種後1週間以内にみられた様々な症状(局所及び全身性の反応や、健康状態、日常生活や登校への支障等)は、12歳~15歳における接種後と比較して、その発現割合が低かったとの報告もあります(※2)。
また、オミクロン株対応2価ワクチン(従来株/BA.4-5)の小児(5~11歳)への初回接種や追加接種について、本2価ワクチンや従来ワクチン(1価)の追加接種による臨床試験の安全性のデータから有害事象の発現傾向が従来型1価ワクチンと概ね同様であることや、海外での安全性情報に特段の懸念が認められないことから、安全性は許容できると考えられています。
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)について、18歳以上において2価ワクチンの追加接種時の安全性は、1価ワクチン(従来株)の追加接種時の安全性と明確な差が認められないこと、6~11歳における1価ワクチン(従来株)の接種時の安全性の試験成績、また、製造販売後に新たな安全性の懸念は報告されていないこと等から、6~11歳における2価ワクチンの追加接種時の安全性は忍容可能とされています。
厚生労働省では、接種後の副反応を疑う事例を収集し、専門家による評価を行うとともに、接種後の健康状況に係る調査を実施しています。
同調査の令和4年(2022年)12月16日の中間報告によれば、初回接種後のスパイクタンパク質に対する抗体価について、接種前と比較して接種1か月後は約1,280倍、3か月後は約1,150倍、6か月後は約1,480倍となりました。令和5年10月27日の中間報告によれば、ファイザー社の従来ワクチン(1価)による3回目接種後のスパイクタンパク質に対する幾何平均抗体価について、接種前は2,977U/mL、接種1か月後は19,035U/mL、接種3か月後は10,211U/mL、接種6か月後は7,285U/mLでした。また、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種後のスパイクタンパク質に対する幾何平均抗体価について、接種前は6,347U/mL、接種1か月後は27,064U/mL、接種3か月後は13,166U/mLでした。安全性については、従来ワクチン(1価)による3回目接種・オミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種ともに、一部の方に発熱や局所の疼痛等がみられました。
今後も新たな知見が得られ次第、速やかにお知らしていきます。
(参考資料)
新変異株対応のコロナワクチンの評価方針について(薬事・食品衛生審議会医薬品第二部会資料)
ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)の審査結果
PMDAの審査報告書(モデルナ社のオミクロン株対応1価ワクチン(初回免疫))
ファイザー社ワクチンの添付文書(PMDAのHP)
モデルナ社ワクチンの添付文書(PMDAのHP)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用))
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(初回免疫等))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
小児(5~11歳)の新型コロナワクチンの有効性、安全性等[1.7MB](第29回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児用のオミクロン株対応2価ワクチンについて[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの初回接種後の健康状況調査
新型コロナワクチンの追加接種後の健康状況調査
オミクロン株対応2価ワクチンの追加接種後の健康状況調査
N Engl J Med. 2021; Nov
(Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age)
※1:COVID-19 vaccine safety updates: Primary series in children and adolescents ages 5-11 and 12-15 years, and booster doses in adolescents ages 16-24 years
※2:Safety monitoring of COVID-19 vaccine among children and young adults in v-safe
【2024年3月時点】子どもがワクチン接種後に発熱しました。対応は成人の場合と同じでよいでしょうか。
成人の場合と同様です。ワクチン接種後の発熱に対しては、日本小児科学会より、発熱の程度に応じて解熱鎮痛薬を使用できることが示されています。ご不安な場合は都道府県の相談窓口や、身近な医療機関にご相談ください。
厚生労働省では、各都道府県に対し、新型コロナワクチン接種後の副反応に係る相談窓口等の設置と、専門的な医療機関を円滑に受診できる体制の確保をお願いしています。小児(5~11歳)に対しては、保護者からの相談も受け付けていますので、都道府県の相談窓口をご活用ください。
なお、副反応を疑う症状に対する診療体制の構築については、こちらでも解説しています。
ワクチン接種後の発熱に対して、日本小児科学会では、ホームページの中で下記のように示しています。
「ワクチン接種後の発熱は、ほとんどが接種当日から翌日にかけてみられ、1日程度で解熱する場合が多いとされています。程度が軽い場合は、冷却などで様子をみていただくことでかまいません。発熱の程度に応じて解熱薬を使用することもできます。こどもで安全に使用できる解熱薬として、アセトアミノフェンがあげられます。サリチル酸系、ジクロフェナクナトリウム、メフェナム酸などの解熱薬は、インフルエンザや水痘などのウイルス感染時に使用した場合の急性脳症発症や重症化との関連の可能性があるため、使用を控えてください。
熱性けいれんを起こしたことがある場合、何らかの病気で治療を受けている場合、薬などでアレルギー症状を起こしたことがある場合などは、発熱時の対応について事前にかかりつけの先生にご相談下さい。
発熱が長く続く場合、発熱以外の症状もある場合などもかかりつけの先生にご相談下さい。」
ご不安な場合は、前述の都道府県の相談窓口や、身近な医療機関にご相談ください。
(参考資料)
新型コロナウイルスワクチン接種後の副反応を疑う症状に対する診療体制の構築について(厚生労働省)
5歳以上11歳以下の者への新型コロナワクチン接種に向けた接種体制の準備について(厚生労働省)
「新型コロナワクチン~子どもならびに子どもに接する成人への接種に対する考え方~」に関するQ&A(日本小児科学会)
【2024年3月時点】小児の接種時に必要なものはありますか。
5~11歳のワクチン接種では、原則、保護者の同伴が必要となります。また、未就学児の子どもの接種履歴は母子健康手帳で管理しているため、特にこの年代の方は、接種当日は可能な限り、母子健康手帳の持参をお願いします。
5~11歳のワクチン接種では、原則、保護者の同伴が必要となります。予診票に保護者の署名が必要となり、署名がなければワクチンの接種はできません。また、未就学児の子どもの接種履歴は母子健康手帳で管理しているため、特にこの年代の方は、接種当日は可能な限り、母子健康手帳の持参をお願いします。この他、送付された接種券等一式と本人確認書類(マイナンバーカード、健康保険証等)を忘れずにお持ちください。
【2024年3月時点】海外では小児(5~11歳)の接種が行われていますか。
2023年秋冬の接種に用いるワクチンについて、海外ではいくつかの国でオミクロン株対応1価ワクチン(XBB.1系統)の接種が承認され、接種が開始されています。
2024年2月時点で、WHO(世界保健機構)、EMA(欧州医薬品庁)、FDA(米国食品医薬品局)から2023年秋冬に用いるワクチンについての推奨が発表されており、米国、英国、カナダ等において、我が国で接種を行うオミクロン株対応1価ワクチン(XBB.1.5)と同様のワクチンの接種が開始されています。
(参考資料)
諸外国の状況について[830KB](第55回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】1回目の接種後、2回目の接種前に12歳の誕生日がきました。どうしたらよいでしょうか。
11歳以下と12歳以上では、接種するワクチンの(種類も)量も異なります。2回目も1回目と同じワクチンを接種します。
11歳以下と12歳以上では、接種するワクチンの(種類も)量も異なります。1回目の接種後、2回目の接種前に12歳の誕生日を迎えた場合は、1回目の接種時の年齢に基づき、2回目も1回目と同じワクチンを接種する必要がありますので、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5、5~11歳用)又は6~11歳の用量でモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)を接種します。
【2024年3月時点】小児(5~11歳)の接種に向けて、保護者が気を付けることはありますか。
ワクチン接種後数日以内は、様々な症状に注意しながら過ごす必要があります。また接種後でも、引き続き効果的な感染対策の継続をお願いします。学校生活では、接種を受けるまたは受けないことによって、差別やいじめなどが起きることのないようお願いします。
ワクチン接種後数日以内は、接種部位の痛みや倦怠感、頭痛、発熱等の症状がみられることが多いため、このような症状に注意しながら過ごす必要があります。また、海外では、ごく稀ですが、接種後に軽症の心筋炎を発症した例が報告されています。接種後4日程度の間に、胸の痛みや動悸、息切れ、むくみなどの症状がみられた場合は、速やかに医療機関を受診し、ワクチンを接種したことを伝えてください。
また、ワクチンの効果は100%ではありません。ワクチン接種後であっても、引き続き、マスクの効果的な場面での着用(※)や石けんによる手洗い、手指消毒用アルコールによる消毒の励行、こまめな換気など、効果的な感染対策の継続をお願いします。
(※)令和5年(2023年)3月13日から、マスクの着用は、個人の主体的な選択を尊重し、個人の判断が基本となりました。ただし、マスクの着用が推奨される場面がありますので、ご留意をお願いします。詳しくはこちらをご覧ください。
5~11歳の子どものワクチン接種についても、発症予防効果など接種のメリットが、副反応などのデメリットよりも大きいことを確認して、皆さまに接種をお勧めしています。しかし、接種を望まない方に接種を強制することはなく、受ける方の同意なく接種が行われることもありません。また、医学的観点から接種をできない方もいます。幼稚園や小学校等においても、接種を受けるまたは受けないことによって、差別やいじめなどが起きることのないようお願いします。
小児接種における有効性についてはこちらをご確認ください。
【2024年3月時点】接種した当日や翌日は学校(幼稚園を含む)等を休んでも大丈夫でしょうか。
ワクチン接種や、その後の副反応等で学校等を休む場合は、欠席としないなど柔軟な取扱いが可能とされています。出欠の取扱いについては、まずは、子どもが通う学校等にご相談ください。
学校等に通う子どもがワクチン接種を受ける場合、例えば、接種の期日や場所の選択が困難であり、かつ、接種場所までの移動に長時間を要する場合等に、校長や園長が「非常変災等生徒又は保護者の責任に帰すことのできない事由で欠席した場合などで、校長(又は園長)が出席しなくてもよいと認めた場合」に該当すると判断し、指導要録上「出席停止・忌引き等の日数」として記録(幼稚園等については備考欄等にその旨を記載)することで、欠席としないなどの柔軟な取扱いをすることを可能としています。
また、副反応であるか否かに関わらず、接種後、子どもに発熱等の風邪の症状がみられたときには、学校等は、学校保健安全法第19条の規定(の準用)に基づく出席停止の措置を取ることができます。また、これらの症状以外の症状がみられた場合にも、子どもやその保護者から状況を伺い、校長や施設長等において適切に判断いただくよう、お願いしています。
学校等の出欠の取扱いについては、こうしたことも踏まえて、まずは、子どもが通う学校等にご相談ください。
また、新型コロナワクチン接種に関することについては、お住まいの市区町村の相談窓口にご相談ください。
(参考資料)
新型コロナウイルス感染症に係る予防接種の幼児児童生徒に対する実施についての学校等における考え方及び留意点等について(文部科学省・内閣府・厚生労働省)
【2024年3月時点】接種後に子どもが副反応等で体調を崩した場合、保護者は仕事を休んでも大丈夫でしょうか。
企業によっては、このような場合に活用できる休暇制度を設けている場合があります。小学校就学前であれば、育児・介護休業法における子の看護休暇の取得を申し出ることも考えられます。また、年次有給休暇の利用目的は限定されていません。子どもへのワクチン接種等のため仕事を休む必要があると考えられる場合は、あらかじめ、職場によく相談しておくことをお勧めします。
小児(5~11歳)のワクチン接種では、原則として、保護者の同伴が必要とされており、また、接種後の副反応等で子どもが体調を崩した場合の看病などで、労働者でもある保護者が急に仕事を休まざるを得ない場合も生じ得ます。
企業によっては、「ファミリーサポート休暇」など、このような場合にも活用できる休暇制度を設けている場合があります。接種対象の子どもが小学校就学前である場合は、育児・介護休業法における子の看護休暇の取得を、事業主に申し出ることが考えられます。
また、年次有給休暇の利用目的は限定されていませんので、このような場合にも取得することが可能です。
子どもへのワクチン接種を希望する労働者が安心してワクチン接種に臨めるような環境整備が企業にも望まれます。
子どもへのワクチン接種等のため仕事を休む必要があると考えられる場合は、あらかじめ、職場によく相談しておくことをお勧めします。
(参考資料)
新型コロナウイルスに関するQ&A(企業の方向け)(厚生労働省)
【2024年3月時点】基礎疾患がある子どもに接種して大丈夫でしょうか。
基礎疾患がある子どもなど、特に重症化リスクの高い方には接種をお勧めしています。主治医とよく相談しながら、接種をご検討ください。
基礎疾患がある子どもなど、特に重症化リスクの高い方には接種をお勧めしています。主治医とよく相談しながら、接種をご検討ください。
5~11歳を対象とした臨床試験では、肥満や喘息、神経疾患、先天性心臓疾患等の基礎疾患がある方も含めて試験が実施され、ワクチン接種の有効性が確認されています。また、安全性についても、評価された例数に限りがあることに留意する必要があるものの、被験者全体における結果と同様であったことが確認されています。
なお、日本小児科学会では、新型コロナワクチンの接種にあたり考慮すべき小児の基礎疾患等を公開しています。詳細はこちらをご覧ください。
(参考資料)
5~17歳の小児への新型コロナワクチン接種に対する考え方(日本小児科学会)
新型コロナウイルス関連情報(日本小児科学会)
【2024年3月時点】ワクチンの接種会場は成人と同じでしょうか。
会場によって取り扱うワクチンは異なります。自治体からのお知らせ等をよくお読みいただき、接種可能な会場をお探しの上、ご予約をお願いします。
会場によって取り扱うワクチンが異なり、5~11歳のワクチン接種のみを実施する会場もあれば、11歳以下の接種と12歳以上の接種の両方を実施する会場もあります。自治体からのお知らせ等をよくお読みいただき、接種可能な会場をお探しの上、ご予約をお願いします。
「コロナワクチンナビ」(*)の接種会場一覧 にも、小児(5~11歳)用のファイザー社のワクチンを取り扱う医療機関情報を掲載しています。
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】小児(5~11歳)の接種に「努力義務」は適用されているのでしょうか。
令和5年(2023年)秋冬の接種では、接種目的が重症化予防とされたことから、重症化リスクの高い方にのみ努力義務の規定が適用されています。ただし、接種は強制ではなく、ご本人や保護者の判断に基づいて受けていただくことに変わりはありません。
新型コロナワクチンの接種については、新型コロナウイルス感染症の緊急のまん延予防のために実施する趣旨に鑑み、予防接種法上の「接種勧奨」及び「努力義務」の規定は原則として適用されることとなっていますが、これまで行われてきた初回(1回目・2回目)接種に関しては、小児におけるオミクロン株の感染状況(感染者、重症化の動向)が確定的でなかったこと(増加傾向の途上にあったこと)、また、オミクロン株については、小児における発症予防効果・重症化予防効果に関するエビデンスが必ずしも十分ではなかったこと(オミクロン株の出現以前の知見であったこと)から、小児については努力義務の規定が適用されていませんでした。
令和4年(2022年)9月現在、オミクロン株の流行にともない、小児の感染者数も増加傾向にあり、重症例や死亡例の割合は低いものの、重症者数が増加傾向にあることが報告されています。このような中、オミクロン株流行下での小児接種のエビデンスとして、
<初回(1回目・2回目)接種に関するエビデンス>
- 発症予防効果は中等度の有効性、入院予防効果は接種後2か月間で約80%の有効性が報告されている(※1)
- 米国の大規模データベースによる解析で、安全性に関する懸念はないと報告され(※2)、日本での副反応疑い報告の状況からも、ワクチンの接種体制に影響を与えるほどの重大な懸念はないとされている
といった報告が新たになされました。そのため、令和4年8月8日の厚生科学審議会において、これまで適用されていなかった、小児(5~11歳)に対する初回接種に関する努力義務が適用されるといった議論が行われました。
また、令和4年9月2日には、小児(5~11歳)に対する3回目接種を特例臨時接種に位置づける議論を行いましたが、このとき、
<3回目接種に関するエビデンス>
- 時間の経過とともに低下した感染予防効果が3回目接種により回復することが、近接した年齢層(12~15歳)で確認され(※3)、日本において薬事承認されている
- 3回目接種による局所及び全身反応について、その頻度は、2回目接種と比較して有意な差がなかったことが海外で報告され(※4)、日本の薬事審査でも、そのほとんどが軽症又は中等症であり大きな懸念はないとされている
などがあり、小児(5~11歳)への3回目接種についても努力義務の規定を適用することが妥当であるとされました。
こうした議論を踏まえ、令和4年9月6日から、小児(5~11歳)に対する初回(1回目・2回目)接種、3回目接種ともに、努力義務が適用されることになりました。
なお、令和5年9月20日以降に行う追加接種については、
- WHO(世界保健機関)は新型コロナワクチンの利用に関する指針において、高齢者等に対しては更なる追加接種を推奨する一方、健康な乳幼児、小児、成人等に対しては推奨せず、健康な乳幼児と小児に対しては、初回接種を含め、疾病負荷等を踏まえ各国において検討すべきとしていること
- 日本におけるオミクロン株の流行状況について、年齢別の重症化率や致死率は令和4年1~8月において、高齢者では高い一方、それ以下の世代では低い状況にあること
を踏まえ、重症者を減らすという接種の目的のもと、重症化リスクが高い者を接種の対象としつつ、その他の全ての者には接種の機会を提供することとしています。
公的関与(接種勧奨及び努力義務)の規定については、令和5年5月8日以降、追加接種では高齢者など重症化リスクの高い方、初回接種では接種可能な全ての年齢の方に適用されていましたが、令和5年秋冬の接種の目的が重症化予防とされていることから、同年9月20日以降、初回接種と追加接種のいずれも重症化リスクの高い方にのみ当該規定が適用されることとなります。
ただし、接種は強制ではなく、ご本人や保護者の判断に基づき受けていただくことに変わりはありません。
努力義務についてはこちらをご覧ください。
(参考資料)
予防接種法における公的関与の規定(参照条文)[549KB](第30回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
5~11歳の小児に対する公的関与の規定の適用(追加接種の場合)[1.9MB](第36回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
※1:N Engl J Med 2022; 387:525-532.
(Effectiveness of BNT162b2 Vaccine against Omicron in Children 5 to 11 Years of Age.)
※2:Pediatrics, 2022;150(2): e2022057313
(Safety of COVID-19 Vaccination in United States Children Ages 5 to 11 Years.)
※3:JAMA, 2022; 327(22):2210-2219
(Association of Prior BNT162b2 COVID-19 Vaccination With Symptomatic SARS-CoV-2 Infection in Children and Adolescents During Omicron Predominance.)
※4:MMWR Morb, 2022; 71:1047 1051
(Safety Monitoring of Pfizer BioNTech COVID 19 Vaccine Booster Doses Among Children Aged 5 11 Years.)
2023年度の接種における公的関与の規定の適用[545KB](第44回及び第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
ワクチンの仕組み
【2024年3月時点】予防接種とは何ですか。
予防接種とは、感染症の原因となる病原体に対する免疫ができる体の仕組みを使って、病気に対する免疫をつけたり、免疫を強くしたりするために、ワクチンを接種することをいいます。
一般に、感染症にかかると、原因となる病原体(ウイルスや細菌など)に対する「免疫」(抵抗力)ができます。免疫ができることで、その感染症に再びかかりにくくなったり、かかっても症状が軽くなったりするようになります。
予防接種とは、このような体の仕組みを使って病気に対する免疫をつけたり、免疫を強くしたりするために、ワクチンを接種することをいいます。
【2024年3月時点】ワクチンにはどのようなものがあるのですか。
病原体(ウイルスや細菌など)そのもの又は、病原体を構成する物質などをもとに作ったワクチンがあります。
病原体(ウイルスや細菌など)そのもの又は、病原体を構成する物質などをもとに作ったワクチンを接種することで、その病原体に対する免疫ができます。具体的には、以下のようなものがあります。
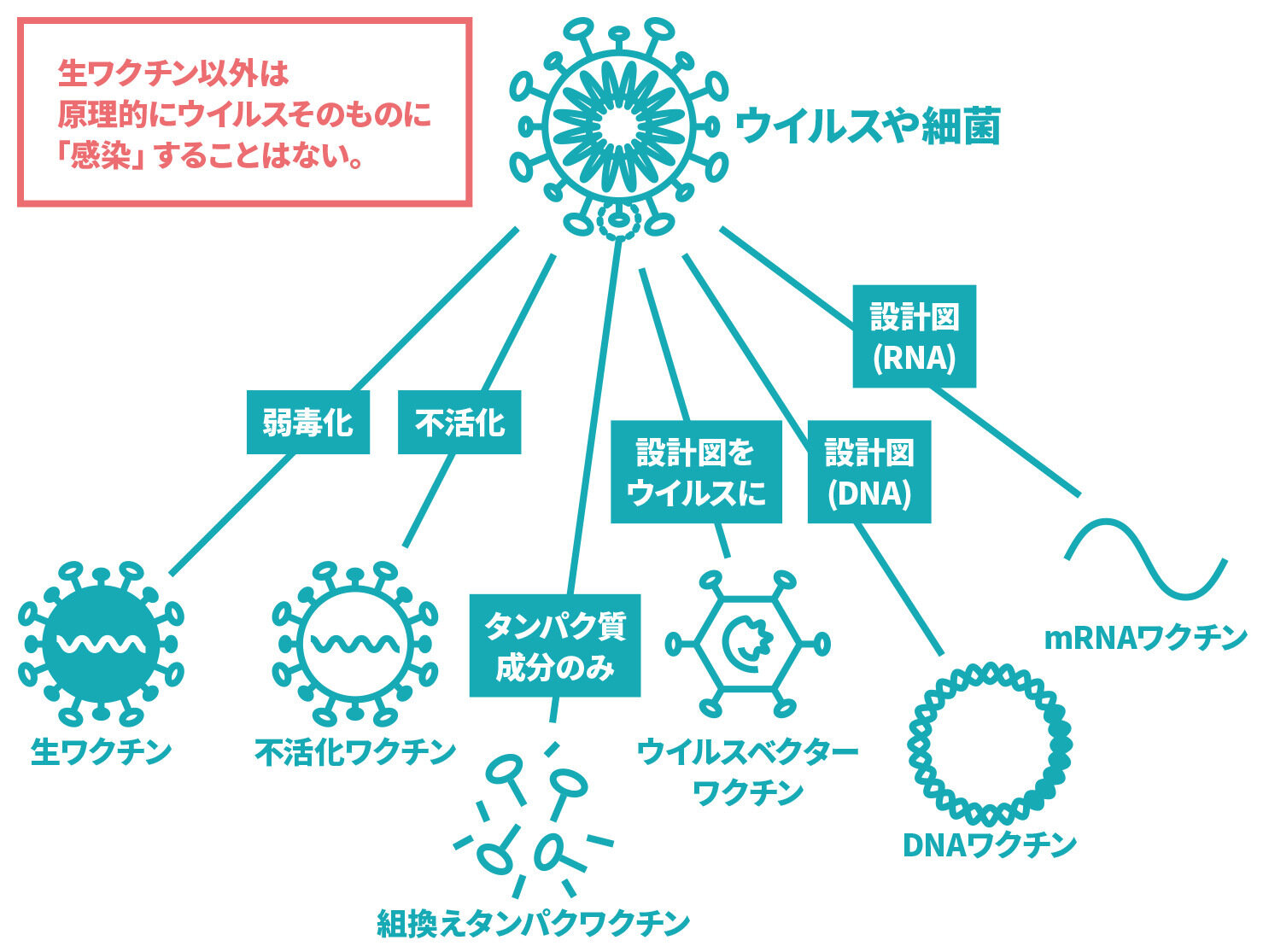
• 生ワクチン
病原性を弱めた病原体からできています。接種すると、その病気に自然にかかった場合とほぼ同じ免疫力がつくことが期待できます。一方で、副反応として、軽度で済むことが多いですが、その病気にかかったような症状が出ることがあります。代表的なワクチンとしては、MRワクチン(M:麻しん、R:風しん)、水痘(みずぼうそう)ワクチン、BCGワクチン(結核)、おたふくかぜワクチンなどがあります。
• 不活化ワクチン、組換えタンパクワクチン
感染力をなくした病原体や、病原体を構成するタンパク質からできています。1回接種しただけでは必要な免疫を獲得・維持できないため、一般に複数回の接種が必要です。代表的なワクチンとしては、DPT-IPV:四種混合ワクチン(D:ジフテリア・P:百日せき・T:破傷風・IPV:不活化ポリオ)、DT:二種混合ワクチン(D:ジフテリア・T:破傷風)、日本脳炎ワクチン、インフルエンザワクチン、B型肝炎ワクチン、肺炎球菌ワクチン、HPV(ヒトパピローマウイルス)ワクチンなどがあります。現在、新型コロナウイルスの表面にあるスパイクタンパク質に対するワクチンが国内外で承認を受けており、日本でも接種されています。
• mRNA(メッセンジャーRNA)ワクチン、DNAワクチン、ウイルスベクターワクチン
これらのワクチンでは、ウイルスを構成するタンパク質の遺伝情報を投与します。その遺伝情報をもとに、体内でウイルスのタンパク質を作り、そのタンパク質に対する抗体が作られることで免疫を獲得します。現在、新型コロナウイルスの表面にあるスパイクタンパク質に対するワクチンが国内外で承認を受けており、日本でも接種されています。
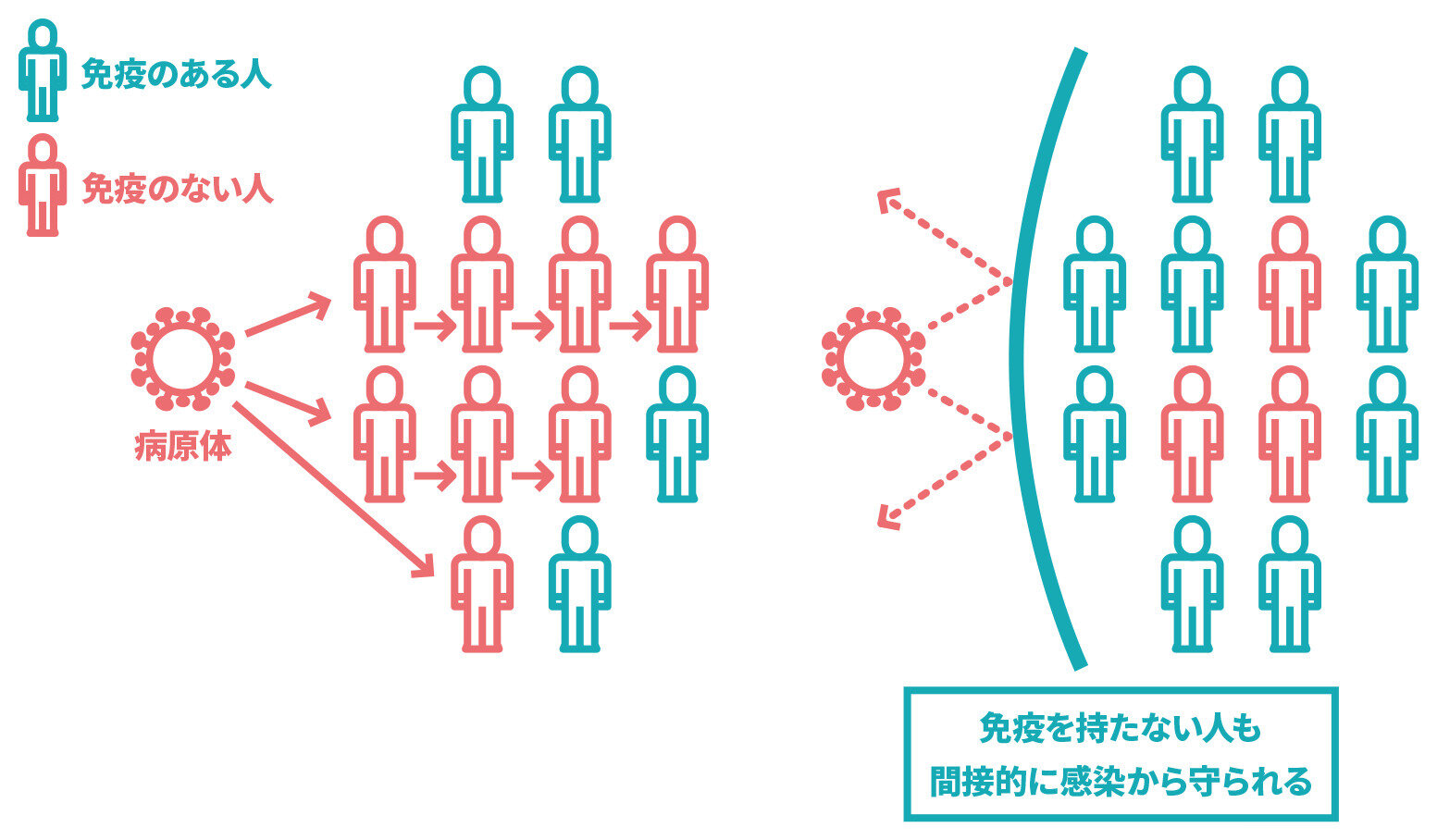
【2024年3月時点】集団免疫とは何ですか。
人口の一定割合以上の人が免疫を持つと、感染患者が出ても、他の人に感染しにくくなることで、感染症が流行しなくなる状態のことです。
感染症は、病原体(ウイルスや細菌など)が、その病原体に対する免疫を持たない人に感染することで、流行します。ある病原体に対して、人口の一定割合以上の人が免疫を持つと、感染患者が出ても、他の人に感染しにくくなることで、感染症が流行しなくなり、間接的に免疫を持たない人も感染から守られます。この状態を集団免疫と言い、社会全体が感染症から守られることになります。
なお、感染症の種類によって、集団免疫を得るために必要な免疫を持つ人の割合は異なります。また、ワクチンによっては、接種で重症化を防ぐ効果があっても感染を防ぐ効果が乏しく、どれだけ多くの人に接種しても集団免疫の効果が得られないこともあります。
新型コロナワクチンによって、集団免疫の効果があるかどうかは分かっておらず、分かるまでには、時間を要すると考えられています。
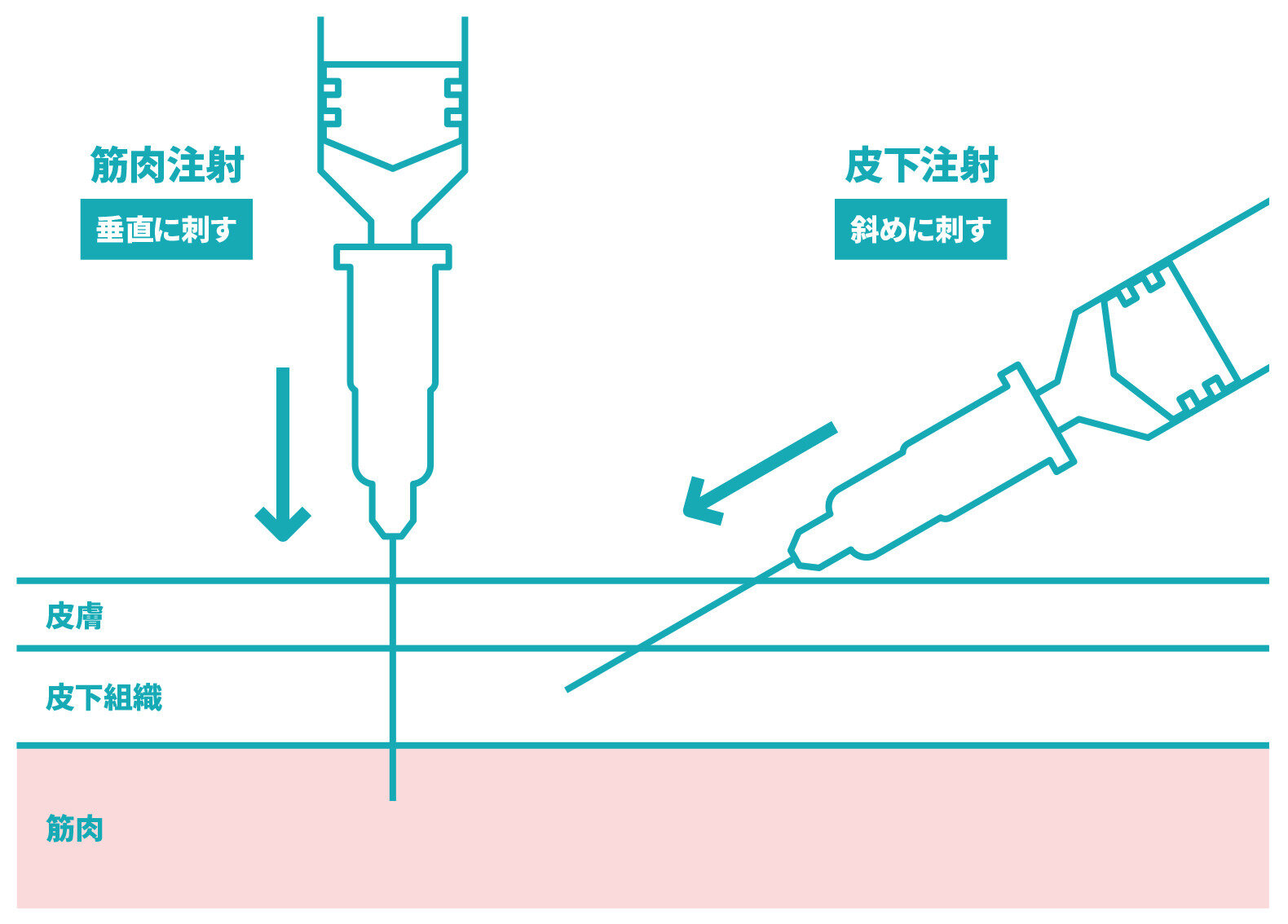
【2024年3月時点】筋肉注射とはどのような注射でしょうか。痛いのでしょうか。
筋肉注射とは、ワクチンなどの医薬品を皮下脂肪の奥にある筋肉に注射する方法のことを指します。一般的に筋肉注射は皮下注射よりも特別に痛みが強い注射方法ではないと考えられています。
筋肉注射とは、ワクチンなどの医薬品を皮下脂肪の奥にある筋肉内に直接注射する方法のことを指します。現在日本で接種されている新型コロナワクチンは、通常、5歳以上の場合は三角筋(肩の筋肉)に、生後6か月~4歳の場合は三角筋中央部または大腿前外側部(1歳未満は大腿前外側部)に、接種を行います。筋肉は皮膚と比べて痛みを感じる神経が少ないともいわれており、皮下注射と比べて痛みが強いという証拠はありません。世界的にはインフルエンザワクチンなども、筋肉注射で行われている例が多くあります。皮下注射と筋肉注射を比べた臨床研究では、筋肉注射は皮下注射に比べてむしろ、注射した部位の痛みといった局所反応が少なかったという報告もあります。
(参考資料)
Vaccine. 2007; Volume25, Issue25, 4767-4774
(Comparative reactogenicity and immunogenicity of 23 valent pneumococcal vaccine administered by intramuscular or subcutaneous injection in elderly adults)
Vaccine. 2006; Volume24, Issue13, 2395-2402
(Reactogenicity and immunogenicity of an inactivated influenza vaccine administered by intramuscular or subcutaneous injection in elderly adults)
Vaccine. 2015; Volume33, Issue6, 789-795
(Comparison of intramuscular and subcutaneous administration of a herpes zoster live-attenuated vaccine in adults aged ≥50 years: A randomised non-inferiority clinical trial)
【2024年3月時点】mRNA(メッセンジャーRNA)ワクチンやウイルスベクターワクチンは新しい仕組みのワクチンということですが、どこが既存のワクチンと違うのですか。
ウイルスのタンパク質をつくるもとになる遺伝情報の一部を注射します。体内で産生されるウイルスのタンパク質に対する抗体などが体内で作られることにより、ウイルスに対する免疫ができます。
これまで我が国において使用されていたワクチン(不活化ワクチン、組換えタンパクワクチン、ペプチドワクチン)はウイルスの一部のタンパク質を人体に投与し、それに対して免疫が出来る仕組みでした。
mRNA(メッセンジャーRNA)ワクチンやウイルスベクターワクチンでは、ウイルスのタンパク質をつくるもとになる遺伝情報の一部を注射します。人の身体の中で、この情報をもとに、ウイルスのタンパク質の一部が作られ、それに対する抗体などができることで、ウイルスに対する免疫ができます。
ファイザー社、モデルナ社及び第一三共社のワクチン(*)はmRNAワクチンと呼ばれ、新型コロナウイルスのスパイクタンパク質(ウイルスがヒトの細胞へ侵入するために必要なタンパク質)の設計図となるmRNAを脂質の膜に包んだワクチンです。このワクチンを接種し、mRNAがヒトの細胞内に取り込まれると、このmRNAをもとに、細胞内でスパイクタンパク質が産生され、そのスパイクタンパク質に対する中和抗体産生や細胞性免疫応答が誘導されることで、新型コロナウイルスによる感染症の予防ができると考えられています。
また、アストラゼネカ社のワクチン(*)は、ウイルスベクターワクチンであり、新型コロナウイルスのスパイクタンパク質のアミノ酸配列をコードする遺伝子をサルアデノウイルス(風邪のウイルスであるアデノウイルスに、増殖できないよう処理が施されています。)に組み込んだワクチンです。このワクチンを接種し、遺伝子がヒトの細胞内に取り込まれると、この遺伝子をもとに細胞内でスパイクタンパク質が産生され、そのスパイクタンパク質に対する中和抗体産生及び細胞性免疫応答が誘導されることで、新型コロナウイルスによる感染症の予防ができると考えられています。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日をもって終了しました。
令和5年9月20日からはオミクロン株対応1価ワクチン(XBB.1.5)による接種が開始されており、ファイザー社のワクチンの詳細はこちら、モデルナ社のワクチンの詳細はこちら、第一三共社のワクチンの詳細はこちらをご覧ください。
【2024年3月時点】組換えタンパクワクチンとはどのようなワクチンですか。
組換えタンパクワクチンである武田社のワクチン(ノババックス)は、新型コロナウイルスの表面にあるスパイクタンパク質の遺伝子をもとに作られた組換えタンパク質を有効成分とするワクチンであり、接種後、ヒトの体内でスパイクタンパク質に対する免疫が誘導されることで、新型コロナウイルス感染症の予防ができると考えられています。
組換えタンパクワクチンである武田社のワクチン(米国ノババックス社から技術移管を受けて武田薬品工業株式会社が国内で生産、流通を行うもの)は、新型コロナウイルスの表面にあるスパイクタンパク質の遺伝子をもとに作られた組換えタンパク質をナノ粒子化した製剤で、免疫の活性化を促進するためのアジュバントが添加されています。本ワクチンの接種により組換えスパイクタンパク質がヒトの細胞内に取り込まれると、スパイクタンパク質に対する中和抗体産生及び細胞性免疫応答が誘導されることで、新型コロナウイルスによる感染症の予防ができると考えられています。また、組換えタンパクワクチンは不活化ワクチンの一種であり、日本においても、B型肝炎ウイルスワクチンなど、他のワクチンでの使用実績があります。
これまで予防接種法に基づき日本で接種が進められてきた新型コロナワクチンには、mRNAワクチンであるファイザー社及びモデルナ社のワクチンのほか、ウイルスベクターワクチンであるアストラゼネカ社のワクチン(現在は接種が終了しています)がありましたが、令和4年(2022年)5月25日から、武田社のワクチン(ノババックス)が加わりました。なお、武田社(ノババックス)のワクチンは令和5年(2023年)12月25日をもって接種が終了しました。
武田社のワクチン(ノババックス)の詳細はこちらをご覧ください。
(参考資料)
武田社組換えタンパクワクチン(ノババックス)の特徴等[3.4MB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社ワクチン(ノババックス)の有効性・安全性、諸外国での接種状況等[1.9MB](第33回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社ワクチン(ノババックス)の有効性・安全性、諸外国での接種状況等[1.4MB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社ワクチン(ノババックス)の接種について[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
ワクチンの効果
【2024年3月時点】日本で接種が進められている新型コロナワクチンにはどのような効果がありますか。
新型コロナワクチンの有効性については、オミクロン株流行下では、感染予防・発症予防効果の持続期間等は2~3か月程度であり、重症化予防効果は1年以上一定程度持続することに加えて、流行株に合わせたワクチンの追加接種を行うことで、追加的な重症化予防効果等が得られると報告されています。
新型コロナワクチンの有効性については、オミクロン株流行下では、感染予防・発症予防効果の持続期間等は2~3か月程度であり、重症化予防効果は1年以上一定程度持続することに加えて、流行株に合わせたワクチンの追加接種を行うことで、追加的な重症化予防効果等が得られると報告されています。
なお、令和5年(2023年)12月26日現在、日本ではファイザー社(12歳以上用/5歳~11歳用/生後6か月~4歳用)のオミクロン株対応1価ワクチン(XBB.1.5)による接種、モデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による生後6か月以上への初回接種と6歳以上への追加接種、第一三共社のオミクロン株対応1価ワクチン(XBB.1.5)による12歳以上への追加接種を受けていただけます。
(アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。)
(参考資料)
2023年度以降の新型コロナワクチンの接種の方針について(厚生科学審議会予防接種・ワクチン分科会予防接種基本方針部会資料)
【2024年3月時点】年齢によって、ワクチンの効果や副反応に違いはありますか。
今回のワクチンは高齢者に対しても発症予防等の効果があることが確認されています。一方、若年者に比べて高齢者の方が少し副反応が出にくいことが分かっています。
従来のワクチンでは、高齢者は若い方に比べてワクチンの効果が劣る場合がありました。しかし、日本で承認されたファイザー社のワクチン(*)では、大規模な臨床試験やイスラエルの実社会での疫学研究において、高齢者に対しても9割以上の発症予防効果があることが報告されています。モデルナ社のワクチン(*)についても、海外での臨床試験において、65歳以上で約9割のワクチン有効率が報告されています。
武田社のワクチン(ノババックス)(*)は、海外で実施された複数の臨床試験結果から、約90%等の発症予防効果が確認されており、若年者のみならず65歳以上の年齢においても、中和抗体価の増加が確認されています。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、ファイザー社の従来ワクチン(1価)による接種は令和5年9月19日、武田社のワクチン(ノババックス)による接種は令和5年12月25日をもって終了しました。
なお、これらのデータはオミクロン株が流行する前のものであることに留意する必要があります。オミクロン株に対する有効性についてはこちらをご覧ください。
一方、副反応については、接種部位の局所の副反応も、発熱や倦怠感、頭痛などの全身性の副反応も、若年者より高齢者の方が少し頻度が低いことが報告されています。これまでに認められている主な副反応は、こちらをご覧ください。
(参考資料)
N Engl J Med. 2020; 383:2603-2615
(Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine)
N Engl J Med 2021; 384:1412-1423
(BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
【2024年3月時点】基礎疾患(持病)の有無によって、ワクチンの効果や副反応に違いはありますか。
今回のワクチンは、基礎疾患をもっている方も含めて臨床試験が行われ、有効性が確認されています。過去に重いアレルギー症状を経験されたことがある方は、接種会場で30分間様子をみることが大切です。
ファイザー社及びモデルナ社(*)の新型コロナワクチンは、高血圧、糖尿病などの基礎疾患をもっている方も含めて臨床試験が行われ、有効性が確認されています。ただし、免疫抑制剤を内服されている方や重い免疫不全がある方は臨床試験の対象とはなっておらず、他の方と同等の効果があるのか、はっきりとは分かっていません。武田社(ノババックス)やアストラゼネカ社(*)の新型コロナワクチンについても、概ね同様の知見が得られています。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日、武田社のワクチン(ノババックス)による接種は令和5年12月25日をもって終了しました。
稀な副反応であるアナフィラキシーについては、過去にアナフィラキシーを含む重いアレルギー症状を引き起こしたことがある人でやや起こりやすい可能性があります。過去に重いアレルギー症状を引き起こしたことがある方は、ワクチン接種後 30 分程度は接種会場で様子をみることが大切です。アナフィラキシー以外の副反応については、臨床試験において基礎疾患の有無による頻度の違いは報告されていません。
(参考資料)
N Engl J Med. 2020; 383:2603-2615
(Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine)
N Engl J Med. 2021; 384:1412-1423
(BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
PMDAの審査報告書(ファイザー社のオミクロン株対応ワクチン)
PMDAの審査報告書(モデルナ社のオミクロン株対応ワクチン)
【2024年3月時点】ワクチン接種後に新型コロナウイルスに感染することはありますか。
ワクチン接種後でも新型コロナウイルスに感染する場合はあります。ワクチンを接種して免疫がつくまでに1~2週間程度かかり、免疫がついても発症予防効果は100%ではありません。効果の持続期間にも留意する必要があります。
ワクチン接種後でも新型コロナウイルスに感染する可能性はあります。
ファイザー社の新型コロナワクチン(*)による初回接種は、通常、3週間の間隔で2回接種します。高い発症予防効果が得られるのは、2回目を接種してから7日程度経って以降です。体の中である程度の抗体ができるまでに1~2週間程度かかるため、1回目の接種後から2週間程度は、ワクチンを受けていない方と同じくらいの頻度で発症してしまうことが論文等でも報告されています。また、臨床試験においてワクチンを2回接種した場合の有効率は約95%と報告されており、100%の発症予防効果が得られるわけではありません。
モデルナ社の新型コロナワクチン(*)による初回接種は、通常、4週間の間隔で2回接種します。臨床試験において、本ワクチンの接種で十分な免疫が確認されたのは、2回目を接種してから14日以降となっています。また、ワクチンを2回接種した場合の有効率は約94%と報告されており、100%の発症予防効果が得られるわけではありません。
武田社の新型コロナワクチン(ノババックス)(*)による初回接種は、通常、3週間の間隔で2回接種します。臨床試験において、本ワクチンの接種で十分な免疫が確認されたのは、2回目を接種してから7日以降となっています。また、ワクチンを2回接種した場合の有効率は約90%等の結果が報告されており、100%の発症予防効果が得られるわけではありません。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、ファイザー社の従来ワクチン(1価)による接種は令和5年9月19日、武田社のワクチン(ノババックス)による接種は令和5年12月25日をもって終了しました。
なお、これらのデータはオミクロン株が流行する前のものです。様々な研究において、オミクロン株に対する発症予防等の効果はデルタ株と比較して低く、2回目接種後経時的に低下することが報告されており、効果の持続期間やウイルスの変異によるワクチンの効果への影響についても留意する必要があります。オミクロン株に対する効果について、従来の1価ワクチンはこちら、オミクロン株対応2価ワクチンはこちら、オミクロン株対応1価ワクチンはこちらをご覧ください。
(参考資料)
N Engl J Med. 2020; 383:2603-2615
(Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine)
N Engl J Med. 2021; 384:1412-1423
(BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
【2024年3月時点】変異株の新型コロナウイルスにも効果はありますか。
一般論として、ウイルスは絶えず変異を起こしていくもので、小さな変異でワクチンの効果がなくなるというわけではありません。それぞれの変異株に対するワクチンの有効性がどのくらいあるのかについても、確認が進められています。
ウイルスは常に一定の頻度でその遺伝情報(新型コロナウイルスの場合はRNA)に変異を起こすものですが、現在世界中で懸念されている変異株とは、新型コロナウイルスがヒトの細胞へ侵入するために必要となるスパイクタンパク質(1,273個のアミノ酸残基で構成)の一部が変化することで、ウイルスの感染性や病原性、ワクチンの有効性等に影響を与えることが懸念されるものを指しています。
変異株に対するワクチンの効果の確認にあたっては、いくつかの方法があります。
一つは、ワクチンを接種した人の血清を用いて、血清中に存在する抗体が、ウイルスの細胞への感染をどの程度中和する(妨げる)ことができるかを測定する方法です。
ファイザー社やモデルナ社の従来ワクチン(1価)(*)においては、様々な変異スパイクタンパク質に対し、ワクチンを接種した人の血清中の抗体が中和活性を有するかが確認されました。その結果、B.1.351(ベータ株。南アフリカ共和国で最初に検出され、N501YやE484K等の変異を有する系統。)への中和作用が少し弱いものの、いずれの変異に対しても一定の中和活性があることが確認されています。また、2021年5月25日付けのWHOの報告では、B.1.351(ベータ株)に加え、P.1(ガンマ株。ブラジルで最初に検出され、N501YやE484K等の変異を有する系統。)でも、中和活性はみられるものの、少し低下する旨の報告がありました。
なお、この測定方法は実験室内で行うものですが、実際に人での感染や発症を確かめるものではなく、抗体の中和活性の低下と免疫力の関係が十分明らかになっているわけではないことから、結果の解釈に留意が必要です。
もう一つは、実際にワクチンを接種した人と接種していない人の感染や発症の状況を調べる方法です。例えばファイザー社の従来ワクチン(1価)は、B.1.1.7(アルファ株。英国で最初に検出され、N501Y等の変異を有する系統。)ではワクチンの有効率に大きな低下はみられませんでした。B.1.351(ベータ株)やB.1.617.2(デルタ株。インドで最初に検出され、L452R等の変異を有する系統。)では、有効率が少し低下するものの、ワクチンは有効であったという報告もありました。
また、英国公衆衛生庁(PHE)が公表した、ファイザー社のワクチンを実際に接種した後の状況に基づく研究結果によると、発症予防効果に係るワクチン有効率は、B.1.1.7(アルファ株)で約94%、B.1.617.2(デルタ株)で約88%、また、デルタ株による入院を予防する効果は約96%と報告されています。
ただし、このような実臨床での観察研究等は、流行状況など別の要因が結果に影響するなど、結果に偏り(バイアス)が生じやすいことから、結果の解釈に留意が必要です。
(*)アストラゼネカ社のワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、ファイザー社の従来ワクチン(1価)による接種は令和5年9月19日をもって終了しました。
上記は、従来の1価ワクチンにおけるデータです。現在、変異株に対応したワクチンの開発や臨床試験も実施されています。世界各国で様々な変異株が出現していることを踏まえると、引き続き、ワクチンの有効性に関する情報を収集していく必要があります。
なお、オミクロン株に対する有効性について、従来の1価ワクチンはこちら、オミクロン株対応2価ワクチンはこちら、オミクロン株対応1価ワクチンはこちらをご覧ください。
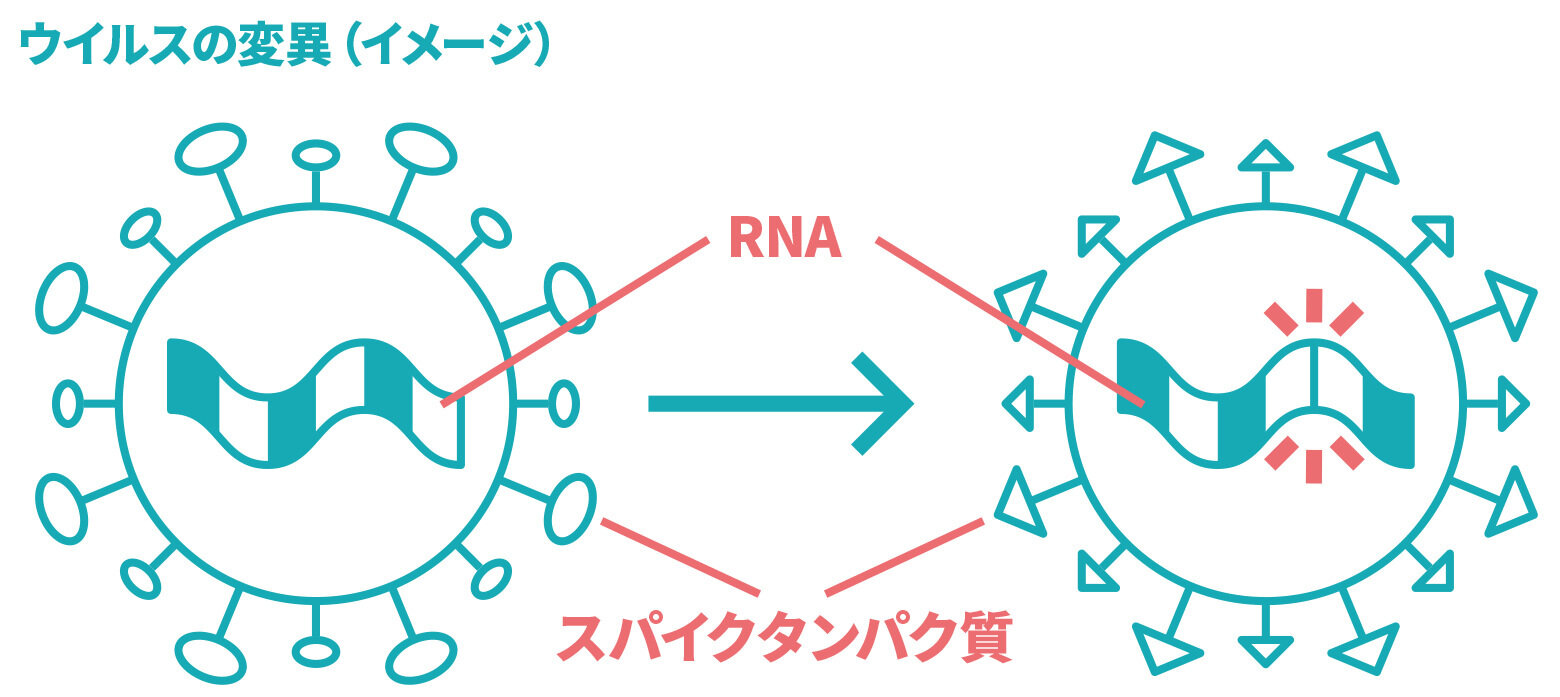
(参考資料)
変異株への有効性[571KB](第20回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
変異株に関するQ&A(厚生労働省)
新型コロナウイルス感染症(COVID-19)関連情報(国立感染症研究所)
N Engl J Med. 2021; 384:1466-1468
(Neutralizing Activity of BNT162b2-Elicited Serum)
Coronavirus disease (COVID-19) Weekly Epidemiological Update and Weekly Operational Update(WHO)
Lancet. 2021;S0140-6736(21)00947-8
(Impact and effectiveness of mRNA BNT162b2 vaccine against SARS-CoV-2 infections and COVID-19 cases, hospitalisations, and deaths following a nationwide vaccination campaign in Israel: an observational study using national surveillance data.)
N Engl J Med. 2021;10.1056
(Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants.)
MedRxiv. 2021. doi: 10.1101/2021.05.22.21257658
(Effectiveness of COVID-19 vaccines against the B.1.617.2 variant.)
N Engl J Med. 2021; 384:1885-1898
(Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant)
N Engl J Med. 2021 July
(Effectiveness of Covid-19 Vaccines against the B.1.617.2(Delta) Variant.)
Vaccines highly effective against hospitalisation from Delta variant
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
【2024年3月時点】妊娠中にワクチンを接種した場合、生まれてくる新生児に免疫はつきますか。
妊娠中(特に妊娠後期)にワクチンを接種することで、新生児にも抗体が移行する可能性があると報告されています。
海外で、妊娠中にmRNA(メッセンジャーRNA)ワクチンを接種した方の臍帯血(胎児の血液と同じ)や母乳を調べた研究では、臍帯血や母乳中にも、新型コロナウイルスに対する抗体があることが報告されました。こうした抗体が産後の新生児の感染を減らすかどうかまでは分かっていませんが、母親から新生児へ抗体が移行する可能性があります。
(参考資料)
妊娠中の方・妊娠を計画中・授乳中の方について[1.2MB](第21回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
American Journal of Obstetrics and Gynecology. 2021 March, Epub
(Coronavirus disease 2019 vaccine response in pregnant and lactating women: a cohort study)
ワクチンの安全性と副反応
【2024年3月時点】ワクチンの安全性の確保のため、どのような取り組みをしていますか(審査の厳格性など)。
臨床試験の結果などに基づいて、ワクチンの安全性についての審査が行われます。国内でのワクチン接種の開始後は、副反応を疑う事例について、専門家による評価を行います。
臨床試験では、有効性・安全性等に関するデータを収集するため、健康な方や患者さんに協力してもらい、開発中のワクチンを実際にヒトに投与して試験します。その後、臨床試験の結果などに基づいて、ワクチンの有効性、安全性、品質についての審査が行われ、ワクチンが承認されます。
国内で予防接種法に基づき接種が進められている、新型コロナワクチンの臨床試験の主な結果について、ファイザー社はこちら、モデルナ社はこちら、武田社(ノババックス)はこちらに掲載しています(1価、従来株)。
また、国内でのワクチンの接種開始後は、副反応を疑う事例を収集し、専門家による評価を行っています。この枠組みで収集された情報には、偶発的なものや他の原因によるものなど、予防接種との関連がない症状も含まれています。
これまでの副反応疑い報告状況等はこちら、接種後の健康状況調査はこちらに掲載しています。このような報告結果の公表等を通じて、安全性に関する情報提供を行っていきます。
なお、オミクロン株対応ワクチンについては、2価ワクチンの効果と副反応、1価ワクチンの効果と副反応をそれぞれご覧ください。
【2024年3月時点】これまでに認められている副反応にはどのようなものがありますか。
注射した部分の痛み、疲労、頭痛、筋肉や関節の痛み等がみられることがあります。稀な頻度でアナフィラキシー(急性のアレルギー反応)が発生します。
現在、日本で接種が進められている新型コロナワクチンでは、接種後に注射した部分の痛み、疲労、頭痛、筋肉や関節の痛み、寒気、下痢、発熱等がみられることがあります。こうした症状の大部分は、接種後数日以内に回復しています。(新型コロナワクチン(1価、従来株)(*)における臨床試験の主な結果について、ファイザー社はこちら、モデルナ社はこちら、武田社(ノババックス)はこちら、接種後の副反応を疑う事例の評価はこちら、接種後の健康状況に係る調査の結果はこちら、参考:第一三共社はこちら)
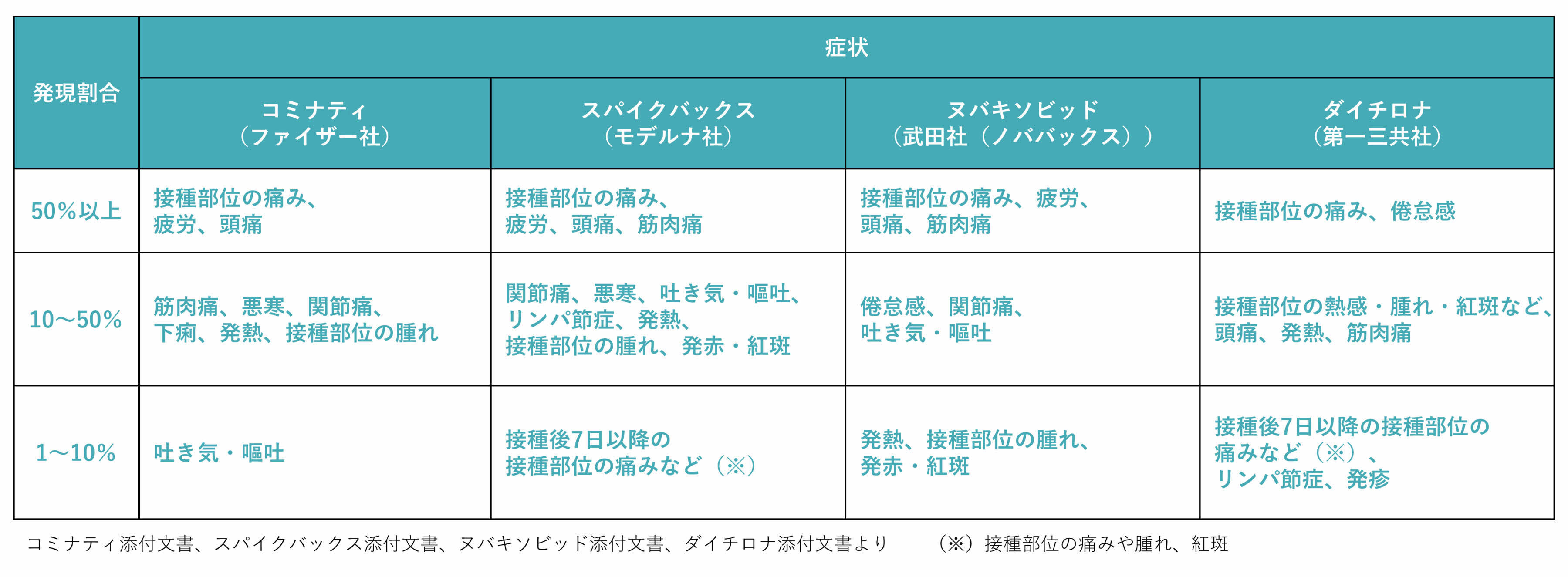
また、稀な頻度でアナフィラキシー(急性のアレルギー反応)が発生したことが報告されています。アナフィラキシーの報告状況等は、こちらに掲載しています。もし、アナフィラキシーが起きたときには、接種会場や医療機関ですぐに治療を行うことになります。
この他、アストラゼネカ社のワクチンでは、稀に珍しいタイプの血栓症が起きるという報告があります。また、ファイザー社及びモデルナ社のワクチンでは、頻度としてはごく稀ですが、心筋炎や心膜炎を疑う事例が報告されています。血栓症についてはこちら、心筋炎や心膜炎についてはこちらをご覧ください。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、ファイザー社の従来ワクチン(1価)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。
なお、追加(3回目)接種における安全性についてはこちら、追加(4回目)接種後の健康状況に係る調査についてはこちらをご覧ください。
【2024年3月時点】副反応は1回目の接種後より2回目の接種後の方が強いと言われるのはどうしてですか。
1回目のワクチン接種でいくらか免疫がつくことで、2回目の接種の方が、免疫反応が起こりやすくなるため、発熱や倦怠感、関節痛などの症状が出やすくなります。
mRNA(メッセンジャーRNA)ワクチンの接種に伴う軽い副反応の症状は、1回目の接種後よりも2回目の接種後の方が頻度が高いことが分かっています。海外の臨床研究の結果に加え、ファイザー社のワクチンの場合、接種開始後に実施された健康状況調査でもその傾向がみられます。1回目の接種で新型コロナウイルスのスパイクタンパク質に対する抗体等ができます。そして2回目の接種時には、既にこれらの抗体等が誘導されていることから、接種されたmRNAをもとに体内で1回目と同じスパイクタンパク質が作られると、1回目より強い免疫応答が起こり、発熱や倦怠感などの副反応がより出やすくなります。
【2024年3月時点】ワクチンを受けた後の発熱や痛みに対し、市販の解熱鎮痛薬を飲んでもよいですか。
ワクチンを受けた後の発熱や痛みに対し、市販の解熱鎮痛薬で対応いただくことも考えられますが、特に下記のような場合は、主治医や薬剤師にご相談ください。
ワクチンを受けた後の発熱や痛みに対し、市販の解熱鎮痛薬(※)で対応いただくことも考えられますが、特に下記のような場合は、主治医や薬剤師にご相談ください。
- 他のお薬を内服している場合や、妊娠中、授乳中、ご高齢、胃・十二指腸潰瘍や腎機能低下など病気治療中の場合(飲める薬が限られていることがあります。)
- 薬などによりアレルギー症状やぜんそくを起こしたことがある場合
- 激しい痛みや高熱など、症状が重い場合や、症状が長く続いている場合
- ワクチン接種後としては典型的でない症状がみられる場合(ワクチン接種後に起こりやすい症状や起こりにくい症状については、こちらをご覧ください。)
なお、ワクチンを受けた後、症状が出る前に、解熱鎮痛薬を予防的に繰り返し内服することについては、現在のところ推奨されていません。
(※)市販されている解熱鎮痛薬の種類には、アセトアミノフェンや非ステロイド性抗炎症薬(イブプロフェンやロキソプロフェン)などがあり、ワクチン接種後の発熱や痛みなどにご使用いただけます。(アセトアミノフェンは、低年齢の方や妊娠中・授乳中の方でもご使用いただけますが、製品毎に対象年齢などが異なりますので、対象をご確認のうえ、ご使用ください。)
小児(5~11歳)接種における発熱時の対応についてはこちらで解説しています。
(参考資料)
新型コロナワクチンの副反応について(厚生労働省)
CDC:Getting Your COVID-19 Vaccine
【2024年3月時点】ワクチンを接種して1週間くらい経ってから、腕にかゆみや痛み、腫れや熱感、赤みが出てきました。どうすればよいですか。
発疹がかゆい場合は、冷やす、あるいは抗ヒスタミン剤やステロイドの外用薬(軟膏等)を塗ることで症状が軽くなります。ワクチンの副反応であれば、数日で改善します。
mRNA(メッセンジャーRNA)ワクチン接種後、数日から1週間後くらい経ってから、接種した腕のかゆみや痛み、腫れや熱感、赤みが出てくることがあり、いわゆる「COVIDアーム」(または「モデルナアーム」)と呼ばれています(※1、※2)。ほとんどがモデルナ社のワクチンで報告されています(※3)が、ファイザー社のワクチンでも稀に起こります。
不快ではありますが、健康に害はなく、数日で自然に治ると報告されています。1回目の接種後にこのような症状が出た場合でも、基本的には2回目の接種を受けてもよいとされています。原因は、T細胞という免疫細胞が反応することにより起こる炎症と考えられています。
発疹がかゆい場合は冷やす、あるいは抗ヒスタミン剤やステロイドの外用薬(軟膏等)を塗ると、症状が軽くなります。こうした成分は、市販の虫刺されの薬などにも含まれています。
もし、痛みがひどいときは、アセトアミノフェンやロキソプロフェン、イブプロフェン等の非ステロイド性抗炎症薬の内服で軽くなることもあります(※1)。症状が特にひどい、または数日経過しても軽快しない場合は、皮膚科医にご相談することをお勧めします。
(参考資料)
「モデルナアーム」(遅延性皮膚反応)の例[274KB](第64回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第13回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会資料より抜粋)
※1:CDC. What to Do If You Have an Allergic Reaction after Getting a COVID-19 Vaccine.
※2:N Engl J Med. 2021; 384:1273-1277
(Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2)
※3:J Am Acad Dermatol. 2021;85:46-55.
(Cutaneous reactions reported after Moderna and Pfizer COVID-19 vaccination: A registry-based study of 414 cases)
※4:N Engl J Med. 2021; 384:403-416.
(Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine)
【2024年3月時点】ワクチン接種後に脇のリンパ節が腫れました。注意すべきことはありますか。
ワクチン接種後に、接種した側の脇や首などのリンパ節が腫れることがありますが、時間の経過とともに自然に治ります。乳がん検診は、ワクチン接種前に受けるか、ワクチン接種後に受ける場合は、リンパ節が腫れている原因について誤った判定がなされないよう、検診医にワクチン接種を受けたことを伝えるとよいでしょう。
新型コロナワクチン接種後に、接種した側の脇の下や首などのリンパ節が腫れることがあります。厚生労働省が実施した、初回(1回目・2回目)接種における健康状況調査においても、例えばファイザー社のワクチン接種後に腋窩リンパ節腫大を含む反応性リンパ節腫脹が1.5%程度報告されています。なお、ワクチン接種後のリンパ節の腫れ自体は、免疫が反応しているためと考えられており、時間の経過とともに自然に治るものです。
ワクチンによるリンパ節の腫れは、一時的なものですので、乳がんによって起こりうるリンパ節の腫れとは異なるものです。乳がん検診は、ワクチン接種前に受けるか、ワクチン接種後に受ける場合は、リンパ節が腫れている原因について誤った判定がなされないよう、いつ、どちらの腕にワクチン接種を受けたか、検診医に伝えるとよいでしょう。
なお、日本乳癌検診学会は、マンモグラフィ検査はワクチン接種前に施行するか、接種後に施行する場合も、接種から4~6週間の間隔をあけることを考慮してもよいが、必要以上に間隔をあけることは推奨しない、としています。また、米国のブレスト・イメージング学会も、ワクチン接種後の乳がん検診について、間隔をあけたスケジュールとすることを推奨しない、としています。
また、従来ワクチン(1価)による追加(3回目)接種において、初回(1回目・2回目)接種時と比較して、リンパ節の腫れの発現割合が高いこと(ファイザー社:5%程度、モデルナ社:20%程度)が、米国で実施された臨床試験の結果の中で報告されています。追加接種の副反応についてはこちらをご覧ください。
(参考資料)
日本乳癌検診学会「乳がん検診にあたっての新型コロナウイルス感染症(COVID-19)への対応の手引き」
Acad Radiol. 2021 Aug; 28(8): 1058-1071
(Lymphadenopathy Following COVID-19 Vaccination: Imaging Findings Review)
米国のブレスト・イメージング学会のガイドライン
【2024年3月時点】アレルギー反応が心配されている、ポリエチレングリコール(PEG)やポリソルベートが含まれる医薬品にはどのようなものがありますか。
日本で承認されているポリエチレングリコールを含むワクチンは、ファイザー社、モデルナ社及び第一三共社の新型コロナワクチンですが、ポリソルベートを含むワクチンは複数存在します。
日本で承認されているポリエチレングリコールを含むワクチンは、ファイザー社、モデルナ社及び第一三共社の新型コロナワクチン(*)です。ポリエチレングリコールとの交差反応性が懸念されているポリソルベートを含んでいる既に承認されたワクチンは、アストラゼネカ社や武田社(ノババックス)の新型コロナワクチン(*)のほか、複数存在します(※1)。
(*)アストラゼネカ社のワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。
(※1)沈降13価肺炎球菌結合型ワクチン(プレベナー13)、インフルエンザHAワクチン「第一三共」、組換え沈降4価ヒトパピローマウイルス様粒子ワクチン(ガーダシル)、乾燥細胞培養日本脳炎ワクチン(エンセバック)、5価経口弱毒生ロタウイルスワクチン(ロタテック)、不活化ポリオワクチン(イモバックス)など(※2)。
(※2)これまでこうしたポリエチレングリコールやポリソルベートを含む医薬品を使用してアレルギー反応がみられていない方については、引き続きこのような医薬品を使用することができます。
また、ポリエチレングリコールは大腸内視鏡検査時に下剤として使用する医薬品をはじめ、様々な医薬品に添加剤として含まれており、ポリソルベートも同様に複数の医薬品に含まれています。なお、ポリエチレングリコールは「マクロゴール」という名称で呼ばれることもあります。
医薬品に含有されている添加剤は、各々の医薬品の添付文書で確認することができます。添付文書は医薬品医療機器総合機構(PMDA)のホームページで検索することが可能です。
<検索方法>
(1)PMDAホームページの上部に「添付文書等検索」の欄がありますので、医師から処方された薬を検索したい場合は「医療用医薬品」を、薬局で購入した薬(OTC)を検索したい場合は「一般用・要指導医薬品」をクリックしてください。
(2)ある医薬品に含まれる添加剤を調べたい場合、画面左上にある「医薬品の名称」欄に薬の名前を入力すると、該当する医薬品の添付文書が閲覧できます。「医療用医薬品」の場合は「添加剤」の項目に、「一般用・要指導医薬品」の場合は「添加物」の項目に、含まれる添加剤(物)一覧が記載されています。
(3)ある添加剤(物)を含む医薬品を検索したい場合、「医療用医薬品」については、検索画面の左下にある「項目内検索」から「組成」を選択し、検索したい添加剤名(例:「ポリエチレングリコール」、「PEG」、「ポリソルベート」等)を入力の上、「検索」ボタンを押してください。「一般用・要指導医薬品」の場合、「添加物名」の欄に入力の上、「検索」ボタンを押してください。
一方、ポリエチレングリコールは化粧品にも含まれていることがあります。化粧品については、含まれている成分が製品に表示されています。
【2024年3月時点】アナフィラキシーではどのような症状が出ますか。治療法はありますか。
皮膚症状、消化器症状、呼吸器症状が急に起こり、血圧低下や意識レベルの低下を伴う場合もあります。薬の注射などで治療します。
薬や食物が身体に入ってから、短時間で起きることのあるアレルギー反応です。
じんま疹などの皮膚症状、腹痛や嘔吐などの消化器症状、息苦しさなどの呼吸器症状が急に起こります。血圧低下や意識レベルの低下(呼びかけに反応しない)を伴う場合を、アナフィラキシーショックと呼びます。
アナフィラキシーは特定のワクチンだけに起きるものではなく、様々な医薬品やワクチンの投与後に報告されています。例えば、インフルエンザワクチン接種後の副反応疑い報告では、因果関係があるかどうか分からないものも含め、1シーズンで、約20件のアナフィラキシーが報告されています。
予防接種後に、息苦しさなどの呼吸器症状がみられれば、接種会場や医療機関で、まず、アドレナリン(エピネフリン)という薬の注射を行います。その後、症状を軽くするために、気管支拡張薬等の吸入や抗ヒスタミン薬、ステロイド薬の点滴や内服なども行います。
接種後にもしアナフィラキシーが起こっても、すぐに対応が可能なよう、予防接種の接種会場や医療機関では、医薬品などの準備をしています。
【2024年3月時点】接種後の「失神」や、その原因ともいわれる「血管迷走神経反射」とは何ですか。
血管迷走神経反射は、緊張やストレスなどで起きる、血圧の低下、脈拍の減少などのことです。「失神」とは、意識を一時的に失うことをいいます。
失神とは、一時的に脳への血流が減少することで意識を失うことを指します。その原因として最も多いのが血管迷走神経反射によるものです。血管迷走神経反射では、様々な原因によって、副交感神経が活発になり、血圧の低下、脈拍の減少などが生じます。睡眠不足や疲れている時、長時間立っている時、痛みや緊張などの精神的ストレスを感じた時などに、血管迷走神経反射は起こりやすくなります。失神する前に、通常、頭がふらふらしたり、吐き気、発汗などの症状を伴います。血管迷走神経反射自体は、横になって休むことなどで治るので、特に健康上大きな問題になることはありませんが、転倒により怪我をしてしまわないよう注意が必要です。
緊張や痛みなどのストレスによって、血管迷走神経反射は、新型コロナワクチンに限らず、ワクチン接種時や血液検査の際に生じることがあります。ワクチン接種前には、十分な睡眠をとり、接種後15分は椅子に座る、体調が優れない場合は体を横たえるなどの予防が重要です。
また、ワクチン接種や採血の時に、血管迷走神経反射が起こり、気分が悪くなったり失神等を起こしたことがある方は、予診の際にその事を伝え、横たわって接種を受けたり、接種後は30分程度様子を見るなどの対策を取りましょう。
(参考資料)
血管迷走神経反射について[1.3MB](第21回 厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
CDC. Fainting (Syncope) after Vaccination
【2024年3月時点】ワクチン接種後にくも膜下出血や急性大動脈解離が起きたと聞いたのですが、ワクチンとの関連はあるのでしょうか。
現時点において、ワクチンを接種した人の方が、接種していない人よりも、くも膜下出血や急性大動脈解離が起こりやすいという知見はありません。くも膜下出血や急性大動脈解離は、偶発的に起こりうることから、ワクチン接種後に起きた場合でも、それだけで、ワクチンが原因で起きたというわけではありません。
厚生労働省では、ワクチン接種後にくも膜下出血などが起きたという報告を公表しています。しかしながら、現時点において、日本で使用されている新型コロナワクチンで、ワクチンを接種した人の方が、接種していない人よりも、こうした重い病気が起こりやすいということが確認されたとの報告はありません。
ワクチン接種後に、くも膜下出血や急性大動脈解離が起きたという事例が報告されていますが、これらの病気はワクチンを接種しない人にもある程度の頻度で常に起こっています。多くの人がワクチンを接種しているので、偶然こうした病気がワクチン接種後に生じることもありえます。ワクチン接種後に起きた好ましくない出来事は、ワクチンと時間的に前後関係があっても、必ずしもワクチン接種のために起こった(因果関係のある)「副反応」というわけではありません。
重大な副反応が、ワクチン接種後に増えることがないかどうか、世界中で注意しながら評価が行われています。承認前に行った大規模な臨床試験だけでなく、承認後も継続的に安全性を確認しています。
国として予防接種の安全性を評価するため、副反応を疑う事例を収集しています。収集した事例はすべて公表しており、ワクチン接種後に死亡したり、重い病気になった事例も全て公表しています。
こうした事例について、専門家による評価を行っています。今後の国内外の報告状況等により、ワクチン接種との因果関係があるかどうかを検討していきます。もし、因果関係がある症状等が認められた場合にも、速やかに公表していく予定です。
(参考資料)
新型コロナワクチンの副反応疑い報告について
厚生科学審議会(予防接種・ワクチン分科会 副反応検討部会)
医師等の皆さまへ~新型コロナワクチンの副反応疑い報告のお願い~|厚生労働省
【2024年3月時点】ワクチン接種後に血栓症が起きると聞いたのですが大丈夫でしょうか。
アストラゼネカ社のワクチンでは、稀に珍しいタイプの血栓症が起きるという報告がありますが、適切な診断・治療方法も報告されています。なお、ファイザー社やモデルナ社のmRNA(メッセンジャーRNA)ワクチンについては、現時点において、血栓症の発症との因果関係は明らかとされていません。
アストラゼネカ社のワクチン(*)では、稀に珍しいタイプの血栓症が起きるという報告があります。
■どのくらいの頻度で起こるのですか。
これまでの報告から、頻度にばらつきはありますが、極めて稀に起こるものであり、ワクチン接種約10万~25万回に1回程度といった報告があります。ワクチン接種後1か月以内に生じ、男性に比べて女性、特に若い女性の方が頻度が高いと報告されています。一般的にみられる下肢静脈等の血栓症と比べて頻度は稀と考えられていますが、注意深く情報収集が行われています。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」は、令和4年(2022年)9月30日をもって、接種が終了しました。
■ファイザー社やモデルナ社のワクチン(※)でも起こるのですか。
ファイザー社のワクチンでは、接種後に同様の血栓症が起きたとして評価された事例がごく稀にあるものの、現時点においては、mRNAワクチンと、この血栓症の発症との因果関係は明らかとされていません。
(※)モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日をもって終了しました。
■もし発症しても治療はできるのでしょうか。
海外で発生した事例において、適切な診断や治療法に関する報告が増えてきました。一般的な血栓症とは治療薬などが異なることから、専門的な診断や治療が必要になります。このような血栓症が起きた際の治療法について、日本血栓止血学会、日本脳卒中学会の両学会において「血小板減少症を伴う血栓症の診断と治療の手引き」を取りまとめられています。
■どんな血栓症なのですか。
ヘパリンという薬を使った後に稀に生じる「ヘパリン起因性血小板減少症」と似ていることが報告されています。これは、血小板第4因子とヘパリンの複合体に対して、抗体ができてしまうことで、血小板の減少とともに、様々な静脈や動脈に血栓ができてしまう病気です。
一般的な血栓症は、下肢の静脈等にできることが多いですが、アストラゼネカ社のワクチン接種後に生じた血栓症は、脳の静脈やお腹の中の静脈などにも生じ、脳静脈洞の血栓症を起こした方では、脳出血も同時に起きやすくなることが報告されています。このため、早期に診断して、適切な治療を行うことが重要になります。
■その他の血栓症について情報はありますか。
アストラゼネカ社ワクチンに特徴的な血栓症以外の血栓症に関する副反応については、厚生労働省の審議会において以下のような議論がなされています。
mRNAワクチン接種後の肺塞栓症について、国立研究開発法人日本医療研究開発機構(AMED)の研究班による報告の層別解析において女性にシグナルが観察されたものの、米国・仏国・イスラエルによる3つの観察研究では、有意なリスク上昇は認められませんでした。これらのエビデンスに係る厚生労働省の審議会での議論を踏まえ、mRNAワクチン接種後の肺塞栓症に係る副反応疑い報告について、複数の条件でO/E(接種後の報告率/期待される発現率)解析を実施したものの、全ての解析条件で、いずれの性別及び年齢層においても、背景発現率と比較して報告頻度に統計学的に有意な上昇はみられませんでした。さらに、海外(米国・英国・EU)では、現時点でmRNAワクチン接種後の肺塞栓症について添付文書で注意喚起がなされていないこと等も踏まえ、現時点ではこの肺塞栓症について追加の安全対策措置は不要と考えられています。
(参考資料)
N Engl J Med. 2021 April, Epub
(Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination)
N Engl J Med. 2021 April, Epub
(Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination)
COVID-19 ワクチン接種後の血小板減少症を伴う血栓症の診断と治療の手引き・第4版(日本脳卒中学会、日本血栓止血学会)
AMED研究班による層別解析及び海外における観察研究の解析結果[235KB](第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会資料1-5より抜粋)
mRNAワクチン接種後の肺塞栓症のリスク解析について(第93回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和5年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会資料)
【2024年3月時点】ワクチンを接種すると心筋炎や心膜炎になる人がいるというのは本当ですか。
新型コロナワクチン接種後、頻度としてはごく稀ですが、心筋炎や心膜炎になったという報告がなされています。軽症の場合が多く、心筋炎や心膜炎のリスクがあるとしても、ワクチン接種のメリットの方が大きいと考えられています。
頻度としてはごく稀ですが、新型コロナワクチンの接種後に、心筋炎や心膜炎を疑う事例が報告されています。mRNAワクチン(ファイザー社及びモデルナ社のワクチン(*1))接種後については、高齢者よりも思春期や若年成人に、女性よりも男性に、より多くの事例が報告されています。
【専門家の見解について】
ワクチン接種後に、心筋炎や心膜炎を疑う事例が国内外で報告されていることについて、新型コロナウイルス感染症の発生状況も踏まえ、心筋炎・心膜炎の専門家は以下のような見解を示しています。
- コロナ禍においては、心不全・不整脈・冠動脈疾患などの心血管病の診断と管理が重要であり、若年者であっても胸部の症状(胸の痛みや違和感、息切れなど)があれば、精査や治療の継続が必要です。
- ワクチン接種後に心筋炎や心不全が疑われた報告の頻度やその重症度、突然死の報告頻度よりも、新型コロナウイルスに感染した場合のそれらの発症頻度は高く、重症です。
- 医学的見地から、心血管合併症の発症、重症化の予防及び死亡率の減少を図るためにも、ワクチン接種は有効であると考えます。
- コロナ禍においても、ワクチン接種歴の有無に関わらず、突然死のリスクである心血管病を早期発見するために、胸部の症状の出現など心血管疾患が疑われる時には、速やかに身近な医療機関などに相談し、必要に応じて精査や治療をすることが重要です。
本邦におけるこれまでの報告状況を踏まえ、心筋炎や心膜炎の典型的な症状としては、ワクチン接種後4日程度の間に、胸の痛みや息切れが出ることが想定されます。令和5年(2023年)7月28日開催による審議会の議論も踏まえ、こうした症状が現れた場合は速やかに医療機関を受診することを改めてお勧めします。
【mRNAワクチン(ファイザー社及びモデルナ社のワクチン)について】
日本で接種が進められているmRNAワクチンについて、接種後に副反応を疑う事例として報告された心筋炎や心膜炎の状況を解析した結果、接種を受けた人の属性がワクチンの種類ごとに異なることに留意が必要であるものの、ファイザー社及びモデルナ社のワクチンいずれも、10代及び20代の男性の報告頻度が他の層と比べて高いという傾向が確認されています。また、10代及び20代の男性では、ファイザー社よりもモデルナ社のワクチンを接種した場合における報告頻度の方が高いことも確認されています。
このような解析結果を踏まえ、厚生労働省の審議会(令和3年10月15日開催)では、
- いずれのワクチンも、新型コロナウイルス感染症により心筋炎や心膜炎を合併する確率は、ワクチン接種後に心筋炎や心膜炎を発症する確率と比較して高い(*2)こと等も踏まえ、現時点においては、接種によるベネフィットがリスクを上回っており、全年代において、ワクチン接種体制に影響を与える重大な懸念は認められない
- ただし、10代及び20代の男性については、ファイザー社のワクチンに比べて、モデルナ社のワクチン接種後の心筋炎や心膜炎が疑われる報告頻度が明らかに高いことから、十分な情報提供の上、ファイザー社のワクチンの接種も選択できることとする
- なお、本人が希望する場合は、引き続き、モデルナ社のワクチン接種も可能である
とされました。
なお、新型コロナウイルス感染後とmRNAワクチン接種後の心疾患発症の比較については、米国CDCからも若年層を含む全ての年齢層の男女において、新型コロナウイルス感染後の方がmRNAワクチン接種後よりも心合併症のリスクが有意に高いと報告されており(※1)、厚生労働省の審議会においても、この報告を踏まえ、引き続き全ての年齢層において新型コロナワクチンの接種体制に影響を与える程の重大な懸念は認められないとされています。
【報告の状況について】
国内における3回目の接種後の心筋炎・心膜炎疑いの全体の報告頻度は、2回目と同様、若い方、特に男性で高かったものの、2回目よりも低い傾向となっています(※2)。また、米国やイスラエルを始めとする海外でも同様の傾向が確認されています(※3、4)。
日本における4回目の接種は令和4年(2022年)5月25日より、5回目の接種は同年9月20日より開始されており、また、小児(5~11歳)接種は令和4年2月21日より、乳幼児(6か月~4歳)接種は同年10月24日より開始されていますが、現時点では、いずれの接種後の心筋炎・心膜炎疑いの全体の報告頻度も極めて稀であり、重大な懸念はないとされています。なお、米国における接種後の心筋炎の報告頻度は、5~11歳男性の方が、12~15歳男性及び16~17歳男性と比べて低かったとされています(※5)。
令和4年5月25日より初回接種及び3回目接種が開始された武田社のワクチン(ノババックス)についても、海外で、心筋炎や心膜炎を疑う事例が報告されています。国内では、当該報告がない時期に、海外の動向も踏まえ、添付文書を改訂することになりました。
また、12歳以上における、ファイザー社及びモデルナ社のワクチン1~3回目接種後の、心筋炎や心膜炎を疑う事例の報告状況については、こちら[592KB]に掲載しています。(審議会(令和4年8月5日開催)報告時点)
なお、令和4年8月5日開催の審議会以降は、ファイザー社、モデルナ社または武田社(ノババックス)のワクチン接種後の、心筋炎や心膜炎と評価された事例(注)を公表しており、最新版はこちら[888KB]に掲載しています。(審議会(令和6年1月26日開催)報告時点)
(注)当該事例における症状が心筋炎や心膜炎であることを評価したものであり、ワクチン接種との因果関係を評価したものではないことに留意が必要です。
今後も情報収集・評価・分析を継続し、最新の情報を皆さまにお知らせしてまいります。
(*1)モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
(*2)国内のレジストリに登録された、新型コロナウイルス感染症による入院患者のうち、15~39歳男性の心筋炎・心膜炎が疑われた報告頻度は100万人あたり834人(2021年5月31日時点データによる解析)(※6)、米国の大学で実施された、大規模な複数の医療機関の電子カルテを集約した調査結果によると、12~17歳男性の心筋炎・心膜炎が疑われた報告頻度は100万人あたり450人(※7)であったとされています。
また、その他の最新のデータによると、新型コロナウイルス感染後の心筋炎等の合併について、米国における心筋炎等の患者は、12~17歳男性で100万人あたり501~649人、18~29歳男性で100万人あたり553~1,006人(※8)、英国における心筋炎の症例は100万人あたり約1,500件(※9)と報告されています。
(参考資料)
一般社団法人日本循環器学会提出資料(第62回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第11回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会)
一般社団法人日本循環器学会提出資料(第69回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第18回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会)
10代・20代の男性と保護者の方へのお知らせ~新型コロナワクチン接種後の心筋炎・心膜炎について~(厚生労働省)
CDC: ACIP Presentation Slides: June 23-25, 2021 Meeting
※1:米国におけるSARS-Cov-2感染後とmRNAワクチン接種後の心疾患発症の比較について[1.2MB](第78回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)資料より抜粋)
※2:心筋炎及び心膜炎の報告状況[1.5MB](第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)資料より抜粋)
※3:CDC:Morbidity and Mortality Weekly Report (MMWR)(2022/2/18)
(Safety Monitoring of COVID-19 Vaccine Booster Doses Among Adults - United States, September 22, 2021 - February 6, 2022)
※4:CDC: ACIP Presentation Slides: November 19, 2021 Meeting
(Updates to the Evidence to Recommendation Framework: Pfizer-BioNTech and Moderna COVID-19 vaccine booster doses)
※5:COVID-19 vaccine safety updates: Primary series in children and adolescents ages 5-11 and 12-15 years, and booster doses in adolescents ages 16-24 years
※6:COVID-19に関するレジストリ研究(COVID-19 REGISTRY JAPAN)
※7:medRxiv. 2021; March
(Risk of Myocarditis from COVID-19 Infection in People Under Age 20: A Population-Based Analysis)
※8:CDC:Morbidity and Mortality Weekly Report (MMWR)(2022/4/8)
(Cardiac Complications After SARS-CoV-2 Infection and mRNA COVID-19 Vaccination - PCORnet, United States, January 2021 - January 2022)
※9:MHRA:Coronavirus vaccine - summary of Yellow Card reporting(2022/6/24)
【2024年3月時点】ワクチン接種後に遷延する症状(いわゆる後遺症)が生じるのでしょうか。
現時点において、ワクチンが原因で接種後に遷延する症状(いわゆる後遺症)が起きるという知見はありませんが、接種後の遷延する症状を含めた副反応が疑われる症状について実態把握をする研究に取り組んでいます。
新型コロナワクチン接種後の副反応を疑う症状については、医療機関等から厚生労働省に報告される副反応疑い報告等に基づき、適時開催される審議会において新型コロナワクチンの安全性に係る評価を行っていますが、これまでワクチン接種後の長引く症状(遷延する症状)については、その実態等は明らかではありませんでした。
このため、厚生労働省においては、遷延する症状を含め、接種後の副反応が疑われる症状について、新型コロナワクチンとの因果関係の有無にかかわらず、必要な医療機関を受診できるよう、症状を訴える方に対応可能な医療提供体制の確保や相談窓口の周知等に取り組み、全ての都道府県において、相談に対応できる窓口の設置と専門的な医療機関の確保を確認するとともに、専門家の意見も聴きながら、遷延する症状に係る実態の把握をする等の必要な研究を行っていく予定としていました。(各都道府県における相談窓口と専門的な医療機関については、こちらをご覧ください。)
令和4年(2022年)12月に研究班が設置され、令和5年(2023年)2月から上記の専門的な医療機関のうち研究への協力が可能と回答があった医療機関を対象として、ワクチンとの因果関係を問わず、接種後の遷延する症状を含めた副反応が疑われる症状について実態調査を行うこととなりました。令和6年(2024年)1月26日に厚生労働省の審議会において研究班より調査結果の第三報があり、(1)IgA腎症の入院事例が複数報告されたが、全てが単一施設・医師からの報告であって、退院して外来治療が継続されていた。研究の性質上、ワクチンとの因果関係を検証することが困難なため、国内外の情報も含めて検討する必要がある、(2)症状の持続期間が31日以上等の事例を精査したが、全体の状況と同様に、特定の症状や疾病の報告の集中はみられず、転帰について多くの事例で軽快又は回復していることが確認された、(3)本調査の性質上、症状とワクチン接種の因果関係を検証できないが、一部には症状の回復に長期間かかる事例や、長期間経過しても未回復の事例が報告されている、(4)遷延する症状の診療にあたる医療従事者に必要な情報を提供することが求められる、との報告がなされました。
また、遷延する症状の疫学的分析については、令和2年度新型コロナワクチンの投与開始初期の重点的調査の追加分析の結果、ファイザー社ワクチン1回目接種後の19,784人のうち、10日目以降にも症状が持続した者は126人(0.64%)であり、このうち31日以上症状が持続したとして報告された事例は2例(0.01%)であり、2回目接種後の19,542人のうち、 10日目以降にも症状が持続した者は211人(1.08%)であり、このうち31日以上症状が持続したとして報告された事例は5例(0.03%)であった、またファイザー社又はモデルナ社のワクチン3回目接種後の4,323人のうち、10日以降にも症状が持続した者は65人(1.50%)であり、このうち31日以上症状が持続したとして報告された事例は5例(0.12%)であり、4回目接種後の3,375人のうち、10日以降にも症状が持続した者は38人(1.13%)であり、このうち31日以上症状が持続したとして報告された事例は1例(0.03%)であった、と報告されています。詳細は、こちら[346KB]をご覧ください。
今後も、新たな知見が得られ次第、速やかにお知らせしていきます。
(参考資料)
新型コロナワクチン接種後の遷延する症状に関する実態調査について(第100回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和5年度第15回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会資料)
【2024年3月時点】ワクチンを受けた後に熱が出たら、どうすればよいですか。
ワクチンによる発熱は接種後1~2日以内に起こることが多く、水分を十分に摂取し、必要な場合は解熱鎮痛剤を服用するなどして、様子をみていただくことになります。
ワクチンによる発熱は接種後1~2日以内に起こることが多く、水分を十分に摂取し、必要な場合は解熱鎮痛剤を服用するなどして、様子をみていただくことになります。このほか、ワクチン接種後に比較的起きやすい症状としては、頭痛、疲労、筋肉痛、悪寒(さむけ)、関節痛などがあります。
ワクチンによる発熱か、新型コロナウイルス感染症かを見分けるには、発熱以外に、最近、咳や咽頭痛、鼻水、味覚・嗅覚の消失、息切れ等の症状が始まっていないかどうかが、手がかりとなります。(ワクチンによる発熱では、通常、これらの症状はみられません。)
ワクチンを受けた後、2日間以上熱が続く場合や、症状が重い場合、ワクチンでは起こりにくい上記の症状がみられる場合には、医療機関等への受診や相談をご検討ください。
【2024年3月時点】高齢者で一番多い副反応は何でしょうか。
高齢者で一番多い副反応は、若年者同様、接種部位の痛みです。その他、頻度の高い副反応として、倦怠感、頭痛、悪寒、筋肉痛、関節痛、発熱などがありますが、たいてい数日以内で回復していることが確認されています。
日本で使用されているワクチンに関して、一番多い副反応はいずれも接種部位の痛み(疼痛や圧痛)です。
例えばファイザー社のワクチン(*)では、国内及び海外で実施された臨床試験において、7~8割の高齢者に発現がみられています。これは高齢者で注意が必要な症状というわけではなく、また、若年者よりも高齢者の方がその発現頻度は少し低い傾向がみられています。モデルナ社、アストラゼネカ社又は武田社(ノババックス)のワクチン(*)でも、発現頻度は異なるものの、一番多い副反応は接種部位の痛み(疼痛や圧痛)となっています。
その他、頻度の高い副反応として、倦怠感、頭痛、悪寒、筋肉痛、関節痛、発熱などが起こることがありますが、たいてい数日以内で回復していることが確認されています。いずれの有害事象も、高齢者で発現頻度が高くなっているというものではありません。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、ファイザー社の従来ワクチン(1価)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。
また、現在、日本国内では、新型コロナワクチンの接種を受けた人を対象に接種後の健康状況に係る調査を実施していますが、いずれのワクチンにおいても、接種部位の痛みが最も多くみられています。
なお、オミクロン株対応ワクチンの副反応について、2価ワクチンはこちら、1価ワクチンはこちらをご覧ください。
(参考資料)
N Engl J Med. 2020; 383:2603-2615
(Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine)
新型コロナワクチンごとの情報(臨床試験の主な結果等)(厚生労働省)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(アストラゼネカ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
【2024年3月時点】ワクチン接種後の副反応はどこに相談したらよいですか。
まずは身近な医療機関や接種を受けた医療機関で診ていただくことになりますが、身近に医療機関が無い方を含め副反応について相談いただけるよう、窓口等の設置を各都道府県にお願いしています。また、受診や相談の結果、必要と判断された場合に、専門的な医療機関を円滑に受診できるよう、体制を確保しています。
新型コロナワクチン接種後、副反応を疑う症状で医療機関を受診したい場合、まずは身近な医療機関や、ご自身が接種を受けた医療機関で診ていただくことになります。各都道府県に、ワクチン接種後の副反応に関する相談窓口等の設置をお願いしていますので、ご相談の際は、お住まいの都道府県のワクチンに関する窓口にお問合せください。
また、接種後の症状等から、より専門的な対応が必要であると判断された場合、相談を受けた医療機関や接種医等から、総合的な診療が可能な医療機関を紹介することとなっています(このような専門的な医療機関の情報は、都道府県から、ワクチンを接種する医療機関等に共有されています)。専門的な医療機関を円滑に受診できる体制確保については、各都道府県宛て通知を発出しています(※1~4)。また、小児(5~11歳)接種における、副反応を疑う症状に対する診療体制の構築(※2)についてはこちらでも解説しています。
各都道府県における相談窓口と専門的な医療機関を一覧で掲載していますので、こちらをご覧ください。
なお、ワクチン接種後の副反応により健康被害が生じ、それが予防接種によるものであると厚生労働大臣が認定したときは、予防接種法に基づく救済(医療費・障害年金等の給付)が受けられます。詳細はこちらをご覧ください。また、副反応以外の一般的な相談についてはこちらをご覧ください。
(参考資料)
※1:新型コロナウイルスワクチン接種後の副反応を疑う症状に対する診療体制の構築について(厚生労働省)
※2:5歳以上11歳以下の者への新型コロナワクチン接種に向けた接種体制の準備について(厚生労働省)
※3:遷延する症状を訴える方に対応する診療体制の構築について(厚生労働省)
※4:新型コロナウイルスワクチン接種後の副反応を疑う症状に対応できる専門的な医療機関の名称等の公表について(厚生労働省)
【2024年3月時点】副反応による健康被害が起きた場合の補償はどうなっていますか。
健康被害が予防接種によるものであると厚生労働大臣が認定したときは、予防接種法に基づく救済(医療費・障害年金等の給付)が受けられます。
一般的に、ワクチン接種では、一時的な発熱や接種部位の腫れ・痛みなどの、比較的よく起こる副反応以外にも、副反応による健康被害(病気になったり障害が残ったりすること)が生じることがあります。極めて稀ではあるもののなくすことができないことから、救済制度が設けられています。
救済制度では、予防接種によって健康被害が生じ、医療機関での治療が必要になったり、障害が残ったりした場合に、その健康被害が接種を受けたことによるものであると厚生労働大臣が認定したときは、予防接種法に基づく救済(医療費・障害年金等の給付)が受けられます。認定にあたっては、予防接種・感染症・医療・法律の専門家により構成される国の審査会で、厳密な医学的な因果関係までは必要とせず、接種後の症状が予防接種によって起こることを否定できない場合も対象とするとの考え方に基づき、因果関係を判断する審査が行われます。
新型コロナワクチンの接種についても、健康被害が生じた場合には、予防接種法に基づく救済を受けることができます。なお、健康被害救済の給付額は、定期接種のA類疾病と同じ水準です。
現在の救済制度の内容については、こちらをご参照ください。
(参考)
予防接種健康被害救済制度について(厚生労働省)
【2024年3月時点】接種後に起きた症状とワクチンとの因果関係の考え方について、副反応疑い報告制度と健康被害救済制度では、どうなっていますか。
副反応疑い報告制度では医学・薬学的観点から総合的に判断し、健康被害救済制度では厳密な医学的な因果関係を必要としない等、考え方に違いがあります。前者の制度で評価できないとされた事例でも、後者の制度で認定される場合があります。
新型コロナワクチン接種後の副反応が疑われる症状については、副反応疑い報告制度により、常に情報を収集しており、定期的に開催している厚生労働省の審議会(※1)において、評価が行われています。
審議会においては、原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、3つの評価記号(※2)を用いて、ワクチン接種と副反応疑い事象の因果関係の評価を行っています。 これまで個別症例の評価や集団での系統的な分析・評価により安全性等を評価した上で、必要な措置を講じてきたところであり、新型コロナワクチンの接種を中止すべきとの判断には至っておりません。
一方で、予防接種法に基づく健康被害救済制度は、接種に係る過失の有無にかかわらず、厚生労働省の審査会(※3)において予防接種と健康被害との因果関係が認定された方を、迅速に救済するものです。
その認定にあたっては、請求された疾病等と予防接種との因果関係について、厳密な医学的な因果関係までは必要とせず、接種後の症状が予防接種によって起こることを否定できない場合も対象とするとの考え方に基づいて審査が行われます。
個々の事例における因果関係の判断にあたって、副反応疑い報告制度における評価は勘案していないため、仮に副反応疑い報告制度において因果関係が評価できないとされている事例であっても、健康被害救済の対象となる場合があります。
(※1)厚生科学審議会予防接種・ワクチン分科会副反応検討部会、薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)
(※2)
- α:ワクチンと症状名との因果関係が否定できないもの
- β:ワクチンと症状名との因果関係が認められないもの
- γ:情報不足等によりワクチンと症状名との因果関係が評価できないもの
(※3)疾病・障害認定審査会感染症・予防接種分科会、同分科会新型コロナウイルス感染症予防接種健康被害審査第一部会、同分科会新型コロナウイルス感染症予防接種健康被害審査第二部会及び同分科会新型コロナウイルス感染症予防接種健康被害審査第三部会
私は接種できますか?
【2024年3月時点】ワクチンを接種することができないのはどのような人ですか。
ワクチンを接種することができないのは下記の方ですので、ご自身が当てはまると思われる方は、身近な医療機関にご相談ください。
一般に、以下の方は、ワクチンを接種することができません。ご自身が当てはまると思われる方は、ワクチンを接種してもよいか、身近な医療機関にご相談ください。
- 明らかに発熱している方(※1)
- 重い急性疾患にかかっている方
- ワクチンの成分に対し、アナフィラキシーなど重度の過敏症(※2)の既往歴のある方
- 上記以外で、予防接種を受けることが不適当な状態にある方
(※1)明らかな発熱とは通常37.5℃以上を指します。ただし、37.5℃を下回る場合も平時の体温を鑑みて発熱と判断される場合はこの限りではありません。
(※2)アナフィラキシーや、全身性の皮膚・粘膜症状、喘鳴、呼吸困難、頻脈、血圧低下等、アナフィラキシーを疑わせる複数の症状。
【2024年3月時点】ワクチンを接種するのに注意が必要なのはどのような人ですか。
ワクチンを接種するにあたって注意が必要なのは下記の方です。予診票に記載した上で予診を受けていただきます。
一般に、以下の方は、ワクチンを接種するにあたって注意が必要です。当てはまる方は、予診票に記載をしていただいた上で、予診を行います。
- 過去に免疫不全の診断を受けた人、近親者に先天性免疫不全症の方がいる方
- 心臓、腎臓、肝臓、血液疾患や発育障害などの基礎疾患のある方
- 過去に予防接種を受けて、接種後2日以内に発熱や全身性の発疹などのアレルギーが疑われる症状がでた方
- 過去にけいれんを起こしたことがある方
- ワクチンの成分に対して、アレルギーが起こるおそれがある方
ワクチン接種は体調のよいときに受けるのが基本ですので、特に基礎疾患のある方は、病状が悪化していたり、全身が衰弱している場合は避けた方がよいと考えられます。ご心配な方は、主治医にご相談ください。
また、新型コロナワクチンは筋肉内に注射することから、
- 抗凝固療法を受けている人、血小板減少症または凝固障害のある方
は、接種後の出血に注意が必要とされています。
【2024年3月時点】私は基礎疾患(持病)を持っていますが、ワクチンを接種することはできますか。
慢性的な病気のある方もワクチン接種ができる場合が多いですが、病気が悪化しているときには避けた方がよいと考えられます。また、かかっている病気によっては、注意した方がよい点があります。
慢性的な病気のある方もワクチンを接種できる場合が多く、むしろ、コロナウイルスに感染した場合、重症化するリスクが他の⽅よりも⾼いため、接種のメリットが大きいと考えられます。一方、ワクチン接種は体調のよいときに受けるのが基本ですので、病状が悪化していたり、全身が衰弱していたりする場合は避けた方がよいと考えられます。かかっている病気によっては、次のような点に注意しましょう。

- ⾼⾎圧や糖尿病、喘息、肥満、心筋梗塞、心不全、腎臓の病気などの基礎疾患があっても、ワクチンを接種することができます。新型コロナウイルスに感染した場合、重症化するリスクが他の⽅よりも⾼いため、こうした病気の治療等のために通院・入院されている方は、接種のメリットが大きいと考えられます。
- がん、⾻髄移植や臓器移植後、先天性免疫不全、HIVに感染している方などは、一般的に免疫力が低下する傾向にあると考えられます。免疫力が低下している⽅は、主治医に接種の可否を相談する必要がありますが、新型コロナウイルスに感染した場合には重症化するリスクが他の⽅よりも⾼いため、他に接種してはいけない理由がなければ、一般的に接種が勧められています。
なお、mRNAワクチン、ウイルスベクターワクチンには新型コロナウイルスそのものが含まれているわけではないので、免疫が低下していることが原因でワクチン接種により新型コロナウイルスに感染することはありません。⼀⽅で、ワクチンの有効性は接種を受ける⽅の免疫応答に依存するため、免疫が低下している⽅では他の⽅よりも予防接種の効果が低い可能性があります。感染の流行が続いている間はワクチンを接種した後も引き続き、マスクの効果的な場面での着用(*)、石けんによる⼿洗いや手指消毒用アルコールによる消毒の励行、こまめな換気などをお願いします。
(*)令和5年(2023年)3月13日からマスクの着用は、個人の主体的な選択を尊重し、個人の判断が基本となりました。ただし、マスクの着用が推奨される場面がありますので、ご留意をお願いします。詳しくはこちらをご確認ください。
- 血友病など血が止まりにくい病気のある方は、筋肉内出血のリスクがあるため、接種後に、接種部位を圧迫していただく必要がありますが、接種は可能です。主治医とご相談をお願いします。
- けいれん発作が起こる方も、けいれん発作状況がよく確認されており、病状と体調が安定していれば、主治医と相談の上、接種することができます。子どもの頃に熱性けいれんを起こしたことのある方も、接種することができます。発熱によってけいれん発作が生じやすい方については、接種後に熱が出た場合の発作予防策や発作時の対策をあらかじめ主治医と相談しましょう。
- 過去に新型コロナウイルスに感染したことがある方はこちらをご覧ください。
- アレルギー疾患にかかっている方や重いアレルギーの既往のある方は、こちらをご覧ください。
【2024年3月時点】海外では、アレルギーのある人は接種を受けていますか。アレルギーのある人は副反応が起きやすいのですか。
米国CDCは、他のワクチンや食べ物に対して重いアレルギーのある方も、新型コロナワクチンの接種が可能としています。 一方で、過去に新型コロナワクチンに対して重いアレルギー反応を起こした方や、同ワクチンに含まれる成分に対して重いアレルギー反応を起こしたことがある方への接種は推奨していません。
米国の疾病予防管理センター(CDC)は、他のワクチンや食べ物に対して、重いアレルギーのある方も、新型コロナワクチンの接種が可能としています。 一方、過去に新型コロナワクチン(mRNAワクチン)に対して、アナフィラキシーなど重いアレルギー反応を起こした方や、同ワクチンに含まれるポリエチレングリコール(PEG、※1)に対して重いアレルギー反応を起こしたことがある方への接種は推奨していません。PEGに似た構造を持つポリソルベート(※2)に対して重いアレルギー反応を起こしたことがある方への接種は、以前は禁忌とされていましたが、現在は、専門医による適切な評価と重度の過敏症発症時の十分な対応ができる体制のもとに限り考慮できるとされています(2021年3月3日時点)。
(※1、※2)ポリエチレングリコールは、一般に、病院で腸内検査をする際に用いる腸管洗浄剤の主成分であり、また、飲み薬や塗り薬、目薬等の添加物としても用いられます。医薬品以外では、ヘアケア製品や歯磨き粉等の医薬部外品に用いられており、保湿等を目的として化粧品にも含まれています。また、ポリソルベートは、医薬品の他、乳化剤などの食品添加物として様々な食品に用いられています。なお、こちらに記載した製品群以外の製品にも含有されている可能性があるため、ご心配の方はご使用されている製品の成分欄をご確認いただくか、身近な医療機関にご相談ください。ただし、ポリエチレングリコールやポリソルベートを含む製品が原因でアレルギー反応を起こしても、必ずしもポリエチレングリコールまたはポリソルベートがアレルギー反応の原因とは限りません。
米国では
- 重いアレルギー反応を起こしたことがある人や、ワクチンや注射で何らかの即時型アレルギー反応を起こしたことがある人は、ワクチン接種後少なくとも30分間
- それ以外の人は、ワクチン接種後少なくとも15分間
アナフィラキシーなどの有無を観察することが推奨されています。
なお、米国において、ファイザー社の新型コロナワクチン接種後に報告されたアナフィラキシーは、2021年1月18日時点で、50例(9,943,247回中)で、100万回あたり5例となっており、74%が接種後15分以内、90%が接種後30分以内に症状が現れています。また、80%にアレルギーの既往があり、24%にはアナフィラキシーの既往があったと報告されています。また、モデルナ社の新型コロナワクチン接種後に報告されたアナフィラキシーは、2021年1月18日時点で、21例(7,581,429回中)で、100万回あたり2.8例となっており、86%が接種後15分以内、90%が接種後30分以内に症状が現れています。また、86%にアレルギーの既往があり、24%にはアナフィラキシーの既往があったと報告されています。
(参考資料)
CDC. Pfizer-BioNTech COVID-19 Vaccine Questions
CDC. Advisory Committee on Immunization Practices (ACIP) January 27, 2021
【2024年3月時点】過去にアレルギー反応やアナフィラキシーを起こしたことがあり、今回も起こすのではないかと心配なのですが、接種を受けても大丈夫でしょうか。
食物アレルギーや、アレルギー体質などがあるといった理由だけで、接種を受けられないわけではありません。
食物アレルギー、気管支喘息、アトピー性皮膚炎、アレルギー性鼻炎や花粉症、じんま疹、アレルギー体質などがあるといった理由だけで、接種を受けられないわけではありません。また、接種するワクチンの成分に関係のないものに対するアレルギーを持つ方も接種は可能です。ただし、これまでに、薬や食品など何らかの物質で、アナフィラキシーなどを含む、重いアレルギー反応を起こしたことがある方は、接種直後に調子が悪くなったときに速やかに対応ができるよう、接種後、通常より長く(30分間)、接種会場で待機していただきます。
過去にアレルギー反応やアナフィラキシーを起こしたことがある方は、予診票にご記入いただくとともに、原因の医薬品等やその時の状況をできるだけ詳しく医師にお伝えください。重いアレルギーで医療機関にかかっている場合には、接種の可否について事前に相談することをお勧めします。
アナフィラキシーの症状、治療法等についてはこちらをご覧ください。
【2024年3月時点】私は過去に蜂に刺されたことがありますが、ワクチンを接種することはできますか。
蜂刺されによるアレルギーがある⽅でも、ワクチンを接種することができます。
蜂刺されによるアレルギーがある⽅でも、新型コロナワクチンを接種することができます。ただし、アナフィラキシーなど重いアレルギー症状の起きたことがある⽅は、新型コロナワクチン接種後に急激なアレルギー反応が出ないことを確認するために、通常より⻑く(30分)接種会場で待機するようお願いしています。
【2024年3月時点】薬を飲んでいる人はワクチンを接種することはできますか。
薬を飲んでいるために、ワクチンが接種できないということはありませんが、かかっている病気によっては、接種を慎重に検討した方がよい場合があります。
薬を飲んでいるために、ワクチンが接種できないということはありませんが、基礎疾患のある方では、免疫不全のある方や病状が重い方など、接種を慎重に検討した方がよい場合がありますので、こちらをご覧ください。
ステロイドや抗がん剤、免疫を下げる薬(臓器移植や骨髄移植後に使用される免疫抑制剤など)を使⽤中の⽅は、免疫力が低下している状態と考えられています。免疫力が低下している⽅は、主治医などに接種の可否を相談する必要がありますが、新型コロナウイルスに感染した場合には重症化するリスクが他の⽅よりも⾼いため、他に接種してはいけない理由がなければ接種が勧められています。「ステロイドなど、免疫の機能を低下させる治療を受けている」⽅は「基礎疾患を有する者」として優先接種の対象となっています。
また、「血液をサラサラにする薬」として処方されている薬の一部(抗凝固薬が含まれます。抗血小板薬は含まれません。)では、出血が止まりにくいことがあるので、予診票でお薬の種類を確認しています。ご自身が飲んでいる薬が抗凝固薬に当てはまるかどうか不明な方は、主治医などにご確認いただくか、こちら[544KB]の資料をご覧ください。服用されている方は、接種後に接種場所を2分程度、しっかりと押さえるようにお願いします。
【2024年3月時点】新型コロナウイルスに感染したことのある人は、ワクチンを接種することはできますか。
これまでに接種した新型コロナワクチンの接種回数及び種類にかかわらず、新型コロナウイルスに感染した方もワクチンを接種することができます。
新型コロナウイルスに感染した方でも、これまでに接種した新型コロナワクチンの接種回数及び種類にかかわらず、ワクチンを接種することができます。これは、このウイルスが一度感染しても再度感染する可能性があることと、自然に感染するよりもワクチン接種の方が、新型コロナウイルスに対する血中の抗体価が高くなることや、多様な変異に対する抗体の産生も報告されているからです(※1~4)。
米国CDCでは、感染歴にかかわらず、生後6か月以上の全ての人にワクチン接種が推奨されています。これには、感染後の症状が長引く人も対象に含まれています。蓄積されつつあるエビデンスによると、より感染性の高い変異株が流行している状況下においても、感染後のワクチン接種が、その後の感染に対する防御をさらに高めるとされています(※5)。
感染後、体調が回復して接種を希望する際には、その治療内容や感染からの期間にかかわらずワクチンを接種することができます。モノクローナル抗体や血漿療法による治療を受けた場合も、本人が速やかにワクチン接種を希望する場合には、必ずしも一定期間を空ける必要はありません。
米国CDCは、過去に抗体製剤(モノクローナル抗体または回復期血漿)の投与を受けた方も、接種を延期する必要はないとしています(※5)。
感染歴のある方に対する追加接種(従来の1価ワクチンにおける)については、諸外国の動向や、現時点で得られている科学的知見(※6)等を踏まえ、厚生労働省の審議会において議論された結果、初回接種を終えた後に感染した方では、体調が回復してから3回目接種までの間隔について、暫定的に3か月を一つの目安(*)にすることとされました。
(*)この目安は、従来の1価ワクチンによる3回目接種に対するものです。オミクロン株対応の2価ワクチンや1価ワクチンによる追加接種については、現時点では、こうした目安はなく、感染からの期間にかかわらずワクチンを接種することができます。
ただし、この場合も、3回目接種は2回目接種から所定の期間が経過している場合に限ります。(例:2回目接種から4か月後に感染し、その後回復した場合、3回目接種は2回目接種から7か月後が一つの目安となります。)
なお、感染から回復後、期間を空けずに追加接種を希望する方についても、引き続き接種の機会を提供していきます。
隔離期間中は、感染性(他の方へ感染させる可能性)が十分低下していないので、外出はお控えください(濃厚接触者も同様です)。
(参考資料)
既感染者への接種について[1.1MB](第21回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
既感染者に対するワクチン接種の効果等[1.6MB](第24回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
既感染者への新型コロナワクチン接種に関する諸外国の対応状況等[1.1MB](第30回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:Nature. 2020;586:594-599
(COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses)
※2:N Engl J Med. 2021;384:80-82
(Durability of Responses after SARS-CoV-2 mRNA-1273 Vaccination)
※3:CDC. Science Brief: SARS-CoV-2 Infection-induced and Vaccine-induced Immunity
※4:N Engl J Med. 2022;386:698-700
(SARS-CoV-2 Omicron Variant Neutralization in Serum from Vaccinated and Convalescent Persons)
※5:CDC. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States
※6:Cell. Published online Jan 2022
(SARS-CoV-2 breakthrough infections elicit potent, broad, and durable neutralizing antibody responses)
【2024年3月時点】寝たきり(在宅介護)の人もワクチン接種は可能ですか。
在宅介護を受けている方もワクチン接種は可能です。在宅での接種が可能かどうかは、主治医と相談してください。
在宅介護を受けている方もワクチン接種は可能です。在宅での接種が可能かどうかは、主治医と相談してください。介助があれば接種会場や医療機関へ移動できそうな場合は、ケアマネージャー等ともご相談ください。接種する方法が分からない場合は、お住まいの市区町村にご相談ください。
接種の見通し
【2024年3月時点】日本の新型コロナワクチン接種はどうなりますか。
令和5年(2023年)9月20日以降、生後6か月以上の全ての方を対象に、オミクロン株対応1価ワクチンによる接種を実施しています。
現在、接種が受けられる期間は、令和3年(2021年)2月17日から令和6年(2024年)3月31日までとしています。接種を希望される方は、無料で受けることができます。まだ接種を終えていない重症化リスクの高い方は、積極的に接種をご検討ください。
WHO(世界保健機関)は新型コロナワクチンの利用に関する指針において、高齢者等に対しては更なる追加接種を推奨する一方、健康な乳幼児、小児、成人等に対しては推奨せず、健康な乳幼児と小児に対しては、初回接種を含め、疾病負荷等を踏まえ各国において検討すべきとしています。
日本におけるオミクロン株の流行状況について、年齢別の重症化率や致死率は令和4年(2022年)1~8月において、高齢者では高い一方、それ以下の世代では低い状況にあります。
以上から、令和5年秋開始接種は重症者を減らす目的で、高齢者など重症化リスクが高い者を接種の対象としつつ、その他の全ての者には接種の機会を提供することとされ、オミクロン株対応1価ワクチン(XBB.1.5)を使用することとされています。
令和5年9月20日以降、生後6か月以上の全ての方を対象に、オミクロン株対応1価ワクチンによる接種を以下のとおり実施しています。
- 初回(1・2回目)接種(※)を終えた方は、これまでに接種した新型コロナワクチンの種類にかかわらず、最後の接種から3か月以上の間隔を空けて、1人1回受けていただくことができます(令和5年秋開始接種)。
- 初回(1・2回目)(※)接種が未了である方も、接種を受けていただくことができます(初回接種)。
(※)ファイザー社の1価ワクチンによる乳幼児(生後6か月~4歳)への初回接種は、3回で1セットです。
なお、令和5年12月26日現在、日本では以下のワクチンが、予防接種法に基づく特例臨時接種で使用されています。
- オミクロン株対応の1価ワクチンとして、ファイザー社のワクチン(XBB.1.5)が令和5年9月1日に薬事承認され、同年9月20日から生後6か月以上を対象とした初回接種及び追加接種が開始されています。またモデルナ社のワクチン(XBB.1.5)も、6歳以上を対象とした追加接種及び生後6か月以上を対象とした初回接種が、それぞれ令和5年9月12日及び同年10月24日に薬事承認され、それぞれ同年9月25日及び同年11月1日から接種が開始されています。また第一三共社のワクチン(XBB.1.5)も、12歳以上を対象とした追加接種が、令和5年11月28日に薬事承認され、同年12月4日から接種が開始されています。
(アストラゼネカ社のワクチン「バキスゼブリア筋注」は、令和3年8月3日より予防接種法に基づく接種の対象となりましたが、令和4年9月30日をもって、接種が終了しました。)
(ファイザー社のワクチン(従来の1価ワクチン)が、令和3年2月14日に薬事承認され、同月17日から接種が開始されましたが、令和5年9月19日をもって接種が終了しました。)
(モデルナ社のワクチン(従来の1価ワクチン)が、令和3年5月21日に薬事承認され、同月24日から接種が開始されましたが、令和5年2月11日をもって、接種が終了しました。)
(ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1及び従来株/BA.4-5)について、それぞれ令和4年9月12日及び同年10月5日に薬事承認され、同年9月20日及び同年10月13日から接種が開始されましたが、いずれも令和5年9月19日をもって接種が終了しました。)
(モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1及び従来株/BA.4-5)について、それぞれ令和4年9月12日及び同年11月1日に薬事承認され、同年10月13日及び同年11月28日から接種が開始されましたが、BA.1対応型は令和5年6月14日、BA.4-5対応型は令和5年9月19日をもって接種が終了しました。)
(武田社のワクチン(ノババックス)(*1)は、令和4年4月19日に薬事承認され、同年5月25日から接種が開始されましたが、令和5年12月25日をもって接種が終了しました。)
<オミクロン株対応1価ワクチンの接種について>
令和5年9月20日からは、オミクロン株対応1価ワクチンによる接種が開始されています。現時点(令和5年12月時点)では、初回接種を完了した方を対象に、オミクロン株対応1価ワクチンによる追加接種を行うこととしており、生後6か月以上の方にはファイザー社の1価ワクチン(XBB.1.5)、6歳以上の方にはモデルナ社の1価ワクチン(XBB.1.5)、12歳以上の方には第一三共社の1価ワクチン(XBB.1.5)が使用いただけます。ただし、いずれの方においても、前回の接種から3か月以上の間隔をあける必要があります。また、初回(1・2回目)接種が未了である方を対象に初回接種も実施しており、生後6か月以上の方にはファイザー社及びモデルナ社の1価ワクチン(XBB.1.5)が使用いただけます。
<小児(5~11歳)接種について>
ファイザー社の小児(5~11歳)用オミクロン株対応1価ワクチン(XBB.1.5)(*2)が令和5年9月1日に薬事承認され、同年9月20日から初回接種及び追加接種が開始されています。また、6~11歳を対象としたモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による追加接種と初回接種も、それぞれ令和5年9月12日及び同年10月24日に薬事承認され、それぞれ同年9月25日及び同年11月1日から接種が開始されています。
<乳幼児(生後6か月~5歳)接種について>
ファイザー社の乳幼児(生後6か月~4歳)用オミクロン株対応1価ワクチン(XBB.1.5)(*2)が令和5年9月1日に薬事承認され、同年9月20日から初回接種及び追加接種が開始されています。また、生後6か月~5歳を対象としたモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)による初回接種も、令和5年10月24日に薬事承認され、同年11月1日から接種が開始されています。なお、ファイザー社の生後6か月~4歳用のワクチンは、合計3回の用法で薬事承認がなされているため、12歳以上及び5歳~11歳用のワクチンとは異なり、3回の接種で1セットとなっています。
(*1)米国ノババックス社から技術移管を受けて武田薬品工業株式会社が国内で生産、流通を行うもの。ファイザー社及びモデルナ社のオミクロン株対応1価ワクチンを何らかの理由で接種できない方に、従来の1価ワクチンである武田社(ノババックス)のワクチンが、使用するワクチンの選択肢として位置づけられていました。
(*2)ファイザー社のワクチンは、12歳以上の方、5~11歳の方、生後6か月~4歳の方、でそれぞれ異なるワクチンを使用することとなるため、接種予約等の際にはご注意ください(生後6か月~4歳の方は、3回の接種で1セットとなっています。)。
初回接種(1回目・2回目接種)についてのお知らせはこちらを、追加接種(令和5年秋開始接種)についてのお知らせはこちらをご覧ください。
ワクチンの供給の見通しはこちらを、接種の実績はこちらをご覧ください。また、追加接種の詳細はこちらを、オミクロン株対応1価ワクチンについてはこちらをご確認ください。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
5~11歳の子どもへの接種(小児接種)についてのお知らせ(厚生労働省HP)
生後6か月~4歳の子どもへの接種(乳幼児接種)についてのお知らせ(厚生労働省HP)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】現在、承認されている新型コロナワクチン以外に、どのようなワクチンが開発されていますか。
新型コロナワクチンについては、早期の実用化を目指し、国内外で多数の研究が精力的に行われています。
一般に、ワクチンの開発は、基礎研究、非臨床試験、臨床試験の大きく3つのステップで進められていきます。その中で、候補物質の探索、有効性・安全性の確認、品質を担保しつつ大量生産が可能かどうかの確認などを行う必要があり、開発には一般に年単位の期間がかかります。
現在、新型コロナワクチンについては、早期の実用化を目指し、国内外で多数の研究が精力的に行われています。通常より早いペースで開発が進められており、既に承認されたワクチン以外にも、海外で開発され実用化されたものや、国内で臨床試験が開始されているものが複数あります。
詳細は、こちらをご覧ください。
接種を受ける方法
【2024年3月時点】新型コロナワクチンとインフルエンザワクチンの同時接種を受ける場合、2つのワクチンの間に、15分や30分といった間隔を空ける必要はありますか?
オミクロン株対応ワクチンを含め、新型コロナワクチンは、インフルエンザワクチンとの同時接種が可能です。15分や30分といった間隔を空ける必要はありません。
オミクロン株対応ワクチンなど新型コロナワクチンは、インフルエンザワクチンとの同時接種が可能です。15分や30分といった間隔を空ける必要はありません。
また、それぞれのワクチンを別の日に接種する場合の接種間隔についても制限はありません。
ただし、インフルエンザワクチン以外のワクチンは、オミクロン株対応ワクチンと同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
なお、創傷時の破傷風トキソイド等、緊急性を要するものに関しては、例外として2週間を空けずに接種することが可能です。
(例)10月1日に新型コロナワクチンを接種した場合、他のワクチンを接種できるのは、10月15日(2週間後の同じ曜日の日)以降になります。インフルエンザワクチンは、10月1日に同時接種が可能なほか、10月3日や10月7日に接種することも可能です。
【2024年3月時点】接種までの流れはどうなりますか。
ワクチン接種を受ける流れについて、6つのステップを動画で纏めています。
ワクチン接種を受ける流れについて、6つのステップ(クーポン券(接種券等)と接種のお知らせ、接種の予約、接種当日までの事前確認、接種当日に準備するもの、1回目の接種、接種後について)を動画でご説明しています。また、接種を受ける際の同意や予防接種健康被害救済制度、各市区町村によって手続きが変わる注意事項についてもお知らせしています。
なお、コロナワクチンナビ(*)でも詳細をご確認いただけます。
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】接種費用はかかるのですか。
新型コロナワクチンの接種は無料です。国や自治体が、ワクチン接種のために金銭や個人情報を電話やメール等で求めることはありません。
新型コロナワクチンの接種は全額公費で行うため、無料で接種いただけます。
なお、新型コロナワクチンに便乗した詐欺が多く発生しています。国や自治体が、ワクチン接種のために金銭や個人情報を電話やメール等で求めることはありません。怪しい電話やメール、郵送物等には反応しないでください。国民生活センターでは、新型コロナウイルス感染症関連の消費者へのアドバイスやトラブル、相談事例等を紹介しています。また、消費者庁でも詐欺への注意喚起を図っています。詳しくはこちらをご覧ください。
【2024年3月時点】令和6年(2024年)4月以降の新型コロナワクチンの接種は有料となるのですか。
全額公費による接種は令和6年3月末で終了し、令和6年4月以降の接種は原則有料となります。
新型コロナワクチンの全額公費による接種は、令和6年3月31日で終了します。
令和6年4月1日以降、65歳以上の方及び60歳から64歳で対象となる方(※)には、新型コロナの重症化予防を目的として秋冬に自治体による定期接種が行われ、費用は原則有料となります(接種を受ける努力義務や自治体からの接種勧奨の規定はありません。)。
令和6年4月1日以降に定期接種以外で接種を希望される方には、任意接種として、自費で接種を受けていただくことになります。
(※)60~64歳で心臓、腎臓又は呼吸器の機能に障害があり、身の回りの生活が極度に制限される方、ヒト免疫不全ウイルス(HIV)による免疫の機能に障害があり、日常生活がほとんど不可能な方
(参考資料)
新型コロナワクチンの全額公費による接種終了について(リーフレット)
新型コロナワクチンについて(厚生労働省HP)
【2024年3月時点】令和6年(2024年)3月31日までに新型コロナワクチンの初回接種を完了できない場合はどうなりますか。
残りの接種は自費で受けていただくこととなりますので、希望される方は令和6年3月31日までに、必要な接種を完了できるようお願いします。
新型コロナワクチンの全額公費による接種は、令和6年3月31日で終了します。
令和6年3月31日までに初回接種(※)を完了できない場合、残りの接種は自費で受けていただくこととなります。初回接種を希望される方は、できるだけ、令和6年3月31日までに必要な接種を完了できるよう余裕を持って受けていただくようお願いします。
(※)新型コロナワクチンの接種を初めて受ける場合、合計2回(生後6か月~4歳の方がファイザー社のワクチンを受ける場合は合計3回)の接種を行い、この1・2回目(生後6か月~4歳の方がファイザー社のワクチンを受ける場合は3回)の接種を1セットとして、「初回接種 」といいます。
(参考資料)
新型コロナワクチンの全額公費による接種終了について(リーフレット)
新型コロナワクチンについて(厚生労働省HP)
【2024年3月時点】住民票所在地以外での接種や、県外にある通院中の医療機関での接種は可能ですか。
原則として住民票所在地で接種していただくことになりますが、住民票所在地外に通院・入院している方などは、その医療機関でも接種できます。その他の方も、市区町村が受け入れ可能と判断する場合は、住民票所在地外でも接種できます。その際の手続きは、接種を受けたい市区町村にご確認ください。また、都道府県が設置する大規模接種会場等でも接種できます。
原則として住民票所在地で接種していただくことになりますが、例えば、次のような方は、住民票所在地以外でのワクチン接種が可能となります。
- 住民票所在地市区町村外の医療機関や施設に入院・入所中で、その医療機関や施設でワクチン接種を受ける方
- 基礎疾患で治療中の医療機関でワクチン接種を受ける方
- 副反応のリスクが高い等のため、医師の判断により、体制の整った医療機関での接種が必要な方
- 都道府県の設置する大規模接種会場等で接種を受ける方(※)
- 単身赴任、下宿などにより、お住まいが住民票所在地と異なる方(この場合、住民票所在地外接種の届出が必要となります。手続きはお住まいの市区町村で行います。市区町村によっては、コロナワクチンナビ(*)で手続きが可能です。)
(※)会場毎に、対象地域にお住まいの方に限ります。
この他、市区町村が受け入れ可能と判断する場合は、住民票所在地外でも接種できます。受け入れの可否や、必要な手続きについては、接種を受けたい市区町村にご確認ください。
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】住所が変更となり、住民票所在地が変更となった場合、接種券の再発行は可能でしょうか。
接種券の発送後に住民票の住所が変更となった場合は、引っ越し後の市区町村に申請を行うことで、接種券の再発行が可能です。
接種券の発送後に住民票所在地が変更となった場合は、転入後の市区町村に申請を行うことで、接種券の再発行が可能です。具体的な申請方法等は、転入した市区町村へお問い合わせください。なお、引っ越し前の市区町村で接種券が既に発行されている場合は、引っ越し後の市区町村に転入届を提出するときに、できるだけ世帯全員の未使用の接種券を一緒に持って行っていただくようお願いしています。
【2024年3月時点】接種券に有効期限はありますか。ワクチン接種を一度見送りましたが、後日、接種を受けたいと考えています。
接種券の取扱いは市町村ごとに異なるため、お住まいの市町村にお問い合わせください。なお、お手元の接種券は引き続き有効な可能性があるため、市町村に確認するまでは保管していただくようお願いいたします。
接種券の有効期限等の取扱いは市町村ごとに異なるため、お住まいの市町村にご相談ください。なお、お手元の接種券は引き続き有効な可能性があるため、市町村に確認するまでは引き続き保管していただくようお願いいたします。
オミクロン株対応1価ワクチン(*)による追加接種を受けるには、初回接種を終えている必要があります。生後6か月以上の方は、初回接種が完了してから3か月後に、追加接種としてオミクロン株対応1価ワクチン(XBB.1.5)の接種を受けることが可能です。また、オミクロン株対応1価ワクチン(XBB.1.5)による初回接種も、生後6か月以上の方を対象に実施しています。
まだ接種を終えていない重症化リスクの高い方は、積極的に接種をご検討ください。
(*)モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
接種できる時期や会場等については、住民票のある市区町村のホームページや広報をご覧ください。
【2024年3月時点】接種を受ける際の本人確認書類は、写し(コピー)でも可能ですか。
原則として原本を持参してください。
原則として、マイナンバーカード、運転免許証、健康保険証などの原本を持参してください。コピーでよいかどうかは自治体の運用によりますので、原本をお持ちいただくことをお勧めします。
【2024年3月時点】予診票の書き方が分からないときはどうすればよいですか。
自治体の窓口やコールセンター、接種会場でご相談いただけます。ご自身の病気等のことについては主治医等にご相談ください。
予診票の書き方についてお困りの場合には、あらかじめ自治体の窓口やコールセンターにお問い合わせいただくか、接種会場でご相談いただくこともできます。ご自身の病気のことについては主治医、飲んでいるお薬については薬剤師等にご相談ください。
【2024年3月時点】接種するワクチンは選べますか。
接種を受ける時期に供給されているワクチンを接種することになります。
接種を受ける時期に供給されているワクチンを接種することになります。また、複数のワクチンが供給されている場合であっても、初回接種の2回目の接種では、原則として、1回目に接種したワクチンと同一のワクチンを接種する必要があります。なお、一定の要件を満たす場合に限り、1回目と異なるワクチンを2回目に接種すること(交互接種)は可能です。
モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
なお、令和5年秋開始接種で使用するワクチンについてはこちら、初回接種で使用するワクチンについてはこちらをご覧ください。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
【2024年3月時点】1回目と2回目で異なる新型コロナワクチンを接種しても問題ないでしょうか。
1回目と2回目の接種では、原則として同一のワクチンを接種する必要がありますが、一定の要件を満たす場合に限り、異なるワクチンを接種することは可能です。
1回目と2回目の接種では、原則として同一のワクチンを接種する必要がありますが、現在接種が進められている新型コロナワクチン(ファイザー社及びモデルナ社)(*)については、下記のような場合に限り、1回目と異なるワクチンを2回目に接種すること(交互接種)は可能です。
- 1回目のワクチン接種後に重篤な副反応が生じたこと等により、医師が医学的見地から、2回目に同一のワクチンを接種することが困難であると判断した場合
- 国内のワクチン流通の減少や接種を受ける方の転居等により、1回目と2回目で同一のワクチンを接種することが困難な場合
1回目と異なるワクチンを2回目に接種する場合、1回目と2回目の接種の間隔は、諸外国の対応状況等を踏まえ、27日以上の間隔をおくこととされています。
(*)モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
また、ファイザー社及びモデルナ社のワクチン接種後に、稀に心筋炎や心膜炎を疑う事例が報告されており、特に10代及び20代の男性では、ファイザー社よりもモデルナ社のワクチンの方が、その報告頻度が高い傾向がみられています。このことを踏まえ、10代及び20代の男性で、1回目にモデルナ社のワクチンを接種したものの、2回目の接種でファイザー社のワクチンへの変更を希望する場合、予約の取り直しは可能です。詳しくはこちらをご参照ください。
なお、追加接種における交互接種については、こちらをご覧ください。
(参考資料)
新型コロナワクチンの交互接種に関する諸外国の対応状況[1.1MB](第24回厚生科学審議会予防接種 ワクチン分科会資料より抜粋)
【2024年3月時点】「基礎疾患を有する者」に当てはまることを証明するために、診断書は必要ですか。
診断書等は必要ありません。
診断書等は必要ありません。予診票に記載していただき、必要があるときは、問診で病気や治療の状況などを確認します。
なお、「基礎疾患を有する者」の具体的な範囲については、こちらをご覧ください。
【2024年3月時点】未成年の接種の場合、親の同意書は必要ですか。
未成年者であっても、16歳以上の方については、親の同意書は必要ありません。15歳以下の方の接種には、予診票に保護者の署名が必要になります。
未成年者であっても、16歳以上の方については、親の同意書は必要ありません。
15歳以下の接種においては、原則、保護者の同伴が必要となります。予診票に保護者の署名が必要となり、署名がなければワクチンの接種は受けられません。
なお、中学生以上の場合、接種医療機関(接種会場)が認める場合(※)には、保護者が説明書を読み、予診票に保護者が自ら署名することによって、保護者の同伴がなくてもワクチンを接種することができます。その場合、予診票の「電話番号」記載欄に、緊急連絡先(予診や接種の際に、必ず保護者と連絡のつく電話番号)の記載も必要となります。接種当日は記入済みの予診票を忘れずお持ちください。
(※)保護者の同伴が必要ない旨の案内をしている場合に限ります。案内をご覧になるか、予約時にご確認ください。
また、未就学児の接種履歴は母子健康手帳で管理しているため、特にこの年代の方は、接種当日は可能な限り、母子健康手帳の持参をお願いします。詳細はこちらをご覧ください。
令和5年(2023年)12月26日現在、接種対象年齢は、ファイザー社及びモデルナ社のワクチンは生後6か月以上、第一三共社のワクチンは12歳以上となっています(*)。
(*)モデルナ社の従来ワクチン(1価)による接種は令和5年2月11日、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は同年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は同年9月19日、武田社(ノババックス)のワクチンによる接種は同年12月25日をもって終了しました。
【2024年3月時点】認知症などで本人に接種意思を確認することができない場合、家族にて同意書を書いてもらってもよいですか。
接種には、ご本人の接種意思の確認が必要です。 確認が難しい場合は身近な方にご協力いただき、本人の接種の意向を丁寧に酌み取ることなどによる意思確認を行ってください。
接種には、ご本人の接種意思の確認が必要です。それぞれの状況に応じて、家族や主治医、高齢者施設の従事者など、日頃から身近で寄り添っている方々の協力を得て、本人の接種の意向を丁寧に酌み取ることなどにより本人の意思確認を行っていただくようお願いいたします。
なお、ご本人が接種を希望されているものの、何らかの理由でご本人による自署が困難な場合は、ご家族の方等に代筆していただくことが可能です。
【2024年3月時点】2回目の接種は、1回目の接種と同じ施設で受ける必要はありますか。
必ずしも同じ施設でなくても構いません。
当初は、原則として2回目の接種は、1回目の接種時と同じ施設で受けていただくこととしていましたが、接種を受けられる施設を探すのが困難な場合等は、必ずしも同じ施設でなくても構いません。コロナワクチンナビ(*)でワクチン接種を受けられる施設を探していただくか、住民票のある市区町村にお問い合わせください。
一方、追加接種時には、お住まいの市区町村から接種券等が届き次第、改めて、接種を実施している医療機関や会場をお探しの上、予約をお願いします。詳細はこちらをご覧ください。
(*)新型コロナワクチンの特例臨時接種が令和6年(2024年)3月31日をもって終了することに伴い、コロナワクチンナビについても同日17時に全ての機能を終了します。(接種券発行申請と住所地外接種届については、同月25日19時に受付を終了します。)
【2024年3月時点】1回目の接種後、2回目の接種を受ける前に住民票を異動させた場合、2回目の接種はどのようにすればよいですか。
住民票の異動後に、転入先の市区町村の予防接種担当課で接種券の再発行を受け、転入先の市区町村で接種を受けてください。
新型コロナワクチンの接種を受ける方が転居された場合は、住民票の異動後に、転入先の市区町村予防接種担当課で接種券の再発行を受け、転入先の市区町村で接種を受けてください。接種券の再発行にあたっては、転居前の市区町村が発行した接種券が必要な場合があります。
【2024年3月時点】新型コロナワクチンとそれ以外のワクチンは、同時に接種することはできますか。
新型コロナワクチンとインフルエンザワクチンとの同時接種は可能です。また、それぞれのワクチンを別の日に接種する場合の接種間隔についても制限はありません。ただし、インフルエンザワクチン以外のワクチンは、新型コロナワクチンと同時に接種できません。互いに、片方のワクチンを受けてから2週間後に接種できます。
新型コロナワクチンとインフルエンザワクチンとの同時接種については、単独で接種した場合と比較して、有効性及び安全性が劣らないとの報告があること等を踏まえ、令和4年(2022年)7月22日開催の審議会において議論された結果、実施が可能となりました。また、それぞれのワクチンを別の日に接種する場合の接種間隔についても制限はありません。
この取扱いは、オミクロンXBB.1.5対応1価ワクチンについても同様です。
一方、新型コロナワクチンとインフルエンザワクチン以外のワクチンの同時接種については、現時点で安全性に関する十分な知見が得られていないため、実施できません。互いに、片方のワクチンを受けてから2週間後に接種できます。特に子どもの場合は、定期接種でワクチンを接種することもあるため、予め計画を立てた上での予約をお願いします。
(例) 10月1日に新型コロナワクチンを接種した場合、他のワクチンを接種できるのは、10月15日(2週間後の同じ曜日の日)以降になります。インフルエンザワクチンは、10月1日に同時接種が可能なほか、10月3日や10月7日に接種することも可能です。
なお、創傷時の破傷風トキソイド等、緊急性を要するものに関しては、例外として2週間を空けずに接種することが可能です。
(参考資料)
新型コロナワクチンとインフルエンザワクチンの同時接種の有効性・安全性[2.1MB](第33回 厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
接種の対象など
【2024年3月時点】私はいつワクチンを接種できますか。
接種を行う期間は、現在は、令和3年(2021年)2月17日から令和6年(2024年)3月31日までとしています。
接種を行う期間は、現在は、令和3年2月17日から令和6年3月31日までとしています。
令和5年(2023年)9月20日以降、オミクロン株対応1価ワクチン(XBB.1.5)による接種は、生後6か月以上の全ての方を対象に、以下のとおり実施しています。
- 初回(1・2回目)接種(※)を終えた方は、これまでに接種した新型コロナワクチンの種類にかかわらず、最後の接種から3か月以上の間隔を空けて、1人1回受けていただくことができます(令和5年秋開始接種)。
- 初回(1・2回目)接種(※)が未了である方も、オミクロン株対応1価ワクチンによる接種を受けていただくことができます(初回接種)。
(※)ファイザー社の1価ワクチンによる乳幼児(生後6か月~4歳)への初回接種は、3回で1セットです。
(参考資料)
令和5年秋開始接種についてのお知らせ(リーフレット)
令和5年秋開始接種についてのお知らせ(厚生労働省HP)
オミクロン株(XBB.1.5)に対応したワクチンの接種について(リーフレット)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
5~11歳の子どもへの接種(小児接種)についてのお知らせ(厚生労働省HP)
生後6か月~4歳の子どもへの接種(乳幼児接種)についてのお知らせ(厚生労働省HP)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.6MB](第54回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】子どもはワクチンを接種することができますか。
予防接種法に基づく公費での接種の対象は、生後6か月以上の方です。生まれてから6か月後の、誕生日に該当する日の前日(令和4年(2022年)4月1日生まれの方の場合は、同年9月30日)から受けられるようになります。
生後6か月以上の方が接種可能です。生後6か月に満たない方は、新型コロナワクチンの接種の対象にはなりません。具体的には、生まれてから6か月後の、誕生日に該当する日の前日(令和4年4月1日生まれの方の場合は同年9月30日)から受けられるようになります。
これまでファイザー社のワクチンについては、米国をはじめ複数の国で、生後6か月~4歳及び5~11歳への接種が進められており、日本においても、5~11歳については、従来ワクチン(1価)に関して令和4年1月21日に初回接種が、同年8月30日に3回目接種が薬事承認され、初回接種は同年2月21日に、3回目接種は同年9月6日に、それぞれ予防接種法に基づく特例臨時接種に位置づけられました。また、オミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種と初回接種も、それぞれ令和5年(2023年)2月28日と同年8月2日に薬事承認され、それぞれ同年3月8日と同年8月7日に予防接種法に基づく特例臨時接種に位置づけられました。生後6か月~4歳についても、同年10月5日に薬事承認されるとともに、同月24日に特例臨時接種に位置づけられました。
モデルナ社のワクチンについては、6~11歳を対象としたオミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種が令和5年8月2日に薬事承認され、同年8月7日に予防接種法に基づく特例臨時接種に位置づけられました。
その後、接種が進められましたが、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)は、令和5年9月19日をもって接種が終了しました。
令和5年9月20日以降は、オミクロン株対応1価ワクチン(XBB.1.5)を使用して接種が進められています。ファイザー社のワクチンについては、生後6か月~11歳を対象とした初回接種と追加接種が、令和5年9月1日に薬事承認され、その後、予防接種法に基づく特例臨時接種に位置づけられ、令和5年9月20日より接種が開始されています。モデルナ社のワクチンについては、6~11歳を対象とした追加接種及び生後6か月~11歳を対象とした初回接種が、それぞれ令和5年9月12日及び同年10月24日に薬事承認され、その後、予防接種法に基づく特例臨時接種に位置づけられ、それぞれ同年9月25日及び同年11月1日より接種が開始されています。
子どもへのワクチン接種について、生後6か月~5歳の接種についてはこちらを、5歳~11歳の接種についてはこちらをご覧ください。
(参考資料)
小児を対象とした新型コロナワクチンの諸外国における状況等[1.7MB](第29回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児用のオミクロン株対応2価ワクチンについて[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
N Engl J Med. 2021; Nov
(Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[2.5MB](第51回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[3.0MB](第52回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】日本に住んでいる外国人は接種を受けられますか。
日本国内に居住する外国人の方は、原則として接種の対象となります。
日本国内に居住する外国人の方は、原則として接種の対象となります。原則として、住民登録をしている市区町村で接種を受けていただくことになります。
【2024年3月時点】新型コロナワクチンの接種を望まない場合、受けなくてもよいですか。
新型コロナワクチンは、発症予防効果などワクチン接種のメリットが、副反応などのデメリットよりも大きいことを確認して、皆さまに接種の機会を提供しています。しかしながら、接種は強制ではなく、あくまでご本人の意思に基づき接種を受けていただくものです。
新型コロナワクチンについては、国内外の数万人のデータから、発症予防効果などワクチン接種のメリットが、副反応などのデメリットよりも大きいことを確認して、皆さまに接種の機会を提供しています。しかしながら、接種は強制ではなく、あくまでご本人の意思に基づき接種を受けていただくものです。接種を望まない方に接種を強制することはありません。また、受ける方の同意なく、接種が行われることはありません。
職場や周りの方などに接種を強制したり、接種を受けていない人に差別的な扱いをしたりすることのないよう、皆さまにお願いしています。また、医学的な理由により接種を受けられない人もいるため、接種に際して細やかな配慮を行うようお願いしています。仮にお勤めの会社等で接種を求められても、ご本人が望まない場合には、接種しないことを選択することができます。
なお、職場におけるいじめ・嫌がらせなどに関する相談窓口はこちらを、人権相談に関する窓口はこちらをご覧ください。
(参考資料)
ワクチン接種を受けていない人に対する偏見・差別事例に関するQ&A(一般の方向け)(厚生労働省)
労働者の採用、配置、解雇等に関するQ&A(企業の方向け)(厚生労働省)
経済団体等への協力依頼(厚生労働省)
接種後の生活
【2024年3月時点】ワクチン接種後、生活上で注意することはありますか。
ワクチンを接種した後は、接種部位の痛みが出たり、倦怠感、発熱、頭痛や関節痛などが生じることがあります。できるだけ接種当日・翌日に無理をしないですむように予定を立てておくとよいでしょう。
ワクチンを接種した後は、接種部位の痛みが出たり、倦怠感、発熱、頭痛や関節痛などが生じることがあります。このような症状が出たときのために、できるだけ接種当日や翌日に無理をしないですむように予定を立てておくとよいでしょう。これらの症状は、たいてい数日以内で軽快することが分かっています。
ワクチンを受けた当日は、激しい運動や過度の飲酒などは控えましょう。接種部位については、清潔に保つよう心がけてください。
また、頻度としてはごく稀ですが、ファイザー社及びモデルナ社のワクチン接種後に、心筋炎や心膜炎を疑う事例が報告されており、特に若年の男性で、1回目よりも2回目の接種後において多く報告され、3回目接種後は2回目よりも低い傾向がみられています。ワクチン接種後4日程度の間に、胸の痛みや息切れ等の症状がみられた場合には、速やかに医療機関を受診してください。詳細はこちらをご覧ください。
【2024年3月時点】ワクチンを接種した日は、車を運転できますか。
ワクチンを接種した後の体調が良好であれば、基本的には運転をしても問題はありません。ただし、体調に不安がある場合は運転を控えることが大切です。
ワクチンを接種した後の体調が良好であれば、基本的には運転をしても問題はありません。ただし、接種部位に痛みが強く出たり、発熱、倦怠感、頭痛や関節痛などの全身性の反応が出たりすることもあり、体調に不安がある場合は運転を控えることが大切です。
【2024年3月時点】ワクチンを接種した日は、お風呂に入れますか。
ワクチンを接種した日にお風呂に入っても構いません。ただし、体調が悪い時は無理をせず、様子を見るようにしてください。
ワクチンを接種した日に入浴することに特別な問題はないと考えられます。注射した部位を強くこすらないようにしましょう。現時点において、ワクチンを接種した後に、入浴した場合としなかった場合での、免疫のつき方や、副反応の違いなどを比較した研究は確認されていません。
ただし、ワクチン接種した日を含め、ワクチン接種後に体調が悪い時は、入浴を控えることも検討してください。
【2024年3月時点】ワクチンの接種前後に飲酒をしても問題ないでしょうか。
少量の飲酒は大きな問題になることは考えにくいですが、過度の飲酒は避けた方がよいでしょう。
短期的な少量の飲酒が免疫に大きな影響を与えることは考えにくいですが、過度の飲酒は免疫機能を低下させる可能性があります(※1、※2)。ワクチン接種後は、発熱や頭痛、倦怠感などの副反応が出ることがあり、過度の飲酒により症状がさらに強くなる可能性があるため、避けた方がよいと考えられます。また、接種当日の体調を整えるためにも、接種前日の深酒も避けた方がよいでしょう。
(参考資料)
※1:Alcohol Res. 2015;37(2):185-197.
(Volume 37 Issue 21 January 2015 Impact of Alcohol Abuse on the Adaptive Immune System)
※2:Clin Microbiol Rev. 2019; 32:e00084-18.
(Factors That Influence the Immune Response to Vaccination)
【2024年3月時点】ワクチンを接種した翌日は仕事を休んでも大丈夫でしょうか。
特に、接種した翌日は、発熱や倦怠感などが生じやすいことを念頭に、予定を立てることが大切です。仕事を休む場合の取扱いは、企業の就業規則などによりますが、接種後に副反応が生じた場合に活用できる休暇制度の新設や、既存の休暇制度の活用等の対応を、政府として企業に呼びかけています。
接種した翌日は、発熱や倦怠感などが生じやすいとされています。仕事を休む場合の取扱いは、企業の就業規則などによりますが、職場における感染防止対策の観点からも、労働者の方が安心して新型コロナワクチンの接種を受けられるよう、企業がワクチンの接種や、接種後に労働者が体調を崩した場合などに活用できる休暇制度等を設けていただくなどの対応は望ましいものです。
そのため、企業においても、接種後に副反応が生じた場合に活用できる休暇制度を新設していただくほか、既存の病気休暇や失効年休積立制度(失効した年次有給休暇を積み立てて、病気で療養する場合等に使えるようにする制度)等を活用できるよう見直していただく等、労働者の希望や意向も踏まえて検討していただくことを、会見等の場を通じて政府として呼びかけています。
(参考資料)
河野内閣府特命担当大臣記者会見要旨(内閣府)
・令和3年5月11日
・令和3年5月14日
・令和3年5月28日
新型コロナウイルスに関するQ&A(企業の方向け)(厚生労働省)
経済団体等への協力依頼(厚生労働省)
【2024年3月時点】ワクチンを接種した後も、マスクは必要ですか。
ワクチンを接種することで、接種した人の発症を予防する効果だけでなく、感染を予防する効果も示唆するデータが報告されています。令和5年(2023年)3月13日から、マスクの着用は個人の判断が基本となりました。
ワクチン承認後に実施された様々な研究結果から、ワクチンを接種することで、新型コロナウイルス感染症の発症だけでなく、感染を予防する効果も示唆するデータが報告されています。しかしながら、その効果は100%ではなく、変異によりワクチンの効果に影響が生じる可能性もあります。
このため、ワクチン接種後であっても、引き続き効果的な感染予防対策を組み合わせることで、可能な限りご自身や周りの方を守っていただくようお願いします。 具体的には、マスクの効果的な場面での着用(※)、石けんによる手洗いや手指消毒用アルコールによる消毒の励行、こまめな換気などをお願いします。
(※)令和5年3月13日からマスクの着用は、個人の主体的な選択を尊重し、個人の判断が基本となりました。ただし、マスクの着用が推奨される場面がありますので、ご留意をお願いします。詳しくはこちらをご確認ください。
(参考資料)
マスクの着用について(厚生労働省HP)
N Engl J Med 2021; 385:585-594
(Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant)
【2024年3月時点】接種後に発熱した状態で人と会った場合、周りの人を感染させてしまうことはありますか。
ワクチンの接種による発熱は免疫反応で起きるものであり、ワクチンが原因で周りの人に感染させることはありません。ただし、たまたま同じ時期に新型コロナウイルスに感染していた場合は、周りの人に感染させる可能性はあります。
新型コロナワクチンにはウイルス自体が含まれているわけではありませんので、接種しても新型コロナウイルスには感染しません。
接種後の発熱は免疫反応で起きるものであり、ウイルスの感染による発熱とは異なります。この免疫反応によって、周りの人にウイルスを感染させることはありません。ただし、たまたま同じ時期に、新型コロナウイルスに感染していた場合には、気付かずに周りの人に感染させる可能性があります。接種後にも、感染予防対策を続けていただくようお願いします。
【2024年3月時点】ワクチンを接種したことにより、効果が出たか(抗体ができたか)を確認するため、抗体検査を受ける必要はありますか。
新型コロナワクチンを接種したほとんどの方でウイルスに対する抗体の産生が認められる一方、抗体検査の結果から実際に予防効果があるかどうかを推測できる状況ではありません。 そのため、通常、ワクチン接種後の抗体検査は必要ないと考えられています。
日本で接種が進められている新型コロナワクチンの効果は高く、接種することで発症を約95%抑えることができるといった結果が報告されています。抗体検査を行わなくても、接種すれば、効果があることが十分期待できます。一方で、ワクチン接種後に抗体検査をしたとしても、必ずしもその方の免疫が十分 なものであるかどうかが分かるわけではありません。
このため、通常、ワクチン接種後の抗体検査は必要ないと考えられています。
また、新型コロナウイルスに対する抗体が産生されているかを検査するキットは複数あり、医療現場でも使われつつありますが、こうしたキットを用いた抗体検査の結果が、ワクチンの効果を正確に反映しているかどうかは、まだ分かっていません。
もし新型コロナワクチン接種後に抗体検査を受け、その結果が陽性だったとしても、引き続き、基本的な感染対策は必要です。
【2024年3月時点】ワクチン接種後に献血をしても問題ないでしょうか。
献血は、ファイザー社、モデルナ社及び第一三共社のワクチン(mRNAワクチン)接種後は48時間が経過した後に、武田社(ノババックス)のワクチン(組換えタンパクワクチン)接種後は24時間が経過した後にお願いします。
献血にご協力いただく場合、現在承認されているファイザー社、モデルナ社及び第一三共社のワクチン(mRNAワクチン)接種後は、従来ワクチン(1価)(*)による初回(1回目・2回目)接種及び追加接種、オミクロン株対応ワクチン(1価、2価)(*)による初回接種及び追加接種のいずれの場合も、接種後48時間が経過してから行っていただくようお願いしています。
武田社(ノババックス)のワクチン(組換えタンパクワクチン)(*)接種後の場合は、接種回数にかかわらず、接種後24時間が経過すれば献血が可能です。
なお、ワクチン接種の有無にかかわらず発熱や全身倦怠感等の体調不良が認められる場合には、症状が改善するまでは献血をご遠慮いただく場合があります。
海外でワクチンの接種を受けた後に日本で献血する場合も、mRNAワクチン(ファイザー社、モデルナ社等のワクチン)を含むRNAワクチンの接種を受けた方は、接種から48時間が経過すれば献血していただくことができます。同様に、武田社(ノババックス)のワクチン(組換えタンパクワクチン)接種を海外で受けた場合も、接種回数にかかわらず、接種後24時間が経過すれば献血が可能です。また、アストラゼネカ社のワクチン(ウイルスベクターワクチン)(*)接種後の場合は、接種から6週間が経過すれば献血が可能です。
ワクチンの接種から献血ができるまでの期間はワクチンにより異なっています。詳しくはこちら(外部サイト:日本赤十字社)をご覧ください。
(*)日本では、アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」による接種は令和4年(2022年)9月30日、モデルナ社の従来ワクチン(1価)による接種は令和5年(2023年)2月11日を、モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社の従来ワクチン(1価)及びオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)並びにモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日、武田社(ノババックス)のワクチンによる接種は令和5年12月25日をもって終了しました。
(参考資料)
新型コロナウイルス感染症に関する献血の受入れについて(厚生労働省HP)
その他
【2024年3月時点】今回のワクチン接種の「努力義務」とは何ですか。
「接種を受けるよう努めなければならない」という予防接種法の規定のことで、義務とは異なります。感染症の緊急のまん延予防の観点から、皆様に接種にご協力をいただきたいという趣旨から、このような規定があります。
今回の予防接種は感染症の緊急のまん延予防の観点から実施するものであり、国民の皆様にも接種にご協力をいただきたいという趣旨で、「接種を受けるよう努めなければならない」という、予防接種法第9条の規定が適用されています。この規定のことは、いわゆる「努力義務」と呼ばれていますが、義務とは異なります。接種は強制ではなく、最終的には、あくまでも、ご本人が納得した上で接種をご判断いただくことになります。
予防接種法に基づいて行われる定期接種の多くのもの(4種混合、麻しん、風しんの予防接種など)にも、同じ規定が適用されています。新型コロナウイルス感染症に係る予防接種については、「予防接種法及び検疫法の一部を改正する法律」(令和2年12月9日施行)により、同法の規定を適用することとなりました。
ただし、本規定は、必要に応じて一部の方には適用しないこととすることが可能とされており、令和5年(2023年)秋冬の接種の目的が重症化予防とされていることから、同年9月20日以降の初回接種と追加接種のいずれも、重症化リスクの高い方(65歳以上の者、基礎疾患を有する者その他重症化リスクが高いと医師が認める者)に該当しない方に対しては、本規定を適用しないこととしています。
※「予防接種法及び検疫法の一部を改正する法律」(令和2年12月9日施行)の条文はこちらに掲載しています。
(参考資料)
令和5年秋冬の接種について[5.4MB](第49回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋冬の接種について[4.5MB](第50回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
【2024年3月時点】ワクチンについて相談したいとき、どこに相談すればよいですか。
自治体の窓口やコールセンター、身近な医療機関などにご相談ください。厚生労働省もコールセンターを設置しています。
ワクチンの接種を受ける方法、接種の予約等に関するお問合せは、市区町村の窓口やコールセンターにご相談ください。また、基礎疾患のある方等で、ワクチンを受けるかどうか相談したい場合には、身近な医療機関等にご相談ください。
ワクチン接種後に体に異常があるときは、ワクチンを受けた医療機関や身近な医療機関、都道府県の窓口等にご相談ください。詳細はこちらをご覧ください。
電話番号は、国内からおかけいただく場合は0120-761770(フリーダイヤル)、海外からおかけいただく場合は(+81)50-3734-0348(通話料がかかります)をご利用ください。
なお、新型コロナワクチン接種に関する相談体制は下記のとおりであり、国・都道府県・市区町村・ワクチンメーカーが各々の役割に応じて国民や医療機関からの相談に対応しています。
■市区町村
相談窓口またはコールセンターにおいて、具体的な接種の案内など、住民や医療機関からの問合せに対応します。
■都道府県
相談窓口またはコールセンターにおいて、医学的知見が必要となる専門的な相談など、市区町村では対応が困難な問合せに対応します。
■国(厚生労働省)
新型コロナワクチンコールセンター(0120-761770)において、コロナワクチン施策の在り方などに関する問合せに対応します。
■ワクチンメーカー
相談窓口において、各ワクチンの製品情報に係る個別具体的な問合せに対応します。
(※)接種の可否・病気の診断・治療等の医師の診察に関わるお問合せは、身近な医療機関にご相談ください。
【2024年3月時点】SNSやニュースでコロナワクチンが危険と取り上げられていて不安です。どの情報を信じたらいいのでしょうか。
できるだけ、公的機関からの情報を確認しましょう。
SNSやメディアでは、新型コロナワクチンに関して様々な情報が溢れています。特に、SNSでは発信者が不明、または科学的根拠や信頼のおける情報源に基づいていない、不正確な情報があり、注意が必要です。
例えば、ワクチンを受けた後に起きた好ましくない出来事(有害事象)を、因果関係が分からないにも関わらず、あたかもワクチンが原因であるような書き方をしている情報もあります。ワクチンの安全性については、大規模な臨床試験だけでなく、承認後の安全性の監視システムによって常に調べられており、調査や評価の結果は国内外の公的機関から発表されています。
ワクチンの情報に関しては、複数の専門家のチェックを受けた、科学的根拠に基づいた情報発信をしている公的機関や団体などから情報を得ることをおすすめします。例えば、こうした情報源としては以下のようなものがあります。
【2024年3月時点】新型コロナワクチンについて多言語対応の資料はありますか。
複数の言語に翻訳した情報提供資材を厚生労働省のホームページに掲載しています。
予診票、説明書、リーフレットについて、17か国語(※)に翻訳したものをこちらに掲載しています。
(※)英語、アラビア語、中国語(簡体字)、中国語(繁体字)、フランス語、インドネシア語、クメール語、韓国語、モンゴル語、ミャンマー語、ネパール語、ポルトガル語、ロシア語、スペイン語、タガログ語、タイ語、ベトナム語
また、接種に関する英語版サイトはこちらです。
【2024年3月時点】ワクチンを接種する前にすでに免疫で守られている可能性はありますか。
自然免疫や他のウイルスに対する獲得免疫などによって、新型コロナウイルスに対する免疫が得られるかどうかはまだ十分に分かっていません。
今回の新型コロナウイルス感染症は、重症化する人がいる一方で、軽症や無症状で済む人も多くいることが知られています。このような症状の違いが起きる理由は、まだ十分に分かっていません。
人間の免疫には、大きく分けて自然免疫と獲得免疫があります。自然免疫は過去に遭遇したことがない病原体にも反応をしてくれる免疫のシステムです。新型コロナウイルスへの感染予防や重症感染予防について、自然免疫が重要な働きをしている可能性が示唆されています。
また、過去の風邪を引き起こすコロナウイルスなど他のウイルスへの感染や曝露によって得られた獲得免疫が、新型コロナウイルスに対する防御効果があるとする説もあります。しかし、他のウイルスに対する獲得免疫が、新型コロナウイルスに対してどの程度有効であるかはまだ分かっていません。
新型コロナウイルス感染症に対する免疫を得るには、ワクチンの接種により自然免疫と獲得免疫を活性化させることが最も有効です。
(参考資料)
Cell. 2021; COVID-19 and the human innate immune system
Science. 2020; Vol370, Issue6512, 89-94
(Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans)
Science. 2020; Vol370, Issue6522, 1339-1343
(Preexisting and de novo humoral immunity to SARS-CoV-2 in humans)
Cell. 2021; Vol184, Issue7, 1858-1864
(Seasonal human coronavirus antibodies are boosted upon SARS-CoV-2 infection but not associated with protection)
【2024年3月時点】免疫力はワクチン接種以外でも上げられますか。
睡眠時間の確保、運動、禁煙、肥満や低体重を避けること、バランスのよい食事を摂ることなどが感染防御のために有利だと考えられています。しかし、食事の工夫などのみでワクチンのように特定の感染症のリスクを下げることは困難です。
「免疫力」は厳密な定義のある言葉ではありません。人間の体を病原体から守る免疫の仕組みは非常に複雑なものであり、免疫機能を単純な言葉で表現することは困難です。
免疫システムは大きく「自然免疫」と「獲得免疫」に分けることができます。自然免疫と獲得免疫はお互いに協力しあって私たちの体を病原体から守っています。栄養、運動、睡眠、ストレス、肥満などが免疫に与える影響については、多くの研究が行われていますが、完全にメカニズムが解明されているわけではありません。一般的に、よく睡眠を取ること、運動すること、禁煙すること、健康な体重を維持すること、バランスのよい食事を摂ることなどが、感染防御に有利に働くのではないかと考えられています。
ワクチン接種は特定の感染症に対して、自然免疫や獲得免疫を活性化させ、感染リスクを下げることが知られています。逆に、食事などの工夫のみでワクチンのように有効な感染症防御を行うことは難しいと考えられています。
【2024年3月時点】ワクチン接種の証明書は発行されますか。
接種後、接種を受けた日付と接種したワクチンの情報が記載された「接種済証」が発行されます。また、海外渡航先での入国時をはじめ、様々な場面で活用できるよう、接種の事実を公的に証明する「接種証明書」も発行しています。この証明書は、接種時点で住民票のある(通常は接種券を発行した)自治体の他、スマートフォン上の専用アプリや、対象となるコンビニでの発行が可能です。
接種を受けた後、接種を受けた日付と接種したワクチンの情報が記載された「接種済証」が発行されます。この接種済証を見れば、いつ、どのワクチンを接種したのかが分かります。
接種済証の発行は、接種券を発行した自治体(接種時点で住民票のある自治体)が行うものです。接種券の右側に接種済証の様式が付いています(一部の自治体では、接種券とは別の紙で送付される場合もあります)ので、通常は申請しなくても、接種会場でシールの貼付と必要事項の記載を受けることで、証明を受けることができます。
また、職域接種等で接種券を持たずに接種を受けた場合には、接種を受けた日付やワクチンの情報を記載した「接種記録書」を受けとることができます。
接種済証や接種記録書は、日本国内での利用が可能です。
このほか、海外渡航先での入国時や、日本国内での利用等、様々な場面で活用できるよう、新型コロナワクチン接種の事実を公的に証明する「接種証明書」を発行しています。取得にあたっては、接種時点で住民票のある自治体(通常は接種券を発行した自治体)への申請が必要です。自治体窓口等での書面による発行のほか、マイナンバーカードによる本人確認の上で、スマートフォン上の専用アプリでの発行、対象となるコンビニでの発行が可能です。詳しい申請方法は、申請先自治体のHP等をご確認ください。
【2024年3月時点】接種済証に貼られたワクチンのシールで、ワクチンの「最終有効年月日」が接種日より前の日付になっていますが問題ないですか。
ワクチンの有効期間は、一定期間保存した後の品質に関するデータに基づき、薬事上の手続きを経て設定されるため、一度設定した後でも延長されることがあり、タイミングによっては印字の有効期限より、実際には長く接種できる場合があります。
ワクチンの有効期間は、当該ワクチンを製造・販売する企業において収集された、一定期間保存した後の品質に関するデータに基づき、薬事上の手続きを経て、設定されます。このため、有効期間を設定した後であっても、新たなデータに基づく薬事上の手続きを経ることにより、有効期間が延長されることがあります。令和5年(2023年)12月25日現在、
- ファイザー社ワクチン(オミクロンXBB.1.5対応1価)の有効期間は18か月
- モデルナ社ワクチン(オミクロンXBB.1.5対応1価)の有効期間は12か月
- 第一三共社ワクチン(オミクロンXBB.1.5対応1価)の有効期間は7か月
となっておりますが、モデルナ社ワクチン(オミクロンXBB.1.5対応1価)のバイアルには有効期間を9か月と印字されたものが流通しています。つきましては、印字されている有効期限に関わらず、上記でお示しした有効期間として取り扱っていただきますようお願いいたします。
- モデルナ社ワクチンの有効期限
| ワクチン/承認日 | 令和5年9月12日 |
|---|---|
| モデルナ社ワクチンの有効期間 | 9か月→12か月 |
なお、ご自身が接種したファイザー社、モデルナ社、武田社(ノババックス)及び第一三共社のワクチンの有効期限を確認したい場合は、こちらでご確認ください。
(参考資料)
ファイザー社ワクチン、モデルナ社ワクチン及び第一三共社ワクチンの有効期限の取扱いについて(厚生労働省、令和5年12月25日事務連絡)
これは本当ですか?
【2024年3月時点】mRNA(メッセンジャーRNA)ワクチンはワクチンとして遺伝情報を人体に投与するということで、将来の身体への異変や将来持つ予定の子どもへの影響を懸念しています。
mRNA(メッセンジャーRNA)ワクチンで注射するmRNAは短期間で分解されていきます。人の遺伝情報(DNA)に組みこまれるものではありません。
mRNA(メッセンジャーRNA)ワクチンで注射するmRNAは、数分から数日といった時間の経過とともに分解されていきます。また、mRNAは、人の遺伝情報(DNA)に組みこまれるものではありません。身体の中で、人の遺伝情報(DNA)からmRNAがつくられる仕組みがありますが、情報の流れは一方通行で、逆にmRNAからはDNAはつくられません。こうしたことから、mRNAを注射することで、その情報が長期に残ったり、精子や卵子の遺伝情報に取り込まれることはないと考えられています。
このような一般的な科学的な知見だけでなく、薬事承認にあたっては、動物試験や臨床試験の結果に基づいて安全性を評価し、審査を行っていきます。
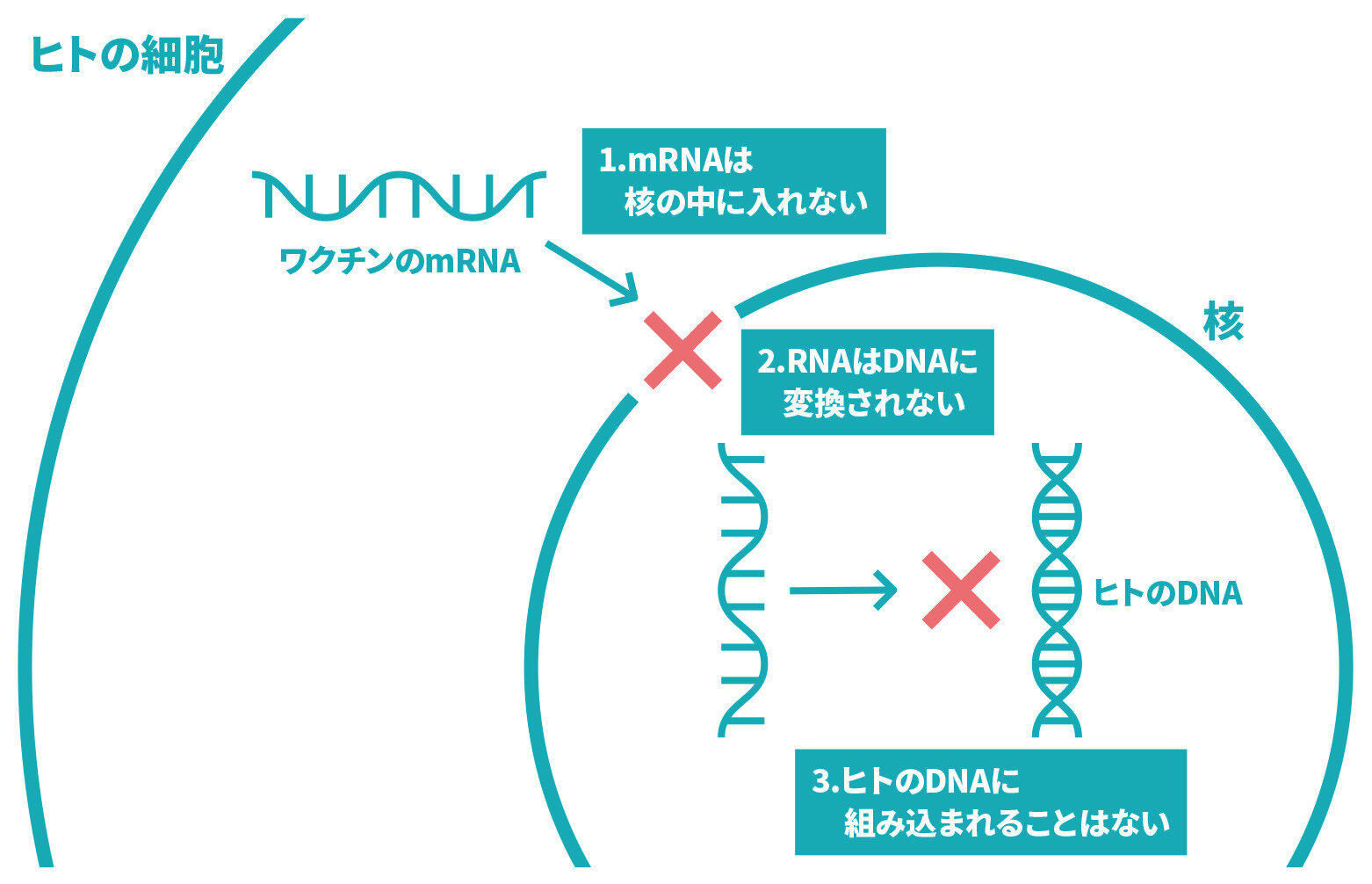
【2024年3月時点】新型コロナワクチンの接種が原因で多くの方が亡くなっているというのは本当ですか。
「ワクチンを接種した後に亡くなった」ということは、必ずしも「ワクチンが原因で亡くなった」ということではありません。接種後の死亡事例は報告されていますが、現時点で、引き続きワクチンの接種体制に影響を与える重大な懸念は認められないとされています。
「ワクチンを接種した後に亡くなった」ということは、必ずしも「ワクチンが原因で亡くなった」ということではありません。人はワクチンの接種とは関係なく突然命を落とすことがあるため、ワクチン接種後の死亡事例が出た時は、ワクチン接種との因果関係を調査することが大切です。
まず、新型コロナワクチンを含むあらゆるワクチンは、大規模な臨床試験で安全性が確認された後に医薬品として承認され、接種が開始されています。日本で使用されているファイザー社及びモデルナ社のmRNA(メッセンジャーRNA)ワクチンは、いずれも臨床試験において、ワクチン接種者とプラセボ接種者で、重い病気を発症した人や亡くなった人の割合に差がないことが確認されています(※1、※2)。
さらに、接種が開始された後においても、接種後に生じた様々な症状の情報を収集・分析して、例えば、個別の死亡事例をみたときに「新型コロナワクチンが原因ではないか」、あるいは、症例数などをみたときに「新型コロナワクチンの接種後に特定の病気による死亡が特に増えていないか」など、引き続き、国内外で慎重なモニタリングが行われ、ワクチンの安全性が継続的に評価・確認されています。
日本においても、副反応疑い報告制度により、ワクチン接種後の死亡事例が報告されていますが、現時点で、ワクチン接種との因果関係が否定できないとされた事例が2例あり、その他の事例についてはワクチン接種との因果関係があると判断されていません。
また、日本医療研究開発機構(AMED)の研究班による日本の一都市における新型コロナワクチン(mRNA型)接種後の一定期間とそれ以外の期間の死亡リスクを比較解析した結果では、新型コロナワクチン(mRNA型)接種後の死亡リスクについて、有意な上昇は認められなかったとされています(※3)。
米国においても、ワクチン接種後の病気の発生率と、接種を行わなかった場合の予想される病気の自然発生率を比較するなどの評価が行われています。これらの調査の結果、米国CDCは2021年6月時点で「死亡事例とmRNAワクチン接種には明らかな因果関係がない」と評価しているほか(※4)、米国におけるVSDを利用した新型コロナワクチン(mRNA型)接種後の死亡リスクに係る観察研究の結果でも、新型コロナワクチン(mRNA型)接種後の死亡リスクについて、有意な上昇は認められなかったとされています(※3)。
これまでの死亡に係る副反応疑い報告の状況、国内外のmRNAワクチン接種後のリスク分析のエビデンスも踏まえると、現時点で、引き続きワクチンの接種体制に影響を与える重大な懸念は認められないとされています。
なお、新型コロナウイルス感染症の流行時における超過死亡(ある時点において全ての死因を含む死亡者数が例年より多かったことを示します。)についても、日本では感染拡大の時期、とりわけ2021年4~6月の時期に、一部の都道府県で超過死亡が確認されましたが、これは日本でワクチン接種が進む時期よりも前であったことが厚生労働省の研究班より報告されています(※5)。ワクチン接種が原因で超過死亡が発生したという科学的根拠は、現時点において確認されていません。
令和5年(2023年)1月25日に開催された新型コロナウイルス感染症対策アドバイザリーボードに報告された分析によると、令和4年(2022年)1月から10月までの超過死亡は、過去(2017~2021年)の同期間と比べて最も大きい規模となっています。これまで超過死亡のピークはそれぞれの新型コロナウイルス感染症の流行のピーク時に観察されていることから、現時点においては、その要因の一つとして新型コロナウイルスの感染拡大の影響が指摘されています。
(参考資料)
※1:PMDAの審査報告書(ファイザー社のワクチン)
※2:PMDAの審査報告書(モデルナ社のワクチン)
※3:COVID-19 mRNAワクチン接種後のリスクの分析[169KB](第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)資料より抜粋)
※4:CDC. Selected Adverse Events Reported after COVID-19 Vaccination
※5:2021年の全死亡超過死亡の発生と新型コロナワクチン接種数の関係(第76回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第28回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)資料より抜粋)
【2024年3月時点】ワクチンを接種することで不妊になるというのは本当ですか。
ワクチンが原因で不妊になるという科学的な根拠はありません。ワクチン接種により流産率は上がっておらず、妊娠しにくくなるという根拠も確認されていません。
新型コロナワクチンも含め、これまでに日本で使用されたどのワクチンも、不妊の原因になるという科学的な根拠は報告されていません(※1、※2、※3)。排卵と妊娠は、脳や卵巣で作られるホルモンによってコントロールされていますが、新型コロナワクチンには、排卵や妊娠に直接作用するホルモンは含まれていません(※4、※5)。また、卵巣や子宮に影響を与えることが知られている化学物質も含まれていません。動物実験においても、ファイザー社のワクチン、モデルナ社のワクチン共に、接種したラットが問題なく妊娠・出産したことが確認されており、生まれた仔にも異常は無かったことが報告されています(※4、※5、※6)。
米国でワクチン接種後に妊娠した827人の女性の経過を調べた研究では、ワクチンを接種した人の流産率が自然に発生する流産率を上回ることはなく、ワクチンが妊娠に与える好ましくない影響は確認されませんでした(※2)。また、mRNA(メッセンジャーRNA)ワクチンの臨床試験では、ワクチン接種後に妊娠した人がいることも報告されており(ファイザー社:ワクチン接種群12人、プラセボ接種群11人、モデルナ社:ワクチン接種群6人、プラセボ接種群で7人)、ワクチン接種により妊娠しにくくなるという根拠は確認されていません(※4、※5)。
新型コロナワクチンの成分が大量に卵巣に蓄積したという情報がSNSで流れていますが、これは正確ではありません。ファイザー社が報告した動物実験結果において、ワクチンの有効成分であるmRNAを封入している「脂質ナノ粒子」の成分が卵巣にも分布したことが示されていますが、分布した量は投与部位が最も多く、卵巣に特に多く集積したわけではありません。投与後48時間までにおいて、卵巣で検出された「脂質ナノ粒子」の成分は総投与量の0.1%未満です。(※7、※9)。
また、新型コロナワクチンは精巣に影響を与える成分も含まれていません。モデルナ社が報告した動物実験結果では、投与したmRNAが精巣にもわずかに分布することが示されていますが、ファイザー社のワクチンと同様、分布した量は投与部位が最も多く、精巣への分布量は血漿中への分布量と比較しても低く、24~72時間以内には検出下限未満となっています(※8、※10)。男性においても、現時点において、ワクチン接種が不妊の原因になるという科学的な根拠は報告されていません。
(参考資料)
※1:CDC. COVID-19 Vaccines While Pregnant or Breastfeeding
※2:N Engl J Med 2021; 384:2273-2282
(Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons)
※3:ACOG. COVID-19 Vaccines and Pregnancy: Conversation Guide for Clinicians
※4:Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum
(Pfizer-BioNTech COVID-19 Vaccine/ BNT162b2)
※5:Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum
(Moderna COVID-19 Vaccine/mRNA-1273)
※6:Reproductive Toxicology. 2021, Vol103, 28-35
(Lack of effects on female fertility and prenatal and postnatal offspring development in rats with BNT162b2, a mRNA-based COVID-19 vaccine)
※7:薬物動態試験の概要文(ファイザー社のワクチン)
※8:薬物動態試験の概要文(モデルナ社のワクチン)
※9:PMDAの審査報告書(ファイザー社のワクチン)
※10:PMDAの審査報告書(モデルナ社のワクチン)
【2024年3月時点】私は妊娠中・授乳中・妊娠を計画中ですが、ワクチンを接種することができますか。
妊娠中、授乳中、妊娠を計画中の方も、ワクチンの接種を受けていただけます。
妊娠中、授乳中、妊娠を計画中の方も、新型コロナワクチンの接種を受けていただけます。
妊娠中、授乳中の方:
国内外の研究において、ワクチン接種を受けた妊婦やその新生児に対して有害事象の増加はなく、ワクチン接種を受けていない妊婦と比べて、流産、早産、新生児死亡の発生率に差はなかった、と報告されています(※1、※2)。また、妊娠中に接種したワクチンによってつくられた抗体は、臍帯を通じて胎児へ移行し、生まれた後に新生児を感染から守る効果が期待されます(※2、※3)。諸外国の統計では、妊娠中のワクチン接種は新生児の入院リスクを減少させるという報告もあります(※4)。なお、ワクチン自体が母乳に移行する可能性は低く、万が一mRNAが母乳中に存在しても、子どもの体内で消化されることが予想され、影響を及ぼすことは考えにくいと報告されています(※2)。
妊娠を計画している方:
現時点では生殖器に悪影響を及ぼす報告はなく、ワクチン接種を受けるために妊娠のタイミングを変更する必要はないと考えられています(※5)。
(参考資料)
リーフレット「新型コロナウイルス感染症(COVID-19)対策~妊婦の方々へ~」(厚生労働省)
接種後の解熱鎮痛薬の服用に関するQA(厚生労働省)
女性のみなさまへ 新型コロナウイルスワクチン(mRNAワクチン) Q&A(日本産婦人科感染症学会)
※1:N Engl J Med.2021; 384:2273-2282
(Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons)
※2:Expert Rev Vaccines. 2021 : 1-10. Published online 2021 Oct 11.
(COVID-19 vaccination in pregnant and lactating women: a systematic review)
※3:American Journal of Obstetrics and Gynecology. 2021 March, Epub
(Coronavirus disease 2019 vaccine response in pregnant and lactating women: a cohort study)
※4:CDC:Morbidity and Mortality Weekly Report (MMWR)
(Effectiveness of Maternal Vaccination with mRNA COVID-19 Vaccine During Pregnancy Against COVID-19 - Associated Hospitalization in Infants Aged <6 Months - 17 States, July 2021 - January 2022)
※5:CDC. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States
【2024年3月時点】新型コロナワクチン接種により月経への影響が生じるのは本当ですか。
最近の報告によると、新型コロナワクチンの月経への影響がないこともあれば、接種後に一時的に月経周期等に僅かな影響が生じることもありますが、そうした場合でも、その後速やかに元に戻ることが知られています。
最近の報告によると、新型コロナワクチンの月経への影響がないこともあれば、新型コロナワクチン接種後に一時的に月経周期がわずかに変化したり、経血量が少量増えたりすることもありますが、そうした場合でも、その後の月経周期で速やかに元に戻ることが知られています。
一般的に、女性の月経周期は、環境ストレスや生活の変化等様々な要因に影響を受けるので、副反応による発熱や体のだるさなどのストレスで月経周期の乱れや経血量の増加が生じる可能性は考えられます。
なお、アメリカ産婦人科学会は、新型コロナワクチンの月経への影響は最小限で一時的であり、ワクチン接種を避ける理由にはならないとしています。
また、ワクチンが原因で不妊になるという科学的な根拠はありません。ワクチンと妊娠との関係については、こちらをご覧ください。
(参考資料)
ACOG. COVID-19 Vaccination Considerations for Obstetric-Gynecologic Care(アメリカ産婦人科学会)
Planning for Pregnancy(CDC)
【2024年3月時点】ワクチン接種で新型コロナウイルスに感染することはありますか。
ワクチンを接種したことが原因で新型コロナウイルスに感染することはありません。
ワクチンを接種したことが原因で新型コロナウイルスに感染することはありません。ファイザー社、モデルナ社、及びアストラゼネカ社の新型コロナワクチンは、新型コロナウイルスの表面にある「スパイクタンパク質」のみの遺伝情報を用いたものであり、ウイルス全体の遺伝情報が含まれているわけではありません。また、武田社の新型コロナワクチン(ノババックス)は、「スパイクタンパク質」の遺伝情報をもとに作られた組換えスパイクタンパク質を接種するものであり、ウイルス全体が含まれているわけではありません。このため、体の中で新型コロナウイルス全体が作られたり、新型コロナウイルスに感染することはありません。また、接種を受けることで、受けた人から感染性のあるウイルスが放出されることもありません。
【2024年3月時点】ワクチンを接種した人が変異株に感染すると重症化しやすい(抗体依存性感染増強(ADE)になりやすい)のは本当ですか。
変異ウイルスに対するものを含め、現在までに、新型コロナワクチンを接種した方に抗体依存性感染増強(ADE)が生じたという報告はありません。
抗体依存性感染増強(ADE)とは、ウイルスの感染やワクチンの接種によって体内にできた抗体が、ウイルスの感染や症状をむしろ促進してしまうという現象です。
新型コロナワクチンを接種した方で、ADEが起こり重症化してしまったという報告は、臨床試験でも実用化後でも、現時点において確認されていません。
稀ではありますが、ワクチン接種によりウイルスに感染した時の症状が増強してしまう現象(ワクチン関連疾患増強)が起きることがあります。免疫に関与するT細胞のうち、Th2とよばれる細胞が優位にはたらくことや、ウイルスへの結合能を有するものの中和活性の低い抗体などがウイルスの細胞内への侵入を助長したり、抗体による複合体を形成して気道などの炎症を引き起こしたりするといった機序が考えられています。
新型コロナワクチンの開発に向けた各国規制当局の会議では、動物実験(非臨床試験)やヒトでの臨床試験の段階から、このようなワクチン関連疾患増強の可能性に注意しながら開発する必要性が指摘され、新型コロナワクチンを開発する製薬企業には、動物実験や臨床試験において、(1)中和抗体の誘導の状況や、(2)Th1とTh2という免疫のバランスを検証する(Th2が優位でないことを確認する)、といったことが求められました。
現在、日本で接種が行われている新型コロナワクチンにおいても、開発段階で様々な実験動物を使用して、中和抗体の誘導の状況やTh1とTh2のバランス、炎症の増強がないかなどが確認されており、ヒトにおける疾患増強リスクについても、引き続き実用化後も情報収集していくことが薬事承認審査の過程で求められました。
今後も、新たな変異ウイルスが出現した場合には、ワクチンを接種した人でADEを含めた疾患増強が生じるかを観察する必要はありますが、現時点ではこのようなリスクの懸念はないと考えられます。
(参考資料)
FDA.Development and Licensure of Vaccines to Prevent COVID-19
ICMRA 第2回COVID-19ワクチン開発に関する世界規制当局ワークショップ(PMDAホームページ)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(アストラゼネカ社のワクチン)
PMDAの審査報告書(武田社(ノババックス)のワクチン)
【2024年3月時点】通常の臨床試験(治験)のプロセスが省略されているのは本当ですか。
新型コロナワクチンは、医薬品開発に必要な臨床試験(治験)のプロセスを経て有効性と安全性が示された結果、世界中で承認されています。
開発開始から一年足らずで実用化された新型コロナワクチンに対して、「臨床試験(治験)のプロセスが省略されているのでは?」という誤解がありますが、今回の新型コロナワクチン開発において臨床試験のプロセスが省略されたという事実はありません。
一般的な医薬品開発の場合、研究室における試験管内での実験や動物実験を経て、人を対象とした「臨床試験」が行われます。臨床試験にもステップがあり、人での忍容性や安全性を確認する第I相試験、有効性の確認や最適な投与方法を見出すための第II相試験、そして第II相試験で見出された有効性を科学的に証明したり、どのような副作用(副反応)が起きうるのかを確認するための第III相試験が行われます。ここまでに得られたデータは企業によりまとめられ、各国の医薬品承認審査機関に提出されます。さらに、申請されたデータや製品の品質管理などに間違いや偽りがないかといった、様々な調査も行われています。
現在日本で承認されている新型コロナワクチンでは、上記のプロセスが省略されることなく実施され、信頼性が確認されたデータによりワクチンの有効性や安全性が示されています。承認審査にあたっては行政機関のみならず、独立した第三者委員会による議論も世界各国で行われています。
(参考資料)
ICH-E8 臨床試験の一般指針
ワクチンの安全性及び有効性担保に関するICMRA共同声明
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(アストラゼネカ社のワクチン)
PMDAの審査報告書(武田社(ノババックス)のワクチン)
【2024年3月時点】新型コロナワクチンの臨床試験(治験)が終わっていないというのは本当ですか。
新型コロナワクチンは、臨床試験(第Ⅲ相試験)で、有効性と安全性に関して厳格な評価が行われた後に承認されています。その上で、効果の持続性等を確認するために、臨床試験の一部が継続されています。
日本で承認され公的接種の対象となっているファイザー社とモデルナ社のmRNA(メッセンジャーRNA)ワクチンは、臨床試験(第Ⅲ相試験)で、有効性と安全性に関して厳格な評価が行われた上で、薬事承認されています(※1、※2)。その上で、効果の持続性等を確認するために、現在も、臨床試験の一部が継続されています。
米国FDAのガイダンスでは、安全性について、大規模な臨床試験を基にした緊急使用を許可するために、接種後観察期間の中央値が2か月間あることを一つの要件としました。これは、従来のワクチンの副反応はほとんどが2か月以内に認められることが分かっているためです(※3、※4)。これらの情報に加えて、日本国内でも、日本人を対象に臨床試験(第Ⅰ/Ⅱ相試験)を実施し、安全性や免疫原性(抗体の産生や細胞性免疫を誘導する性質)があること等が確認された後、特例承認を受けています(※1、※2)。
このように、既に、有効性と安全性の評価は丁寧に行われましたが、一部の臨床試験の終了予定時期が、将来の日付になっている場合があります。これは、こうした臨床試験に参加した方々に、より長期に有効性や安全性が認められるかどうかについて、引き続き情報収集が行われているためです。臨床試験に参加した方々は、世界で最初に新型コロナワクチンを接種した方々ですので、情報収集を続けることで、免疫の持続期間など、大変重要な科学的知見が得られると考えられます。
なお、ワクチンの臨床試験(治験)が終わっていないため、ワクチンを接種したら民間保険に加入できない、もしくは加入中の保険の契約が無効になる等のSNS上の情報については根拠がなく、そのような事実は確認されていません。接種を受けるのは既に承認されたワクチンであり、接種を受けることで、治験に参加することになるわけではありません。
(参考資料)
※1:PMDAの審査報告書(ファイザー社のワクチン)
※2:PMDAの審査報告書(モデルナ社のワクチン)
※3:Emergency Use Authorization for Vaccines to Prevent COVID-19
※4:CDC.National Childhood Vaccine Injury Act: Vaccine Injury Table
【2024年3月時点】新型コロナワクチンの動物実験で全ての動物が死んだというのは本当ですか。
新型コロナワクチンの実験動物がワクチンの毒性によって異常な死を遂げたという事実は確認されていません。
新型コロナワクチンの毒性試験において、ワクチンを投与された実験動物に、有害事象による死亡例はみられませんでした。通常の毒性試験と同様に、実験動物の各臓器の変化を調べましたが、ワクチンによる明らかな毒性は認められませんでした(※1、※2)。
医薬品開発にあたっては、動物実験において、実験動物に毒性が認められない用量を確認した上で、ヒトでの臨床試験が実施されており、動物実験で十分な安全性が確認されることが必須条件となっています(※3)。
なお、「ワクチン接種された実験用のネズミやネコが全て死亡した」等のSNS上の情報には、根拠となる事実は確認されていません。
(参考資料)
※1:申請資料概要(ファイザー社のワクチン)
※2:申請資料概要(モデルナ社のワクチン)
※3:「医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験の実施についてのガイダンス」について
アーカイブ
1・2回目の接種後、3回目の接種前に12歳の誕生日を迎えました。どうしたらよいでしょうか。※最終更新日:2023年11月1日
3回目の接種前に12歳の誕生日を迎えた場合は、12歳以上の用量を接種します。
11歳以下と12歳以上では、接種するワクチンの(種類も)量も異なります。1・2回目の接種後、3回目の接種前に12歳の誕生日を迎えた場合は、3回目の接種時の年齢に基づき、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5、12歳以上用)又は12歳以上の用量でモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)を接種します。
一方、1回目の接種後、2回目の接種前に12歳の誕生日を迎えた場合は、1回目と2回目の接種は原則として同じワクチンを接種する必要がありますので、ファイザー社のオミクロン株対応1価ワクチン(XBB.1.5、5~11歳用)又は6~11歳の用量でモデルナ社のオミクロン株対応1価ワクチン(XBB.1.5)を接種します。
接種済証に貼られたワクチンのシールで、ワクチンの「最終有効年月日」が接種日より前の日付になっていますが問題ないですか。※最終更新日:2023年9月25日
ワクチンの有効期間は、一定期間保存した後の品質に関するデータに基づき、薬事上の手続きを経て設定されるため、一度設定した後でも延長されることがあり、タイミングによっては印字の有効期限より、実際には長く接種できる場合があります。
ワクチンの有効期間は、当該ワクチンを製造・販売する企業において収集された、一定期間保存した後の品質に関するデータに基づき、薬事上の手続きを経て、設定されます。このため、一度有効期間を設定した後であっても、新たなデータに基づく薬事上の手続きを経ることにより、有効期間が延長されることがあります。
こうした手続きを経て、令和5年(2023年)6月30日現在、
- ファイザー社ワクチンの有効期間は24か月
- 武田社ワクチン(ノババックス)の有効期間は12か月
となっておりますが、バイアルには延長前の有効期間(6か月、9か月又は12か月)を前提とした有効期限が印字されたものが流通しています。つきましては、別添1~6にあるロットNoのバイアルについては、印字されている有効期限に関わらず、延長後の有効期間として取り扱っていただきますようお願いいたします。
- ファイザー社ワクチンの有効期限
| ワクチン/変更日 | 令和3年9月10日 | 令和4年4月22日 | 令和4年8月19日 | 令和4年12月15日 | 令和5年1月25日 | 令和5年6月29日 |
|---|---|---|---|---|---|---|
| 1価:起源株 | ||||||
| 12歳以上用 | 6か月→9か月 | 9か月→12か月 | 12か月→15か月 | - | 15か月→18か月 | 18か月→24か月 |
| 5~11歳用 | - | 9か月→12か月 | - | 12か月→18か月 | - | 18か月→24か月 |
| 6か月~4歳用 | - | - | - | 12か月→18か月 | - | 18か月→24か月 |
| 2価:起源株/オミクロン株 | ||||||
| 12歳以上用 | - | - | - | 12か月→18か月 | - | 18か月→24か月 |
| 5~11歳用 | - | - | - | 12か月→18か月 | - | 18か月→24か月 |
- 武田社ワクチン(ノババックス)の有効期限
| ワクチン/変更日 | 令和5年6月20日 |
|---|---|
| 12歳以上用 | 9か月→12か月 |
- モデルナ社ワクチンの有効期限
令和5年2月11日をもって、モデルナ社ワクチン(12歳以上用、1価:従来株)は、すべて有効期限が到来しています。
※なお、モデルナ社ワクチン(12歳以上用、2価:起源株/オミクロン株)の有効期限については下記のモデルナ社HPに掲載されております。
https://modernacovid19global.com/ja-jp/vial-lookup
なお、ご自身が接種したファイザー社、モデルナ社及び武田社(ノババックス)のワクチンの有効期限を確認したい場合は、こちらでご確認ください。
(参考資料)
ファイザー社ワクチン、モデルナ社ワクチン及び武田社ワクチン(ノババックス)の有効期限の取扱いについて(厚生労働省、令和5年6月30日事務連絡)
なぜ、オミクロン株対応2価ワクチンの接種が必要なのですか。※最終更新日:2023年9月20日
オミクロン株の流行が続く中、審議会での議論を踏まえ、重症化予防はもとより、感染や発症を予防する目的で、オミクロン株対応2価ワクチンの接種が推奨されています。
令和4年(2022年)10月現在、日本において、オミクロン株の流行が続いています。
こうした中、WHO(世界保健機関)、FDA(米国食品医薬品局)、EMA(欧州医薬品庁)では、オミクロン株系統の成分を新型コロナワクチンに含め、追加接種を実施するよう見解が示され、諸外国において、2022年秋のオミクロン株対応2価ワクチンによる追加接種の方針が示されています。
日本では、ファイザー社とモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による追加接種について、臨床試験における中和抗体価(ウイルスの感染力または毒素の活性を中和できる抗体の数値)の上昇等の有効性についてのデータ及び有害事象の発生頻度等の安全性についてのデータをもとに、令和4年9月12日に薬事承認されました。
その後、厚生労働省の審議会で議論した結果、オミクロン株対応2価ワクチンの追加接種により、従来の1価ワクチンを上回る重症化予防効果と、短期間の可能性はあるものの、オミクロン株に対する感染・発症予防効果が期待されることから、ファイザー社とモデルナ社のワクチン(従来株/BA.1)による接種を、予防接種法上の特例臨時接種に位置づけることが適当であるとされ、同年9月20日より順次接種が開始されています。
なお、ファイザー社とモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種についても、同様の効果が期待されており、それぞれ同年10月5日と同年11月1日に薬事承認された後、審議会の議論を経た上で、それぞれ同年10月13日と同年11月28日より順次接種が開始されています。
さらに、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又は従来株/BA.4-5)による初回接種についても、これまで同様に一定の有効性が期待され、安全性も重大な懸念は認められず許容可能とされており、令和5年(2023年)8月2日に薬事承認された後、審議会の議論を経た上で特例臨時接種に位置づけることが適当であるとされ、同年8月7日より接種が開始されています。
また、小児(5~11歳)用のオミクロン株対応2価ワクチンについては、こちらをご覧ください。
オミクロン株の流行が続く中、重症化予防はもとより、感染や発症を予防する目的で、初回(1・2回目)接種を完了した方に対する追加接種だけでなく、従来型ワクチンを用いている初回接種や小児及び乳幼児の接種についても早急に切り替え、オミクロン株対応2価ワクチンを接種することが望ましいとされています。
※モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1)による接種は令和5年6月14日、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又はBA.4-5)及びモデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による接種は令和5年9月19日をもって終了しました。
(参考資料)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1))
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[872KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[959KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
2022年秋以降の新型コロナワクチン追加接種及びオミクロン株対応ワクチン等の接種に係る諸外国の状況[916KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(初回免疫等))
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
オミクロン株対応2価ワクチンとは、どのようなワクチンですか。※最終更新日:2023年9月20日
オミクロン株対応2価ワクチンは、mRNA(メッセンジャーRNA)ワクチンの一つで、従来株(新型コロナウイルス感染症発生時の株のこと。オリジナル株、起源株ともいいます。 )に由来する成分と、オミクロン株に由来する成分の両方を含む「2価ワクチン」です。従来のワクチン(従来株のみに由来する成分を含むワクチン)と比較して、オミクロン株に対する重症化・感染・発症予防効果がそれぞれ強いことが期待されています。
オミクロン株対応2価ワクチンは、mRNA(メッセンジャーRNA)ワクチンの一つで、従来株(新型コロナウイルス感染症発生時の株のこと。オリジナル株、起源株ともいいます。)とオミクロン株の2種類の、スパイクタンパク質の設計図となるmRNAを成分として含む「2価ワクチン」です。従来のワクチン(従来株のmRNAのみを成分として含む「1価ワクチン」)と比較して、オミクロン株に対する重症化予防効果や、短い期間である可能性はあるものの、感染予防効果、発症予防効果がそれぞれ強いことが期待されています。
また、異なる2種類の抗原(体内で免疫反応を誘導する物質)があることにより、誘導される免疫も、より多くの種類の新型コロナウイルスに反応するため、今後の変異株に対しても有効である可能性がより高いと期待されています。
オミクロン株対応2価ワクチンには、BA.1対応型とBA.4-5対応型があります。BA.1、BA.4-5は、いずれもオミクロン株の種類(亜系統)であるため、BA.1対応型であっても、BA.4-5対応型であっても、現在流行の中心であるオミクロン株に対しては、1価ワクチンを上回る効果が期待されています。
令和5年(2023年)8月7日現在、各ワクチンはそれぞれ以下の方に対して接種することが可能となっています。
- ファイザー社の2価ワクチン:1・2回目接種(*)が未了である又は完了した、5歳以上のすべての方(5~11歳の方には、BA.4-5対応型を使用)
- モデルナ社の2価ワクチン:1・2回目接種(*)を終えた6歳以上のすべての方(BA.1対応型は、令和5年6月14日をもって接種が終了)
※追加接種の場合は、前回の接種から3か月以上の間隔をあける必要があります。
各ワクチンの有効性についてはこちらを、安全性についてはこちらをご覧ください。
(*)乳幼児(生後6か月~4歳)接種の初回接種は3回で1セットです。
(参考資料)
ファイザー社のオミクロン株対応2価ワクチンの特徴等[1.5MB](第37回及び第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチンの特徴等[2.1MB](第37回、第40回及び第42回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
追加接種に係る前回の接種からの接種間隔と有効性について等[1.7MB](第39回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児用のオミクロン株対応2価ワクチンについて[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
オミクロン株対応2価ワクチンの接種にはどのような効果がありますか。※最終更新日:2023年9月20日
オミクロン株対応2価ワクチンの接種により、従来のワクチンの接種と比較して、中和抗体価と中和抗体応答率が同等以上であること等が確認され、重症化・感染・発症を予防する効果が期待されています。
ファイザー社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1)については、海外で実施された臨床試験において、従来の1価ワクチン(従来株)を3回接種した者を対象に、本ワクチンの追加(4回目)接種から1か月後のオミクロン株BA.1に対する中和抗体価(*1)と中和抗体応答率(*2)を評価したところ、従来ワクチンの追加接種に比べて、それぞれ優越性(優れていること)と非劣性(劣っていないこと)が示されたことが確認されています。
モデルナ社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1)については、海外で実施された臨床試験において、従来の1価ワクチン(従来株)を3回接種した者を対象に、本ワクチンの追加(4回目)接種から28日後のオミクロン株BA.1に対する中和抗体価と中和抗体応答率を評価したところ、従来ワクチンの追加接種に比べて、それぞれ優越性と非劣性が示されたことが確認されています。
また、新型コロナワクチン接種後の中和抗体価と発症予防効果との相関性(※1)や、オミクロン株による新型コロナウイルス感染症に対する、従来の1価ワクチンの効果が報告されている(※2)ことから、オミクロン株対応2価ワクチンの追加接種による、一定の発症及び重症化を予防する効果が期待され、日本ではファイザー社製、モデルナ社製のどちらも令和4年(2022年)9月12日に薬事承認がなされています。
一方、ファイザー社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.4-5)については、追加接種により、従来株・デルタ株・オミクロン株に対する中和抗体価を誘導することが非臨床試験で確認されていること、モデルナ社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.4-5)については、追加接種により変異株に対する免疫原性及び感染予防効果が非臨床試験で確認されていることから、いずれもBA.5を含む変異株に対して幅広い予防効果が期待され、それぞれ同年10月5日と同年11月1日に薬事承認がなされています。
また、モデルナ社のオミクロン株対応2価ワクチン(従来株/オミクロン株BA.1、従来株/オミクロン株BA.4-5)の対象年齢について、薬事承認上、同年12月13日から、従来株の1価ワクチンによる追加接種の対象年齢拡大に合わせて12歳以上に拡大することとされました。
さらに、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1又は従来株/BA.4-5)による初回接種について、他の年齢層(18歳以上)へのBA.4-5対応2価ワクチンの4回目接種による中和抗体の誘導や、非臨床試験での初回接種による起源株とオミクロン株亜系統に対する中和抗体の誘導等から、一定の有効性が期待できるとされ、令和5年(2023年)8月2日に薬事承認がなされました。その後、厚生科学審議会の議論を経た上で、5歳以上の方への初回接種を特例臨時接種に位置づけることが適当であるとされ、同年8月7日より接種が開始されています。
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種について、他の年齢層(18歳以上)への2価ワクチンの追加接種による試験成績や、6~11歳への従来型1価ワクチンの追加接種による試験成績、これまでの知見等から、一定の有効性が期待できるとされ、令和5年8月2日に薬事承認がなされました。その後、厚生科学審議会の議論を経た上で、6~11歳の方への追加接種を特例臨時接種に位置づけることが適当であるとされ、同年8月7日より接種が開始されています。
また、小児(5~11歳)用のオミクロン株対応2価ワクチンについては、こちらをご覧ください。
なお、厚生科学審議会において、現時点の医学的知見に基づき、従来の1価ワクチンとオミクロン株対応の2価ワクチンの免疫原性(*3)の比較から、オミクロン株対応2価ワクチンの追加接種により、従来の1価ワクチンを上回る重症化予防効果と、短期間の可能性はあるものの、オミクロン株に対する感染・発症予防効果が期待される、と判断されています。
(*1)ウイルスの感染力または毒素の活性を中和できる抗体の数値
(*2)中和抗体価がベースライン値(1回目接種前の数値)から4倍以上に上昇した被験者の数
(*3)抗体の産生や細胞性免疫を誘導する性質
(参考資料)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1))
オミクロン株対応2価ワクチンの有効性及び安全性について[1.2MB](第37回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[872KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[959KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチンの対象年齢について[1.3MB](第42回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:Nature Med. 2021 May 17; 27: 1205-1211
(Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection)
※2:CDC:ACIP Presentation Slides: April 20, 2022 Meeting
(COVID-19 Vaccine Effectiveness during Omicron)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(初回免疫等))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(6~11歳))
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
BA.1対応型ワクチンとBA.4-5対応型ワクチンは、どちらのほうが効果がありますか。どちらを接種したほうがよいのですか。※最終更新日:2023年9月20日
オミクロン株対応2価ワクチンは、BA.1対応型であっても、BA.4-5対応型であっても、従来の1価ワクチンを上回る効果と、今後の変異株にも有効である可能性が期待されています。対応するオミクロン株の種類にかかわらず、その時点で接種可能なオミクロン株対応2価ワクチンを接種するようお願いします。
BA.1、BA.4-5は、いずれもオミクロン株の種類(亜系統)です。抗原性(免疫反応を引き起こす性質)について、オミクロン株と従来株との間の差に比べ、BA.1とBA.4-5との間の差は大きくないことが示唆されています。
オミクロン株対応2価ワクチンは、BA.1対応型であっても、BA.4-5対応型であっても、オミクロン株の成分を含んでいるため、現在流行の中心であるオミクロン株に対し、従来の1価ワクチンを上回る効果が期待されています。
また、従来株とオミクロン株の2種類の成分があることにより、誘導される免疫も、より多様な新型コロナウイルスに反応すると考えられるため、今後の変異株に対しても有効である可能性がより高いことが期待されています。
このため、対応するオミクロン株の種類にかかわらず、その時点で接種可能なオミクロン株対応2価ワクチンの接種をお願いします。
*オミクロン株対応2価ワクチンの接種は、BA.1対応型とBA.4-5対応型のいずれも、令和5年(2023年)9月19日をもって終了しました。
(参考資料)
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[872KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[959KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年春開始接種で用いられているオミクロン株対応2価ワクチンは、現在流行しているXBB系統に対して効果がありますか。※最終更新日:2023年9月20日
現時点の科学的知見を踏まえると、オミクロン株対応2価ワクチンは、オミクロンXBB系統株の感染による重症化を予防する効果があります。
オミクロン株対応2価ワクチン(BA.4-5対応型)のXBB系統に対する有効性については、米国における研究において、オミクロン株対応2価ワクチンは、XBB系統株に対しても接種後約2か月の間、死亡を60~70%程度予防する効果が持続することが報告されています。
こうした科学的知見を踏まえ、令和5年春開始接種の対象者である重症化リスクの高い方には、オミクロン株対応2価ワクチンを用いて接種を行うこととしています。重症化リスクの高い高齢者の方などは現行のオミクロン株対応2価ワクチンを接種いただくようお願いします。
*オミクロン株対応2価ワクチンの接種は、BA.1対応型とBA.4-5対応型のいずれも、令和5年(2023年)9月19日をもって終了しました。
(参考資料)
N Engl J Med. 2023; 388:1818-1820
(Durability of Bivalent Boosters against Omicron Subvariants)
新型コロナワクチン令和5年春開始接種についてのお知らせ(第3版(2023年7月3日))
オミクロン株対応2価ワクチンの接種は、どのような人が対象になりますか。※最終更新日:2023年9月20日
令和5年(2023年)8月7日現在、追加接種として重症化リスクが高い方(高齢者や基礎疾患を有する方等)、医療従事者等、5~11歳の方、初回接種として5歳以上の方が接種対象となっています。
令和5年5月8日以降、オミクロン株対応2価ワクチンの接種は、初回(1・2回目)接種(*)を終えた下記の方を対象に実施しています。
- 重症化リスクが高い方(65歳以上の高齢者、5~64歳で基礎疾患を有する方その他重症化リスクが高いと医師が認める方)
- 重症化リスクが高い多くの方にサービスを提供する医療機関や高齢者・障害者施設等に従事する方
上記に該当する方は、これまでに接種した新型コロナワクチンの種類にかかわらず、最後の接種から3か月以上の間隔を空けて、1人1回受けていただくことができます(令和5年春開始接種)。
(*)乳幼児(生後6か月~4歳)接種の初回接種は3回で1セットです。
ただし、初回接種を終了した5~11歳の方であってオミクロン株対応2価ワクチンによる追加接種をまだ受けていない方については、上記の令和5年春開始接種に該当しない方であっても、引き続き1人1回受けることができます(令和4年秋開始接種)。
また同年8月7日から、初回(1・2回目)接種が未了である5歳以上の方も対象に、オミクロン株対応2価ワクチンの接種を実施しています(初回接種)。
今後、令和5年の秋冬(令和5年9月20日~令和6年3月31日)に、初回接種を終了した生後6か月以上のすべての方は、1人1回の追加接種を受けていただけることとする予定です。なお、秋冬の接種で使用するワクチンについては、厚生労働省の審議会で議論した結果、国内外の流行状況や今後の開発状況を踏まえ、よりオミクロンXBB.1系統の株に対応したワクチンを選択することとし、薬事申請されたオミクロンXBB.1.5対応1価ワクチンの使用を基本としています。
(参考資料)
令和4年秋開始接種についてのお知らせ(厚生労働省HP)
令和5年春開始接種についてのお知らせ(リーフレット)
令和5年春開始接種についてのお知らせ(厚生労働省HP)
初回接種(1回目・2回目接種)についてのお知らせ(厚生労働省HP)
5~11歳の子どもへの接種(小児接種)についてのお知らせ(厚生労働省HP)
令和5年度の接種について[4.1MB](第47回厚生科学審議会予防接種・ワクチン分科会資料1-1より抜粋)
令和5年の秋冬の接種において用いるワクチンについて[1.3MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
令和5年秋開始接種についてのお知らせ(リーフレット)
初回接種にオミクロン株対応2価ワクチンを使用できるのですか。※最終更新日:2023年9月20日
オミクロン株対応2価ワクチンの初回接種が薬事承認されたこと、現在流行しているオミクロン株に対して、従来型ワクチンよりも高い効果が見込まれること等を踏まえて、令和5年(2023年)8月7日から、初回接種にオミクロン株対応2価ワクチンを使用することとしました。
令和5年7月31日に薬事・食品衛生審議会において、オミクロン株対応2価ワクチンを用いた初回接種の有効性・安全性について検討され、同年8月2日付けでオミクロン株対応2価ワクチンの初回接種での使用が承認されました。
新型コロナワクチンの接種に当たっては、その時点で利用可能なワクチンのうち、その時々の流行株により近い抗原性のワクチンを使用することとしています。
こうした考え方に基づき、オミクロン株対応2価ワクチンが
- 初回接種に使用可能となったこと(薬事承認されたこと)
- 現在流行しているオミクロン株に対して、従来型ワクチンよりも高い効果が見込まれること
を踏まえて、令和5年8月7日から、初回接種に用いるワクチンについて、より高い効果が見込まれるオミクロン株対応2価ワクチンを使用することとしました。
(参考資料)
新型コロナワクチンの接種について(第48回厚生科学審議会予防接種・ワクチン分科会 資料1)
なぜ乳幼児(生後6か月~4歳)用のワクチンは、成人や小児(5~11歳)と違い、3回の接種で1セットになっているのですか。※最終更新日:2023年9月20日
現時点で乳幼児用のワクチンは、初回接種として臨床試験が実施され合計3回接種の用法で薬事承認がなされたものについて、予防接種で使用しています。
現時点で乳幼児(生後6か月~4歳)用のファイザー社ワクチンは、初回接種として臨床試験が実施され合計3回接種の用法で薬事承認がなされたものについて、予防接種法上の特例臨時接種で使用しています。ただし、5歳以上に使用される複数の同社製ワクチンと比べて、用量は少なくなっています。
同ワクチンによる追加接種についても令和5年(2023年)8月2日に薬事承認がなされていますが、現時点では、厚生科学審議会における議論の結果、初回接種(合計3回接種)以外では使用しないこととしています。
(参考資料)
PMDAの審査報告書(ファイザー社のワクチン(生後6か月~4歳用))
オミクロン株対応2価ワクチンの初回接種等について[7.8MB](第48回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
従来ワクチン(1価)による追加(3回目)接種では、どのような副反応がありますか。2回目より重いのでしょうか。※最終更新日:2023年9月20日
従来ワクチン(1価)において、海外の臨床試験の結果では、ファイザー社のワクチン及びモデルナ社のワクチンいずれの場合も、2回目の接種後と比較して有害事象の発現傾向は概ね同様であると確認されていますが、リンパ節の腫れなどについては、初回(1回目・2回目)接種時と比較して、発現割合が高い傾向にあります。心筋炎の報告頻度は2回目接種後よりも3回目接種後の方が低い傾向がみられています。
従来ワクチン(1価)において、ファイザー社のワクチン及びモデルナ社のワクチンいずれの場合も、米国で実施された3回目接種に係る臨床試験の結果、3回目接種後に確認された様々な有害事象は、2回目の接種後に確認されたものと比較して、その発現傾向は概ね同様であるとされています。
米国CDCのデータによると、いずれのワクチンにおいても、3回目接種後1週間以内にみられた様々な症状(局所及び全身性の反応や、健康状態、日常生活や勤務への支障等)は、2回目接種後と比較して、その発現割合が低かったとの報告もあります(※1)。
武田社のワクチン(ノババックス)の場合も、海外で実施された3回目接種に係る臨床試験の結果、追加接種後に初回接種を超える安全性の懸念は確認されておらず、3回目接種に係る安全性は許容可能とされています。武田社ワクチン(ノババックス)以外の従来ワクチン(1価)による追加接種は、令和5年(2023年)3月31日をもって終了しました。
国内で実施されている接種後の健康状況に係る調査の中間報告(令和3年12月24日公表)によると、初回接種時にファイザー社のワクチンを受けた方に対してファイザー社のワクチンを3回目接種したところ、接種から1週間後までの有害事象の発現状況は、2回目接種後とほぼ類似していました。
同調査の中間報告(令和4年4月13日公表)によると、初回接種時にファイザー社のワクチンを受けた方において、3回目接種でファイザー社のワクチンを接種(同種接種)した場合とモデルナ社のワクチンを接種(交互接種)した場合では、ワクチンの種類で一部の症状の発現頻度に違いはあるものの、いずれのワクチンでも接種部位の痛み、倦怠感等が多くの方にみられました。なお、発熱の頻度はファイザー社のワクチンよりもモデルナ社のワクチンの方が高い傾向がみられていますが、いずれのワクチンにおいても、接種翌日の発現頻度が最も高く、接種3日後にはほぼ消失していました。
また、令和4年(2022年)5月13日の中間報告によると、初回接種でモデルナのワクチンを受けた方において、3回目接種で同種接種又は交互接種したいずれの場合でも、接種部位の痛みや倦怠感等が多くの方にみられました。発熱については、いずれのワクチンにおいても、接種翌日の発現頻度が最も高く、接種3日後にはほぼ消失していました。
なお、それぞれの調査において、調査対象者の数、年齢分布、性別の分布及び2回目接種から3回目接種までの間隔が異なることから、初回接種としてファイザー社ワクチンを接種した方に関する調査結果と、初回接種としてモデルナ社のワクチンを接種した方に関する調査結果の直接の比較は難しいことに留意が必要です。
腋窩痛(わきの下の痛み)、リンパ節症(リンパ節の腫れ)及びリンパ節痛については、3回目接種後の方が、2回目接種後と比較して、その発現頻度は高い傾向がみられました。このような、3回目接種時でリンパ節の腫れ等の発現割合が高いことは、米国で実施された臨床試験の結果の中でも報告されています(3回ともファイザー社のワクチンを接種した場合:5%程度、3回ともモデルナ社のワクチンを接種した場合:20%程度)。ファイザー社からの報告によると、臨床試験において発現したリンパ節の腫れ等については、ほとんどの場合が軽度であり、発現後短期間で症状が治まっていることが確認されています。ワクチン接種後のリンパ節の腫れについては、こちらでも解説しています。
心筋炎や心膜炎については、現時点において、国内におけるその疑い報告頻度は1回目や2回目と比較して高くない状況であり、3回目接種が先行している海外においても、例えば米国では、3回目接種後の心筋炎はモデルナ社のワクチンを接種した18~24歳の男性で報告が多かったものの、2回目接種時よりも報告頻度は低かったとされています(※2)。また、イスラエルにおいても、ファイザー社のワクチンを3回目接種した後の心筋炎リスクは、2回目接種後よりも低かったとの暫定的な報告がなされています(※3)。心筋炎についてはこちらでも解説しています。
12~17歳に対しては、令和4年3月25日より3回目接種が開始されています。米国での評価によると、ファイザー社のワクチンの3回目接種後に報告された局所及び全身の様々な症状の発現頻度は、2回目接種時と比較して同様あるいは若干高いものの、ほとんどが軽度から中程度であり、接種翌日の頻度が最も高かったと報告されています(※4)。心筋炎の報告頻度についても、2回目接種後と比較して低かったことが報告されています(※4)。
また、小児(5~11歳)に対しても、令和4年9月6日より3回目接種が開始されています。5~11歳の3回目接種における安全性については、こちらをご覧ください。
厚生労働省では、初回接種時と同様、追加接種においても、接種後の副反応を疑う事例を収集し、専門家による評価を行うとともに、引き続き、接種後の健康状況に係る調査を実施してまいります。新たな知見が集積され次第、速やかにお知らせしていきます。
(参考資料)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
追加接種でファイザー社ワクチンを用いることの安全性[734KB](第26回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
追加接種でモデルナ社ワクチンを用いることの安全性[963KB](第27回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
12~17歳の者に対する3回目接種でファイザー社ワクチンを用いることの安全性[969KB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社組換えタンパクワクチン(ノババックス)の特徴等[3.4MB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの追加接種後の健康状況調査(厚生労働省)
※1:CDC:COVID-19 Vaccine Booster Dose Safety
※2:CDC:Morbidity and Mortality Weekly Report (MMWR)
(Safety Monitoring of COVID-19 Vaccine Booster Doses Among Adults - United States, September 22, 2021 - February 6, 2022)
※3:CDC:ACIP Presentation Slides: November 19, 2021 Meeting
(Updates to the Evidence to Recommendation Framework: Pfizer-BioNTech and Moderna COVID-19 vaccine booster doses)
※4:CDC:Morbidity and Mortality Weekly Report (MMWR)
(Safety Monitoring of COVID-19 Vaccine Booster Doses Among Persons Aged 12-17 Years - United States, December 9, 2021-February 20, 2022)
ファイザー社のワクチンは、通常、1回目から3週間後に2回目を接種することになっていますが、どのくらいずれても大丈夫ですか。※最終更新日:2023年9月20日
一番早くて19日後に接種を受けられますが、それより前には受けることができません。なお、標準の接種間隔を超えても、2回目の接種を受けることができます。
ファイザー社のワクチンは、標準として、1回目から3週間後(3週間後の同じ曜日)に2回目を接種することになっています。一番早くて19日後(木曜日に1回目の接種を受けた場合、3週間後の火曜日)に接種を受けられますが、それより前には受けることができません。
接種できる間隔の上限が定められているわけではありません。標準の接種間隔を超えても、2回目の接種を受けることができます。接種を1回目からやり直す必要はありませんので、なるべく早く、2回目の接種を受けましょう。
なお、標準の接種間隔を超えた場合のデータは限られているものの、効果は期待できることから、WHO、米国や、EUの一部の国では、3週間を超えた場合でも、1回目から6週間後までに2回目を接種することを目安として示していますので、こうした目安も参考になると考えられます。
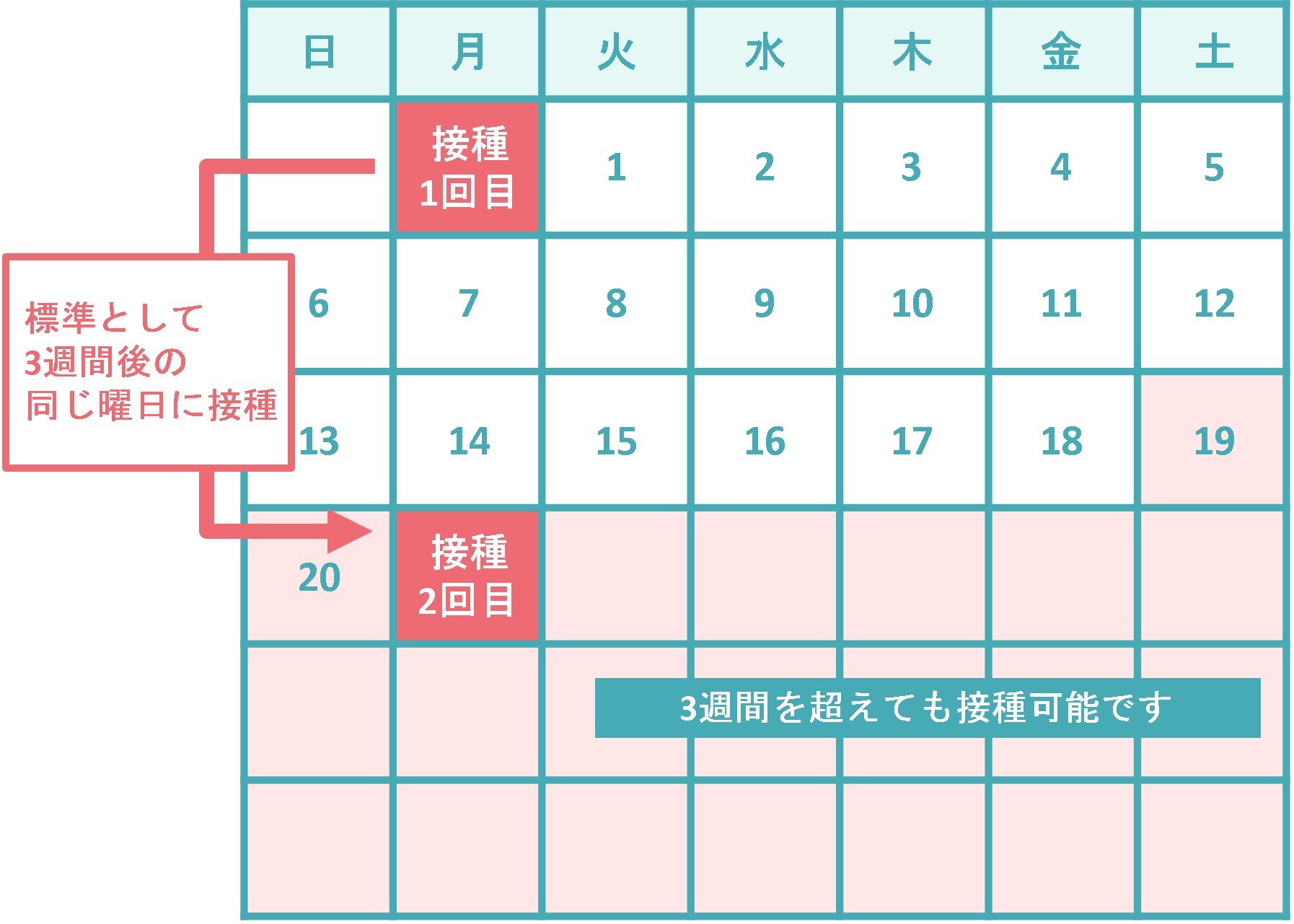
オミクロン株対応2価ワクチンが追加接種のみで、初回(1・2回目)接種として使用されないのはなぜですか。※最終更新日:2023年8月7日
オミクロン株対応2価ワクチンは、現時点で追加接種として臨床試験等が実施されており、追加接種の用法のみで薬事承認がなされています。
オミクロン株対応2価ワクチンは、現時点で追加接種として臨床試験等が実施されており、追加接種の用法のみで薬事承認がなされています。
今後、新たなデータが得られれば初回(1・2回目)接種の用法も含めて薬事承認がなされることも考えられますが、現時点では、薬事承認に基づき、初回(1・2回目)接種としては使用しないこととしています。
(参考資料)
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.1))
PMDAの審査報告書(モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.1))
PMDAの審査報告書(ファイザー社のオミクロン株対応2価ワクチン(5~11歳用(追加接種)))
ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[872KB](第38回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の評価について[959KB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
小児用のオミクロン株対応2価ワクチンについて[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新たな変異株(XBB、BQ.1.1など)が出現したと報道されていますが、これらの変異株も含めて、BA.1対応型ワクチンとBA.4-5対応型ワクチンは効果がありますか。※最終更新日:2023年7月4日
現時点の知見を踏まえると、オミクロン株対応2価ワクチンによる接種は、オミクロン株の種類(BA.1とBA.4-5)に関わらず、従来型ワクチン接種を上回る効果がみられ、今後の変異株にも有効である可能性が期待されています。
オミクロン株対応2価ワクチン(BA.4-5対応型)の追加接種後の中和抗体価は、従来型ワクチンの3回目、4回目接種後と比較して、オミクロン株の亜種(BA.1、BA.5、BA.2.75.2、BQ.1.1、XBB)のいずれに対しても高かったという報告があります。
また、オミクロン株対応2価ワクチン(BA.4-5対応型)の有効性について、
- 接種後約1か月において、新型コロナワクチン非接種者と比較して56%、従来型ワクチン接種後2~4か月の者と比較して31%、救急外来受診を減らす効果があった
- 接種後約1か月において、新型コロナワクチン非接種者と比較して57%、従来型ワクチン接種後5~7か月の者と比較して38%、入院を減らす効果があった
という報告や、
- BA.4-5対応型による追加接種は、従来型mRNAワクチンのみを2回以上接種した者のうち、直近の接種から2~3か月の者や8か月以上の者と比較して、それぞれ18~49歳で30%と56%、50~64歳で31%と48%、65歳以上で28%と43%、発症を予防する効果があった
という報告があります。
上記の報告はBA.4-5対応型ワクチンに関するものですが、現時点の知見を踏まえた専門家による検討では、免疫を刺激する性質を比較した場合、従来株と現在流行しているオミクロン株との差と比較すると、オミクロン株の中での種類(BA.1とBA.4-5)の差は大きくないことが示唆されています。オミクロン株対応2価ワクチンによる接種は、オミクロン株の種類(BA.1とBA.4-5)に関わらず、オミクロン株成分を含むことで、現在の流行状況では従来型ワクチンの接種を上回る効果がみられ、オミクロン株と従来株の2種類の成分が含まれることで、今後の変異株に対しても有効である可能性がより高いことが期待されています。
そのため、従来型ワクチンによる最終の接種から3か月以上経過後の時点で接種可能な、オミクロン株成分を含むワクチンを接種いただくようお願いします。
(参考)
オミクロン株対応2価ワクチン(BA.4-5対応型)の有効性[1.6MB](第51回厚生科学審議会予防接種・ワクチン分科会基本方針部会資料より抜粋)
従来ワクチン(1価)による追加(4回目)接種には、どのような効果がありますか。※最終更新日:2023年3月31日
感染予防効果は短期間しか持続しなかったという報告がある一方、重症化予防効果は6週間経過しても低下せず維持されていたことや、死亡予防効果を示唆する報告があります。※令和4年(2022年)9月20日からは、4回目接種となる方も含めて、オミクロン株対応2価ワクチンによる追加接種を受けていただくこととしています。
ファイザー社の従来ワクチン(1価)は、オミクロン株流行下において、3回目接種と比較した4回目接種の感染予防効果が、60歳以上の者において短期間しか持続しなかった一方、重症化予防効果は4回目接種後6週間低下しなかったとする報告(※1)や、接種後30日間で、感染予防効果が45%、発症予防効果が55%、入院予防効果が68%、重症化予防効果が62%、死亡予防効果が74%であったとする報告(※2)、60歳から100歳の者において、死亡、入院のハザード比がそれぞれ78%、64%減少したとの報告(※3)等があります。
日本においても、新型コロナワクチンの4回目接種を受けた人を対象に接種後の健康状況に係る調査を実施しており、接種前後の抗スパイクタンパク質抗体価の推移や、一定期間内に見られた症状等を調査しています。
令和4年12月16日の中間報告によると、3回目接種を完了した人が4回目にファイザー社又はモデルナ社のワクチンを接種した場合、いずれのワクチンでも接種から1か月後と3か月後のスパイクタンパク質に対する抗体価が追加接種前と比較して上昇しており、ファイザー社の場合はそれぞれ約4.5倍と約2.8倍、モデルナ社の場合はそれぞれ約4.1倍と約2.6倍でした。
なお、それぞれの調査において、調査対象者の数、年齢分布、性別の分布が異なることから、それぞれの調査結果について、直接の比較は難しいことに留意が必要です。
武田社(ノババックス)のワクチンについては、初回(1回目・2回目)接種を終えた12~17歳と18歳以上の健康な人を対象に実施された臨床試験において、初回接種後に上昇した中和抗体価は時間の経過とともに徐々に低下するものの、同ワクチンの追加接種(3回目や4回目)により、2回目接種後に比べて高い中和抗体価(12~17歳で3回目接種後は2.7倍、18歳以上で3回目接種後は3.5倍、4回目接種後は3.7倍)が確認されたことから、一定の有効性が期待できるとされています。
なお、令和4年9月20日からは、4回目接種となる方も含めて、初回(1回目・2回目)接種を完了した方は、基本的にオミクロン株対応2価ワクチンによる追加接種を受けていただくこととしています(「令和4年秋開始接種」)。
オミクロン株対応2価ワクチンについて詳しくはこちらをご覧ください。
従来の1価ワクチンによる追加接種については、武田社(ノババックス)のワクチンを除き、令和5年(2023年)3月31日をもって終了しました。
(参考資料)
コミナティ筋注、スパイクバックス筋注の4回目接種について(令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料)
コミナティ筋注、スパイクバックス筋注の4回目接種の対応について(令和4年度第2回薬事・食品衛生審議会医薬品第二部会資料)
新型コロナワクチンの4回目接種の有効性、安全性等[2.0MB](第32回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
リーフレット「4回目接種のお知らせ(接種対象者拡大:医療従事者や高齢者施設の従事者など)」(厚生労働省)
リーフレット「令和4年秋開始接種のお知らせ」(厚生労働省)
新型コロナワクチンの追加接種後の健康状況調査(厚生労働省)
武田社ワクチン(ノババックス)の有効性、安全性等[1.3MB](第40回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社ワクチン(ノババックス)の接種について[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:N Engl J Med 2022; 386:1712-1720
(Protection by a Fourth Dose of BNT162b2 against Omicron in Israel)
※2:N Engl J Med 2022; 386:1603-1614
(Fourth Dose of BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting)
※3:Nature Medicine. 2022 April
(Effectiveness of a second BNT162b2 booster vaccine against hospitalization and death from COVID-19 in adults aged over 60 years)
従来ワクチン(1価)による追加(3回目)接種には、どのような効果がありますか。※最終更新日:2023年3月31日
3回目接種を行わなかった場合と比較して、発症予防効果や重症化予防効果等を高める効果があります。
従来の1価ワクチンについて、日本で接種が進められているワクチンは、デルタ株等に対して発症予防効果等がある一方、その効果は時間の経過に伴い、徐々に低下していくことが示唆されています。一方、3回目接種により、低下した発症予防効果や重症化予防効果等を高める効果があることが、臨床試験や様々な疫学研究等で報告されています。
イスラエルで実施された、ファイザー社の従来ワクチン(1価)(*)の接種後の情報を集めた研究では、3回目接種をした場合における入院予防効果は93%、重症化予防効果は92%、死亡に対する予防効果は81%であったと報告されています(※1)。さらに、60歳以上で3回目接種を受けた場合では、3回目接種を受けなかった場合と比較して、感染例の発生率が11.3分の1、重症例の発生率が19.5分の1であったとの報告もあります(※2)。
また、ファイザー社の従来ワクチン(1価)について、米国で実施された臨床試験の結果によると、18~55歳の被験者を対象に3回目接種を行い、血清中の新型コロナウイルスに対する中和抗体(ウイルスの感染力または毒素の活性を中和できる抗体)の推移を確認したところ、3回目の接種から1か月後の中和抗体価は、2回目の接種から1か月後の中和抗体価よりも数倍高い値であることが確認されています(※3)。
なお、ファイザー社の同ワクチンについては、日本では令和3年(2021年)11月11日に追加接種に係る薬事承認がなされています。
モデルナ社の従来ワクチン(1価)(*)については、米国で18歳以上を対象に実施された臨床試験の結果によると、3回目接種から28日後の中和抗体価は、2回目接種から28日後の中和抗体価よりも高く、本剤の3回目接種により臨床的な有効性を支持する免疫応答が認められると判断されています。日本では令和3年12月16日に追加接種に係る薬事承認がなされています。また、12~17歳を対象に実施された臨床試験の結果によると、3回目接種から28日後の中和抗体価は、18~25歳における2回目接種から28日後の成績と比較して、非劣性(劣っていないこと)を示したことが確認されています。日本では追加接種に係る対象年齢を、薬事承認上、同年12月13日から、12歳以上に拡大することとされました。
なお、モデルナ社の同ワクチンの追加接種では、初回(1回目・2回目)接種時の半分の量を投与することとされています。臨床試験では、初回接種の半分の量でも血清中の中和抗体価の上昇が認められ、必要な免疫応答が得られたことが確認されています。米国や欧州においても、追加接種では初回接種の半量を投与することで緊急使用許可又は薬事承認がなされています。
(*)武田社ワクチン(ノババックス)以外の従来ワクチン(1価)による追加接種は、令和5年(2023年)3月31日をもって終了しました。
オミクロン株に対しても、その効果はデルタ株より低下するものの、発症予防効果等が確認されていること、3回目接種によりその効果が回復することが示唆されています。詳細はこちらをご覧ください。
なお、武田社のワクチン(ノババックス)については、海外で18歳以上を対象に実施された臨床試験の結果によると、3回目接種から28日後の中和抗体価は、2回目接種から14日後の中和抗体価と比較して約4倍の上昇が認められており、薬事承認審査の過程でも、一定の有効性が期待できると判断されています。日本では令和4年(2022年)4月19日に初回接種及び3回目接種に係る薬事承認がなされています。
また、海外で12~17歳を対象に実施された臨床試験の結果によると、3回目接種から28日後の中和抗体価は、2回目接種から14日後の成績と比較して非劣性を示したことが確認されています。日本では追加接種に係る対象年齢を薬事承認上、令和5年2月28日から12歳以上に拡大することとされました。
小児(5~11歳)の3回目接種における有効性については、こちらをご覧ください。
従来ワクチン(1価)による追加接種の持続期間について、新たな知見が得られています(※5)。今後も、新たな知見が集積され次第、速やかにお知らせしていきます。
(参考資料)
PMDAの審査報告書(ファイザー社のワクチン)
PMDAの審査報告書(ファイザー社のワクチン(5~11歳用(追加接種)))
PMDAの審査報告書(モデルナ社のワクチン)
PMDAの審査報告書(武田社のワクチン(ノババックス))
追加接種の効果[2.5MB](第25回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
追加接種でモデルナ社ワクチンを用いることの有効性・安全性[800KB](第27回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
モデルナ社のオミクロン株対応2価ワクチンの対象年齢について[1.3MB](第42回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
武田社ワクチン(ノババックス)の接種について[1.8MB](第45回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:Lancet. 2021; S0140-6736(21)02249-2
(Effectiveness of a third dose of the BNT162b2 mRNA COVID-19 vaccine for preventing severe outcomes in Israel: an observational study)
※2:N Engl J Med. 2021; 385:1393-1400
(Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel)
※3:N Engl J Med. 2021; 385:1627-1629
(SARS-CoV-2 Neutralization with BNT162b2 Vaccine Dose 3)
※4:JAMA, 2022; 327(22):2210-2219
(Association of Prior BNT162b2 COVID-19 Vaccination With Symptomatic SARS-CoV-2 Infection in Children and Adolescents During Omicron Predominance.)
※5:新型コロナワクチンの追加接種の持続期間(従来型)に係る新たな知見[4.3MB](2023年度以降の新型コロナワクチンの接種の方針について<参考資料>より抜粋)
海外在住者が日本でワクチン接種を受けるにはどうしたらよいでしょうか。※最終更新日:2023年3月31日
成田空港及び羽田空港において実施されていたワクチン接種事業は、令和5年(2023年)3月29日をもって終了しました。日本に帰国後、日本国内で接種を希望される場合は、今後お住まいになる予定の自治体にご相談ください。
令和3年(2021年)8月1日より、日本国内に住民票を有しない海外在留邦人等の中で、在留先ではなく、日本に一時帰国してワクチンを接種することを希望する方々を対象に、成田空港及び羽田空港においてワクチン接種事業を実施されましたが、令和5年3月29日をもって終了しました。
海外から、日本に帰国後、日本国内で接種を希望される場合は、今後お住まいになる予定の自治体にご相談ください。
(参考資料)
日本での新型コロナウイルス・ワクチン接種を希望する海外在留邦人等の皆様へのお知らせ(外務省)
何歳になれば、従来ワクチン(1価)による追加(3回目)接種を受けられますか。※最終更新日:2023年2月9日
現時点では、従来ワクチン(1価)による3回目接種は5歳以上の方が対象です。
令和5年(2023年)2月9日時点では、従来ワクチン(1価)による3回目接種は5歳以上の方が対象です。令和4年(2022年)9月6日から、5~11歳の方も3回目接種を受けられるようになりました。
従来ワクチン(1価)による3回目接種の対象は、ファイザー社のワクチンが5歳以上の方(※)、モデルナ社のワクチンが12歳以上の方となっています。
(※)ファイザー社のワクチンは、12歳以上の方と、5~11歳の方で異なるワクチンを使用することとなるため、接種予約等の際にはご注意ください。
なお、令和4年9月20日からは、オミクロン株対応2価ワクチンの接種が開始されており、3回目の接種となる12歳以上の方は、基本的に同ワクチンの接種を受けていただくことになります。詳しくはこちらをご覧ください。
モデルナ社のワクチンは、通常、1回目から4週間後に2回目を接種することになっていますが、どのくらいずれても大丈夫ですか。※最終更新日:2023年2月9日
一番早くて21日後に接種を受けられますが、それより前には受けることができません。なお、標準の接種間隔を超えても、2回目の接種を受けることができます。
モデルナ社のワクチンは、標準として、1回目から4週間後(4週間後の同じ曜日)に2回目を接種することになっています。一番早くて21日後(3週間後の同じ曜日)に接種を受けられますが、それより前には受けることができません。
接種できる間隔の上限が定められているわけではありません。標準の接種間隔を超えても、2回目の接種を受けることができます。接種を1回目からやり直す必要はありませんので、なるべく早く、2回目の接種を受けましょう。
なお、標準の接種間隔を超えた場合のデータは限られているものの、効果は期待できることから、WHO、米国や、EUの一部の国では、4週間を超えた場合でも、1回目から6週間後までに2回目を接種することを目安として示していますので、こうした目安も参考になると考えられます。
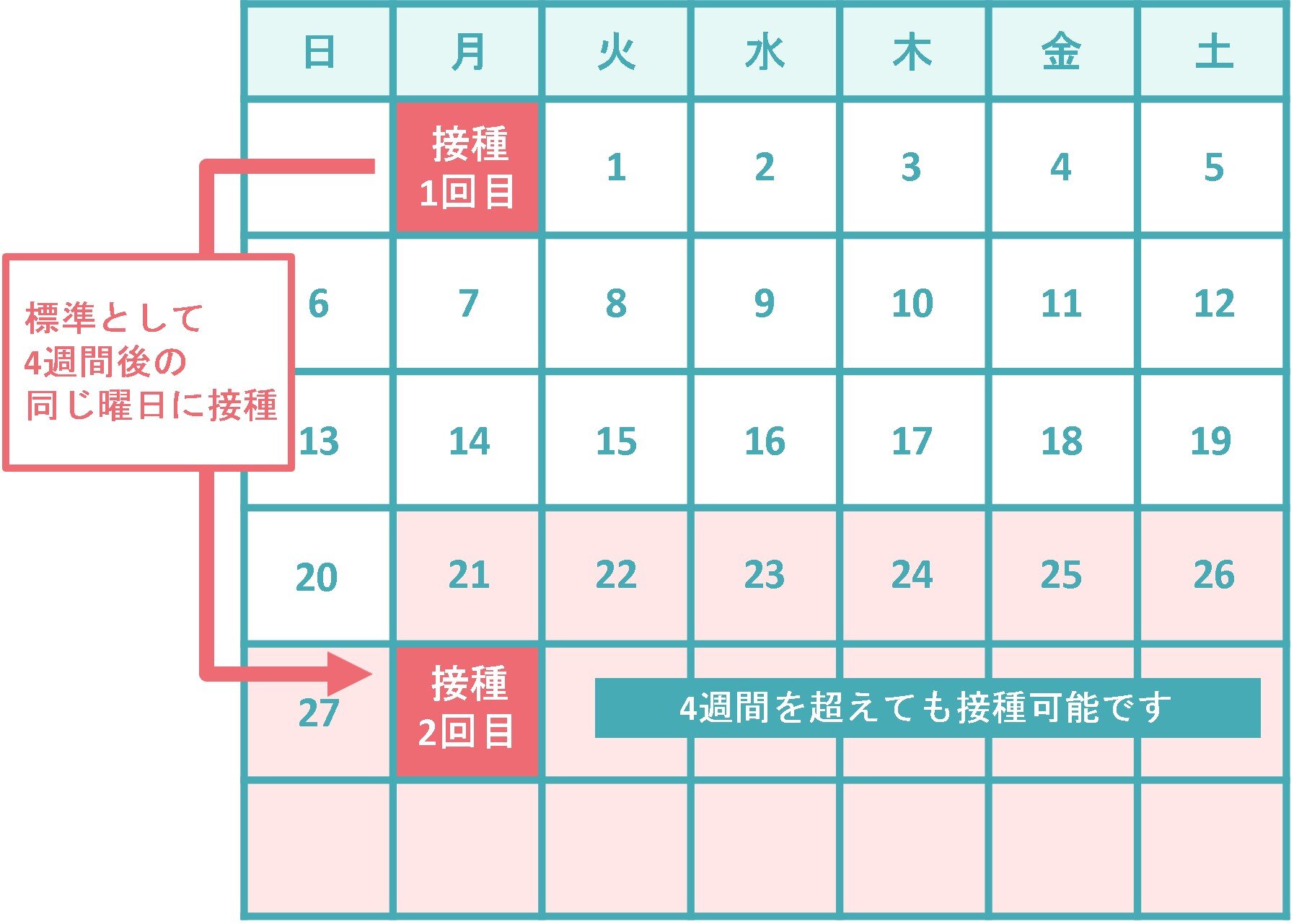
なぜ、従来の1価ワクチンによる追加(4回目)接種が必要とされたのですか。 ※最終更新日:2022年12月1日
新型コロナウイルス感染症は、高齢者ほど重症化しやすく、一定の基礎疾患を持つ方についても重症化しやすいことが明らかとなっています。このようなデータや諸外国の動向等を踏まえ、新型コロナウイルスに感染した場合の重症化予防を目的として、従来の1価ワクチンによる4回目接種を実施することとなりました。 ※令和4年(2022年)9月20日からは、4回目接種となる方も含めて、オミクロン株対応2価ワクチンによる追加接種を受けていただくこととしています。
新型コロナウイルス感染症は、高齢者ほど重症化しやすく、また、一定の基礎疾患を持つ方についても重症化しやすいことが明らかとなっています。
こうした中、従来ワクチン(1価)について、オミクロン株流行下において、60歳以上の方に対する4回目接種により、死亡予防効果が得られるという報告(※1)や、重症化予防効果は、少なくとも接種から6週間経過しても3回目接種と比較して大きく低下せず維持されていたという報告(※2)があり、重症化リスクの高い方への効果が期待されています。
また、査読前の研究結果ではありますが、安全性については、4回目接種後には軽度の全身又は局所の反応が見られたものの、現時点では、重大な副反応は認められなかったとされています(※3)。
このようなデータや諸外国の動向等を踏まえ、厚生労働省の審議会で議論した結果、新型コロナウイルスに感染した場合の重症化予防を目的として、従来ワクチン(1価)による4回目接種を実施することとなりました。
従来ワクチン(1価)による4回目接種の、効果についてはこちらを、接種対象者に関する詳細はこちらを、諸外国の対応状況についてはこちらをご覧ください。
なお、令和4年(2022年)9月20日からは、4回目接種となる方も含めて、初回(1回目・2回目)接種を完了した方は、基本的にオミクロン株対応2価ワクチンによる追加接種を受けていただくこととしています(「令和4年秋開始接種」)。
オミクロン株対応2価ワクチンについて詳しくはこちらをご覧ください。
(参考資料)
新型コロナワクチンの4回目接種の有効性、安全性等[2.0MB](第32回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの接種について(第39回厚生科学審議会予防接種・ワクチン分科会資料)
オミクロン株対応2価ワクチンの接種間隔短縮について(第39回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
リーフレット「令和4年秋開始接種のお知らせ」(厚生労働省)
※1:N Engl J Med 2022; 386:1603-1614
(Fourth Dose of BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting)
※2:N Engl J Med 2022; 386:1712-1720
(Protection by a Fourth Dose of BNT162b2 against Omicron in Israel)
※3:N Engl J Med 2022; 386:1377-1380
(Efficacy of a Fourth Dose of Covid-19 mRNA Vaccine against Omicron)
従来ワクチン(1価)による追加(4回目)接種は、3回目接種からどのくらい間隔をあけたら接種できますか。 ※最終更新日:2022年11月30日
従来ワクチン(1価)による4回目接種は、3回目接種の完了から3か月以上あけて実施します。4回目接種を実施している諸外国での状況や、添付文書の内容等を踏まえ、接種間隔は3か月以上となりました。 ※令和4年(2022年)9月20日からは、3回目以降の接種については、オミクロン株対応2価ワクチンによる接種を受けていただくこととしています。
従来ワクチン(1価)による4回目接種は、ファイザー社及びモデルナ社のワクチンでは3回目接種の完了から3か月以上あけて実施します。
また、国内においては、薬事・食品衛生審議会で有効性・安全性を検討した結果、添付文書の改訂が行われ、ベネフィットとリスクを考慮した上で、高齢者等において、ファイザー社またはモデルナ社の従来ワクチン(1価)を用いて、3回目接種から3か月以上の間隔をあけて4回目接種を判断することができるとされました。
これらを踏まえ、厚生科学審議会において3回目接種からの接種間隔は、令和4年10月21日より、3か月以上とすることが了承されました。
なお、令和4年9月20日からは、オミクロン株対応2価ワクチンの接種を開始しており、3回目以降の接種については、基本的に同ワクチンの接種を受けていただくこととなります。詳しくはこちらをご覧ください。
武田社のワクチン(ノババックス)の接種をご希望の方にも、接種の機会を設けています。詳しくはこちらをご覧ください。
ただし、追加接種については、適切な時期に接種を行うことで効果を回復させることが重要であり、単に多くの回数の接種を行うことを推奨するものではありません。単に接種回数を増やす目的で従来ワクチン(1価)による追加接種を行うことは適切ではないことにご留意ください。
(参考資料)
諸外国の4回目接種の対応状況について[746KB](第32回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
新型コロナワクチンの接種について(第39回厚生科学審議会予防接種・ワクチン分科会資料)
オミクロン株対応2価ワクチンの接種間隔短縮について(第39回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
リーフレット「令和4年秋開始接種のお知らせ」(厚生労働省)
従来ワクチン(1価)による追加(3回目)接種は、どのような人が対象になりますか。 ※最終更新日:2022年11月30日
感染拡大防止や重症化予防の観点から、初回(1回目・2回目)接種を完了したすべての方に3回目接種の機会を提供することとされています。現時点では、初回接種が完了した5歳以上の方がファイザー社、12歳以上の方がファイザー社またはモデルナ社の従来ワクチン(1価)を接種できます
厚生労働省の審議会での議論の結果、感染拡大防止や重症化予防の観点から、初回接種を完了したすべての方に対して、3回目接種の機会を提供することとされました。
日本では現在、初回接種が完了した5歳以上の方はファイザー社、12歳以上の方はファイザー社またはモデルナ社の従来ワクチン(1価)による3回目接種の対象となっています。
(※)ファイザー社の従来ワクチン(1価)は、12歳以上の方と、5~11歳の方で異なるワクチンを使用することとなるため、接種予約等の際にはご注意ください。
特に、下記に該当する方には接種をお勧めしています。
- 高齢者、基礎疾患を有する方などの「重症化リスクが高い方」
- 重症化リスクが高い方の関係者・介助者(介護従事者など)などの「重症化リスクが高い方との接触が多い方」
- 医療従事者などの「職業上の理由などによりウイルス曝露リスクが高い方」
ファイザー社の従来ワクチン(1価)は12~17歳に加え、令和4年(2022年)9月6日から、5~11歳も3回目接種の対象となりましたが、この年代の方においても、基礎疾患を有する方など、重症化リスクの高い方への接種を特にお勧めしています。
厚生労働省が示す「基礎疾患を有する者」はこちら[169KB]をご覧ください。なお、日本小児科学会からは、新型コロナワクチン接種にあたり考慮すべき小児の基礎疾患等の情報がホームページの中で示されていますので、基礎疾患をお持ちの方は、これらの情報も参考にしながら、かかりつけ医などとよく相談してください。
なお、令和4年9月20日からは、オミクロン株対応2価ワクチンの接種が開始されており、3回目の接種となる12歳以上の方は、基本的に同ワクチンの接種を受けていただくことになります。詳しくはこちらをご覧ください。
(参考資料)
諸外国における新型コロナワクチン追加接種対象者[1.1MB](第26回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
諸外国における新型コロナワクチン追加接種対象者[874KB](第27回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
追加(3回目)接種のお知らせ(厚生労働省)
新型コロナウイルスワクチン接種に関する、小児の基礎疾患の考え方および接種にあたり考慮すべき小児の基礎疾患等(日本小児科学会)
どの会社のワクチンが一番効果がありますか。 ※最終更新日:2022年11月18日
現在、日本で接種可能なワクチンは、いずれも、ワクチンを接種するメリットが、副反応のリスクを上回るため、接種をおすすめしています。
現在、日本ではファイザー社、モデルナ社、及び武田社(ノババックス)のワクチンが、予防接種法に基づく接種の対象となっています。いずれのワクチンも、海外で数万人単位の大規模な臨床試験が実施されており、発症予防効果は、2回目の接種から一定の期間において、ファイザー社のワクチンが約95%、モデルナ社のワクチンが約94%、武田社のワクチン(ノババックス)が約90%と、高い効果が確認されています。
現在、日本で接種可能なワクチンは、いずれも、ワクチンを接種するメリットが、副反応のリスクを上回るため、接種をおすすめしています。
なお、ファイザー社及びモデルナ社のワクチンについて、初回(1回目・2回目)接種後24週までの効果を比較した疫学研究の結果によると、モデルナ社のワクチンの方が、ファイザー社のワクチンよりも、感染予防、発症予防、及び重症化予防の効果が有意に高かったとの報告もあります(※)。
ここで、これらのデータはオミクロン株が流行する前のものであることに留意する必要があります。オミクロン株に対する有効性についてはこちらをご覧ください。
(参考資料)
初回シリーズにおけるモデルナ社及びファイザー社ワクチンの有効性について[1.1MB](第27回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※N Engl J Med 2021; Dec
(Comparative Effectiveness of BNT162b2 and mRNA-1273 Vaccines in U.S. Veterans)
従来ワクチン(1価)による追加(4回目)接種は、どのような人が対象になりますか。 ※最終更新日:2022年10月21日
4回目接種は、重症化予防等を目的として実施しています。3回目接種から3か月以上が経過した、(1)60歳以上の方、(2)18歳以上60歳未満で、基礎疾患を有する方や重症化リスクが高いと医師が認める方、医療従事者等及び高齢者施設等の従事者、が対象です。 ※令和4年(2022年)9月20日からは、4回目接種の対象となる方も含めて、オミクロン株対応2価ワクチンによる接種を順次開始しています。
従来ワクチン(1価)による4回目接種は、重症化予防等を目的として、令和4年5月25日から開始されています。接種対象者は、3回目接種から3か月以上が経過した下記の方となっています。
- 60歳以上の方
- 18歳以上60歳未満で、
・基礎疾患を有する方や重症化リスクが高いと医師が認める方
・医療従事者等及び高齢者施設等の従事者
新型コロナウイルスに感染すると、基礎疾患を有する方は重症化しやすいことに加え、高齢の方や妊娠している方も重症化しやすいことが科学的に明らかとなってきています(※1)。また、海外の報告によれば、喫煙や身体不活動(*)といった生活習慣がある方も重症化しやすいとされています(※2)。これらを踏まえ、接種にあたっては、医学的見地から総合的に判断される必要があります。
(*)例えば、米国では通常の人の生活と比較して、極度に運動が不足している状態の人の重症化リスクが高いという報告があります(※3)。
基礎疾患等で医療機関を受診している方や、事前に相談できる医療機関をお持ちの方は、4回目接種について、その医療機関の医師にご相談ください。事前に相談できる医療機関をお持ちでない方は、接種会場の予診の際にご相談ください。
重症化リスクが高い基礎疾患を有する者の範囲についてはこちら[169KB]をご覧ください。また、医療従事者等及び高齢者施設等の従事者の範囲についてはこちらをご覧ください。
ただし、同年9月20日からは、オミクロン株対応2価ワクチンの接種を開始しており、4回目の接種となる方は、基本的に同ワクチンの接種を受けていただくこととなります。なお、同ワクチンを使用する場合は、4回目の新型コロナワクチン接種となる場合であっても、12歳以上の全ての方が接種可能です。詳しくはこちらをご覧ください。
(参考資料)
重症化リスクの高い基礎疾患を有する者の範囲について[540KB](第32回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:新型コロナウイルス感染症(COVID-19)診療の手引き 第8.0版
※2:CDC:People with Certain Medical Conditions 2022/5/2
※3:Br J Sports Med. 2021 Oct;55(19):1099-1105.
(Physical inactivity is associated with a higher risk for severe COVID-19 outcomes: a study in 48 440 adult patients)
なぜ、従来ワクチン(1価)による追加(3回目)接種が必要とされたのですか。 ※最終更新日:2022年10月21日
日本で接種が進められているワクチンは、デルタ株等だけでなく、オミクロン株に対しても発症予防効果や重症化予防効果等が確認されていますが、その効果は経時的に低下していきます。このため、感染拡大防止及び重症化予防の観点から、初回(1回目・2回目)接種を完了したすべての方に対して、3回目接種の機会を提供することが望ましいとされています。 ※令和4年(2022年)9月20日からは、3回目接種の対象となる方も含めて、オミクロン株対応2価ワクチンによる接種を順次開始しています。
日本で接種が進められているワクチンは、デルタ株等に対して、高い発症予防効果があり、感染や重症化を予防する効果も確認されています。しかしながら、感染予防効果等は時間の経過に伴い、徐々に低下していくことが、様々な研究結果等から示唆されています。
例えば、ファイザー社の従来ワクチン(1価)を接種された人の情報を集めた米国での研究によると、12歳以上における感染予防効果は、2回目接種後1か月以内では88%であったところ、5~6か月後には47%にまで有意に低下したとの報告があります(※1)。発症予防効果についても、6か月間の追跡調査の結果、2回目接種後7日以降2か月未満では96.2%であったところ、4か月以降では83.7%であり、経時的に低下していくことが確認されています(※2)。また、入院予防効果や重症化予防効果は、2回目接種から6か月後まで維持されるとの報告(※1、※3)がある一方、60歳以上において、接種完了から半年以降で重症例の発生率に上昇傾向が見られたという報告もあります(※4)。
モデルナ社の従来ワクチン(1価)についても、発症予防効果や入院予防効果は、2回目接種から4か月以降でも90%以上であったとの報告(※5、※6、※7)がある一方、感染予防効果については、全年代において、2回目接種の約1~4か月後ではおおよそ97%であったところ、その約4か月後には80%前後に低下したという報告もあります(※6)。
アストラゼネカ社のワクチン(*)については、デルタ株に対して発症予防効果が2回目接種後2~9週で最大(66.7%)となり、その後20週以降で47.3%に低下したとの報告や、20週以降の入院予防効果や死亡予防効果の低下は限定的であったものの、高齢者や基礎疾患のある方ではより大きな入院予防効果の低下が確認されたとの報告があります(※8)。
(*)アストラゼネカ社の新型コロナワクチン「バキスゼブリア筋注」は、令和4年(2022年)9月30日をもって、接種が終了しました。
このようなデータを踏まえ、厚生労働省の審議会で議論された結果、感染拡大防止及び重症化予防の観点から、2回の接種が完了した方を対象に、従来ワクチン(1価)による3回目接種を実施することとされました。
また、オミクロン株に対しても、デルタ株と比較してその効果は低下するものの、発症予防効果等が確認されていますが、初回接種完了後、その効果は経時的に低下していくことが報告されています。オミクロン株に対する、従来ワクチン(1価)での3回目接種の効果についてはこちらをご覧ください。
小児(5~11歳)の3回目接種についてはこちらをご覧ください。
なお、令和4年9月20日からは、オミクロン株対応2価ワクチンの接種を開始しており、3回目の接種となる12歳以上の方は、基本的に同ワクチンの接種を受けていただくことになります。詳しくはこちらをご覧ください。
(参考資料)
新型コロナワクチンの効果の推移[1.9MB](第25回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:Lancet. 2021; S0140-6736(21)02183-8
(Effectiveness of mRNA BNT162b2 COVID-19 vaccine up to 6 months in a large integrated health system in the USA: a retrospective cohort study)
※2:N Engl J Med. 2021; 385:1761-1773
(Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months)
※3:N Engl J Med. 2021; Oct
(Waning of BNT162b2 Vaccine Protection against SARS-CoV-2 Infection in Qatar)
※4:N Engl J Med. 2021; Oct
(Waning Immunity after the BNT162b2 Vaccine in Israel)
※5:N Engl J Med 2021; 385:1774-1785
(Efficacy of the mRNA-1273 SARS-CoV-2 Vaccine at Completion of Blinded Phase)
※6:medRxiv. 2021; Oct
(COVID-19 Vaccine Effectiveness by Product and Timing in New York State)
※7:CDC:Morbidity and Mortality Weekly Report (MMWR)
(Comparative Effectiveness of Moderna, Pfizer-BioNTech, and Janssen (Johnson & Johnson) Vaccines in Preventing COVID-19 Hospitalizations Among Adults Without Immunocompromising Conditions -- United States, March-August 2021)
※8:medRxiv. 2021; Oct
(Vaccine effectiveness and duration of protection of Comirnaty, Vaxzevria and Spikevax against mild and severe COVID-19 in the UK)
従来ワクチン(1価)による接種について、オミクロン株にも追加(3回目)接種の効果はありますか。 ※最終更新日:2022年10月21日
オミクロン株に対する初回(1回目・2回目)接種による感染予防効果や発症予防効果は、デルタ株と比較して低下するものの、3回目接種により一時的に回復することが示唆されています。入院予防効果も、デルタ株と比較すると一定程度の低下はありますが、発症予防効果と比較すると保たれており、3回目接種で回復することが報告されています。※令和4年(2022年)9月20日からは、3回目接種の対象となる方も含めて、オミクロン株対応2価ワクチンによる接種を順次開始しています。
2021年11月末以降、日本を含む世界各地において、新型コロナウイルスのB.1.1.529系統の変異株(オミクロン株)の感染が報告されています。
従来の1価ワクチンにおける、オミクロン株に対する感染予防効果については、米国で18歳以上を対象に実施された研究によると、モデルナ社の従来ワクチンを2回接種後14~90日後には44.0%であったところ、その後経時的に低下していくことが確認されています。ここで、3回目接種により、接種から14~60日後には71.6%、61日後以降には47.4%となり、デルタ株より低いものの、感染予防効果が一時的に回復することが示唆されています(※1)。
オミクロン株に対する発症予防効果については、英国健康安全保障庁(UKHSA)の報告(2022年4月21日時点)によると、ファイザー社及びモデルナ社の従来ワクチン(1価)ではデルタ株より低く、2回目接種から2~4週間後は65~70%であったところ、25週間後までには15%程度に低下することが示されています。ここで、3回目接種により、その2~4週間後には発症予防効果が60~75%程度に高まり、一時的に回復することが示唆されています。ただし、20週後以降はその効果がほぼ見られなくなるまで低下したというデータもあり(※2)、効果の持続期間については、引き続き科学的知見を収集していく必要があります。
オミクロン株に対する入院予防効果については、ワクチンの種類毎に解析はなされていないものの、3回目接種から105日以降では、18~64歳で67.4~75.9%、65歳以上で85.3~86.8%というUKHSAの報告(※2)や、3回目接種後の発症予防効果や入院予防効果は、オミクロン株BA.1とBA.2に対して同様であったとの報告もあります(※3)。
小児(5~11歳)の3回目接種における、オミクロン株に対する有効性については、こちらをご覧ください。
なお、令和4年9月20日からは、オミクロン株対応2価ワクチンの接種が開始されており、3回目の接種となる12歳以上の方は、基本的に同ワクチンの接種を受けていただくことになります。詳しくはこちらをご覧ください。
(参考資料)
オミクロン株に対する新型コロナワクチンの有効性等[1.6MB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
「オミクロン株対応ワクチン」について[2.9MB](第33回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
※1:Nature Medicine. 2022 February
(Effectiveness of mRNA-1273 against SARS-CoV-2 Omicron and Delta variants)
※2:COVID-19 vaccine surveillance report Week 16 UK Health Security Agency 2022/4/21
※3:medRxiv. 2022; March
(COVID-19 Vaccine Effectiveness against the Omicron BA.2 variant in England)
追加(3回目)接種はどのようにしたら受けられますか。 ※最終更新日:2022年10月21日
お住まいの市区町村から3回目接種用の接種券等が送付されます。初回(1回目・2回目)接種時と同様、実施している医療機関や会場をお探しの上、予約をお願いします。
お住まいの市区町村から3回目接種用の接種券等が送付されます。自治体からのお知らせをご確認いただき、初回接種時と同様、接種を実施している医療機関や会場をお探しの上、予約をお願いします。
接種時には、初回接種時と同様、送付された接種券等一式と本人確認書類(マイナンバーカード、運転免許証、健康保険証等)をお持ちになり、受付で提示してください。初回接種時の接種券は使用できませんので、まだお手元に残っている場合は、間違えてお持ちにならないようご注意ください。
2回目の接種完了から3か月以上経過したにもかかわらず、ご自宅に接種券が届かない場合は、お住まいの市区町村へお問い合わせください。また、引っ越し等で住民票所在地が変更になった場合等は、接種券の発行申請が必要になります。(一部の市区町村では、申請なしで接種券が送付される場合もあります。)詳細はこちらをご覧ください。
海外ではどのような人に追加(4回目)接種が行われていますか。 ※最終更新日:2022年10月14日
4回目接種の開始を決定している諸外国では、対象者を重症化リスクの高い者等に限定しています。
諸外国においては4回目接種の開始を決定している国が増加しており、これらの国では対象者を重症化リスクの高い者等に限定しています。3回目接種から4回目接種までの間隔は、国によってばらつきがあります。
例えば米国では、追加接種から4か月以上が経過した、50歳以上の者、12歳以上の中等度から重度の免疫不全者等が対象となっています。
また、英国では、追加接種から6か月以上が経過した、75歳以上の者、介護施設に居住する高齢者、12歳以上の免疫不全者等が対象となっています。
(2022年7月20日時点)
海外でのオミクロン株対応2価ワクチンの使用状況については、こちらをご覧ください。
(参考資料)
諸外国の4回目接種の対応状況について[639KB](第33回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
海外ではどのくらい、従来ワクチン(1価)による追加(3回目)接種が行われているのでしょうか。 ※最終更新日:2022年10月14日
既に複数の国で、従来ワクチン(1価)による3回目接種が行われています。
海外では、2021年7月にイスラエルで3回目接種が開始されているほか、同年8月以降には、米国や英国等、複数の国で従来ワクチン(1価)による3回目接種が行われています。
ファイザー社のワクチンによる3回目接種については、令和4年(2022年)3月23日時点で、米国やフランス、ドイツ、イスラエルでは12歳以上の者を対象に推奨している一方、英国では16歳以上の者及び12~15歳のうち重症化リスクの高い者等、カナダでは18歳以上の者及び12~17歳のうち重症化リスクの高い者等に対して推奨しています。
モデルナ社のワクチンによる3回目接種については、令和4年3月23日時点で、米国や英国、イスラエルでは18歳以上の者、フランスやドイツでは30歳以上の者、カナダでは18歳以上の者及び12~17歳のうち重症化リスクの高い者等に対して推奨しています。
小児(5~11歳)に対するファイザー社のワクチンによる3回目接種については、令和4年8月31日時点で、米国とイスラエルではすべての小児を対象に推奨している一方、ドイツでは基礎疾患をもつ小児にのみ接種が推奨されています。また、カナダでは重症化リスクが高い基礎疾患を持つ小児に3回目接種を推奨しており、その他の小児についても接種できる、としています。
海外でのオミクロン株対応2価ワクチンの使用状況については、こちらをご覧ください。
(参考資料)
諸外国における新型コロナワクチン追加接種の状況[615KB](第31回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
諸外国における新型コロナワクチン追加接種の状況等[2.0MB](第32回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
5-11歳児への新型コロナワクチン追加接種に関する諸外国の推奨状況[1.8MB](第36回厚生科学審議会予防接種・ワクチン分科会資料より抜粋)
ファイザー社のワクチンと、モデルナ社のワクチンの安全性には違いがありますか。 ※最終更新日:2022年10月14日
いずれも、安全性を確認した上で承認され、世界各国で接種されています。接種後の軽い副反応については、症状ごとの頻度等に多少の違いがみられます。
ファイザー社のワクチンとモデルナ社のワクチンは、いずれも臨床試験で安全性を確認した上で承認され、既に世界各国で接種されています。
接種後の主な副反応として、いずれのワクチンも、接種部位の痛み、疲労、頭痛、筋肉痛、悪寒、関節痛等が報告されています。異なる臨床試験の結果を単純に比較することはできませんが、臨床試験の結果では、モデルナ社のワクチンの方がこれらの副反応の発生頻度が5~20ポイント程度高く報告されているほか、接種から1週間くらい経った後に、接種した場所の痛みや腫れなどがみられる遅延性の皮膚反応(いわゆる「COVIDアーム」又は「モデルナアーム」)が報告されています。こうした症状の大部分は接種後数日以内に回復しています。さらに、いずれのワクチンも高い有効性があることを踏まえると、こうした軽い副反応の頻度の違いを重視するよりも、いずれかのワクチンを接種できる時に接種することをお勧めします。
また、いずれのワクチンも、添加剤の中に、稀なアレルギー反応との関連が懸念されているポリエチレングリコール(PEG)が含まれています。国内における接種開始後の副反応の発生状況については、副反応疑い報告や健康状況調査等を行い、引き続き評価を行っていくことになります。
なお、接種された人の属性がワクチンの種類ごとに異なることに留意が必要であるものの、ファイザー社及びモデルナ社のワクチンでは、頻度としてはごく稀ですが、心筋炎や心膜炎を疑う事例が報告されており、特に10代及び20代の男性では、ファイザー社よりもモデルナ社のワクチンにおける報告頻度の方が高いことが確認されています。詳細はこちらをご覧ください。
なお、従来の1価ワクチンによる追加(3回目)接種における安全性についてはこちらを、オミクロン株対応2価ワクチンにおける安全性についてはこちらをご覧ください。
追加(4回目)接種はどのようにしたら受けられますか。 ※最終更新日:2022年6月21日
4回目接種では、接種券の配布方法が自治体によって異なります。お住まいの市区町村からのお知らせをよくご確認ください。
初回(1回目・2回目)接種や3回目接種では、接種対象者に対し、お住まいの市区町村から接種券等一式が送付されましたが、4回目接種の場合は、接種券の配布方法が自治体によって異なります。お住まいの市区町村からのお知らせをよくご確認ください。
一部の自治体においては、コロナワクチンナビでも4回目接種用接種券の発行申請が可能です。
なお、接種時には、初回接種や3回目接種と同様、接種券等一式と本人確認書類(マイナンバーカード、運転免許証、健康保険証等)を忘れずにお持ちください。
海外への留学を予定している人は、ワクチンを優先的に接種できますか。 ※最終更新日:2021年10月31日
渡航先でワクチン接種が必要とされている海外留学予定者に対しては、文部科学省において、大学拠点接種の枠組みの中で接種を受けられるよう支援する事業を行っています。
渡航先でワクチン接種が必要とされている海外留学予定者に対しては、文部科学省において、大学拠点接種の枠組みの中で接種を受けられるよう支援する事業を行っています。
ワクチン接種案内、接種記録保有証明(英語)を希望される方は、文部科学省のホームページをご覧ください。
なお、令和3年(2021年)10月31日をもって、新規の申請受付は終了しています。
(参考資料)
ワクチン接種が留学先から求められている今秋留学予定の皆さんへ(文部科学省)
私は65歳以上ですが、ワクチンを接種することができますか。 ※最終更新日:2021年8月3日
65歳以上の方は接種対象です。新型コロナウイルス感染症の重症化リスクが高いため、初回(1回目・2回目)接種では、早い優先順位で接種することとされました。
65歳以上の方は接種対象です。高齢者の方は、新型コロナウイルス感染症の重症化リスクが高いため、初回(1回目・2回目)接種では、早い優先順位で接種することとされました。現在使用されているファイザー社、モデルナ社及び武田社(ノババックス)の新型コロナワクチンでは、65歳以上の高齢者も参加した国内外の臨床試験のデータを踏まえて、医薬品医療機器総合機構(PMDA)での審査、薬事・食品衛生審議会の専門家による審議を経て、有効性・安全性を確認しています。



