特定細胞加工物等製造施設について(概要)
再生医療等の安全性の確保等に関する法律(以下「法律」という。)に基づく特定細胞加工物等製造事業者及び特定細胞加工物等製造施設について紹介しています
※各種届出や報告の詳細については「特定細胞加工物等製造施設に関する手続きについて[718KB]」をご参照ください。
※各種届出や報告の詳細については「特定細胞加工物等製造施設に関する手続きについて[718KB]」をご参照ください。
1.特定細胞加工物等製造施設とは?
特定細胞加工物等製造施設とは、特定細胞加工物の製造をする施設です。
(※再生医療等製品として製造する場合を除く)
(※再生医療等製品として製造する場合を除く)
用語の定義について
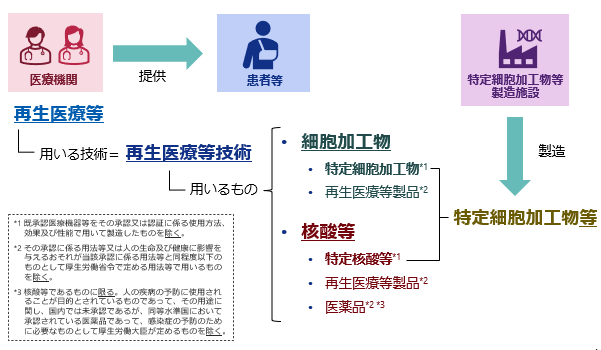
- 法において「特定細胞加工物等」とは、「特定細胞加工物」及び「特定核酸等」をいいます。(法第2条第6項)
- 特定細胞加工物等について「製造」とは、以下を指します。
- 「特定細胞加工物」・・・人又は動物の細胞に培養その他の加工を施すこと
- 「特定核酸等」・・・化学合成その他の方法により生成すること
- 「特定細胞加工物等製造施設」とは、特定細胞加⼯物等の製造をする施設をいいます。
- 「特定細胞加工物等製造事業者」とは、法に基づく許可(第35条第1項)若しくは認定(法第39条第1項)を受けた者又は届出(法第40条第1項)をした者をいいます。
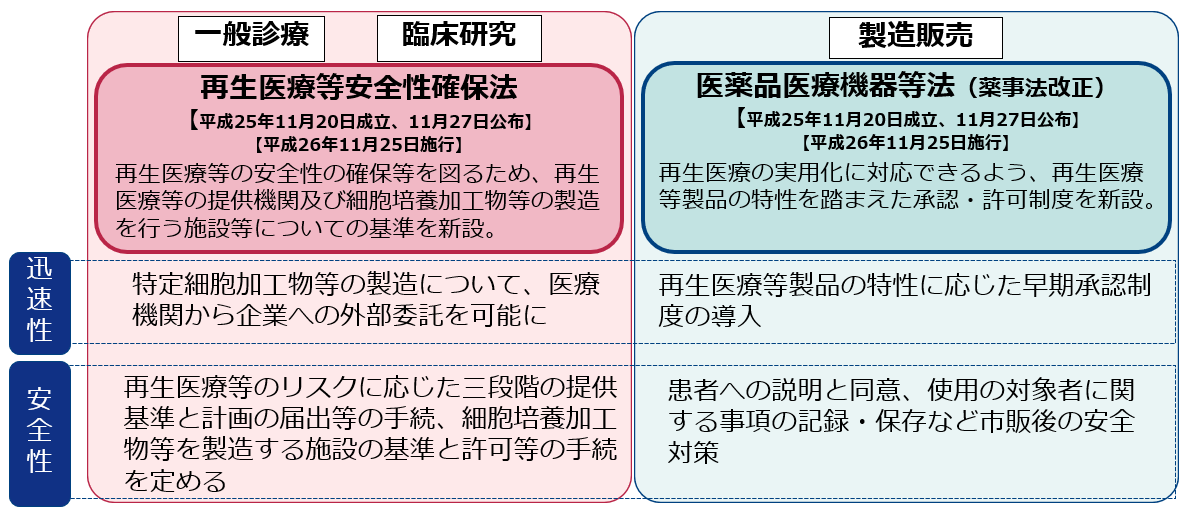
2.再生医療等安全性確保法と医薬品医療機器等法における取扱い
再生医療等安全性確保法と医薬品医療機器等法におけるの特定細胞加工物等取扱いは以下のとおりです。
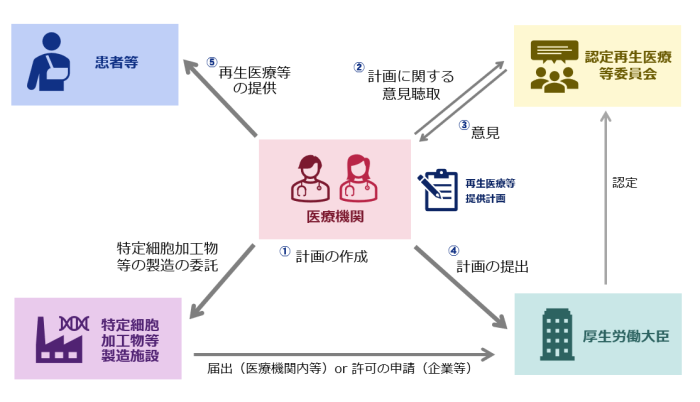
3.特定細胞加工物等製造施設及び製造事業者等の遵守事項
届出・許可・認定に関する手続き
- 第72条 特定細胞加工物等の製造の許可の申請
- 第73条 特定細胞加工物等の製造の許可証の交付
- 第74条 許可事業者の届出を要する変更の範囲
- 第75条 許可事業者の変更の届出
- 第76条 特定細胞加工物等の製造の許可証の書換え交付の申請
- 第77条 特定細胞加工物等の製造の許可証の再交付
- 第78条 特定細胞加工物等の製造の許可の更新の申請
- 第79条 製造の許可証の返納
- 第80条 特定細胞加工物等の製造の許可台帳
- 第81条 機構に対する特定細胞加工物等の製造の許可又は許可の更新に係る調査の申請
- 第82条 機構による特定細胞加工物等の製造の許可等に係る調査の結果の通知
- 第83条 外国における特定細胞加工物等の製造の認定の申請
- 第84条 準用
- 第85条 特定細胞加工物等の製造の届出
- 第86条 届出事業者の届出を要する変更の範囲
- 第87条 届出事業者の変更の届出
- 第88条 廃止の届出
構造設備基準、遵守事項等
- 第89条 細胞培養加工施設の構造設備
- 第90条 施設管理者の基準
- 第91条 特定細胞加工物等製造事業者の遵守事項
-
- 第92条~110条までに定める。
- 第92条 品質リスクマネジメント
- 第93条 製造部門及び品質部門
- 第94条 施設管理者
- 第95条 職員
- 第96条 特定細胞加工物等標準書
- 第97条 手順書等
- 第98条 特定細胞加工物等の内容に応じた構造設備
- 第99条 製造管理
- 第100条 品質管理
- 第101条 特定細胞加工物等の取扱い
- 第102条 検証又は確認
- 第103条 特定細胞加工物等の品質の照査
- 第104条 変更の管理
- 第105条 逸脱の管理
- 第106条 品質等に関する情報及び品質不良等の処理
- 第107条 重大事態報告等
- 第108条 自己点検
- 第109条 教育訓練
- 第110条 文書及び記録の管理
- 第111条 特定細胞加工物等の製造に関する記録に関する事項
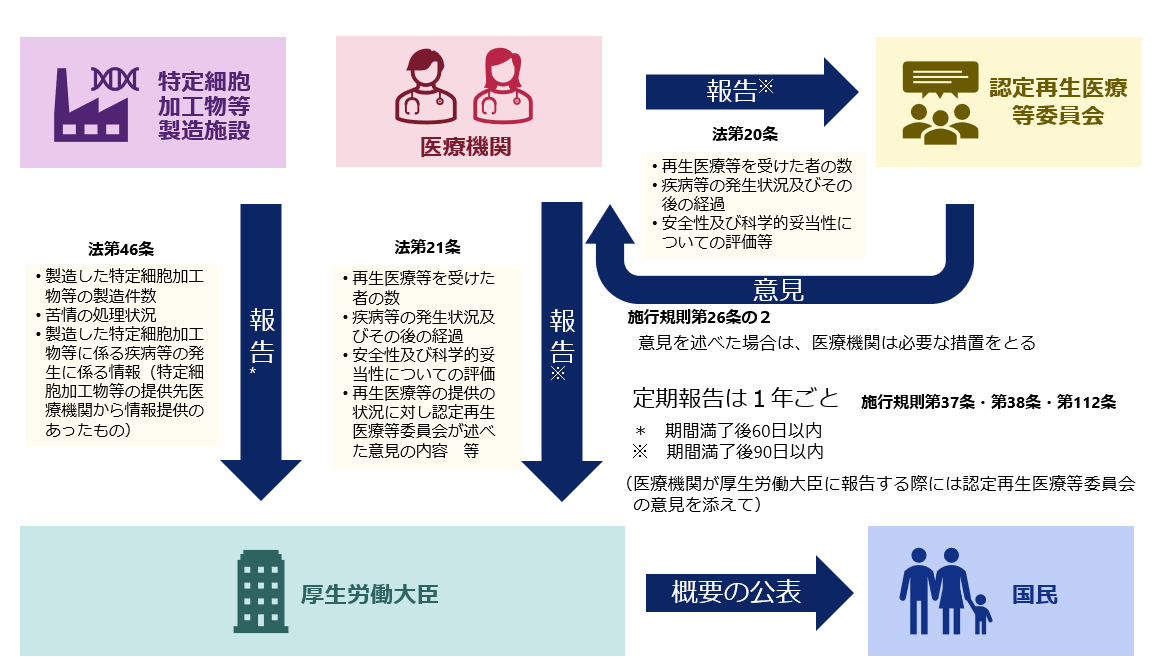
- 第112条 定期報告
4.特定細胞加工物等の製造の手続きについて
特定細胞加工物等製造施設で特定細胞加工物等を製造しようとする場合、施設毎にあらかじめ手続きが必要です。
| 必要な手続きの種類 | |||
| 届出 | 許可 | 認定 | |
| 対象 | 国内の医療機関内で製造を行おうとする場合 | 国内の医療機関外で製造を行おうとする場合 | 国外で製造を行おうとする場合 |
| 必要な手続(新たに製造を行う場合) |
|
|
|
| 提出先 | 管轄の地方厚生局 | 厚生労働省 | |
※ 変更、更新、廃止、許可証/認定証の再交付又は書換えについても必要に応じて手続きを行うこと。
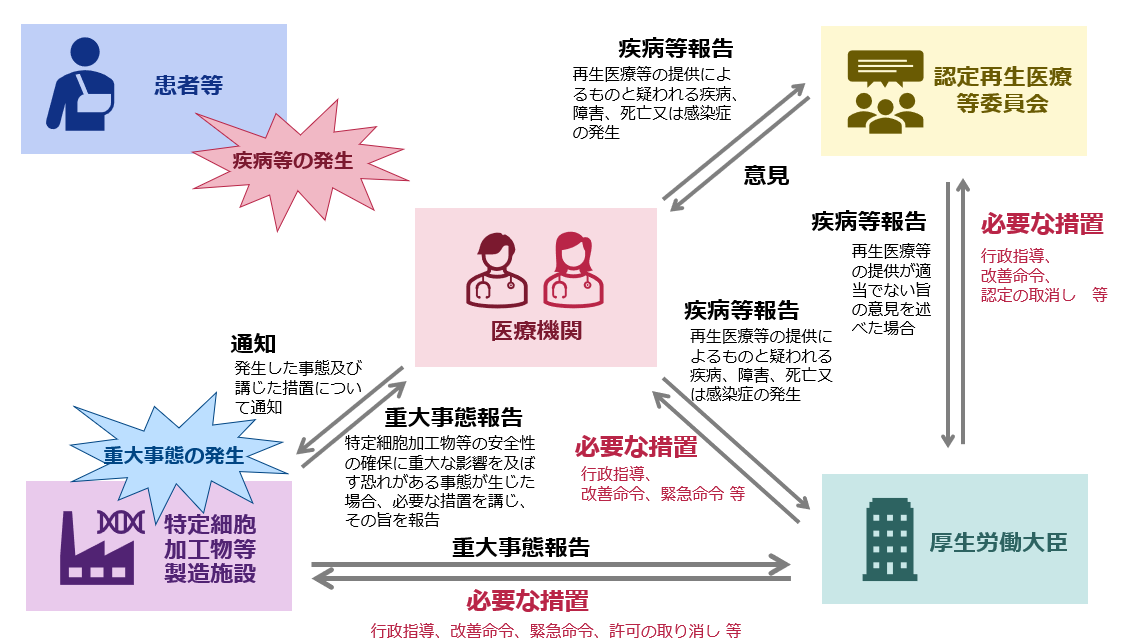
5.重大事態報告
重大事態が生じた場合には厚生労働大臣に速やかに報告が必要です。
特定細胞加工物等製造事業者は、特定細胞加工物等の安全性の確保に重大な影響を及ぼすおそれがある事態(重大事態)が生じた場合には、必要な措置を講ずるとともに、その旨を速やかに特定細胞加工物等の提供先の再生医療等提供機関及び厚生労働大臣に報告しなければなりません。(省令第107条)
6.定期報告
毎年の定期報告を忘れずに行って下さい。
特定細胞加工物等製造事業者は、以下の特定細胞加工物等の製造の状況について、定期的に、厚生労働大臣に報告する必要があります。(法律第46条・省令第112条)
-
特定細胞加工物等の製造件数
-
苦情の処理状況
-
特定細胞加工物等の提供先の再生医療等提供機関から通知を受けた疾病等の発生に係る次に掲げる情報
-
疾病等の発生があった年月日
-
疾病等の発生に対する措置状況
-
特定細胞加工物等製造事業者による対策等
-
※ 上記の報告は、許可又は認定を受けた日若しくは届出をした日から起算して、1年ごとに、当該期間満了後60日以内に行わなければなりません。
7.罰則等
届出や許可申請を行わずに特定細胞加工物等の製造を行った場合は法に基づく罰則が適用されます。
罰則 (特定細胞加工物等の製造関係)
6月以下の拘禁刑又は30万円以下の罰金
- 許可を受けないで、特定細胞加工物等の製造を行った場合
- 緊急命令に違反した場合
- 許可を受けた事業者が改善命令に違反した場合 他
- 特定細胞加工物等の製造の届出を行わないで、又は虚偽の届出をして、特定細胞加工物等の製造をした場合
- 改善命令に違反した場合(許可事業者を除く)
- 立入検査を拒み、妨げ、若しくは忌避し、又は質問に対し正当な理由なしに答弁せず、若しくは虚偽の答弁をした場合 等



