医薬品等の緊急承認制度について
Q1 自分が使用している医薬品等が緊急承認されたものかはどのように調べれば良いですか?
A1
厚生労働省のHPに緊急承認された医薬品等の一覧が掲載される予定です。
また、使用する医薬品等の添付文書や、その他の資料を用いての周知広報もなされる予定です
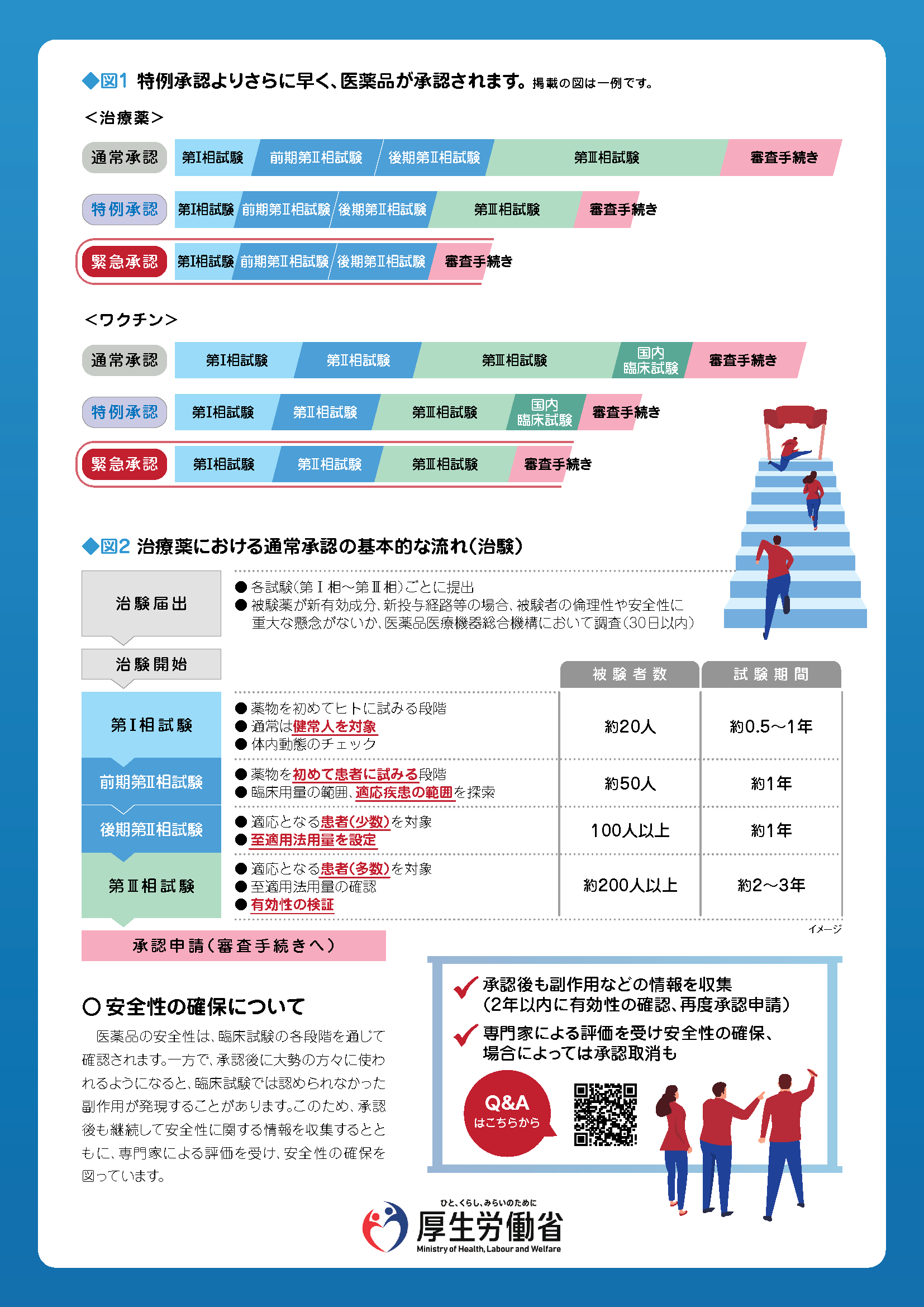
Q2 有効性が推定された段階で緊急承認されるとのことですが、その後、緊急承認された医薬品等の有効性はいつ確認されるのでしょうか。
A2
緊急承認は一定の期限(原則として最大2年)を付して行われます。緊急承認された医薬品等の製造販売業者は、その間に有効性を確認するための臨床試験等を行い、再度承認申請することが求められます。
Q3 治験の被験者数について、リーフレットに掲載されている人数では有効性の推定、安全性の確認ができないのではないでしょうか?
A3
リーフレットに掲載している治験の被験者数は「治験の在り方に関する検討会」(平成17年3月29日開催)で示した一例であり、対象疾病や医薬品等の特徴に応じ、より大規模な臨床試験が求められる場合もあります。有効性の推定・安全性の確認にあたっては、治験を行う企業と医薬品医療機器総合機構(PMDA)の相談の中で、必要十分な被験者数を求めていきます。
Q4 緊急承認したものの、有効性の確認が出来なかった医薬品等はどうなりますか?
A4
有効性の確認が出来なかった医薬品等は承認が取り消されます。
Q5 緊急承認された医薬品の副作用により健康被害が発生した場合は補償されるのでしょうか?
A5
医薬品の副作用による健康被害を救済するための制度として「医薬品副作用被害救済制度」があります(詳しくは以下のサイトをご覧ください)。緊急承認された医薬品もこの制度の対象となります。
https://www.pmda.go.jp/kenkouhigai_camp/
※救済制度の対象となる医薬品や健康被害には一定の要件があり、救済給付の支給決定に当たっては専門家による判定が行われます。
※医薬品のほか、再生医療等製品や生物由来製品(生物に由来する原材料を用いた医薬品や医療機器)についても同様の制度があります。
お問い合わせ先
医薬・生活衛生局医薬品審査管理課(2735)