再生医療等提供計画の提出等について(概要)
1.再生医療等提供機関が行うべき手続の概要
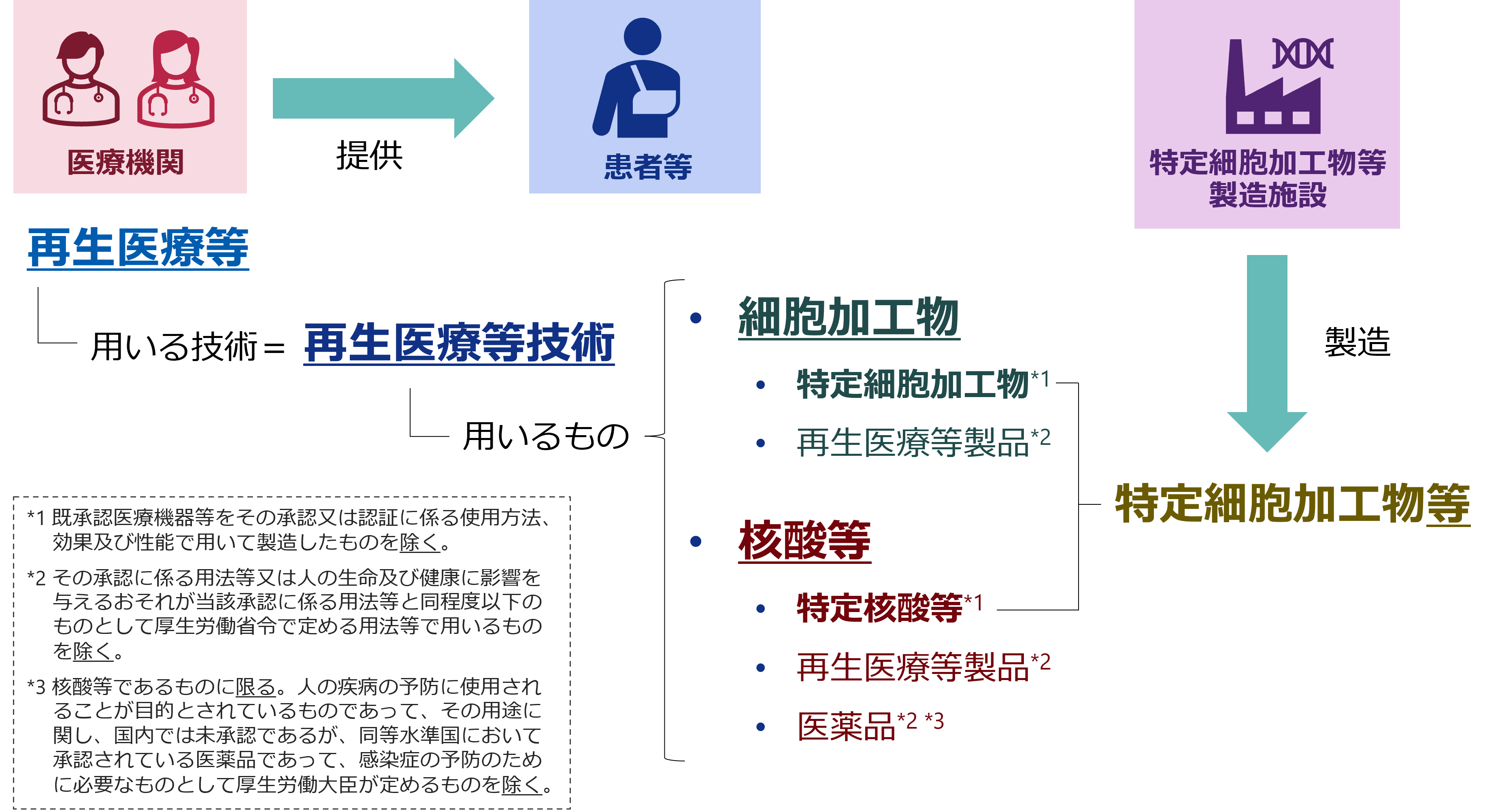
再生医療等安全性確保法における用語の概念について
| 用語 | 定義 |
| 再生医療等 | 再生医療等技術を用いて行われる医療 (医薬品医療機器等法第80条の2第2項に規定する治験に該当するものを除く。) |
| 再生医療等技術 | 人の身体の構造若しくは機能の再建、修復若しくは形成又は人の疾病の治療若しくは予防に用いられることが目的とされている医療技術であって、次のうち、その安全性の確保等に関する措置その他のこの法律で定める措置を講ずることが必要なものとして政令で定めるもの
|
| 細胞加工物 | 人又は動物の細胞に培養その他の加工を施したもの |
| 細胞 | 細胞加工物の原材料となる人又は動物の細胞 |
| 核酸等 | 人の体内で当該人の細胞に導入される核酸並びに核酸及びその他の遺伝子の発現と密接な関係を有する物を加工するための機能を有する物(これらを含有する物を含む。) |
| 特定細胞加工物 | 再生医療等に用いられる細胞加工物のうち再生医療等製品であるもの以外のもの |
| 特定核酸等 | 再生医療等に用いられる核酸等のうち医薬品及び再生医療等製品であるもの以外のもの |
| 特定細胞加工物等 | 「特定細胞加工物」及び「特定核酸等」 |
*2 核酸等として医薬品又は再生医療等製品のみをそれぞれその承認に係る用法等又は人の生命及び健康に影響を与えるおそれが当該承認に係る用法等と同程度以下のものとして厚生労働省令で定める用法等で用いるものを除く。
| 用語 | 定義 |
| 細胞加工物における「加工」 | 細胞・組織の人為的な増殖・分化、細胞の株化、細胞の活性化等を目的とした薬剤処理、生物学的特性改変、非細胞成分との組み合わせ又は遺伝子工学的改変等を施すことをいう。組織の分離、組織の細切、細胞の分離、特定細胞の単離*3、抗生物質による処理、洗浄、ガンマ線等による滅菌、冷凍、解凍等は「加工」とみなさない*4。 *3 薬剤等による生物学的・化学的な処理により単離するものを除く。 *4 ただし、本来の細胞と異なる構造・機能を発揮することを目的として細胞を使用するものについてはこの限りではない。 |
| 核酸等の「導入」 | 遺伝子の発現に必要な遺伝情報を有する核酸、当該核酸を加工するための機能を有する物又はヒストンを加工するための機能を有する物等を、必要に応じて細胞内に能動的に送達する技術等を用いて人に投与し、その細胞内に取り込ませることをいう。 免疫応答を惹起する目的で外来遺伝子の挿入のない微生物(継代培養し弱毒化したものを含む。)を人に投与する場合はこれに含まない。 |
再生医療等安全性確保法で用いられる用語の概念(イメージ)
再生医療等安全性確保法の対象となる再生医療等技術(イメージ)

再生医療等安全性確保法の対象とならない医療技術
細胞加工物を用いる再生医療等技術から除外される医療技術(再生医療等の安全性の確保等に関する法律施行令(平成26年8月8日政令第278号。以下、「施行令」という。)第1条第1号)
- 細胞加工物を用いる輸血
遺伝子を導入した血球成分又はiPS細胞等から作製された血球成分を用いるものを除く。
- 造血幹細胞移植
遺伝子を導入した造血幹細胞又はiPS細胞等から作製された造血幹細胞を用いるものを除く。
- 生殖補助医療(人の精子若しくは未受精卵又は人の精子と未受精卵との受精により生ずる胚に培養その他の加工を施したものを用いる医療技術)
人から採取された人の精子及び未受精卵から樹立された胚性幹細胞又は当該胚性幹細胞に培養その他の加工を施したものを用いるものを除く。
- 適応症を含む承認又は認証を取得した医療機器で作製した細胞加工物を用いる再生医療等技術
既承認医療機器等を当該承認又は認証に係る使用方法等で用いて人又は動物の細胞に培養その他の加工を施した細胞加工物のみを当該使用方法等で用いる医療技術
核酸等を用いる再生医療等技術から除外される医療技術(施行令第1条第2号)
- 適応症を含む承認又は認証を取得した医療機器で生成した核酸等を用いる再生医療等技術
既承認医療機器等を当該承認又は認証に係る使用方法等で用いて生成した核酸等のみを当該使用方法等で用いる医療技術
- 医薬品のうち、人の疾病の予防に使用されることが目的とされているものであって、その用途に関し、外国において、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列することが認められている核酸等*のみを用いる医療技術
* 感染症の予防のために必要なものとして厚生労働大臣が定める核酸等に限る。
2.リスクに応じた再生医療等提供の手続き
再生医療等安全性確保法では、再生医療等技術を第一種再生医療等技術、第二種再生医療等技術又は第三種再生医療等技術の3つに分類し、それぞれに応じた手続を定めています。
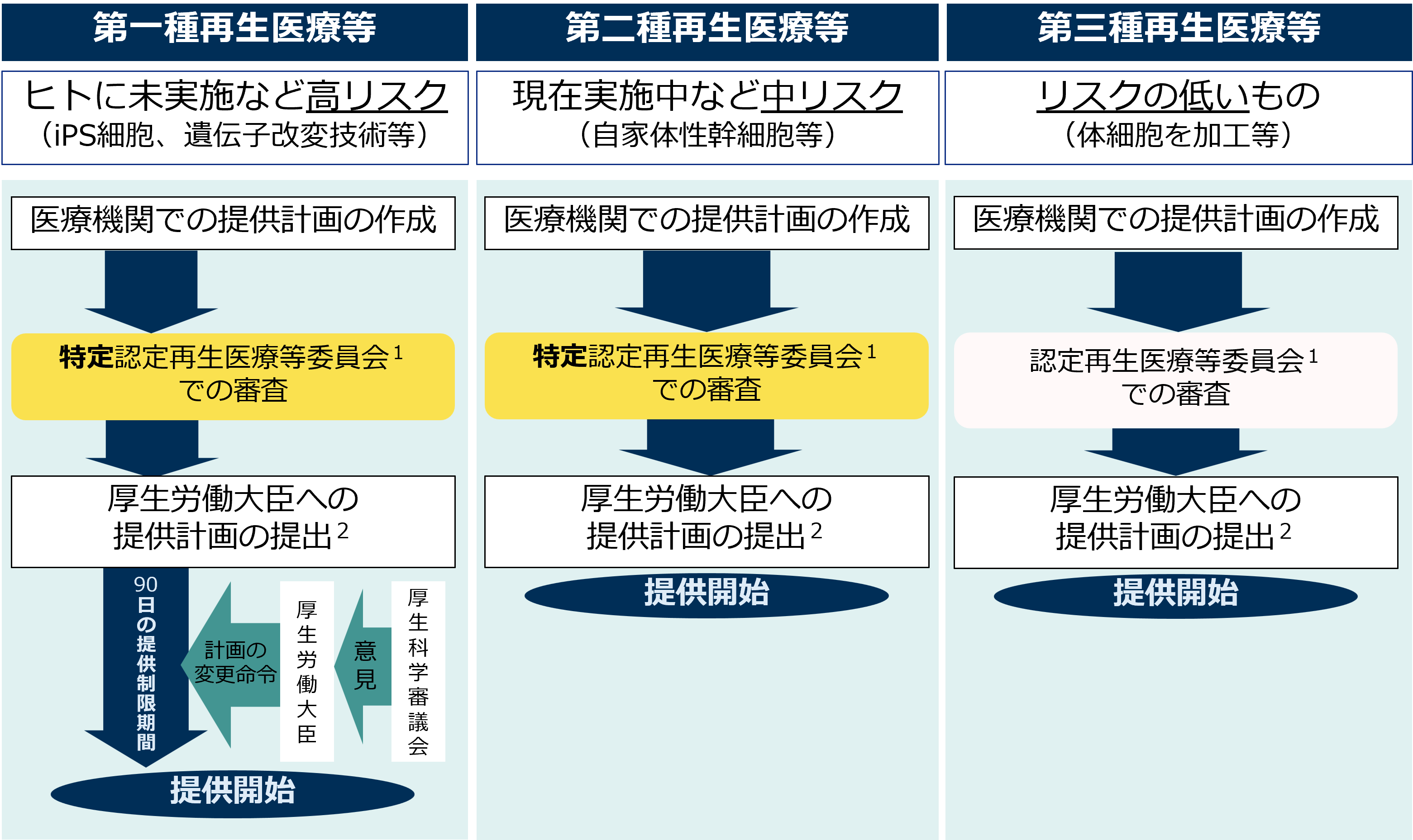
(注1)「認定再生医療等委員会」とは、再生医療等技術や法律の専門家等の有識者からなる合議制の委員会で、一定の手続により厚生労働大臣の認定を受けたものをいい、「特定認定再生医療等委員会」は、認定再生医療等委員会のうち、特に高度な審査能力、第三者性を有するもの。
(注2) 厚生労働大臣への提供計画の提出の手続を義務付ける。提供計画を提出せずに再生医療等を提供した場合は、再生医療等安全性確保法違反となる。
再生医療等技術のリスク分類
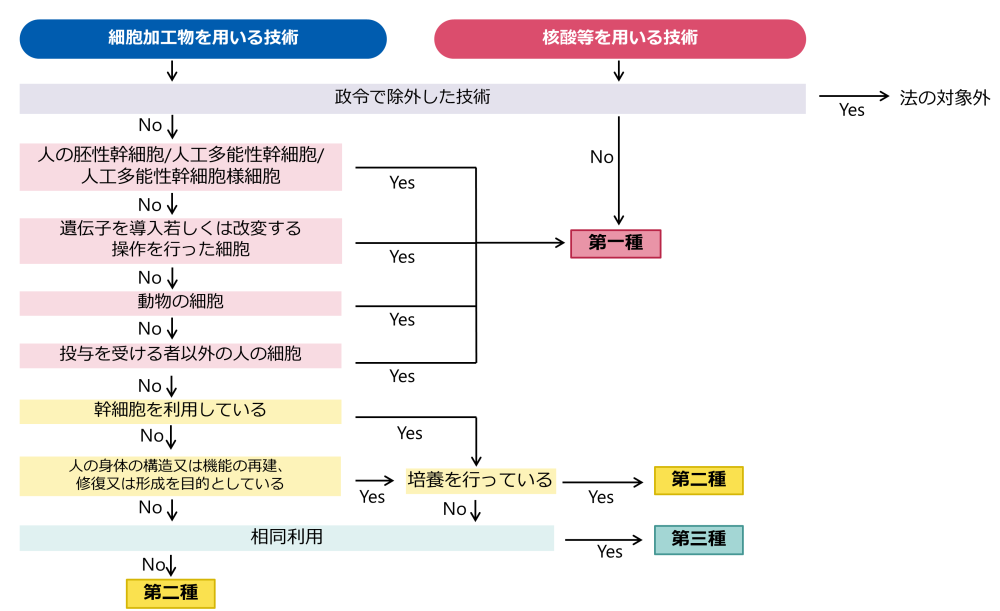
※相同利用・・・「相同利用」については、採取した細胞が再生医療等を受ける者の再生医療等の対象となる部位の細胞と同様の機能を持つ細胞加工物の投与方法をいい、例えば、腹部から脂肪細胞を採取し、当該細胞から脂肪組織由来幹細胞を分離して、乳癌の術後の患部に乳房再建目的で投与することは相同利用に該当するが、脂肪組織由来幹細胞を糖尿病の治療目的で経静脈的に投与することは、脂肪組織の再建を目的としていないため相同利用には該当しない。また、末梢血を遠心分離し培養せずに用いる医療技術については、例えば、皮膚や口腔内への投与は相同利用に該当するが、関節腔内等、血流の乏しい組織への投与は相同利用に該当しない。
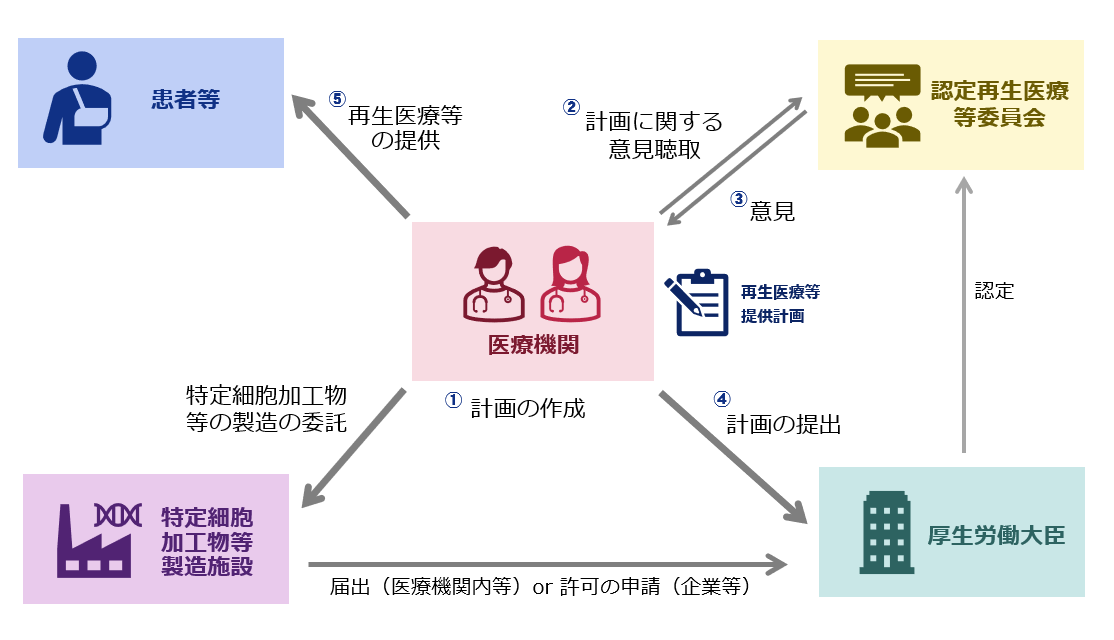
再生医療等提供計画の手続等のイメージ
研究として再生医療等を行う場合
 |
研究として再生医療等を行う場合は「jRCT(臨床研究等提出・公開システム)」から各種申請書を提出してください。 jRCT内に登録したデータは公表されます(添付資料を除く※) ※マスキングされた説明同意文書のみ公表対象 |
研究以外で再生医療等を行う場合
 |
研究以外で再生医療等を行う場合は「e-再生医療(再生医療等の各種申請等のオンライン手続サイト)」から各種申請書を提出してください。 |
計画の変更
再生医療提供計画を変更する場合には、1.認定再生医療等委員会の意見を聴いた上で、あらかじめ提出が必要な変更事項、2.変更から10日以内に届出が必要な軽微な変更事項があります。
認定再生医療等委員会の意見を聴いた上で、あらかじめ提出が必要な変更事項(法第5条第1項、再生医療等の安全性の確保等に関する法律施行規則(平成6年厚生労働省令第110号。以下「施行規則」という。)第28条)
- 再生医療等の安全性に影響を与える提供方法の変更
- 特定細胞加工物等を用いる場合、再生医療等の安全性に影響を与える特定細胞加工物等の製造及び品質管理方法の変更
- 医薬品又は再生医療等製品を承認の内容に従わず用いる変更
- 再生医療等が研究として行われる場合にあっては、研究の実施方法の変更
- その他、再生医療等の安全性に影響を与えるもの
届出が必要な軽微な変更事項(法第5条第3項、施行規則第29条・第30条)
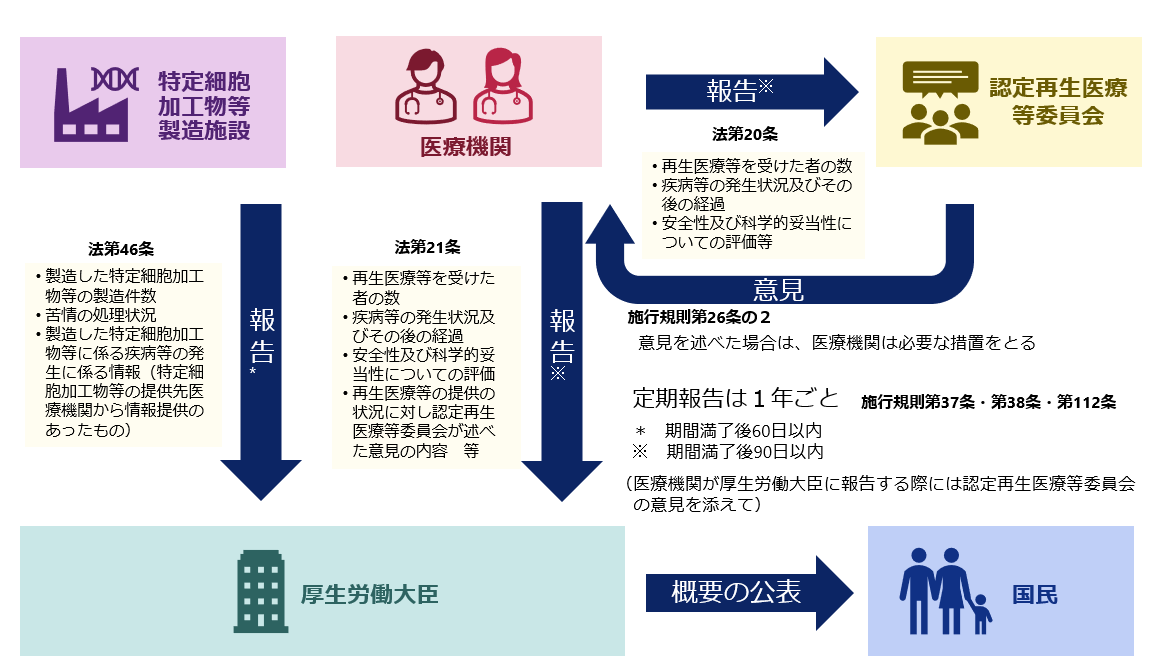
3.定期報告
毎年の「定期報告」を忘れずに
報告事項
報告事項(認定再生医療等委員会)
- 当該再生医療等を受けた者の数
- 当該再生医療等に係る疾病等の発生状況及びその後の経過
- 当該再生医療等の安全性及び科学的妥当性についての評価
- 当該再生医療等に対する利益相反管理基準で定められる関与に関する事項(研究の場合)
- 当該再生医療等に係るこの省令又は再生医療等提供計画に対する不適合の発生状況及びその後の対応
報告事項(厚生労働大臣又は地方厚生局長)
- 当該再生医療等を受けた者の数
- 当該再生医療等提供計画に記載されている認定再生医療等委員会の名称
- 当該認定再生医療等委員会による当該再生医療等の継続の適否に係る意見
報告期限
※ 厚生労働大臣又は地方厚生局長への報告については、認定再生医療等委員会への報告に対して当該委員会が意見を述べた際には当該意見を添えてください。
4.疾病等報告・不適合報告
疾病等報告
- 再生医療等提供機関の管理者は、再生医療等提供計画に記載された再生医療等の提供に起因するものと疑われる疾病、障害若しくは死亡又は感染症の発生を知ったときは、その旨を以下のとおり報告しなければなりません。
- また、特定細胞加工物等を用いた場合は当該特定細胞加工物等の製造事業者、医薬品又は再生医療等製品を用いた場合は当該医薬品又は再生医療等製品の製造販売業者に対し、発生した事態及び講じた措置について速やかに通知しなければなりません。
| 疾病等の内容 | 報告期限 | 報告先 |
以下に掲げる疾病等の発生のうち、再生医療等の提供によるものと疑われるもの又は当該再生医療等の提供によるものと疑われる感染症によるもの
|
7日以内 | 厚生労働大臣又は 地方厚生局長※ 及び 認定再生医療等委員会 |
以下に掲げる疾病等の発生のうち、再生医療等の提供によるものと疑われるもの又は当該再生医療等の提供によるものと疑われる感染症によるもの
|
15日以内 |
厚生労働大臣又は 地方厚生局長※ 及び 認定再生医療等委員会 |
| 再生医療等の提供によるものと疑われる又は当該再生医療等の提供によるものと疑われる感染症による疾病等の発生(上記に掲げる疾病等を除く。) | 定期報告時 | 認定再生医療等委員会 |
※ 第1種再生医療等提供計画については、地方厚生局長を経由して厚生労働大臣。第2種又は第3種再生医療等提供計画については地方厚生局長。
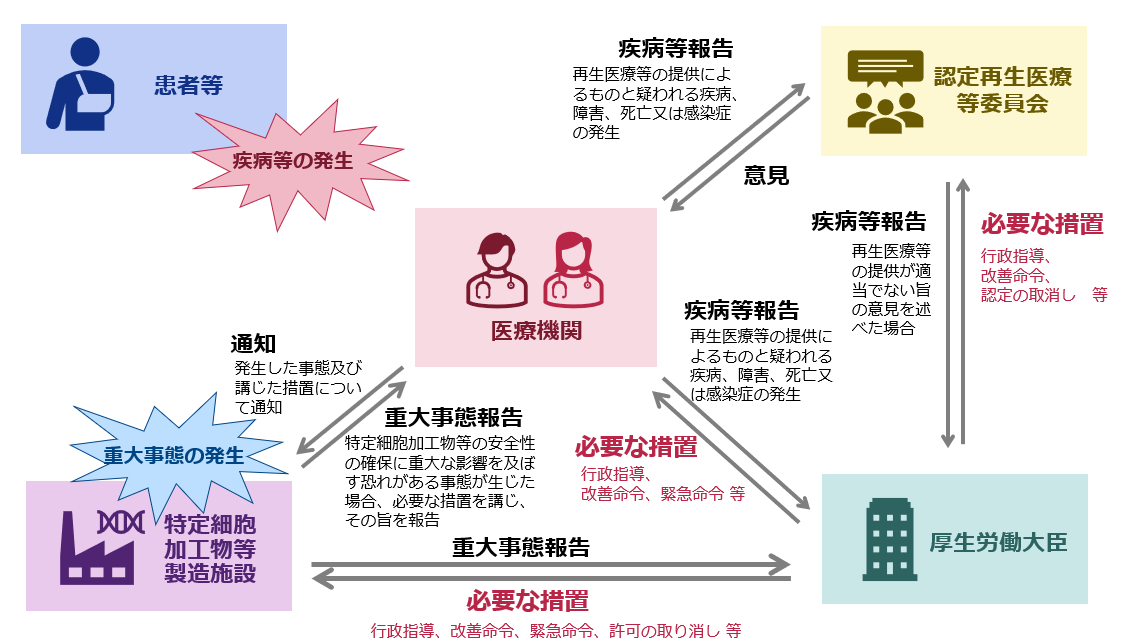
不適合報告
不適合
具体的には、施行規則又は再生医療等提供計画、研究計画書等の不遵守をいい、逸脱、研究として再生医療等を行う場合は研究データの改ざん、ねつ造等を含みます。
不適合報告
- 再生医療等を行う医師又は歯科医師は、再生医療等が不適合であると知ったときは、再生医療等提供機関の管理者及び実施責任者*1に対し、速やかにその旨を報告しなければなりません。
*1 第三種再生医療等の場合は、実施責任者を置いている場合のみ
- 実施責任者は、再生医療等が不適合であると知ったとき*2は、再生医療等提供医療機関の管理者に報告しなければなりません。
*2 再生医療等を行う医師又は歯科医師からの不適合報告により知った場合を除きます。
- 再生医療等を多施設共同研究として行っている場合、上記の報告を受けた再生医療等提供機関の管理者は、当該報告の内容を速やかに代表管理者に通知しなければなりません。
重大な不適合
- 不適合のうち、「特に重大なもの」とは、細胞提供者又は再生医療等を受ける者の人権や安全性又は結果の信頼性に影響を及ぼすもの*3をいいます。(選択・除外基準や中止基準、併用禁止療法等の不遵守等)
*3 再生医療等を受ける者の緊急の危険を回避するためその他医療上やむを得ない理由により再生医療等提供計画、研究計画書に従わなかったものについては含まない。
- 再生医療等提供機関の管理者*4は、不適合であって、特に重大なもの(重大な不適合)が判明した場合においては、速やかに認定再生医療等委員会の意見を聴かなければなりません。
*4 再生医療等を多施設共同研究として行っている場合にあっては代表管理者
- 認定再生医療等委員会の設置者は、認定再生医療委員会が重大な不適合の報告に関して意見を述べたときは、遅滞なく厚生労働大臣に報告しなければなりません。
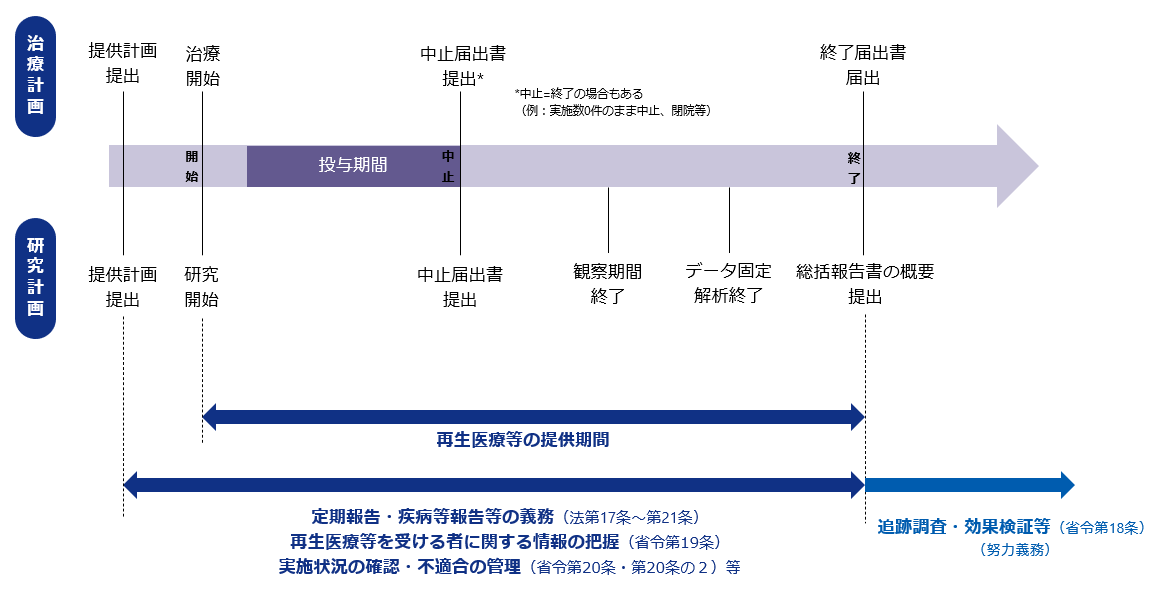
5.再生医療等の提供の中止・終了
再生医療等の提供を中止又は終了するときも届出が必要です
治療計画の場合
- 再生医療等提供機関管理者は、再生医療等提供計画に記載された再生医療等(研究として行われる場合を除く。)の提供を中止又は終了したときは、遅滞なく、その旨を、再生医療等提供計画に記載された認定再生医療等委員会に通知するとともに、厚生労働大臣に届け出る必要があります。
研究計画の場合
- 研究として再生医療等を行う医療機関の管理者は、再生医療提供計画に記載された全ての評価項目に係るデータ収集期間が終了したときは、認定再生医療等委員会の意見を聴いた上で、主要評価項目報告書又は総括報告書の概要を公開しなければなりません。
- また、総括報告書の概要を公表しようとするときは、あらかじめ、これを厚生労働大臣に提出する必要があります。
6.再生医療等に関する記録及び保存
記録事項
- 再生医療等を受けた者の住所、氏名、性別及び生年月日
- 病名及び主要症状
- 使用した特定細胞加工物等、医薬品又は再生医療等製品の種類、投与方法その他の再生医療等の内容及び評価
- 再生医療等に用いる細胞に関する情報
- 特定細胞加工物等の製造を委託した場合は委託先及び委託業務の内容
- 再生医療等を行った年月日及び場所
- 再生医療等を行った医師又は歯科医師の氏名 等
(研究として再生医療等を行う場合の追加事項)
- 再生医療等を受ける者を特定する事項
- 再生医療等を受ける者に対する診療及び検査に関する事項
- 研究への参加に関する事項 等
※ 「再生医療等に関する記録」は、再生医療等を受けた者ごとに一連の文書として遡及的に確認ができる形でまとめて作成してください。当該記録については、法に基づく立入検査等を受けた際には、速やかに提供可能な状態とされている必要があります。
保存期間
- 特定生物由来製品該当医薬品若しくは特定生物由来製品該当医薬品又は特定生物由来製品該当医薬品若しくは指定再生医療等製品の原料と類似の原料から成る特定細胞加工物等を用いる場合 30年間
- 上記以外の細胞加工物及び核酸等を用いる場合 10年間
7.報告徴収・立入検査
- 厚生労働大臣は、法第2章の規定の施行に必要な限度において、再生医療等提供機関の管理者若しくは開設者に対し、必要な報告をさせ(報告徴収)、又は当該職員に、再生医療等提供機関に立ち入り、その構造設備若しくは帳簿、書類その他の物件を検査させ、若しくは関係者に質問させること(立入検査)ができます。
- 厚生労働大臣は、上記に定めるもののほか、以下の場合において、病院、診療所の管理者又は開設者に対し、必要な報告をさせ、又は当該職員に、病院若しくは診療所に立ち入り、その構造設備若しくは帳簿、書類その他の物件を検査させ、若しくは関係者に質問させることがでます。
- 病院又は診療所の管理者が法第2章の規定に違反していると認めるとき
- 病院又は診療所の管理者が法第2章の規定に基づく命令又は処分に違反していると認めるとき
- 再生医療等技術の安全性の確保等その他再生医療等の適正な提供のため必要があると認めるとき
8.行政処分
再生医療等提供機関に対する行政処分
緊急命令(法第22条)
- 厚生労働大臣は、再生医療等の提供による保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、再生医療等を提供する病院又は診療所の管理者に対し、当該再生医療等の提供を一時停止することその他保健衛生上の危害の発生又は拡大を防止するための応急の措置をとるべきことを命ずることができます。
改善命令等(法第23条)
- 厚生労働大臣は、再生医療等技術の安全性の確保等その他再生医療等の適正な提供のため必要があると認めるときは、法第2章の規定の施行に必要な限度において、再生医療等提供機関の管理者に対し、再生医療等提供計画の変更その他再生医療等の適正な提供に関し必要な措置をとるべきことを命ずることができます。
- 厚生労働大臣は、再生医療等提供機関の管理者が上記の規定による命令に従わないときは、当該管理者に対し、期間を定めて再生医療等提供計画に記載された再生医療等の全部又は一部の提供を制限することを命ずることができます。
9.罰則等
罰則
3年以下の拘禁刑若しくは300万円以下の罰金又はこれを併科
- 緊急命令に違反した場合
1年以下の拘禁刑又は100万円以下の罰金
- 第一種再生医療等提供計画の提出の規定に違反して、その提出をせず、又は記載すべき事項を記載せず、若しくは虚偽の記載をしてこれを提出して、第一種再生医療等を提供した場合
- 第一種再生医療等の提出があった場合において、提供制限期間を経過する前に当該第一種再生医療等提供計画に記載された第一種再生医療等を提供した場合
- 改善命令に従わない場合であって、再生医療等の全部又は一部の提供を制限することを命じられたにもかかわらず第一種再生医療等を提供した場合 他
50万円以下の罰金
- 病院又は診療所の管理者が、再生医療等提供計画の提出の規定に違反して、その提出をせず、又は記載すべき事項を記載せず、若しくは虚偽の記載をしてこれを提出して、第二種再生医療等又は第三種再生医療等を提供した場合
- 医師又は歯科医師が、再生医療等に係る記録の作成をせず、又は虚偽の記録を作成した場合
- 再生医療等提供機関の管理者が再生医療等に係る記録の保存をしなかった場合
- 改善命令に従わない場合であって、再生医療等の全部又は一部の提供を制限することを命じられたにもかかわらず第二種再生医療等又は第三種再生医療等を提供した場合 他