健康・医療医療上の必要性の高い未承認薬・適応外薬の今後の要望募集について
平成25年8月1日
(平成27年7月1日更新)
厚生労働省医政局研究開発振興課
医薬生活・衛生局審査管理課
これまで、欧米等では使用が認められているものの、国内では承認されていない医薬品及び適応については、開発要望を募集し(第I回:平成21年6月18日から8月17日、第II回:平成23年8月2日から平成23年9月30日、第III回:平成25年8月1日から平成27年6月30日)、寄せられた要望について「医療上の必要性の高い未承認薬・適応外薬検討会議」(以下「検討会議」という。)において、医療上の必要性を評価するとともに、承認申請のために実施が必要な試験の妥当性や公知申請への該当性を確認すること等により、製薬企業による未承認薬・適応外薬の開発を促しているところです。
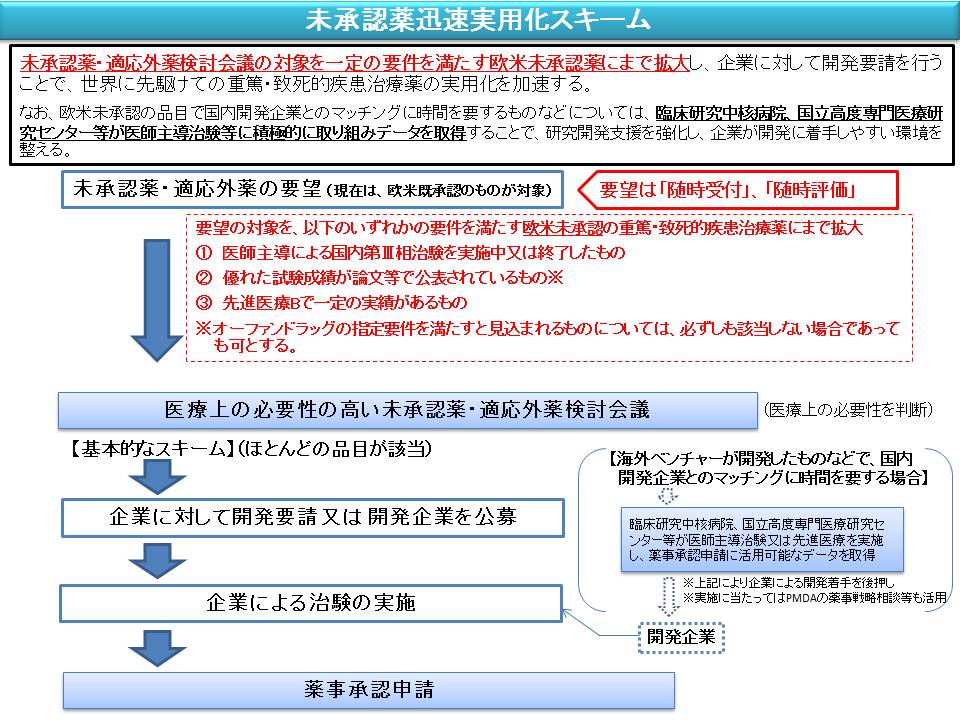
今般、平成26年6月17日に厚生労働省において革新的医薬品等の実用化を促進するための「先駆けパッケージ戦略」を策定し、欧米等でも未承認の医薬品のうち、一定の要件を満たすものについては、検討会議の検討対象を拡大することで、国内での実用化を加速する「未承認薬迅速実用化スキーム」を適用することとしています。
これに伴い、開発要望の募集対象を従来のものから拡大することとし、あわせて、検討会議における検討の迅速化を図るため、これまでの検討会議における検討実績を踏まえ、開発要望の募集及び検討会議における要望の取扱いを見直すこととしますので、今後ご要望される場合には、下記によりご提出をお願いいたします。
なお、皆様からいただいたご要望については、検討会議の検討において活用させていただきますが、要望対象の要件を満たすことが示されないご要望につきましては、検討の対象外といたしますので、予めご了承くださいますようお願いいたします。また、今後の要望募集に関する基本的な方針については、以下の資料をご参考にしてください。
今後の要望募集の取り扱い及び流れについて
要望募集等の流れ(既存のスキームと同様)
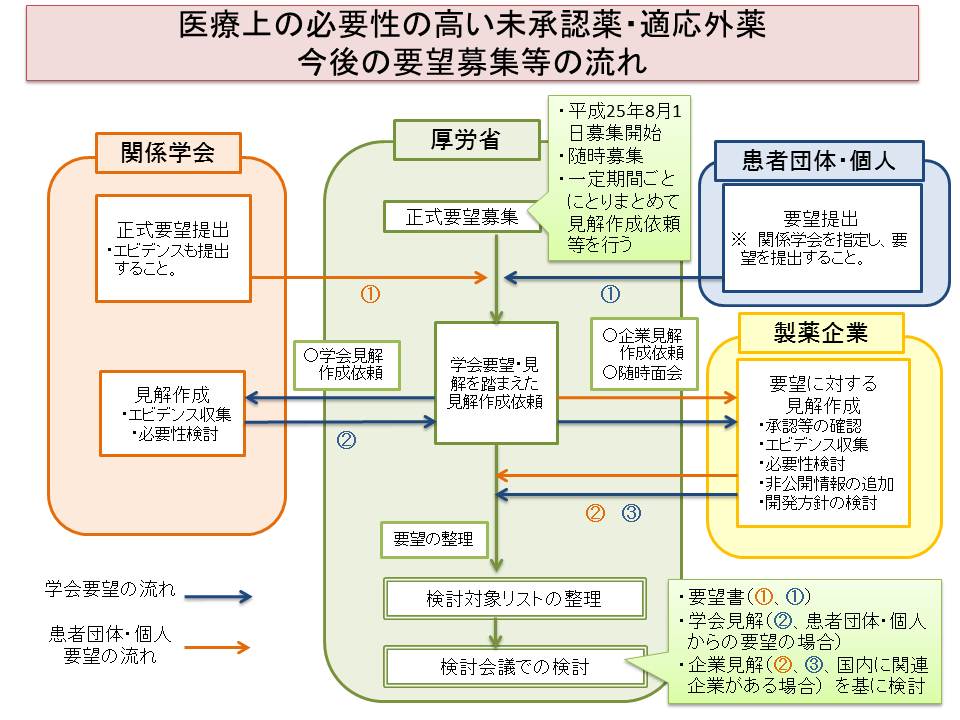
なお、ご提出いただいたご要望についての検討状況等は厚生労働省ホームページにおいて公表することとしています。(検討会議における検討結果を個別にお伝えすることはいたしません)また、要望に対する検討結果にもございますように、要望された未承認薬・適応外薬について、我が国においては使用経験やエビデンスが不足している場合、治験や使用実態調査等の実施が必要と判断される場合があります。このような場合には、要望を提出した学会においてご協力いただくこともありますので、予めご承知おき願います。
記
1. 募集対象
(1)未承認薬
欧米等6か国(米・英・独・仏・加・豪)(以下、「欧米等6か国」という。)のいずれかの国で承認注1)された医薬品であって、医療上その必要性が高い注2)もの
(2)適応外薬
要望対象となる適応(効能・効果、用法・用量の両方又はいずれかが既承認の適応と異なるもの。本邦で承認されていない剤型、投与経路の追加を必要とするものを含む)について、以下のいずれかの基準を満たす場合
- 1.欧米等6か国のいずれかの国で承認注1)された適応であって、医療上その必要性が高い注2)もの
- 2.欧米等6か国のいずれかの国で、一定のエビデンスに基づき、特定の用法・用量で広く使用されていることが確認できる適応であって、医療上その必要性が高い注2)もの
(3)未承認薬迅速実用化スキーム対象品目
以下のいずれかの基準を満たす医療上その必要性が高い注2)欧米未承認注3)のもの
- 1.国内第III相の医師主導治験が実施中又は終了したもの
- 2.優れた試験成績に係る論文が権威のある学術雑誌等で公表されているもの注4)
- 3.先進医療Bで一定の実績があるもの
- 注1)EUで中央承認されているものは、英、独、仏における承認があるものとみなす。
- 注2)以下の2つの判断基準の両方に該当するもの
- 1.適応疾病の重篤性が次のいずれかの場合
- ア.生命に重大な影響がある疾患(致死的な疾患)
- イ.病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患
- ウ.その他日常生活に著しい影響を及ぼす疾患
- 2.医療上の有用性が次のいずれかの場合
- 募集対象(1)、(2)
- ア.既存の療法が国内にない
- イ.欧米等の臨床試験において有効性・安全性等が既存の療法と比べて明らかに優れている
- ウ.欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考えられる
- 募集対象(3)
- ア.既存の療法が国内にない
- イ.国内外の臨床試験において有効性・安全性等が既存の療法と比べて明らかに優れている
- 募集対象(1)、(2)
- 1.適応疾病の重篤性が次のいずれかの場合
- 注3)募集対象(2)適応外薬の2.及び(3)未承認薬迅速化スキーム対象品目のいずれにも該当する場合にあっては、募集対象(2)適応外薬の2.に係る要望として提出すること。
- 注4)希少疾病用医薬品の指定要件を満たすと見込まれるものについては、必ずしも該当しない場合であっても可とする EUで中央承認されているものは、英、独、仏における承認があるものとみなす。
2. 募集期間
随時募集
(募集対象(3)に係る要望の募集は、平成27年7月1日から開始)
第IV回要望:平成27年7月1日から開始
3.作成方法
募集対象(3) 未承認薬迅速実用化スキームについては、欧米等6か国での使用実績が無く、慎重な検討が必要と考えられることから、募集対象(1)(2)とは別の様式で募集を行うこととしますので、ご注意ください。
募集対象(1)(2)の要望については、別添1「要望書作成の留意事項(募集対象(1)(2))[PDF形式:492KB]」に従い、別添様式1-1「未承認薬・適応外薬の要望(募集対象(1)(2)」[DOC形式:254KB]及び別添様式2-1「開発要望の総括表(募集対象(1)(2))」[XLS形式:27KB]を作成してください。
募集対象(3)の要望については別添2「要望書作成の留意事項(募集対象(3))」[PDF形式:351KB]」に従い、別添様式1-2「未承認薬・適応外薬の要望(募集対象(3))」[DOC形式:195KB]及び別添様式2-2「開発要望の総括表(募集対象(3))」[XLS形式:27KB]を作成してください。
要望が募集対象の範囲内である根拠となる文献及びその他の参考文献については、文献番号を付与した写しを併せて提出してください。
4.提出方法
提出は電子メールにて以下の送付先に提出してください。電子メールでの提出が困難な場合には、ファクシミリ又は郵送にて提出してください。
なお、電子メールでご要望を提出していただく際には、必ず「件名」を「未承認薬等について」として提出してください。また、郵送にてご提出いただく場合には、電子媒体(CD-R(RW)及びDVD-R(RW)に限る。)を同封のうえ、「未承認薬等について」と朱書きして、提出してください。
送付先
電子メールの場合
アドレス:kaihatsuyoubou@mhlw.go.jp
厚生労働省医薬・生活衛生局審査管理課
ファクシミリの場合
ファクシミリ番号:03-3597-9535
厚生労働省医薬・生活衛生局審査管理課宛
郵送の場合
〒100-8916 東京都千代田区霞が関1-2-2
厚生労働省医薬・生活衛生局審査管理課宛



