健康・医療医療ニーズの高い医療機器等の早期導入に関する要望対象の拡大と要望の募集について
照会先
医政局医薬産業振興・医療情報企画課
医薬局医療機器審査管理課
これまで、欧米等では使用が認められているものの、国内では承認されていない医療機器及び体外診断用医薬品(以下「医療機器等」という。)、並びに医療機器等としては薬事承認されているものの、欧米で承認されている一部の適応が国内では承認されていないものについては、開発要望を募集してきました。応募された開発要望については、「医療ニーズの高い医療機器等の早期導入に関する検討会」(以下「検討会議」という。)において、医療上の必要性を評価し、我が国の医療ニーズの高いものを選定することにより、企業による開発を促してきました。
また、厚生労働省においては、平成26年6月17日に、革新的医薬品・医療機器等の実用化を促進するための「先駆けパッケージ戦略」を策定したところです。この「先駆けパッケージ戦略」の一つとして、欧米等でも未承認の医薬品のうち、一定の要件を満たすものについては、「医療上の必要性の高い未承認薬・適応外薬検討会議」の検討対象を拡大することで、国内での実用化を加速する「未承認薬迅速実用化スキーム」を適用することとしています。医療機器等についても同様に、検討会議の検討対象を一定の要件を満たす欧米未承認の医療機器等にまで拡大し、国内での実用化を加速するスキームを適用することとしました。
これに伴い、下記のとおり、開発要望の募集対象を従来のものから拡大することとし、あわせて、検討会議における検討の迅速化を図るため、これまでの検討実績を踏まえ、開発要望の募集及び検討会議における要望の取扱いを見直し、平成27年10月1日から要望を募集することとしましたので、お知らせします。
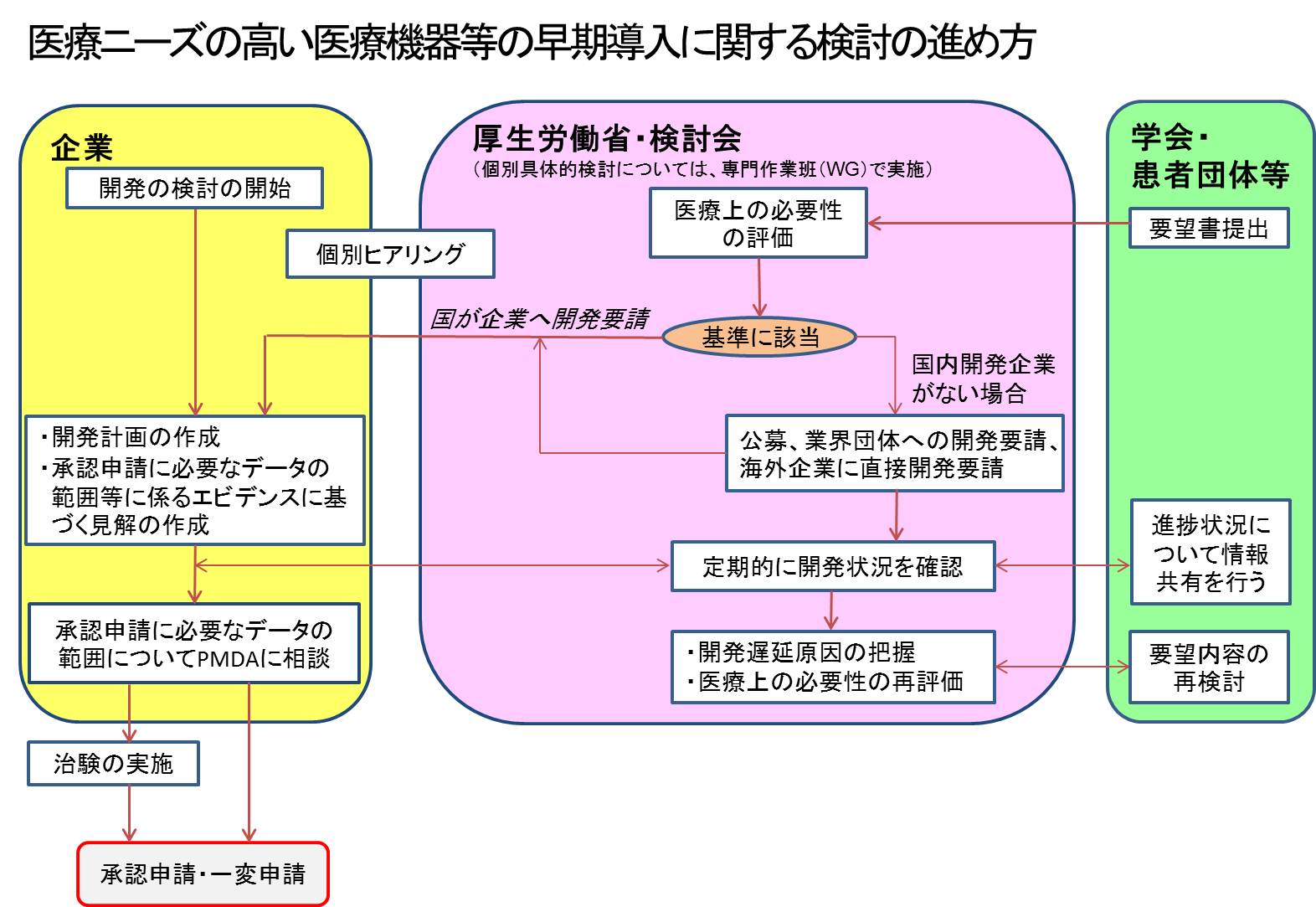
なお、今回新たに募集対象として追加した範囲及び検討会議における検討の進め方については、それぞれ図1及び図2も参考にしてください。
照会先
要望書等の提出に係るお問い合わせ
医政局医薬産業振興・医療情報企画課
- 電話番号
- 03(5253)1111(内線4465)
その他の検討会議全般にわたるお問い合わせ
医薬局医療機器審査管理課
- 電話番号
- 03(5253)1111(内線2788)

<記>
1 募集対象
以下の(1)~(3)のいずれかに該当するものについて、要望を募集します注1)注2)。
- (1)欧米において承認されている医療機器等であって、医療上その必要性が高いもの注3)。
- (2)適応外の医療機器等(医療機器等としては薬事承認されているものの、欧米で承認されている一部の適応が、国内では承認されていないもの。)であって、医療上その必要性が高いもの注3)。
- (3)以下のいずれかの要件を満たす欧米において承認されていない医療機器等であって、医療上その必要性が高いもの注3)。
- 1優れた試験成績が論文等で公表されているもの
- 2医師主導治験を実施中または終了したもの
- 3先進医療Bで一定の実績があるもの
- 注1)今回新たに募集対象として追加した(3)については、従来の募集対象の(1)及び(2)とは分けて、今後、処理方法を検討していく必要があることから、要望の提出段階から明確に区別して募集することとしましたので、ご留意ください。
- 注2)国内での実用化を加速するためにも募集対象として追加した(3)は、国内もしくは国外において開発されている医療機器等を対象とすること。
- 注3)医療上その必要性が高いものとは、以下の1及び2に掲げる基準に該当するものであること。
- 1医療上の有用性:次のいずれかの場合
- ア既存の治療法、予防法もしくは診断法がないこと
- イ有効性、安全性、肉体的・精神的な患者負担、操作性等の観点から、治療法、予防法もしくは診断法として医療上の有用性が期待できること注4)注5)
- 2適応疾病の重篤性:次のいずれかの場合
- ア生命に重大な影響がある疾患(致死的な疾患)であること
- イ病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患であること
- ウその他日常生活に著しい影響を及ぼす疾患であること
- 1医療上の有用性:次のいずれかの場合
- 注4)要望された医療機器等について、既存の治療法、予防法もしくは診断法に比して、侵襲性の低下、合併症の発生の減少、小型化・軽量化による小児への適応、手技の安全性・簡便性の向上、耐久性の向上、操作性の向上、医療従事者への安全性の向上などが期待できる場合、医療上の有用性の評価基準イに該当するものとする。
- 注5)医療上の有用性の評価基準イについて、募集対象の(1)又は(2)の場合は、既存の治療法、予防法もしくは診断法に比した医療上の有用性について、欧米承認時に提出された臨床試験成績等により示されていること。
2 募集期間
平成27年10月1日から随時募集します。
3 要望作成
- (1)要望については、別添様式1「早期導入を要望する医療機器等に関する要望書」及び別添様式2「開発要望の総括表」を作成してください。
- (2)要望内容が募集対象の範囲内であることを示す根拠となる文献その他の参考文献については、文献番号を付与した写しを併せて提出してください。
- (3)要望内容における医療上の必要性の評価時には、当該要望内容の妥当性を示唆する文献だけでなく、要望内容に反する内容の文献についても検討が必要です。適切な評価を行うため、要望内容に関する文献は網羅的に調査し、要望書に盛り込むこととしてください。
- (4)要望内容が募集対象であることを示す文献等が不足している場合には、円滑かつ迅速な事務処理のために、受付前並びに専門作業班(以下「WG」という。)及び検討会議における検討の段階においても再提出をお願いする場合がありますので予めご留意ください。
- (5)また、検討会議において、「医療上の必要性が高い」とは必ずしも判断できないと結論され、開発要請・公募に至らなかった要望について、再度要望を提出する場合には、前回の評価時点からの医療上の必要性の変化等、改めて評価結果が変更されうる根拠となる具体的な資料やデータを添えた上で、変更部分を明記し、ご要望ください。
4 提出方法
※平成27年10月1日から募集を開始します※
提出は電子メールにて下記の送付先に提出してください。電子メールでの提出が困難な場合には郵送にて提出してください。
なお、電子メールで要望を提出する際には、「件名」を必ず「未承認機器等の早期導入要望」としてください。郵送で提出する場合には、簡易書留等配達されたことが証明できる方法とし、電子媒体(CD-R(RW)及びDVD-R(RW)に限る。)を同封のうえ、宛先の左下に「未承認機器等の早期導入要望在中」と朱書きしてください。
送付先
電子メールの場合
医政局医薬産業振興・医療情報企画課
- アドレス
- kiki-needs@mhlw.go.jp
- 厚生労働省医政局医薬産業振興・医療情報企画課
郵送の場合
厚生労働省医政局医薬産業振興・医療情報企画課
- 〒100-8916
- 東京都千代田区霞が関1-2-2
5 検討会議における要望の取扱い
- (1)要望の受付
- 要望は提出後に事務局において内容の確認を行い、要望者に対するヒアリングを行った上で、添付資料、説明等が十分であると判断された時点で要望を受け付けたものとして取り扱います。・要望内容が募集対象の範囲内であることを示す文献等が不足している場合、募集対象への該当性に関する説明が不十分な場合等には、受付前に要望の再検討を依頼させていただきます。
- なお、提出された要望及び要望の再検討の依頼内容については、個人名や連絡先等を除き厚生労働省のHPにて公表させていただきます。
- (2)検討の対象外
- 要望する医療機器等について、既に国内で承認申請されている場合には、当該要望は検討の対象外として取り扱います。
- (3)関連学会及び関連企業の見解聴取
- 患者団体又は個人から提出された場合には、要望書に記載された関連学会から、さらに、日本国内での要望内容に関する開発権を有する企業が存在すると確認できる場合には、当該企業から、それぞれ当該要望の妥当性等について見解を聴取し、当該要望及び聴取した見解に基づいて検討を行うこととしています。このため、患者団体又は個人から要望が提出された場合には、臨床現場での医療上の必要性に関してご見解をいただきますようにお願いします。
- (4)要望内容の検討
- 要望に係る医療上の必要性の検討は、検討会議が行います。ただし、個別要望のエビデンスの具体的な検討は、検討会議の下に設置する、各診療科領域の専門家等で構成するWGが行うこととします。
- WGにおいて、要望の受付から一定期間が過ぎても当該要望に係る医療上の必要性に関する結論が得られない場合には 、その時点のWGでの議論内容を検討会議に報告することとします。
- 要望者が学会である場合には、公平性の観点から、当面、検討会議構成員のうち、当該学会の執行部(理事会メンバー以上を想定)に在籍する者は、当該要望に係る背景事情等の説明は行うものの、当該要望の議決には参加しないこととします。
- 通常、個別の品目の検討状況を要望者に個別に連絡することはありません。ただし、検討過程において追加の具体的な資料やデータが必要になった場合等は、個別に要請を行うことがあります
- WGにおいて、より詳細な現状(臨床現場での使用実態、開発状況等)の確認や、要望内容の意図等の確認のため、必要に応じて要望学会等の適当な方に説明をお願いすることがあります
- 医療上の必要性が高いと評価された場合であっても、検討時点でのエビデンスでは有効性等が十分に確認できず、承認申請のために新たに追加のエビデンスが必要となった場合、当該エビデンスの収集への協力の可否について、別添様式1でお示しください。なお、追加のエビデンスの収集にご協力いただけない場合は、当該要望を検討の対象外とさせていただくことがございますので、ご留意ください。
- 要望は随時受け付けておりますので、開発要請に至らなかった要望についても、新たなエビデンスが追加される等、明らかな状況の変化が認められた場合には、変化が生じた部分を明確にした上で、再度改めて要望いただけます。
- (5)要請後の要望の医療上の必要性の低下に伴う再検討
- 検討会議において、医療上の必要性が高いと評価され、該当企業への開発要請や開発企業の公募が行われた医療機器等については、適切に開発が進められることになりますが、医療上の必要性を評価した時点以降、標準的な治療法の変化等により、医療環境が大きく変化する場合が想定されます。
- このような場合には、開発を行う企業等からの再検討の申し入れを受け付け、医療上の必要性を再検討することとします。
- なお、再検討においては医療上の必要性に係る医療環境の変化及び当該開発中の医療機器等の必要性が低下したことを示す資料の提示を求めることとします。
- 再検討の方法・結果の公表等は、従来の医療上の必要性の評価と同様とします。また、医療上の必要性の評価が、再検討の時点で高いとはいえないと判断された場合には、当該企業への開発要請や公募を撤回することとします。
- (6)企業への開発要請及び開発企業の公募
- 検討会議において「医療上の必要性が高い」と評価された要望について、日本国内で要望内容に関する開発権を有する企業が確認できる場合には、当該企業に対して開発要請を行います。
- 開発権を有する企業が確認できない場合には、開発企業の公募を行うとともに、国内の関連する業界団体に対して開発要請を行います。また、外国製造の医療機器等については、外国の製造元の企業に対して開発要請を行います。
※要望内容の検討にあたって、関連企業及び要望を提出された学会等には、独立行政法人医薬品医療機器総合機構(PMDA)から連絡することがあります。
6 要望提出前の事前面談
様式:事前相談申込書[22KB]
電子メールの送付先
医薬局医療機器審査管理課
アドレス prep_needs[AT]mhlw.go.jp
(迷惑メール防止対策のため、[AT]を半角のアットマークに置き換えてください)
(2)事前面談日は、(1)の申込みが行われた後、厚生労働省医薬局医療機器審査管理課の担当者より要望学会・患者団体等に連絡の上、決定いたします。



