4 医療用具における「コンピュータの西暦2000年問題」への対応について(その4)
(1)概要
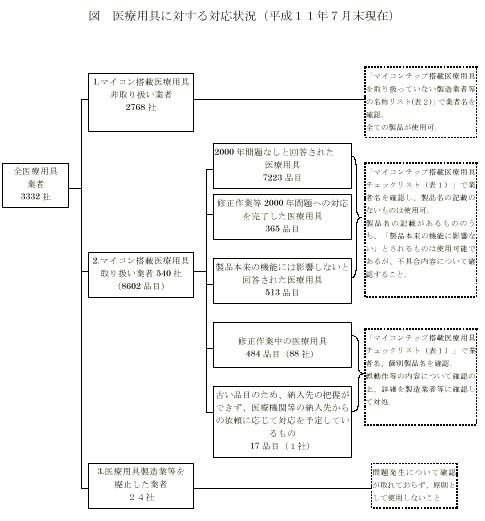
- 平成11年7月末時点での医療用具業界における「コンピュータの西暦2000年問題」(以下「2000年問題」という。)への対応状況について調査を行ったところ(注),マイコンチップ搭載医療用具は8602品目あり,このうち8101品目(94.2%)については,修正・模擬テストの実施等必要な対応を完了した。また,2000年問題の対応が完了していない501品目全てについても,11月末までに対応が完了するよう進められている。
- 注)
- ・都道府県及び業界団体を通じ過去2回(平成10年12月,平成11年3月)調査を実施,さらに対応未了の業者に絞って今回調査を実施し,前2回の調査結果とあわせて,医療用具製造業者等の対応状況をとりまとめたもの。
- ・「製造業者等」は,製造業者,輸入販売業者,外国製造承認取得者及び国内管理人を含む。
(2)医療用具製造業者等のマイコンチップ搭載医療用具の製造等状況
- ・全ての医療用具のうち,2000年問題発生の恐れがあるのは,マイコンチップを搭載したもののみであり,マイコンチップを搭載していない医療用具に関しては,2000年問題発生の恐れはない。
- ・マイコンチップ搭載医療用具を取り扱っていた業者は,全医療用具製造等許可業者3332社のうち,540社であり,合計8602品目を取り扱っていたことを把握した。
- ・全医療用具製造等許可業者のうち,24社については,すでに医療用具製造許可を廃止等しており,マイコンチップ搭載医療用具の製造状況は不明。
マイコンチップ搭載医療用具を取り扱っていない業者: 2768社 マイコンチップ搭載医療用具を取り扱う業者: 540社(8602品目) 医療用具製造許可を廃止等した業者: 24社 合計 3332社
(3)マイコンチップ搭載医療用具の修正等対応状況について
- ・全てのマイコンチップ搭載医療用具8602品目について,全製造業者等540社の修正等対応状況を把握。
- ・不具合が全くないもの7223品目,全ての納入されている製品に対して不具合の修正・模擬テストを完了しているもの365品目及び日付誤表示等軽微な不具合はあるが使用に支障がないため納入されている製品について修正・模擬テストは不要と判断されたもの513品目,併せて8602品目中8101品目(94.2%)については「2000年問題の対応が完了した医療用具」であり,問題なく使用できることが判明。
- ・残りの501品目のうち,484品目については不具合の修正・模擬テストの作業を実施中である(11月末完了予定)。このうち,重篤な健康被害につながるような不具合を来す製品は1品目(平成10年12月末調査で判明のもの)のみであることが確 認されている。当該1品目については27台が納入されているが,26台については既に修正等が完了しており,残り1台についても11月中に対応完了予定である。
- ・また,1社17品目については,古い品目のため,納入先の把握ができないことから,医療機関等の納入先からの依頼に応じて対応することとしている。
・不具合が全くないことが確認されたもの 7223品目(84.0%) ・不具合の修正・模擬テストを完了しているもの 365品目( 4.2%) ・日付誤表示等軽微な不具合はあるが使用に支障がないため修正・模擬テストは不要と判断されたもの 513品目( 6.0%) ・不具合の修正・模擬テストの作業を実施中のもの 88社 484品目( 5.6%) ・古い品目のため,納入先の把握ができず、医療機関等の納入先からの依頼に応じて対応を予定しているもの 1社 17品目( 0.2%)
(4)マイコンチップ搭載医療用具の製造業者等の体制整備状況について
- ・マイコンチップ搭載医療用具の製造業者等のうち,体制整備が完了あるいは11月末までに完了予定のものが9割以上。
- (1)2000年問題の対応窓口の設置について
既に設置: 474社(87.8%) 11月末までに設置予定: 33社( 6.1%)
小計507社(93.9%)設置予定なし: 33社( 6.1%)
- (設置しない主な理由)
- ・取り扱っている全製品はカレンダー機能を内蔵しているマイコンチップは使用しておらず問題発生のおそれはない。
- ・取り扱っている全製品の医療機関は全て把握しており直接連絡を行っている。
- (2)危機管理計画の策定
策定済み: 211社(39.1%) 11月末までに策定予定: 282社(52.2%)
小計493社(91.3%)策定予定なし: 47社( 8.7%)
- (策定しない主な理由)
- ・全ての製品が2000年問題には該当しないことを確認した。
(5)医療機関へのお願い
- 今回までの調査結果をふまえ別添のとおり「コンピュータの西暦2000年問題:医療用具チェックリスト」を作成したので「このチェックリストの使い方」を活用し,医療機関において保有されている用具のチェックを効率的に進めていただきたい。
-
PDFファイルを見るためには、アクロバットリーダーというソフトが必要です。アクロバットリーダーは無料で配布されています。
次のアイコンをクリックしてください。
図医療用具に対する対応状況(平成11年7月末現在) PDFファイル (9KB)
マイコンチップ搭載医療用具チェックリスト(PDF113KB)
マイコンチップ搭載医療用具を取り扱っていない製造業者等の名称リスト(PDF44KB)
使用上の注意の改訂について(その116)
医薬品等安全性情報No.156掲載分以降に改訂を指導した使用上の注意について,改訂内容,主な該当販売名,参考文献等をお知らせいたします。
1〈血圧降下剤〉
ロサルタンカリウム
[販 売 名] ニューロタン錠25(萬有)他
[慎重投与]
- 体液量が減少している患者(利尿降圧剤投与中,厳重な減塩療法中,血液透析中)(「重要な基本的注意」の項参照)
- 本剤の投与によって,一過性の血圧低下(ショック症状,意識喪失,呼吸困難等を伴う)を起こすおそれがあるので,そのような場合には投与を中止し,適切な処置を行うこと。また,特に次の患者では投与は少量より開始し,増量する場合は患者の状態を十分に観察しながら徐々に行うこと。
- ア.利尿降圧剤投与中の患者
イ.厳重な減塩療法中の患者
ウ.血液透析中の患者
- 失神・意識喪失:血圧低下に伴う一過性のショック症状があらわれることがあるので,症状があらわれた場合には,投与を中止し,適切な処置を行うこと。
急性肝炎又は劇症肝炎:症状があらわれた場合には,投与を中止し,適切な処置を行うこと。
2〈気管支喘息・脳血管障害改善剤〉
イブジラスト
[販 売 名] ケタスカプセル10mg(杏林)他
[副作用(重大な副作用)]
- 血小板減少:血小板減少があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
3〈非ステロイド性消炎鎮痛剤〉
アルミノプロフェン
[販 売 名] ミナルフェン錠100(富士レビオ)他
[副作用(重大な副作用)]
- 胃・十二指腸潰瘍,消化管出血:胃・十二指腸潰瘍,吐血,下血等の消化管出血があらわれることがあるので,このような症状があらわれた場合には,投与を中止し,適切な処置を行うこと。
肝機能障害:GOT上昇,GPT上昇,Al−P上昇等があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止するなど,適切な処置を行うこと。
〈参 考〉 企業報告
4〈非ステロイド性消炎鎮痛剤〉
プラノプロフェン(経口剤)
[販 売 名] ニフラン錠(吉富)他
[副作用(重大な副作用)]
- 肝機能障害,黄疸:肝機能障害,黄疸があらわれることがあるので,肝機能検査値に注意するなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
5〈選択的セロトニン再取り込み阻害剤〉
マレイン酸フルボキサミン
[販 売 名] デプロメール錠25(明治製菓),ルボックス錠25(藤沢)他
[禁 忌] (シサプリドを削除)
[原則禁忌]
- シサプリドを投与中の患者[併用によりQT延長,心室性不整脈等が発現する可能性があるので,治療上やむを得ないと判断される場合にのみ慎重に投与すること(「相互作用」の項参照)。]
[相互作用(原則併用禁忌)]
- シサプリド[併用によりシサプリドの血中濃度上昇の可能性があり,QT延長,心室性不整脈等が発現するおそれがある。やむを得ず併用する場合には,定期的に心機能検査等を実施し,異常が認められた場合には直ちに投与を中止すること。]
6〈総合感冒剤〉
サリチルアミド・アセトアミノフェン・無水カフェイン・メチレンジサリチル酸プロメタジン
[販 売 名] PL顆粒(塩野義)他
[副作用(重大な副作用)]
- 間質性肺炎,好酸球性肺炎:発熱,咳嗽,呼吸困難,胸部X線異常,好酸球増多等を伴う間質性肺炎,好酸球性肺炎等があらわれることがあるので,このような症状があらわれた場合には投与を中止し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
7〈四級アンモニウム塩製剤〉
臭化ジスチグミン(経口剤)
[販 売 名] ウブレチド錠(鳥居)他
[用法・用量に関連する使用上の注意]
- コリン作動性クリーゼを防ぐため,医師の厳重な監督下のもとに通常成人1日1回5mgから投与を開始し,患者の状態を観察しながら症状により適宜増減すること。
なお,効果が認められない場合には,漫然と投与せず他の治療法を検討すること。
8〈強心剤〉
ベスナリノン
[販 売 名] アーキンZ錠60(大塚製薬)
[警 告]
警告
- 無顆粒球症が発現するおそれが高く,死亡に至った例も報告されている。また,VesT(重症心不全を対象とした外国での長期臨床試験)において,本剤投与群でプラセボ群に比し死亡率が高かったという報告がある。そのため,本剤の投与は他の薬剤の効果が不十分な場合で,予後不良が予想される場合に限ること。また,投与中は,患者を入院させるなど常に医師の監視下に置き頻回に血液検査を実施すること。(「重要な基本的注意」の項参照)
- 重篤な不整脈(心室頻拍,心室細動,高度な徐脈等)の患者[重篤な不整脈が更に悪化したとの報告がある。また,VesT(重症心不全を対象とした外国での長期臨床試験)における死亡率の増加は不整脈に由来する突然死に起因すると想定している。]
- (重篤な不整脈の患者[重篤な不整脈が更に悪化したとの報告がある。]
重篤な肝障害あるいは腎障害のある患者[本剤の血中半減期が約45時間と長いため,薬剤の蓄積が起こるおそれがある。]を削除)
腎機能低下状態の患者[ジギタリス製剤の血中濃度が上昇するおそれがある。また,本剤の血中半減期が約45時間と長いため,薬剤の蓄積が起こるおそれがある。]
重篤な肝障害のある患者[本剤の血中半減期が約45時間と長いため,薬剤の蓄積が起こるおそれがある。]
9〈不整脈用剤〉
ナドロール
[販 売 名] ナディック錠30mg(大日本)他
[禁 忌]
- 異型狭心症の患者[症状を悪化させるおそれがある。]
高度の徐脈(著しい洞性徐脈),房室ブロック(II,III度),洞房ブロック,洞不全症候群のある患者[心刺激伝導の抑制により,症状の悪化を来す。]
- 洞房ブロック,洞不全症候群:他のβ−遮断剤でこれらの副作用が報告されているので,観察を十分に行い,このような症状が認められた場合には,減量又は投与を中止するなど適切な処置を行うこと。
塩酸ベラパミル(経口剤)
[販 売 名] ワソラン錠(エーザイ)他
[副作用(重大な副作用)]
- 循環器:心不全,洞停止,房室ブロック,徐脈,意識消失があらわれることがある。
11〈プロスタグランジンE1製剤〉
アルプロスタジルアルファデクス(20μg注射剤)
[販 売 名] 注射用プロスタンディン(小野)他
[副作用(重大な副作用)]
- 白血球減少:まれに白血球減少があらわれることがあるので,異常が認められた場合には投与を中止すること。
12〈鎮咳去たん剤〉
ヒベンズ酸チペピジン
[販 売 名] アスベリン錠(田辺)他
[禁 忌] 本剤の成分に対し過敏症の既往歴のある患者
[副作用(重大な副作用)]
- アナフィラキシー様症状:咳嗽,腹痛,嘔吐,発疹,呼吸困難等を伴うアナフィラキシー様症状があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
13〈止しゃ剤,整腸剤〉
タンニン酸アルブミン
[販 売 名] タンナルビン(メルクホエイ)他
[禁 忌]
- 牛乳アレルギーのある患者[ショック又はアナフィラキシー様症状を起こすことがある。]
- (牛乳アレルギーのある患者[呼吸困難,蕁麻疹,顔面浮腫等があらわれることがある。]を削除)
- (過敏症:まれに呼吸困難,蕁麻疹,顔面浮腫等があらわれることがあるので,このような症状があらわれた場合には投与を中止すること。を削除)
ショック,アナフィラキシー様症状:ショック,アナフィラキシー様症状を起こすことがあるので,観察を十分に行い,呼吸困難,蕁麻疹,顔面浮腫等の過敏症状あるいは気管支喘息発作等の症状が発現した場合には投与を中止し,適切な処置を行うこと。
網戸公美他:アレルギーの領域,4(3):394(1997)
小林一彦他:日本小児科学会雑誌,101(9):1456(1997)
芦田雅士他:日本皮膚科学会雑誌,108(4):554(1998)
14〈消化管運動改善剤〉
シサプリド
[販 売 名] アセナリン錠(ヤンセン協和)他
[禁 忌]
- QT延長のある患者(先天性QT延長症候群,特発性QT延長,糖尿病性QT延長),先天性QT延長症候群の家族歴のある患者[心室性不整脈を起こすおそれがある。]
重篤な心室性不整脈,II度あるいはIII度の房室ブロック,極端な徐脈(40拍/分未満),うっ血性心不全,虚血性心疾患の既往歴のある患者[QT延長,心室性不整脈を起こすおそれがある。]
[原則禁忌]
- マレイン酸フルボキサミンを投与中の患者[併用によりQT延長,心室性不整脈等が発現する可能性があるので,治療上やむを得ないと判断される場合にのみ慎重に投与すること(「相互作用」の項参照)。]
[相互作用(原則併用禁忌)]
- マレイン酸フルボキサミン[併用により本剤の血中濃度上昇の可能性があり,QT延長,心室性不整脈等が発現するおそれがある。やむを得ず併用する場合には,定期的に心機能検査等を実施し,異常が認められた場合には直ちに投与を中止すること。]
15〈抗甲状腺剤〉
チアマゾール
[販 売 名] メルカゾール錠(HMR)他
[妊婦,産婦,授乳婦等への投与]
- 妊娠中の投与により,新生児に頭皮皮膚欠損症等があらわれたとの報告がある。
〈参 考〉 企業報告
16〈黄体ホルモン剤〉
酢酸クロルマジノン(25mg,50mg)
[販 売 名] プロスタール錠25,プロスタールL錠(帝国臓器)他
[副作用(重大な副作用)]
- 肝機能障害,黄疸:肝機能障害,黄疸があらわれることがあるので,肝機能検査値に注意するなど観察を十分に行い,異常が認められた場合には投与を中止し適切な処置を行うこと。
17〈LH−RHアゴニスト〉
酢酸ゴセレリン
[販 売 名] ゾラデックス3.6mgデポ(ゼネカ)
[副作用(重大な副作用)]
- 間質性肺炎:間質性肺炎があらわれることがあるので,患者の状態を十分に観察すること。
18〈ビタミンB6剤〉
リン酸ピリドキサール,リン酸ピリドキサールカルシウム,塩酸ピリドキシン
[販 売 名]
- ピロミジン錠10mg(山之内)他
アデロキザール散(ゾンネボード)他
塩酸ピリドキシン(丸石)他
- 依存症に大量を用いる必要のある場合は観察を十分に行いながら投与すること。特に新生児,乳幼児への投与は少量から徐々に増量し,症状に適合した投与量に到達させること。
〈参 考〉大塚頌子他:小児内科,23(9):1417(1991)
19〈静注用鉄剤〉
含糖酸化鉄
[販 売 名] フェジン(吉富)他
[禁 忌]
- (重篤な腎障害のある患者[腎障害を増悪させるおそれがある。]を削除)
[慎重投与] 腎障害のある患者[腎障害が悪化するおそれがある。]
20〈静注用鉄剤〉
シデフェロン
[販 売 名] フェリコン(日本臓器)
[禁 忌]
- (重篤な腎障害を有する患者[増悪を来すおそれがある。]を削除)
[慎重投与] 重篤な腎障害を有する患者[増悪を来すおそれがある。]
〈参 考〉
- Anemia Working Group, Dialysis Outcomes Quality Initiative, National Kidney Foundation(USA):Clinical Practice Guidelines for the Treatment of Anemia of Chronic Renal Failure
山崎悟他:腎と透析,46(4):537(1999)
前田和弘他:新薬と臨床,47(3):286(1998)
川越裕也:日本網内系学会会誌,14(3):129(1975)
静注用鉄剤(InFeD)の添付文書(USA)
21〈抗腫瘍性抗生物質〉
アクチノマイシンD
[販 売 名] コスメゲン(萬有)
[副作用(重大な副作用)]
- 再生不良性貧血,無顆粒球症,汎血球減少等の骨髄抑制:重篤な血液障害があらわれることがあるので,頻回に臨床検査を行うこと。
肝静脈閉塞症:肝腫大,腹水等を伴う重篤な肝障害があらわれることがあるので,観察を十分に行うこと。
〈参 考〉 企業報告
22〈抗エストロゲン剤〉
クエン酸タモキシフェン
[販 売 名] ノルバデックス(ゼネカ)他
[相互作用(併用注意)]
- リファンピシン[本剤の血中濃度が低下したとの報告がある。ただし,相互作用に起因する効果の減弱及び副作用の報告はない。]
[副作用(重大な副作用)]
- 間質性肺炎:間質性肺炎があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
〈参 考〉 Kivisto, K. T., et al.:Clin. Pharmacol. Ther., 64:648(1998)
23〈ロイコトリエン受容体拮抗剤〉
プランルカスト水和物
[販 売 名] オノンカプセル(小野)
[重要な基本的注意]
- 本剤を含めロイコトリエン拮抗剤使用時にChurg-Strauss症候群様の血管炎を生じたとの報告がある。これらの症状は,おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は,好酸球数,血管炎症状(しびれ,発熱,関節痛,肺の浸潤等)等の推移に注意すること。
[副作用(重大な副作用)]
- 肝機能障害:黄疸,GOT・GPTの著しい上昇等を伴う肝機能障害があらわれることがあるので,観察を十分に行い,このような場合には投与を中止し適切な処置を行うこと。
24〈グリコペプチド系抗生物質〉
テイコプラニン
[販 売 名] 注射用タゴシッド(HMR)
[副作用(重大な副作用)]
- 血小板減少:血小板減少があらわれることがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
25〈ペネム系抗生物質〉
ファロペネムナトリウム
[販 売 名]
- ファロム錠150mg(サントリー)他
- 皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群):まれに皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群)があらわれることがあるので,観察を十分に行い,このような症状があらわれた場合には投与を中止し,適切な処置を行うこと。
[副作用(重大な副作用(類薬))]
- (皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群):類似化合物(ペニシリン系,セフェム系又はカルバペネム系薬剤等)で,まれに皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群)があらわれることが報告されているので,観察を十分に行い,このような症状があらわれた場合には投与を中止し,適切な処置を行うこと。を削除)
〈参 考〉 企業報告
連絡先
100−8045東京都千代田区霞が関1−2−2
厚生省医薬安全局安全対策課
03−3595−2435(直通)
[現在ご利用いただけません](内線)2751,2757
(Fax)03−3508−4364
NTTのファクシミリ通信網サービス「Fネット」を通じ,最近1年間の「医薬品等安全性情報」がお手元のファクシミリから随時入手できます(利用者負担)。
「Fネット」への加入等についての問い合わせ先: 0120−161−011
また,この情報はパソコン通信「MEDINET−P」を通じ日本薬剤師会より提供されています。なお他の医療情報用パソコン通信でも入手可能です。
日本薬剤師会中央薬事情報センター: 03−3406−9140
なお,医薬品情報提供ホームページ(http://www.pharmasys.gr.jp/)又は厚生省ホームページ(http://www.mhw.go.jp/)からも入手可能です。