| 現状 |
○医薬分業は順調に進展しており、特に、最近の伸びは著しく、平成12年度の処方せん枚数は約5億枚、医薬分業率は39.5%、対前年度比4.7ポイント増となっている。
○医薬分業の進展を支援するとともに、かかりつけ薬局の育成を図り、医薬分業のメリットがさらに広く国民に受け入れられるよう、次の事業を実施している。
| 上位10都県 (%) | 下位10府県 (%) | |||||
| 順位 | 都県名 | 分業率 | 順位 | 府県名 | 分業率 | |
| 1 | 秋田県 | 62.9 | 47 | 福井県 | 10.8 | |
| 2 | 佐賀県 | 58.9 | 46 | 石川県 | 12.2 | |
| 3 | 神奈川県 | 56.2 | 45 | 和歌山県 | 12.9 | |
| 4 | 東京都 | 53.3 | 44 | 富山県 | 19.1 | |
| 5 | 沖縄県 | 50.8 | 43 | 京都府 | 19.2 | |
| 6 | 福岡県 | 49.4 | 42 | 徳島県 | 20.7 | |
| 7 | 宮城県 | 49.0 | 41 | 大阪府 | 23.2 | |
| 8 | 長崎県 | 48.7 | 40 | 愛媛県 | 24.2 | |
| 9 | 宮崎県 | 48.4 | 39 | 奈良県 | 24.9 | |
| 10 | 青森県 | 48.2 | 38 | 高知県 | 26.6 | |
| 平成14年以降の予定事項 |
○医薬分業の質の向上を目指すとともに、国民がそのメリットを十分享受できる理想的な薬局像について検討を行う。また、質の高い医療を効率的に提供するために薬局機能を評価する仕組みの導入に向けた検討を行う。
| 都道府県への要請 |
○各都道府県におかれては、各種事業費を活用しつつ、医薬分業の量的な拡充と併せて質的な充実が図られるよう、積極的な取り組みをお願いする。
○なお、医薬分業推進支援センターの設備整備に対する補助事業において、昨年会計検査院から不当事項として指摘を受けた県があったところである。今後、当該補助事業の実施に当たっては、適正な執行に努められるようお願いする。
(2)薬剤師資格について
| 平成13年までの実施事項 |
○薬剤師については、これまで、
○薬事関係の障害者に係る欠格条項については、平成12年12月に、中央薬事審議会常任部会より、見直しを行うよう報告書が提出され、薬剤師の欠格条項については、次のような方針が立てられた。
○この報告書を踏まえ、「障害者等に係る欠格事由の適正化等を図るための医師法等の一部を改正する法律案」を平成13年通常国会に提出し、薬剤師法について必要な見直しを行ったところである。
○この改正により、薬剤師については、
| 都道府県への要請 |
○障害を有する薬剤師が適正に業務を行うため、適切な補助者の配置や設備の整備その他必要な措置が講じられるよう、地域の薬局等に対する御指導をお願いしたい。
| 現状 |
○薬剤師の資質向上のため、(財)日本薬剤師研修センターが実施する実務研修事業(厚生労働省の補助事業、平成9年度〜)が進められている。また、実務研修受入医療機関の問題点等を把握するため、「薬剤師卒後受入医療機関等確保対策検討事業」を行っている。
○薬剤師養成に係る諸問題については、「薬剤師養成問題懇談会」において、厚生労働省省、文部科学省、(社)日本薬剤師会、(社)日本病院薬剤師会、国公立及び私立の大学薬学部・薬科大学の関係者間で精力的に意見交換を行ってきた。昨年6月には、薬剤師を取り巻く環境の変化、国民から期待される薬剤師の役割、大学における薬学教育の改善の方向性等についてのこれまでの論点をとりまとめた「薬剤師養成問題に関する論点整理メモ」が作成され、現在、このメモなどを踏まえつつ薬学教育のコアカリキュラムが作成されているところである。
| 平成14年以降の予定事項 |
○薬剤師養成の問題については、長期に渡って議論されてきていることから、厚生労働省としては、関係団体等のご協力をいただきながら、薬学教育の修業年限に関するコンセンサスの構築を推し進めるとともに、コアカリキュラム(作成中)の内容を踏まえた新しい薬剤師国家試験の在り方等について検討を行う予定。
| 都道府県への要請 |
○各都道府県においては、引き続き、実務研修事業の地域薬剤師への周知等、実務研修事業への御協力をお願いする。
| 平成12年中の実施事項 |
○ 形状に関する規制を緩和し、食品と明示されている場合、原則として、形状のみによって医薬品に該当するか否かの判断は行わないこととした。(平成12年4月5日医薬安全局長通知「医薬品の範囲に関する基準の一部改正について」)
| 平成13年中の実施事項 |
| 平成14年以降の予定事項 |
○ 新たな成分本質(原材料)について定期的に通知を改正し、リストに掲載していく予定。
| 都道府県への要請 |
○ 新たな成分本質(原材料)について、ご照会の際は、十分な資料の提出をお願いいたしたい。
○ 新たな保健機能食品制度が創設されたことを踏まえ、薬務主管課(部)と食品主管課(部)の連携を密に行うなど、無承認無許可医薬品の監視指導の円滑な実施につき協力方お願いしたい。
(2)医薬品の販売規制について
| 平成13年中の動き |
○ 旧中央薬事審議会で医学的・薬学的観点からの十分な審議を行った上で、平成11年3月にビタミン含有保健剤等15製品群が一般用医薬品から医薬部外品に移行されたが、平成13年3月に閣議決定された「規制改革推進3か年計画」においても、これを踏まえ、医薬品の範囲について、一般小売店でも販売可能とするための見直しを必要に応じ引き続き行うこととされている(※1)。
○ 平成13年12月には、総理の諮問機関である総合規制改革会議が「規制改革の推進に関する第1次答申」をとりまとめ、その中で医薬品販売に関する規制緩和について述べられている(※2)。
○ 今後とも、閣議決定を踏まえ、医薬品の範囲について必要に応じ見直しを行うこととなるが、厚生労働省としては専門家等の意見を踏まえつつ、国民の生命や健康を第一に考え、適切に対応していきたいと考えている。
(※1)医薬品販売における範囲の見直し【実施状況を踏まえつつ、必要に応じ見直しを実施】
(※2)医薬品販売に関する規制緩和【平成14年度中に措置(逐次実施)】
○開示請求
平成13年4月の情報公開法の施行に伴い、国民一般、マスコミ、患者団体、薬事関連企業等による開示請求に対し、不開示とする情報の範囲を定めた審査基準「医薬局の保有する情報の公開に係る開示・不開示基準」を基に対応しているところ。
現在までに、医薬局に対する開示請求は約1200件(厚生労働本省全体の約5割)があり、約1000件の開示・不開示決定を行った。
[主な開示請求の内容]
| 平成14年以降の予定事項 |
○先の国会で特殊法人等情報公開法が成立し、本年中に施行される予定。
| 都道府県への要請 |
○ 各都道府県において保有する医薬品等にかかる行政文書の公開にあたっては、「医薬局の保有する情報の公開に係る開示・不開示基準」を参考にしつつ、各都道府県において整備された条例等にしたがい、適正な情報公開の推進に努められるようお願いする。
4.医薬品・医療用具の承認審査等
(1)医薬品・医療用具の承認審査
| 平成13年までの実施事項 |
| 平成14年以降の予定事項 |
○ リスクの低い医療用具については、「規制改革推進3カ年計画」(平成13年3月30日閣議決定)に示されている考え方に基づき、第三者認証制度の導入を図るため、第三者認証機関が備えるべき要件や認証基準など必要なインフラの整備を順次進めるとともに、リスクの高い医療用具については、治験相談の他申請資料の信頼性確保等を図るためのマニュアル等の整備を進めていく予定である。
(2)生物由来医薬品・医療用具等の品質及び安全性確保対策
| ヒト・動物由来の医薬品等の対策 |
○ ヒトや動物の細胞・組織から構成される医薬品や医療用具(細胞・組織利用医薬品等)については、人工培養皮膚や人工培養軟骨、分離や増殖を行った幹細胞、トランスジェニック動物を用いた移植用臓器などの開発が進展しているが、これらの細胞・組織利用医薬品・医療用具等については、
○ こうした現状を踏まえ、平成12年12月の中央薬事審議会バイオテクノロジー特別部会において「細胞・組織利用医薬品等の取扱い及び使用に関する基本的考え方」及び「ヒト由来細胞・組織加工医薬品等の品質及び安全性確保に関する指針」がまとめられた。
○ 平成13年3月には、この「基本的考え方」に基づき、細胞又は組織採取や製造段階時などの品質確保対策として、薬事法第42条に基づく「細胞組織医薬品及び細胞組織医療用具に関する基準」の整備、及び「医薬品及び医薬部外品の製造管理及び品質管理規則(GMP)」等の省令改正を行った。
○ ヒト又は動物由来原料を使用する医薬品・医療用具等についても、品質及び安全性を確保するため、製造・輸入業者に対し、「基本的考え方」に基づき、自主点検を行い、平成14年3月末までに承認書の整備を行うことを指示。
| 都道府県への要請 |
○ ヒト又は動物由来原料に関する承認書の記載整備及び原料の切替え等に伴う一部変更承認申請に関する進達及び都道府県知事承認品目に係る事務処理を円滑に行われたい。
(3)後発医薬品の品質確保対策等
| 現状 |
○ 後発医薬品は、国民医療上一定の役割を果たしているが、経口固形剤の溶出性等その品質が不十分なものがあるのではないかとの指摘がある。このため、平成7年4月以降に申請された医療用の新内服用医薬品について、溶出規格の設定を行うこととし、当該医薬品の後発品についても、既承認品目(先発品)との有効成分の同一性に加え、溶出性の同一性についても確認した上で承認することとしている。
○ 平成7年4月以前に申請された内服用医薬品についても品質の信頼性を確保するため、平成10年度より計画的に再評価を着実に実施している。既に、生産額構成比において約90%以上のものについて指定を行い、順次、溶出試験規格を策定して再評価を行っており、平成15年度中には再評価の指定を終了したいと考えている。
○ 品質再評価にあたっては、国立医薬品食品衛生研究所及び10都府県(埼玉県、東京都、神奈川県、富山県、静岡県、愛知県、京都府、大阪府、兵庫県、福岡県)の衛生研究所の御協力を得て溶出試験規格を策定しているところであり、お礼申し上げたい。
○ 品質再評価の結果については、その都度「医療用医薬品品質情報集(日本版オレンジブック)」を公表するとともに、品目リストをインターネット(医薬品情報提供システムhttp://www.pharmasys.gr.jp/)において公開している。これまでの結果については、以下のとおり。
○ なお、このほど脳循環代謝改善薬の有効性の再評価が全て終了したところであるが、12月11日に公表された総合規制改革会議の答申において、既存薬の効能に関する再評価を充実すべき旨指摘されており、有効性の再評価についても、今後着実に実施する予定。
(品質再評価結果について)
| 回 | 年月日 | 成分・処方数 | 規格数 | 品目数 | 承認整理品目数 |
| 第1回 | 平成11年3月23日 | 6 | 11 | 137 | 21 |
| 第2回 | 平成11年10月7日 | 8 | 21 | 209 | 34 |
| 第3回 | 平成12年 2月16日 | 5 | 19 | 94 | 20 |
| 第4回 | 平成12年 5月11日 | 13 | 36 | 135 | 13 |
| 第5回 | 平成12年 7月25日 | 9 | 19 | 42 | 6 |
| 第6回 | 平成12年10月12日 | 10 | 20 | 61 | 8 |
| 第7回 | 平成12年12月21日 | 16(14) | 35 | 97 | 9 |
| 第8回 | 平成13年4月25日 | 21(18) | 48 | 216 | 27 |
| 第9回 | 平成13年7月3日 | 18(16) | 31 | 148 | 11 |
| 第10回 | 平成13年10月3日 | 14(12) | 30 | 113 | 6 |
| 第11回 | 平成13年12月25日 | 22 | 44 | 174 | 12 |
| 計(成分数は重複を除いた数) | 133 | 314 | 1,426 | 167 | |
| 平成14年以降の予定事項 |
○品質再評価の指定においては、下記のスケジュールに従い、順次、実施する予定。
| 回 | 薬効分類 | 予試験指示 | 指定告示 |
| 第16回 | 自律神経用剤、副腎ホルモン剤 | 平成13年10月 | 平成14年1月 |
| 第17回 | 鎮咳剤、鎮咳去たん剤、酵素製剤 | 平成13年12月 | 平成14年4月 |
| 第18回 | 吸器促進剤、泌尿器官用剤、痔疾用剤、ビタミンA及びD剤、ビタミンE剤、ビタミンK剤、その他ビタミン剤、主としてグラム陰性菌に作用するもの、抗ウイルス剤、機能検査用試薬 | 平成14年2月 | 平成14年7月 |
| 第19回 | 局所麻酔剤、骨格筋弛緩剤、止しゃ剤、整腸剤、下剤、浣腸剤、混合ホルモン剤、サルファ剤 | 平成14年4月 | 平成14年7月 |
| 第20回 | 精神神経用剤 | 平成14年6月 | 平成14年10月 |
| 第21回 | たん白同化ステロイド剤、カルシウム剤、無機質製剤、その他抗生物質製剤(複合抗生物質製剤を含む)、抗原虫剤、駆虫剤 | 平成14年8月 | 平成15年1月 |
| 第22回 | 甲状腺及び副甲状腺ホルモン剤、男性ホルモン剤、その他の細胞賦活用剤、抗ヒスタミン剤、主としてカビに作用するもの、抗結核剤 | 平成14年10月 | 平成15年1月 |
| 第23回 | 興奮剤、覚せい剤、総合感冒剤、眼科用剤、耳鼻科用剤、その他の外皮用薬、その他の個々の器官系用医薬品、止血剤、主としてグラム陽性・陰性菌、リケッチア、クラミジアに作用するもの、あへんアルカロイド系麻薬 | 平成14年12月 | 平成15年4月 |
| 第24回 | ビタミンB1剤、ビタミンC剤、混合ビタミン剤、主としてグラム陽性菌に作用するもの | 平成15年2月 | 未定(平成15年度中) |
| 第25回 〜 |
再評価指定時において再審査期間中であっ た医薬品 |
未定(平成15年度中) | 未定(平成15年度中) |
| 都道府県への要請 |
○ 品質再評価の円滑な処理のため、申請期限後できるだけ速やかな進達に努めていただくようお願いする。また、業者が期限に遅れて申請し、又は申請を失念することなどのないよう適切な指導をお願いしたい。
(4)承認審査に関する国際的調和の推進
| 現状 |
| 都道府県への要請 |
| 平成13年中の実施事項 |
○ ヒト由来細胞・組織加工医薬品や培養皮膚・軟骨等の細胞利用医薬品・医療用具について、GMPハード、GMPソフト、GMPI等について以下の内容の省令改正を行った。(4月1日施行)
○ ICH原薬GMPガイドラインを周知した。(通知)
○ 薬事監視に関する情報の交換・共有化を図るため、本年度中には「薬事監視情報交換システム」の運用を開始する予定。当面はGMPに関する情報を中心として運用する。
| 平成14年以降の予定事項 |
○ 引き続き大臣許可施設のGMP査察は地方厚生局で行う。
| 都道府県への要請 |
○ 輸入販売業者によるGMPIの遵守のため、その趣旨及び具体的実施方法等について指導の強化をお願いしたい。
○ 大臣許可施設については地方厚生局で立入検査を実施することとなるが、日本赤十字社血液センターに対するGMP通常監視については、引き続き都道府県のご協力をお願いしたい。
○ 薬事監視情報交換システムは、監視指導における業務の迅速化・効率化を図ることを目的として、国と地方自治体との間の情報ネットワークを内容とするものであり、国及び都道府県間におけるGMP査察等に十分活用されたい。
(2) 医薬品の市販後安全対策
| 新しい制度の概要 |
医薬品の市販後安全対策を強化するため、平成12年12月の医薬品の市販後調査の基準に関する省令(医薬品GPMSP)等の改正により、「市販直後調査」制度を新設し、昨年10月1日に施行した。本制度の具体的な内容は次のとおり。
○ 新医薬品の承認までに得られる有効性、安全性に関する情報等については、患者数、併用薬、合併症、年齢等に関する一定の制限のもとに行われる治験等により得られたものに限られることから、限定された情報とならざるを得ない。しかし、新医薬品がいったん販売開始されると、治験時に比べてその使用患者数が急激に増加するとともに、使用患者の状況も治験時に比べて多様化することから、治験段階では判明していなかった重篤な副作用等が発現する可能性がある。
○ これまで、市販後の情報収集については、医薬品の市販後調査の基準に関する省令(医薬品GPMSP)等に基づき実施してきたところであるが、こうした新医薬品の特性に応じ、注意深い使用を促し、重篤な副作用、感染症が発生した場合の情報収集体制を強化するため、「市販直後調査」制度が新設された。
この市販直後調査は、
| 都道府県への要請 |
○ 昨年10月以降に承認されたものから順次実施されているところであり、関係企業に対して本制度の趣旨及び具体的な内容について周知徹底を行うなど新たな仕組みが円滑に導入されるようご協力をお願いする。
(3)医療用具の市販後安全対策
・医家向け医療用具の添付文書記載要領
| 現状 |
医療用具の添付文書については、平成7年6月26日付け薬発第600号薬務局長通知「薬事法の一部を改正する法律の施行について」により、その適正運用に努めてきたところであるが、近年、医療技術の進歩や科学技術の進歩に伴い、医療を支える道具としての医療用具の重要性が一層増している一方、医療用具が関与する医療事故の報告が増加している。
また、添付文書のなかには情報内容に乏しいものも散見されることから、添付文書の内容を充実し、より理解しやすく活用しやすい内容にすることにより、医療用具の適正使用を一層推進する必要があるため、「医家向け医療用具添付文書の記載要領」を定め、平成13年12月14日付けで公布した。
| 都道府県への要請 |
医療用具については、都道府県知事承認品目や承認不要品目もあることから、これらの品目に係る添付文書の作成等にあたっては、貴管下関係業者、団体等に対し周知徹底を図るとともに、医家向け医療用具添付文書に関する指導につき格段の御配慮を願いする。
なお、既存の製品については平成15年1月13日までの猶予期間をおいているので、これまでに整備していない業者がいる場合には、指導方お願いする。
(4)薬事監視の状況
| 現状 |
○ 医薬品、医薬部外品、化粧品及び医療用具の品質不良、不正表示、虚偽誇大広告等の指導取締りを行うため、厚生労働省並びに各都道府県、保健所設置市及び特別区に薬事監視員3,551名(平成13.4.1現在)が配置され、製造業者、輸入販売業者、販売業者その他業務上医薬品等を取り扱う者の施設に随時立ち入り検査等を行い、不良医薬品等の発見、発生防止に努めている。
○ 平成12度中には許可届出施設488,741施設のうち119,268施設及びその他業務上取り扱う施設に立入検査を行った結果(許可届出施設に対する立入検査率24.4%)
| 都道府県への要請 |
○ 薬局等における薬剤師不在問題について、前年度の結果と比較するとやや悪化している。引き続き薬局等医薬品販売業者に対する監視指導の徹底をお願いする。
○ 医薬品、医療用具等の自主回収が着手された場合には、平成12年度からすべての事例をインターネット上で公開しているが、平成13年4月から11月までの件数は268件であり平成12年度同時期の251件から増加している。また、死亡又は重篤な健康被害が予想されるクラスIが13件(12年度同時期10件)、一時的な健康被害が予想されるクラスIIが153件(12年度同時期96件)といずれも増加しており、製造業者、輸入販売業者に対してさらなる品質確保の徹底をご指導願いたい。
○ また、製造業者、輸入販売業者は医薬品、医療用具等の自主回収着手の届けをした後、迅速にこれを進めることが求められているが、クラスIとして自主回収の着手報告を提出した後、数か月たっても回収が進捗せず、県から回収命令が出された事例が平成13年10月にあった。同様の例は平成12年度にも1件あり、各都道府県におかれては、回収に着手した製造業者等に対し、回収の進捗状況につき定期的に報告を求める等、必要な指導を徹底されるようお願いする。
6.医薬品・医療用具等におけるBSE対策
(1)リスクの高い部位の使用禁止措置等
| これまでに行った対策 |
○ 平成12年12月、品質及び安全性確保のための予防的措置を講ずるため、ウシ等由来原料の原産国にかかわらず医薬品、医療用具、医薬部外品及び化粧品について製造業者等に以下の事項を指示。
| 都道府県等への要請 |
○ 引き続き、企業による自主的な回収等の着手及び完了に対する指導をお願いする。
○ 原料としての使用が禁止されたウシ等由来物から製造された医薬品、医療用具等を製造・輸入する企業に対し、可及的速やかな原料の切替又は承認整理等に関する指導をお願いする。
| 左欄 | 右欄 |
| BSEが発生している国 | 英国、ポルトガル、スイス、フランス、チェコ、アイルランド、オマーン、オランダ、ベルギー、デンマーク、ルクセンブルグ、ドイツ、ギリシャ、イタリア、スペイン、リヒテンシュタイン、日本 |
| BSEのリスクの高い国 | アンドラ、アルバニア、オーストリア、ボスニア・ヘルチェゴビナ、ブルガリア、ノルウェー、クロアチア、ユーゴスラビア、フィンランド、ハンガリー、マケドニア、モナコ、ポーランド、ルーマニア、スロバキア、スウェーデン、サンマリノ、キプロス、エストニア、リトアニア、スロベニヤ |
| BSEのリスクの低い国 | アルゼンチン、オーストラリア、ボツワナ、ブラジル、チリ、コスタリカ、エルサルバドル、ナミビア、ニカラグア、ニュージーランド、パナマ、パラグアイ、シンガポール、スワジランド、ウルグアイ、カナダ、コロンビア、インド、ケニア、モーリシャス、ナイジェリア、パキスタン、米国 |
| 原料として使用が禁止されているウシ等の部位 |
| 脳、脊髄、眼、腸、扁桃、リンパ節、脾臓、松果体、硬膜、胎盤、脳脊髄液、下垂体、胸腺又は副腎 |
(2)企業による自主点検の徹底等
| 現状 |
○ 平成13年10月29日、回収等の予防的措置を効果的・効率的に行うため、ウシ等由来製品に関するBSE感染の理論的リスクを科学的に評価し、製品のリスクに応じた優先順位を示した。
また、平成13年10月2日付けの通知に基づく、企業による自主点検の結果及び自主的回収等の状況を定期的に公表している。平成13年12月25日時点における状況は、以下のとおり。
| 報告品目数 | 回収等着手 品目数(率) (A) |
回収等完了 品目数(率) (B) |
回収等着手又は 完了品目数(率) (A)+(B) |
|
| 区分(イ) | 46 | − | 46(100%) | 46( 100%) |
| 区分(ロ) | 828 | 425(51.3%) | 403(48.7%) | 828( 100%) |
| 区分(ハ) | 1,788 | 1, 261(70.5%) | 486(27.2%) | 1, 747(97.7%) |
| (注) | 区分(イ): リスクの目安が1/1万〜1/100万 |
| 区分(ロ): 同 1/1億 | |
| 区分(ハ): 同 1/100億 |
| 都道府県等への要請 |
○ 引き続き、企業による自主的な回収等の着手及び完了に対する指導をお願いする。
○ 原料としての使用が禁止されたウシ等由来物から製造された医薬品、医療用具等を製造・輸入する企業に対し、可及的速やかな原料の切替又は承認整理等に関する指導をお願いする。
過去5年間の新医薬品承認状況(新有効成分数)
| 年次 | 製造 | 輸入 | 合計 |
| 9年 | 5 | 10 | 15 |
| 10年 | 8 | 14 | *21 |
| 11年 | 12 | 28 | *39 |
| 12年 | 10 | 29 | 39 |
| 13年 | 8 | 15 | 23 |
| 年次 | 製造 | 輸入 | 外国製造 | 合計 |
| 9年 | 16 | 51 | 0 | 67 |
| 10年 | 12 | 21 | 0 | 33 |
| 11年 | 10 | 23 | 0 | 33 |
| 12年 | 5 | 8 | 0 | 13 |
| 13年 | 3 | 14 | 1 | 18 |
| 暦 年 |
区分 | 製造(輸入)承認関係 | 製造(輸入)許可関係 | 合計 | |||||
| 新規承認 | 一変承認 | 計 | 追加・変更 | 業許可 | 更新許可 | 計 | |||
| 平 成 11 年 |
医薬品 | 1,807 | 1,671 | 3,478 | 191 | 4 | 18 | 213 | 3,691 |
| 医薬部外品 | 2,544 | 262 | 2,806 | 0 | 0 | 0 | 0 | 2,806 | |
| 化粧品 | 451 | 247 | 698 | 0 | 0 | 0 | 0 | 698 | |
| 医療用具 | 1,493 | 1,536 | 3,029 | 0 | 0 | 0 | 0 | 3,029 | |
| 合計 | 6,295 | 3,716 | 10,011 | 191 | 4 | 18 | 213 | 10,224 | |
| 平 成 12 年 |
医薬品 | 1,734 | 2,246 | 3,980 | 130 | 7 | 44 | 181 | 4,161 |
| 医薬部外品 | 2,773 | 350 | 3,123 | 0 | 0 | 0 | 0 | 3,123 | |
| 化粧品 | 534 | 277 | 811 | 0 | 0 | 0 | 0 | 811 | |
| 医療用具 | 1,528 | 1,388 | 2,916 | 0 | 0 | 0 | 0 | 2,916 | |
| 6,295 | 3,716 | 10,011 | 191 | 4 | 18 | 213 | 20,448 | ||
| 合計 | 6,569 | 4,261 | 10,830 | 130 | 7 | 44 | 181 | 11,011 | |
| 平 成 13 年 |
医薬品 | 2,210 | 6,158 | 8,368 | 194 | 3 | 14 | 211 | 8,579 |
| 医薬部外品 | 2,307 | 2,501 | 4,808 | 0 | 0 | 0 | 0 | 4,808 | |
| 化粧品 | 117 | 20 | 137 | 0 | 0 | 0 | 0 | 137 | |
| 医療用具 | 1,315 | 1,367 | 2,682 | 9 | 3 | 0 | 12 | 2,694 | |
| 合計 | 5,949 | 10,046 | 15,995 | 203 | 6 | 14 | 223 | 16,218 | |
| 現状 |
○ 少子高齢社会の一層の進展により、血液製剤の使用量の増加が見込まれる一方で、献血の担い手である若年層が減少することが予想されていることから、今後、若年層を中心とした国民各層への成分献血、400ml 献血を主体とした献血の推進をより一層展開する必要がある。
| 都道府県への要請 |
○ 各都道府県においては、的確な採血計画の策定を行うなど管下市町村及び各血液センターと十分な連携を図りつつ、献血制度推進特別事業に係る国庫補助金の活用等により若年層対策など効果的な献血推進運動を実施されたい。
○ また、献血思想普及活動を一層全国的な運動として展開することが重要であることから、献血推進運動に携わる関係者の協議の場として平成11年度に設置した「献血推進運動中央連絡協議会」の趣旨を御理解の上、積極的な活用をお願いする。
(2)血液凝固第VIII因子製剤の供給見通しについて
| 現状 |
○ 遺伝子組換え血液凝固第VIII因子製剤の一部輸入製剤に係る供給の一時停止により、国内への供給不足が懸念された。このため国内における血液凝固第VIII因子製剤の安定供給を確保するため、成分献血を主とした献血の推進について協力をお願いするなどによって、製造に必要な原料血漿を確保するなどとともに、国内製造者に対して最大限の増産を要請しているところであるが、現時点において、短期的には第VIII因子製剤の供給不足が生じる心配はない。
| 平成14年度以降の見通し |
○ 平成14年末までの間、全体として必要最小限の在庫を維持しつつ、患者の需要を満たすことが可能と見込まれる。なお、今後の供給見通しについては、適宜情報を提供する予定である。
(3)原料血漿の確保
| 現状 |
○ 全ての血液製剤の国内自給の達成に必要な原料血漿150万Lを確保するため、毎年度、都道府県別原料血漿確保目標量を設定しその達成をお願いしてきているが、平成14年度の目標量は、108万Lと設定し、昨年9月の血液事業担当者会議において示したところである。
| 平成14年度以降の予定 |
○ 血漿分画製剤の国内自給に必要な原料血漿を確保するとともに、ウィンドウ・ピリオド対策に活用するため、日本赤十字社において複数回献血を推進するモデル事業(健康管理増進事業の充実、献血ルームにおけるサービスの向上等)を実施する予定。
| 都道府県への要請 |
○ 平成14年度の原料血漿確保目標量の確実な達成をお願いする。
(4)血液製剤の安全性確保対策の推進
| 現状 |
○ 安全な血液製剤を供給するためには問診や各種ウイルス等の検査の充実、製造工程の厳格な管理等が必要であることから、最近では次のような取り組みを進めている。
○ HIV検査目的の献血を防止するため、検査目的の献血の危険性の周知とともに、検査については保健所等を活用するように広く住民への呼びかけを行っている。
○ 自己血輸血については、医療機関における採血、保存等に当たって、専門的技術を有する血液センターの協力を得つつ、その普及に努めている。
○ 輸血によるvCJD発症の可能性は科学的に未知であるが、理論的感染のリスクを減らす観点から、当分の間の予防措置として、献血時の欧州渡航歴に関する問診の強化を実施しており、血液センターの協力を得つつ国民の理解を得られるよう努めている。
| 平成14年以降の予定事項 |
○ HIV等検査目的の献血者の排除のための問診の強化策についての検討
○ NAT実施方法に関するガイドラインの策定
○ 保存前白血球除去の導入に関する検討
○ 院内採血ガイドラインの策定
| 都道府県への要請 |
○ 各都道府県においては、引き続き、検査目的の献血の危険性等について広く住民へ呼びかけるとともに、自己血輸血について管下血液センターから医療機関への適切な支援が得られるよう特段の御協力をお願いする。
(5)血液製剤の適正使用の推進
| 現状 |
○ 平成11年度においては、血液製剤の適正使用を推進するため、次のような基準等の見直しを実施した。
○ 各都道府県において、地域医療の代表者及び医療機関の管理者等の委員からなる血液製剤の使用に関する懇談会が設置され、多くの都道府県において、当該懇談会を通じて血液製剤の使用に係る問題点の整理が進んでいる。
| 都道府県への要請 |
○ 各都道府県においては、引き続き医師等の医療従事者を対象とした指針の説明会を行うとともに、二次医療圏の中核病院を対象とした専門家による個別説明会を実施し、これらの指針に基づく血液製剤の適正使用及び輸血療法の適正化に一層努めるようお願いする。
○ 特に適正使用の進んでいない都道府県においては、血液製剤の使用に関する懇談会の場などを活用して、調査・分析等による改善策の検討をお願いする。
8.ワクチン等対策
(1)インフルエンザワクチン
| 現状 |
○ 今冬のインフルエンザワクチンについては、昨冬の1.4倍の約1,060万本が製造された。インフルエンザワクチンは、製造から供給までに4〜5ヶ月を要することから、その需要を製造前の段階に適切に見込むことは難しい面があるが、より需要に見合う量のワクチンをできる限り円滑に供給できるようワクチン製造業者、卸売業者、医療機関、都道府県などの関係者からなる「インフルエンザワクチン需要検討会」を設置し、ワクチンの接種状況の把握及び需要予測のための検討を行っているところである。
○ さらに、製造されたワクチンが安定的に供給されるよう、卸売販売業者に対して相互融通を求めるとともに、各医療機関や各卸売業者が過剰な量の注文・供給を行わないよう昨年10月に依頼したところである。
○ なお、予防接種法の一部改正により、昨年11月7日から、65歳以上の高齢者等へのインフルエンザワクチンの予防接種が、公費負担による市町村事業として行われることとなり、これに伴い一時的にワクチンの供給が逼迫した地域が一部にあったが、都道府県、製造業者及び卸売業者等の協力により、その調整が行われたところである。
| 都道府県への要請 |
○ 各都道府県においても、インフルエンザ対策委員会の設置をはじめ、種々の取組、協力をいただいたところであるが、今後とも、インフルエンザワクチンの安定的供給確保について、引き続き御協力をお願いする。
(2)その他のワクチン及び抗毒素
| 現状 |
○ 伝染病等の予測及び需給の見通しが困難であるコレラワクチン、ガスえそウマ抗毒素等は、製造に長期間を要することや、有効期間が短いこと等の特殊性から、緊急時の対処等を目的に国家買い上げを行い、一定量備蓄している。
○ これらの供給については、昭和26年8月6日付薬発第357号「国有ワクチン供給要領」により、都道府県からの供給申請に基づき、緊急時には速やかに供給できるよう万全を期している。
| 都道府県への要請 |
○ 各都道府県においては、緊急時の供給に対処するべく、ワクチン及び抗毒素を平素から備蓄する等引き続きその供給体制に万全を期すよう御配慮をお願いする。
9.医薬品副作用被害等の救済
(1)医薬品副作用被害救済制度
| 現状 |
○ 医薬品副作用被害救済・研究振興調査機構において、昭和55年5月1日以降に使用した医薬品の副作用による健康被害の迅速な救済を図る観点から医療費、障害年金、遺族年金等の給付を行っている。
(平成12年度には343件、総額9億3515万円の給付を実施)
○ 例年10月の「薬と健康の週間」の期間中に、救済制度のパンフレット、リーフレット等を同機構から全国の主要医療機関、医師会や病院団体等の医療関係機関、都道府県等の行政関係機関に配布し、救済制度の周知を図っている。
| 都道府県への要請 |
○ 救済制度の適切な運営を図るためには、副作用の治療にあたる医療機関の理解が不可欠であることから、引き続き管下の医療機関に対する周知方お願いする。
(2)エイズ訴訟和解の推進
| 現状 |
○ エイズ訴訟については、平成8年3月に和解が成立したところであるが、未提訴の血友病患者等の方々については、プライバシーに配慮しつつ、訴えの提起を待って順次和解を進めている。
(平成13年末の和解患者数は 1,348名であり、既に大半の患者が和解済みの状況)
| 都道府県への要請 |
○ 厚生労働省では、全国の主要医療機関、血友病治療専門医、関係学会等に対し、未提訴の血友病患者等の方々に対する和解の枠組の周知等について協力をお願いする文書を送付しているので、引き続きその周知についてご協力方お願いする。
(参考)エイズ訴訟の和解等
I.エイズ訴訟の和解内容
| (1)一時金 | 1人 4,500万円 (製薬会社6割、国4割負担) |
| (2)発症者健康管理手当 | 月額 15万円 (製薬会社6割、国4割負担) |
| (3)未提訴者の取扱い | |
| 未提訴者についても、訴えの提起を待って、非加熱製剤の使用によるHIV感染の事実についての証拠調べを実施した上、順次和解の対象とする。 | |
* 和解に関する照会先
| 厚生労働省医薬局総務課医薬品副作用被害対策室 住所 東京都千代田区霞が関1−2−2 TEL(03)3595-2400 |
II.健康管理費用について
血液製剤によるHIV感染者であってエイズ発症前の者に対し、「健康管理費用」を支給し、健康状況を報告していただき、HIV感染者の発症予防に役立てる事業
| CD4の値が200を越える者 | 月額 36,330円 |
| CD4の値が200以下の者 | 月額 52,330円 |
| (CD4:免疫機能の状態を示すT4リンパ球の1μリットル当たりの数) | |
* 健康管理費用の支給に関する照会先
| 医薬品副作用被害救済・研究振興調査機構 業務部 調査研究事業担当 住所 東京都千代田区霞が関3−3−2 TEL(03)3506-9415 |
| 現状 |
○ 医療法第25条による医療機関への立入検査については、平成12年4月より自治事務となったところであるが、特定機能病院に対する立入検査については、各自治体に加え、厚生労働省も実施できることとされており、平成12年度から各自治体と合同での立入検査を実施している。
○ 平成13年1月の省庁再編に伴い、厚生労働省に各地方厚生局が設けられ、特定機能病院に対する立入検査については、この地方厚生局が各自治体と合同で実施している。
| 都道府県への要請 |
○ 都道府県においては、各地方厚生局の医療監視専門官等と連絡を密にし、引き続き円滑な合同の立入検査の実施ができるよう、御協力をお願いしたい。
○ 立入検査に関連する情報については、幅広く各地方厚生局を通じて情報提供をお願いしたい。
(2)院内感染防止対策
| 平成13年中に実施した事項 |
医療施設における院内感染対策は、(1)手洗いの励行、(2)清掃等院内の環境整備、(3)院 内感染に関する医療従事者への教育が基本である。こうした医療機関における院内感染 対策を支援するため、厚生労働省では次のような事業を進めたところ。
| 平成14年以降の予定 |
| 都道府県への要請 |
内分泌かく乱化学物質は、内分泌系の機能をかく乱して、生殖系、神経系等に重大な障害を与えることが懸念されているが、どのような化学物質に内分泌かく乱作用があるのか等、未解明な部分が多く、厚生労働省では主として健康影響の観点から、国際的な枠組みや他省庁とも協力して、必要な調査研究及び検討を進めているところである。
| 平成13年中の実施事項 |
○ 「内分泌かく乱化学物質の健康影響に関する検討会」では、中間報告(平成10年11月)後の調査研究の成果を踏まえ、引き続き検討を重ねたうえで、次の重点事項について、検討成果と今後の取組を中間報告書追補としてとりまとめた。
(注)平成13年度予算 内分泌かく乱化学物質スクリーニング試験実施事業(31,847千円)
○ 平成13年度厚生科学研究において以下の調査研究等を実施した。
| 平成14年以降の予定事項 |
○ 「内分泌かく乱化学物質の健康影響に関する検討会」中間報告書追補に記された行動計画を実行に移す。
○ スクリーニング試験実施事業についても平成17年度までを目途に順次実施する予定。
| 都道府県への要請 |
○ 上記実施結果や試験結果については適宜情報提供を行っていく予定であるので、各都道府県におかれては関係各方面への周知等御協力をお願いする。
(2)シックハウス対策の推進
近年、家庭用品、建材等から室内に放散する化学物質による室内空気汚染とそれによる健康影響が指摘され、「シックハウス症候群」と呼ばれて社会問題化していることから、省内及び関係省庁とも連携・協力して、原因分析、基準設定、防止対策、相談体制整備、医療・研究対策などのシックハウス総合対策を図っているところである。
| 平成13年中の実施事項 |
○ 平成12年4月より「シックハウス(室内空気汚染)問題に関する検討会」を開催しているところであるが、平成13年7月に新たに中間報告書をとりまとめた。主な内容は下記の通りである。
○ また、厚生科学研究により室内汚染や健康影響の実態調査等のシックハウス症候群に関する研究を実施した。
| 平成14年以降の予定事項 |
○ 引き続き指針値及び標準的測定法の策定を推進する。
○ 測定マニュアル、相談マニュアル等、各種マニュアルの改訂を進める。
| 都道府県への要請 |
○ これまでに策定した指針値やその他の「シックハウス(室内空気汚染)問題に関す検討会」における検討事項については、各都道府県、政令市、特別区あて通知し、関係各者への周知等をお願いしているところである。今後とも適宜情報提供を行うこととしているので引き続きご協力をお願いする。
表1
| 揮発性有機化合物 | 毒性指標 | 室内濃度指針値* |
| ホルムアルデヒド | ヒト吸入暴露における鼻咽頭粘膜への刺激 | 100μg/m3 (0.08ppm) |
| トルエン | ヒト吸入暴露における神経行動機能及び生殖発生への影響 | 260μg/m3 (0.07ppm) |
| キシレン | 妊娠ラット吸入暴露における出生児の中枢神経系発達への影響 | 870μg/m3 (0.20ppm) |
| パラジクロロベンゼン | ビーグル犬経口暴露における肝臓及び腎臓等への影響 | 240μg/m3 (0.04ppm) |
| エチルベンゼン | マウス及びラット吸入暴露における肝臓及び腎臓への影響 | 3800μg/m3 (0.88ppm) |
| スチレン | ラット吸入暴露における脳や肝臓への影響 | 220μg/m3 (0.05ppm) |
| クロルピリホス | 母ラット経口暴露における新生児の神経発達への影響及び新生児脳への形態学的影響 | 1μg/m3 (0.07ppb) 但し、小児の場合は 0.1μg/m3 (0.007ppb) |
| フタル酸ジ-n-ブチル | 母ラット経口暴露における新生児の生殖器の構造異常等の影響 | 220μg/m3 (0.02ppm) |
| テトラデカン | C8-C16混合物のラット経口暴露における肝臓への影響 | 330μg/m3 (0.04ppm) |
| フタル酸ジ-2-エチルヘキシル | ラット経口暴露における精巣への病理組織学的影響 | 120μg/m3 (7.6ppb) |
| ダイアジノン | ラット吸入暴露における血漿及び赤血球コリンエステラーゼ活性への影響 | 0.29μg/m3 (0.02ppb) |
* 両単位の換算は、25℃の場合による
太字が平成13年中に新たに指針値が策定された物質。
(3)特定化学物質の環境への排出量の把握等及び管理の改善の促進に関する法律(PRTR法)について
PRTR法とは(Pollutant Release and Transfer Register)
事業者による化学物質の自主的な管理の改善を促進し、環境の保全上の支障を未然に防止するため、1)特定の化学物質の環境への排出量等把握に関する措置、2)事業者による特定の化学物質の性状及び取扱いに係る情報の提供に関する措置、を講じることを定めた法律である。平成11年7月に制定され、厚生労働省は、管理すべき化学物質を選定し、また、業を所管することにより、この法律に関与している。
| 平成13年中の実施事項 |
○ PRTR法の制定後、法施行令(管理すべき化学物質の指定、対象業種等)及び法施行規則(排出量等の算出方法、届出事項、届出の方法等)がそれぞれ制定されてきた。
| 平成14年以降の予定事項 |
○ 平成14年1月には、手数料、電子媒体を用いた届出事項等を定めるため法施行令及び法施行規則の一部改正がなされ、PRTRに関する届出作業を実施するにあたり必要とされる手続規定がそろったところである。
○ 平成14年度より、PRTR法において対象業種となっている事業者(従業員数21人以上)より、法で指定されている第一種指定化学物質の排出量及び移動量の届出が開始され(提出先は都道府県知事)、それらのデータをもとに国では集計作業を行い、結果を公表していく予定である。
○ 開始当初の平成14年は、取扱量5トン以上の対象事業者等による対象化学物質の排出量等の届出が開始されることになっており、平成16年より取扱量1トン以上の対象事業者等による届出が行われる予定である。
| 都道府県への要請 |
○ 第一種指定化学物質の排出量及び移動量は、対象となる事業所の所在地を管轄する都道府県知事あてに届出が行われるものであり、その後、国に集積されていくことになっているので、かかる作業への取り組みをご協力願いたい。
○ 国に集積されたデータは、地域におけるニーズに応じて活用できるようにしていく予定であるので、事業者への技術的助言、指導等が円滑に推進されるようご協力願いたい。
(4)毒物劇物対策
毒物及び劇物については、各都道府県、保健所設置市及び特別区に置かれた約3,400名の毒物劇物監視員が、毒物及び劇物取締法に基づき、毒物劇物営業者、特定毒物研究者及び業務上取扱者について、(1)登録・許可・届出状況、(2)製造・販売、取扱場所の状況、(3)譲渡・交付手続き、(4)表示の適否、(5)盗難紛失の防止措置等の監視を行うとともに、貯蔵、運搬、廃棄に関する技術基準等を遵守するよう指導を行っている。
| 平成13年中の実施事項 |
○ 登録・届出・許可施設98,092施設のうち延べ42,476施設(検査率43.3%)及び届出の不要な施設のうち4,577施設、合計47,053施設に対して立入検査を行った結果4,407施設において違反が発見されており(発見率9.4%)、これらに対し改善の指導を行っている。(平成12年度実績)
○ 毒物劇物による保健衛生上の危害の防止措置を実施する際に必要な毒物劇物に係る情報を円滑に入手できるよう、1月1日以降、毒物劇物営業者が、毒物若しくは劇物を販売し、又は授与するときは、当該毒物又は劇物の性状及び取扱いに関する情報(いわゆるMSDS)を提供しなければならないこととしている。
○ 平成11年8月に政府の障害者施策推進本部において決定された「障害者に係る欠格条項の見直しについて」を踏まえ、障害者の社会経済活動への参加の促進等を図るため、資格制度等において定められている欠格事由の適正化等を図ることとし、毒物及び劇物取締法においては、毒物劇物取扱責任者の資格、特定毒物研究者の資格等について見直し、7月16日から施行されているところである。
○ 9月11日に端を発する米国における同時多発テロを踏まえ、毒物劇物による事故等の未然防止について、関係業者・団体等に対し毒物劇物管理の一層の徹底等を要請しているところである。
| 都道府県等への要請 |
○ 毒物又は劇物の性状及び取扱いに関する情報の提供の義務化について、制度が円滑に運用されるよう、御配慮をお願いする。
○ 毒物又は劇物による事故等の未然防止について、関係業者、団体等に対する指導の一層の徹底についてお願いする。
12.麻薬・覚せい剤等対策
(1)第三次覚せい剤乱用期と薬物乱用対策推進本部
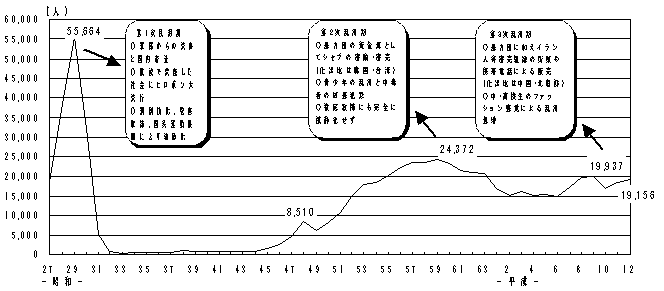
| 現状 |
○ 我が国における薬物事犯は、覚せい剤事犯が最も多く、その検挙者数は平成12年において19,156人(前年:18,491人)と依然高い水準で推移している。また、覚せい剤の押収量も、平成12年において約1トンと前年の約2トンに次ぐ大量押収となっており、依然として「第三次覚せい剤乱用期」の深刻な情勢が続いている。
○ 覚せい剤事犯における未成年の検挙者数は、平成12年には1,148人(うち、中学生54人、高校生105人)にのぼり、青少年の間で薬物乱用に対する警戒感や抵抗感が薄れ、薬物乱用が広がっている。

○ 薬物乱用対策推進本部が策定した「薬物乱用防止五か年戦略」に基づき、関係省庁が連携し、各種の薬物乱用対策を進めており、厚生労働省においては、取締りの強化、啓発活動の充実、再乱用防止対策の推進、国際協力の推進などの各種施策に総合的に取り組んでいる。
| 都道府県への要請 |
○ 各都道府県に設置されている薬物乱用対策推進地方本部においても、国の取組を踏まえて、啓発活動の充実、再乱用防止対策の推進等について、効果的・積極的な取組をお願いする。
(2)麻薬・覚せい剤等の取締りと適正管理
| 現状 |
○ 最近の覚せい剤事犯の特徴は、従来の暴力団に加え、一部の来日不良外国人による組織的密売の増加や検挙者の国籍の多様化のほか、携帯電話やインターネットを用いた密売など、複雑かつ巧妙化しているとともに、使用方法が「注射」から手軽な「あぶり」へ移行している。
○ 地方厚生局麻薬取締部においては、密売人及び乱用者に対する徹底した取締りに一層努力することとしており、平成14年度には、麻薬取締官の増員により特別捜査体制の充実を図るなど取締体制を強化することとしている。
○ 病院・診療所及び薬局における向精神薬の盗難・所在不明事故件数は、平成12年には81件(前年:89件)であり、麻薬、向精神薬、覚せい剤原料等の製造業者、卸売業者、医療施設、研究施設等に対する各都道府県の麻薬取締員等による立入検査等は、正規薬物の不正ルートへの横流れを防止する上で重要となっている。
| 都道府県への要請 |
○ 各都道府県に置かれている麻薬取締員について、麻薬取扱者等への立入検査に加え、麻薬等犯罪取締についても積極的な対応をお願いする。
○ 麻薬取締官が行う犯罪捜査に当たり、情報提供や協力捜査についても引き続き協力をお願いする。
○ 都道府県の麻薬取締員等により実施されている薬局、医療機関等の麻薬取扱者等への指導監督にあたっては、近時の向精神薬等を用いた犯罪の発生も踏まえ、一層の管理徹底の周知をお願いする。
(3)啓発活動の充実
| 現状 |
○ 薬物乱用の多くは、薬物に対する正しい知識が不十分でその恐ろしさを知らないことに起因しており、特に、薬物乱用が増加傾向にある青少年に対しては、薬物乱用防止に対する啓発を行うことが重要である。
○ 薬物乱用防止キャラバンカーについては、平成13年度より全国8台体制となり、学校又は地域の場における啓発活動の推進を図っている。
また、中学・高校等において開催される「薬物乱用防止教室」に講師として派遣できる、地域の中心的な指導員を養成するための研修を平成13年度より実施しており、薬物乱用防止指導員の活動の一層の推進を図っている。
さらに、毎年実施している「『ダメ。ゼッタイ。』普及運動」、「麻薬・覚せい剤乱用防止運動」についても、引き続き全国的に展開し啓発活動の充実を図ることとしている。
| 都道府県への要請 |
○ 全国の各地域で、薬物乱用防止キャラバンカーや啓発用読本等の啓発資材を活用するとともに、麻薬・覚せい剤乱用防止運動等の実施に当たり、効果的な啓発活動の取組をお願いする。
○ 平成13年度より開始した薬物乱用防止指導者研修事業については、各都道府県における薬物乱用防止指導員の積極的な参加について、引き続きご協力をお願いする。
(4)再乱用防止対策の充実
| 現状 |
○ 薬物犯罪の大きな特徴は、再犯性が高いことであり、本人の再乱用を防止するのみならず、新たな薬物乱用者を作らないという意味においても、薬物依存の治療と社会復帰への取組を行い、再乱用の防止対策を充実することが必要である。
○ 平成11年より、全国の精神保健福祉センターにおいて、(1)技術指導及び技術援助、(2)薬物関連問題に関する知識の普及、(3)薬物関連問題に関する家族教室の開催、(4)個別相談指導を行うことを内容とする「薬物関連問題相談事業」を実施している。
| 都道府県への要請 |
○ 各都道府県及び薬物乱用対策推進地方本部におかれては、引き続き本事業の円滑な推進に努められ、保健所、精神保健福祉センター、医療機関、地方厚生局麻薬取締部、警察等の関係機関間における薬物乱用・依存に関する相談・指導業務ネットワークの整備をお願いする。
○ 「薬物関連問題相談事業」に取り組んでいない都道府県等においては、地域の薬物乱用の実情に即して本事業を活用するなど、再乱用の防止対策の充実に努められたい。
(5)国際協力の推進
| 現状 |
○ 本年4月に東京において、麻薬・覚せい剤乱用防止対策推進議員連盟、日本政府、UNDCPの共催により、第5回国際麻薬統制サミットが開催され、世界的に拡大している覚せい剤問題を中心に討議される予定である。
○ 「海外麻薬行政研修((社)国際厚生事業団実施)」及び「日米協力による開発途上国薬物乱用防止啓発活動研修((財)麻薬・覚せい剤乱用防止センター実施)」がが開催されており、平成13年は東京都、大阪府に御協力をいただいたところ。
(6)脱法ドラッグ対策
| 現状 |
○ 近年、多幸感、快感等を高めるものとしてインターネット等で、「合法ドラッグ」と称して販売されているものがあるが、これらは、薬事法上の医薬品に該当するものが多く、行政としては「脱法ドラッグ」と呼んでいる。これらは、麻薬等の薬物乱用の契機となることが危惧されることから、従来より取締りを強化しているところである。
| 平成13年の実施事項 |
○ 近年における販売実態を踏まえ、平成13年度予算計上し、(1)インターネット上の広告監視の強化、(2)全都道府県での買い上げ調査の実施を行っているところである。なお、買い上げ調査の結果等の状況は公表することとしている。
| 平成14年以降の予定事項 |
○ 平成13年度に引き続き予算として、以下の対策を講じるための経費を計上しており、今後、取締りの更なる強化を図っていく予定である。
| (1)インターネット上の広告監視の強化 | 128万円 |
| (2)全都道府県での買い上げ調査の実施 | 572万円 |
○ 現在、麻薬成分であるサイロシン、サイロシビンを含む幻覚きのこ(通称『マジックマッシュルーム』)の規制について、検討を急いでいるところである。
| 都道府県への要請 |
○ 今後も、全都道府県での買い上げ調査を行うこととしているので、本事業の円滑な実施への協力方お願いしたい。
○ 買い上げ調査に基づき必要な措置を講じる等、監視指導の一層の強化をお願いしたい。
(参考)
1.検挙人員
| (単位:人) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.主な薬物の押収量
| (単位:kg) | ||||||||||||||||||||||||||||||||||||||||||
|
3.覚せい剤事犯における未成年者検挙者の推移
| (単位:人) | ||||||||||||||||||||||||||||||
|
4.覚せい剤事犯における直近の傾向
| 平成12年(1月〜11月) | 平成13年(1月〜11月) | 対前年比% | |
| 検挙者数(人) | 17,912 | 17,003 | -5.1 |
| うち未成年者(人) | 1,086 | 908 | -16.4 |
| うち中学生(人) | 51 | 43 | -15.7 |
| うち高校生(人) | 96 | 77 | -19.8 |
| 押収量(kg) | 946.8 | 402.0 | -57.5 |