ホーム > 政策について > 分野別の政策一覧 > 健康・医療 > 食品 > 食品添加物 > 保健機能食品であって,カプセル,錠剤等通常の食品形態でない食品の成分となる物質の指定及び使用基準改正に関する指針について > 保健機能食品であって,カプセル,錠剤等通常の食品形態でない食品の成分となる物質の指定及び使用基準改正に関する指針について(別添)
保健機能食品であって,カプセル,錠剤等通常の食品形態でない食品の成分となる物質の指定及び使用基準改正に関する指針について(別添)
(別添)
保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品
の成分となる物質の指定及び使用基準改正に関する指針
I 目的
本指針は、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質のうち、栄養成分たるビタミン類、ミネラル類及び製造、加工等において使用される賦形剤や乳化剤等の添加物について、厚生労働大臣が食品衛生法施行規則別表第2の指定又は使用基準改正を行うための要請手続、要請書に添付すべき安全性に関する試験成績等必要な資料の範囲等を規定するものである。
本指針の対象となる物質は、ビタミン類、ミネラル類であって化学的手段により元素又は化合物に分解反応以外の化学的反応を起こさせて得られた物質及びこれと同等の安全性等の確保が必要と認められる物質(天然からの抽出物であって分画、精製等により本来天然に存在するものと成分割合が異なっているもの等)又は保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の製造において使用される添加物(天然香料及び一般に食品として飲食に供されているものを除く)である。
なお、本指針に基づき指定された物質については、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品に対してのみ使用することができるものであり、それ以外の通常の食品に使用する場合には、「食品添加物の指定及び使用基準改正に関する指針」(平成8年3月衛化第29号 生活衛生局長通知)(以下、「衛化29号」という。)に基づく指定又は使用基準改正の手続が必要となるものである。
| II | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定及び使用基準改正に関する基本的考え方
ビタミン類、ミネラル類については栄養を補給、補完するなど、生活の質の向上や健康の維持増進に役立つものとして意義があり、かつ安全性が確保されたものでなければならない。また、これらの成分に関して行おうとする表示については科学的な妥当性が示されなければならない。
賦形剤や乳化剤等の添加物については、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品を製造、加工等する際に必要不可欠なものであり、かつ安全性が確保されたものでなければならない。
そのため、CODEX(FAO/WHO合同食品規格計画)の基準等を参考にするとともに、わが国の食品摂取の状況等を勘案し、公衆衛生の観点から、薬事・食品衛生審議会において科学的見地に基づき評価される必要がある。 |
| 1. | 安全性
要請する品目について、要請された使用方法において、安全性が実証又は確認されること。
|
| 2. | 有効性/必要性
要請する品目がビタミン類、ミネラル類の場合には(1)が、賦形剤や乳化剤等の添加物の場合には(2)が実証又は確認されること。
| (1) | 有効性
ヒトにおいて、必要かつ重要な要素であり、栄養素となる成分であること。また、保健の目的を表示する食品にあっては、保健機能を有することが実証又は確認されること。
ただし、医薬品及び医薬部外品とみなされる場合を除く。 |
| (2) | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の製造、加工、処理等で必要とされるもの。
ただし、劣悪な原料又は保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品の製造、加工、処理等の過程における好ましからざる手段若しくは技術(非衛生的なものを含む。)の使用による影響を隠ぺいする目的で使用される場合を除く。 |
|
| III | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定又は使用基準改正に係る手続 |
| 1. | 要請
保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質について、指定又は使用基準改正を要請する者は、厚生労働大臣あて、それぞれ別紙様式1又は別紙様式2により要請書を提出することができる。要請書には、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の成分規格案及び使用基準案並びに安全性に関する資料等を添付しなければならない。
なお、要請者が外国に在住する場合には、日本国内において当該要請に関する事項について責任をもって対応できる者(国内連絡先)を明記すること。また、要請書は、直接、厚生労働省医薬局食品保健部基準課に提出すること。
|
| 2. | 成分規格案及び使用基準案の添付
| (1) | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質についての指定を要請する場合には、原則として、成分規格案を要請書に添付する。また、使用基準案は当該物質の使用対象食品、使用量及び使用方法等を限定する必要がある場合に添付する。 |
| (2) | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質について使用基準の改正を要請する場合には、当該物質の使用基準と要請する使用基準改正案の対照表を要請書に添付する。 |
|
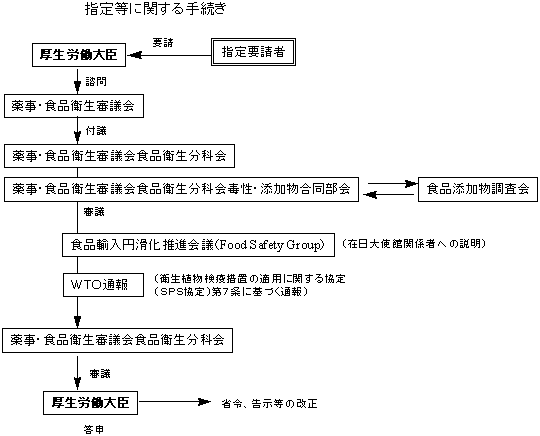
| 3. | 審査
保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定又は使用基準改正の要請については、厚生労働省医薬局食品保健部企画課新開発食品保健対策室及び基準課において事務局審査を行い、薬事・食品衛生審議会の意見を聴くことが適切であると認められる場合には、当該要請について薬事・食品衛生審議会への諮問に必要な事務を開始する。
薬事・食品衛生審議会は審査終了後、諮問された事項に関し厚生労働大臣あて答申を行う。厚生労働省は、薬事・食品衛生審議会の答申を踏まえ、食品衛生法施行規則改正等必要な事務手続を行う。(下記の図参照)なお、薬事・食品衛生審議会における審査の過程等において、必要とされる場合には、要請者に資料の追加提出等を求めることがある。 |
| 注: | 平成15年度の内閣府食品安全委員会の設置により指定等に関する手続は、次のように変更しております。 |
| 4. | 標準的事務処理期間
要請書が受理された日から、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定又は使用基準改正までに要する標準的事務処理期間は1年とする。ただし、本期間には、提出された書類又は資料等に不備があり、これを要請者が修正するのに要する期間及び薬事・食品衛生審議会等における指摘事項に対し要請者が回答するまでの期間は含まない。 |
| IV | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定及び使用基準改正の要請書に添付すべき資料 |
| 1. | 添付資料の範囲
ビタミン類、ミネラル類の指定及び使用基準改正の要請に際しては、原則として、表1のA欄◎で示された資料を、賦形剤や乳化剤等の添加物の指定及び使用基準改正の要請に際しては、原則として、表1のB欄◎で示された資料を、添付すること。
| (1) | 既に指定されている品目に類するもので合理的な理由があるものについては、その理由を説明した上で、当該要請に係る資料の添付を省略することができる。 |
| (2) | 当該品目が食品常在成分(当該成分について、通常の食品から摂取する量を大幅に超えることが明らかであるものは除く。以下同じ。)であるか又は消化管内等で分解して食品常在成分になることが科学的に明らかである場合には、原則として、表1のうち毒性に関する資料の添付を省略することができる。
なお、上記に該当するか否かは、表2の事項について検討の上薬事・食品衛生審議会において判断することが必要である。 |
| (3) | 要請に係る品目のうち、長年医薬品又は医薬部外品あるいはそれらの添加物としてヒトが用いてきた経験(使用実績)があるものについては、医薬品又は医薬部外品あるいはそれらの添加物としての評価に用いた資料を提出することにより、当該事項に関する資料の一部を省略することが出来る。省略することが出来ると考えられるものは、表1において○印で示されているが、薬事・食品衛生審議会において審議した結果、必要と判断された資料については提出しなければならない。 |
| (4) | また、表1において△印を付した資料は、指定や基準改正後に新たな知見が得られた場合及びその他必要な場合に添付する必要がある。 |
| (5) | 要請に係る品目について、品質、安全性又は有効性/必要性を有することを疑わせる資料については、当該資料の信頼性等にかかわらず、提出しなければならない。 |
|
| 2. | 添付資料作成上の一般的注意
| (1) | 本指針における評価は、物質として個々に評価を行うものである。従って、複数の物質が混合されているような場合には、本指針に該当する個々の物質それぞれについて資料を作成する必要がある。 |
| (2) | 添付資料は、要請者がその責任において提出するものであり、資料内容の信頼性は要請者が確保しなくてはならない。 |
| (3) | 資料概要は邦文で記載されていなければならない。ただし、資料概要以外の添付資料(表1の区分2〜6の資料)については英文で記載されたものであっても差し支えない。 |
| (4) | 添付資料を作成するために必要とされる試験は、試験成績の信頼性を確保するために必要な施設、機器、職員等を有し、かつ適正に運営管理されていると認められる試験施設において実施されなければならない。 |
|
| 3. | 指定要請添付資料の作成上の留意事項
| (1) | 要請の目的及び理由
要請する品目を保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品に用いなければならない理由を記載すること。
| ア) | ビタミン類、ミネラル類について
通常の食品から摂取する場合と保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品から摂取する場合について比較を行い、保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品から当該成分を摂取する必要性や有効性について検討し記載すること。本項では、概要を記載することとし、データ等具体的な事項については有効性の項において記載すること。 |
| イ) | 賦形剤や乳化剤等の添加物について
保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品に使用しなければならない理由について記載すること。本項では、概要を記載することとし、添加物の必要性や他の添加物との比較等に関する具体的な事項については必要性の項において記載すること。 |
|
| (2) | 資料概要
| (1) | 資料区分ごとに簡潔にまとめ、全資料の概要を把握できるよう考慮すること。 |
| (2) | 重要事項については、必要に応じ具体的なデータや図表を付して記載すること。 |
| (3) | 概要に記載されている内容と各資料との関連が容易に判るように目次や資料番号を付して、通しページをつけること。 |
| (4) | 表1に示された資料であって、添付を省略した資料については、その理由を記載すること。 |
|
| (3) | 起源又は発見の経緯及び使用状況に関する資料
| (1) | 起源又は発見の経緯
要請する品目がいつ、どの国で開発又は発見されたかを記載する。 |
| (2) | 外国における許可状況
要請する品目の諸外国における許可状況。使用基準、成分規格等が定められている場合にはそれらについても合わせて記載すること。また、コーデックス等の国際機関における安全性評価状況や使用基準、成分規格等も記載すること。 |
| (3) | 諸外国での使用状況や医薬品等としての使用実績
要請する品目が、既に諸外国等において、食品、医薬品あるいは医薬品の添加物等としてヒトが用いている実績がある場合には、その経緯や今日までの使用、流通、摂取等の状況について記載する。 |
|
| (4) | 物理化学的性質及び成分規格に関する資料
食品添加物公定書の通則及び一般試験法等を参考にして、適切な方法により試験した結果に基づき作成すること。
| (1) | 名称
目的物質(要請する品目の構成成分のうち有効性/必要性を示す物質)の一般名、化学名(IUPAC名に準拠する。)等を記載すること。 |
| (2) | 構造式又は示性式
目的物質について食品添加物公定書を参考に構造式又は示性式を記載すること。 |
| (3) | 分子式及び分子量
目的物質について食品添加物公定書の通則に準拠し記載すること。 |
| (4) | 含量規格
含量規格は、製造過程、定量誤差及び安定性等に基づき、要請する品目の安全性と有効性/必要性に関して同等とみなせる一定品質を保証するのに必要な目的物質の値を設定すること。 |
| (5) | 製造方法
要請する品目の製造方法によっては、不純物の種類又は量が異なる可能性もあるので、製造工程を簡明に記載すること。 |
| (6) | 性状
性状は、要請する品目の使用時の識別及び取扱い上必要となる事項について、通例、味、におい、色、形状等を記載すること。 |
| (7) | 確認試験
確認試験は、当該物質が目的物質であるか否かをその特性に基づいて確認するための試験である。従って、物質の化学構造上の特徴に基づいた特異性のある試験である必要がある。
確認試験以外の項目の試験によっても目的物質の確認が可能な場合には、その試験を確認試験とすることができる。例えば、定量法に特異性の高いクロマトグラフ法を採用する場合には、当該試験を確認試験とし、添付資料を簡略化することができ、あえて定量法とは別の試験方法を設定する必要はない。
確認試験を行う方法としては、通例、スペクトル分析に基づく方法及び化学反応による方法が考えられる。なお、化学反応については、化学構造の特徴を確認するのに適切なものがある場合に設定すること。 |
| (8) | 示性値
示性値とは、吸光度、旋光度、pH及び融点等の物理的化学的方法により測定される数値をいい、要請する品目の品質を確保するうえで必要な項目を記載すること。 |
| (9) | 純度試験
純度試験は、要請する品目中の目的物質以外の不純物を試験するために行うもので、定量法とともに物質の純度を規定する試験である。要請する品目中に混在する可能性のあるもの(原料、中間体、副生成物、分解生成物、試薬・触媒、重金属、無機塩及び溶媒)のうち必要なものを対象とすること。 |
| (10) | 乾燥減量、強熱減量、水分
乾燥減量試験は、乾燥することによって失われる要請する品目中の水分、結晶水の全部又は一部及び揮発性物質等の量を測定するために行う。強熱減量試験は、強熱することによって、要請する品目中の構成成分の一部又は混在物を失う無機物について行う。水分試験は、要請する品目中に含まれる水分含量を知る目的で行う。 |
| (11) | 強熱残分(強熱残留物)または灰分
強熱残分試験は、通例、要請する品目が有機物である場合に不純物として含まれる無機物の含量を知るために行うが、場合によっては、有機物中に構成成分として含まれる無機物又は熱時揮発する無機物中に含まれる不純物の量を測定するために行う。灰分試験は、強熱することによって、要請する品目中に残留する物質の量を測定するために行う。 |
| (12) | 定量法
定量法は、要請する品目中に含まれる目的物質の含量を、物理的、化学的又は生物学的方法により測定する試験である。相対的な試験方法を設定する場合には、定量試験に用いる標準物質について規格を設定すること。
正確さ、再現性及び特異性を重視して、試験法を設定する。ただし、特異性の低い方法であっても、適切な純度試験により、混在物の限度が規制されている場合には、再現性のよい絶対量を測定しうる試験方法を設定して差し支えない。その場合には、特異性にかける部分について、純度試験等に特異性の高い方法を用いることにより、相互に補完し合うことが必要である。
なお、定量しようとする目的物質が2種以上ある場合は、重要なものから記載すること。 |
| (13) | 物質の安定性
目的物質について、酸・アルカリの液性、温度、湿度、熱等の変化に対する安定性や水溶液中での安定性を分解物等の検索を含め、検討を行うこと。 |
| (14) | 保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品中の目的物質の分析法
目的物質を保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品中から、効率的かつ正確に分析し定性又は定量するための方法を記載する。原則として当該物質を使用する対象食品につき検討すること。なお、同様の目的をもつ他の成分等との分離定量に留意すること。 |
| (15) | 成分規格案の設定根拠
| ア) | 成分規格案は、コーデックス等の国際機関によって設定された成分規格を参考とし、上記(1)〜(12)の資料に基づき、当該物質の安全性、有効性/必要性に関し、一定の品質を担保するために必要なものを設定すること。 |
| イ) | コーデックス等の国際機関によって設定された成分規格及び諸外国の成分規格と成分規格案との対照表を添付すること。 |
|
|
| (5) | 有効性/必要性に関する資料
| (1) | ビタミン類、ミネラル類については下記について資料を提出すること。
| ア) | ヒトにおける有効性
要請する品目の栄養素としての機能、保健機能等が、ヒトにおいて科学的に実証又は確認されること。当該成分の機能が科学的データにより証明されており、一般的に広く知られているものについては、その概要を記載すればよい。それ以外の場合には、動物を用いた試験結果から、目的とする効果が確認されること。 |
| イ) | 同様の効果をもつ成分との比較検討
要請する品目の有効性と同様の効果を持つものがある場合には比較等を行い、その概要を記載すること。 |
| ウ) | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品中における安定性
要請する品目の保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品中における安定性に関する試験を行う。なお、安定でない場合は、主な分解物の種類及びその生成程度について検討し記載すること。 |
| エ) | 他の成分との相互作用等
要請する品目の摂取により、医薬品の効能効果に影響を及ぼす可能性、通常の食事から摂取される食品成分の摂取バランスへの影響、他の食品成分の代謝・吸収等への影響等、ヒトに与える影響の可能性について検討し記載すること。 |
|
| (2) | 賦形剤や乳化剤等の添加物となるものについては、下記について資料を提出すること。
| ア) | 賦形剤や乳化剤等の添加物としての必要性
要請する品目について、期待する効果があることを裏付ける試験を行い記載すること。具体的には、錠剤、カプセル等を製造する場合の賦形剤や乳化剤等の添加物としての必要性を添加量及び時間経過との関係において明らかになるような試験を行うこととし、例えば乳化剤であれば乳化作用が、添加量や時間経過においてどのように変化するかを検討し記載すること。 |
| イ) | 同種の添加物との比較検討
既に用いられている同様の効果を持つ物質がある場合には、それらの食品添加物との比較を保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品に用いる場合について検討し記載すること。 |
| ウ) | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品中における賦形剤や乳化剤等の添加物の安定性
要請する品目の保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品中における安定性に関する試験を行う。なお、安定でない場合は、主な分解物の種類及び生成程度について検討し記載すること。 |
| エ) | 要請する品目の食品中の主要な栄養成分に及ぼす影響
要請する品目を摂取することにより、食品中の主要な栄養成分に及ぼす影響について検討すること。 |
|
|
| (6) | 安全性に関する資料
保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質についての安全性評価は、物質として評価を行うものであり、(1)、(2)及び(4)について留意する必要がある。また、ビタミン類、ミネラル類については、(3)についても原則として検討することが必要である。
| (1) | 毒性に関する資料
| ア) | 毒性試験は、ヒトの摂取様式に基づき投与方法等を検討し適切に実施されなければならない。また、毒性試験データの信頼性を確保するため、これらの試験は医薬品の安全性試験の実施に関する基準等、適切なGLP(Good Laboratory Practice)に従って実施されなくてはならない。 |
| イ) | 各々の毒性試験についての標準的な実施方法は、衛化29号第V章に示されている。
しかし、本来、すべての物質について一律の試験方法を定めることは合理的でなく、また、今後とも科学技術の進歩に応じ新しい試験方法の開発が行われることも考えられるので、得られた所見が物質の安全性評価に資するものである限り、必ずしも衛化29号に示された方法に固執するものではない。
例えば、OECDガイドライン、米国FDAガイドラインに準拠した試験は、物質の安全性評価にとって基本的に問題ないものと考えられる。 |
| ウ) | 90日間反復投与毒性試験をげっ歯類1種又は非げっ歯類1種について実施した場合には、それぞれに相当する動物種に係る28日間反復投与毒性試験の実施を省略することができる。 |
| エ) | 1年間反復投与毒性試験、発がん性試験を各々所要の動物種について実施した場合には、1年間反復投与毒性/発がん性併合試験を実施する必要はない。
また、1年間反復投与毒性/発がん性併合試験をげっ歯類1種について実施した場合には、1年間反復投与毒性試験及び発がん性試験のげっ歯類1種について試験の実施を省略することができる。 |
| オ) | 要請する品目の分解物及び混在する不純物の安全性についても、必要に応じ検討を行う。 |
|
| (2) | 体内動態に関する資料
| ア) | ヒトが摂取した場合の生体内における吸収、分布、代謝、排泄を推定するため、体内動態に関する動物を用いた試験を実施する。従って、動物試験結果をまとめるのみでなく、ヒトにおける体内動態や有害な作用の発現の推定等について考察を行わなくてはならない。 |
| イ) | 体内動態に関する試験の標準的な実施方法も、衛化29号第V章に示されているが、その取扱いについては、上記(1) イ)に述べた毒性試験の場合と同様である。 |
|
| (3) | ヒトにおける安全性に関する資料
無作用量に関する知見、長期摂取した場合の知見、諸外国及び医薬品における使用上限値の設定状況等要請する品目の安全性に関して明らかとなっている知見を記載すること。 |
| (4) | 一日摂取量に関する資料
| ア) | 要請する品目の一日摂取量は、使用対象食品の一日あたりの喫食量に当該食品中に含まれる要請品目の量を乗じて求める。通常の食品にも使用又は含まれている場合にはそれらの量も合わせ、総摂取量を求める必要がある。食品の一日あたりの喫食量は、国民栄養調査の食品群別摂取量又はその他の資料等により適切に推定する。また、ビタミン類及びミネラル類については、同様の効果をもつと考えられる物質を通常の食事から摂取している場合には、当該物質を併せた推定を行うこと。 |
| イ) | 要請する品目の安全性について、許容上限摂取量あるいは一日摂取許容量との比較等につき考察する。なお、考察に当たっては、同種の物質等が併せて摂取される場合等の安全性についても検討すること。 |
| ウ) | 国民栄養調査成績等我が国の食物摂取の実態を踏まえ、栄養成分の過剰摂取や電解質バランスへの影響等についても検討すること。特にビタミン類及びミネラル類については、欠乏症及び過剰摂取の危険性についても充分に考察し記載される必要がある。 |
|
|
| (7) | 使用基準案に関する資料
| (1) | 要請する品目の安全性、有効性/必要性を総合的に検討し、使用対象食品及び使用用量等を限定するため、使用基準を設定する必要があると判断した場合には、当該使用基準を設定する根拠を上記(2)〜(5)の資料に基づき明らかにすること。なお、使用基準案はできる限り具体的に記載し、当該物質が使用される食品を限定できるような記載とすること。 |
| (2) | (1)の基準を設定する必要がないと判断した場合には、上記(2)〜(5)の資料に基づき、その根拠を明らかにすること。 |
|
|
| 4. | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の使用基準改正要請添付資料の作成上の留意事項
「3.指定要請添付資料の作成上の留意事項」に準ずる。ただし、使用基準案の設定に関する資料においては、要請した使用対象食品の追加、使用量の変更等、使用基準を改正する根拠を、資料に基づき明らかにする。 |
| 表1 | 保健機能食品であってカプセル、錠剤等通常の食品形態ではない食品の成分となる物質の指定又は使用基準改正の要請書に添付すべき資料 |
| 資料の種類 |
A欄
(ビタミン類、
ミネラル類) |
B欄
(賦形剤や
乳化剤等の
添加物) |
指定
要請 |
使用
基準
改正 |
指定
要請 |
使用
基準
改正 |
(1) 本要請の目的及び理由
(2) 資料概要
(3) 起源又は発見の経緯及び使用状況に関する資料
(1) 起源又は発見の経緯
(2) 外国における許可状況
(3) 諸外国での使用状況や医薬品等としての使用実績
(4) 物理化学的性質及び成分規格に関する資料
(1) 名称
(2) 構造式又は示性式
(3) 分子式及び分子量
(4) 含量規格
(5) 製造方法
(6) 性状
(7) 確認試験
(8) 示性値
(9) 純度試験
(10) 乾燥減量、強熱減量、水分
(11) 強熱残分(強熱残留物)又は灰分
(12) 定量法
(13) 物質の安定性
(14) 保健機能食品であって、カプセル、錠剤等通常の食品形態でない
食品中の目的物質の分析法
(15) 成分規格案の設定根拠
(5) 有効性/必要性に関する資料
(1) ビタミン類、ミネラル類について
ア ヒトにおける有効性
イ 同様の効果をもつ成分との比較検討
ウ 保健機能食品であってカプセル、錠剤等通常の食品形態ではない
食品中における安定性
エ 他の成分との相互作用等
(2) 賦形剤や乳化剤等の添加物について
ア 賦形剤や乳化剤等の添加物としての必要性
イ 同種の添加物との比較検討
ウ 保健機能食品であってカプセル、錠剤等通常の食品形態ではない
食品中における添加物の安定性
エ 要請する品目の食品中の主要な栄養成分に及ぼす影響
(6) 安全性に関する資料
(1) 毒性に関する資料
ア 単回投与毒性試験
イ 28日間反復投与毒性試験
ウ 90日間反復投与毒性試験
エ 1年間反復投与毒性試験
オ 繁殖試験
カ 催奇形性試験
キ 発がん性試験
ク 1年間反復投与毒性/発がん性併合試験
ケ 抗原性試験
コ 変異原性試験
サ 一般薬理試験
シ その他参考となる試験(医薬品として実施された試験等)
(2) 体内動態に関する資料
(3) ヒトにおける安全性に関する資料
(4) 1日摂取量に関する資料
(7) 使用基準案に関する資料 |
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
−
−
−
−
◎
◎
◎
○
○
○
○
○
○
◎
○
○
◎
◎
◎
◎ |
◎
◎
−
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
◎
◎
◎
◎
−
−
−
−
△
△
△
△
△
△
△
△
△
△
△
△
△
◎
◎
◎ |
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
◎
−
−
−
−
◎
◎
◎
◎
◎
◎
◎
○
○
○
○
○
○
◎
○
○
◎
△
◎
◎ |
◎
◎
−
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
△
−
−
−
−
◎
◎
◎
◎
△
△
△
△
△
△
△
△
△
△
△
△
△
△
◎
◎ |
| (注) | ◎印は添付すべき資料、○印は原則として添付すべきであるが、医薬品としての試験成績やその他合理的な理由がある場合には省略することができると考えられる資料、△印は新たな知見がある場合等必要な場合において添付すべき資料を示す。 |
| 表2 | 保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品の成分となる物質が食品内又は消化管内で分解して食品常在成分となることを確認する場合の検討事項 |
| 1. | 通常の使用条件下で、当該物質が容易に食品内又は消化管内で分解して食品常在成分と同一物質になること。
|
| 2. | 食品内又は消化管内での分解に関わる主要な因子(pH、酵素等)が明らかであること。
|
| 3. | 通常の使用条件下で適正な量を使用した場合、当該物質の体内への吸収が食品成分と同程度であり、他の栄養成分の吸収を阻害しないこと。
|
| 4. | 摂取された物質の未加水分解物又は部分加水分解物が大量に糞便中に排泄されないこと。更に、未加水分解物又は部分加水分解物が生体組織中に蓄積しないこと。
|
| 5. | 当該物質を含む保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品を摂取したとき、過剰摂取の問題が起きないこと。 |
|
様式1
年 月 日
厚生労働大臣殿
住所(法人にあっては、主たる事務所の所在地)
氏名(法人にあっては、名称及び代表者の氏名) |
印 |
食品衛生法第6条及び第7条第1項の規定に基づき、保健機能食品であって通常の食品形態でないものに使用する物質として、食品衛生法施行規則別表第2に下記品目を指定されるよう要請します。
記
( 品名 )
(注意)
| 1. | 用紙の大きさは、日本工業規格A4とすること。 |
| 2. | 字は、墨、インク等を用い、邦文にあっては楷書ではっきり書くこと。 |
| 3. | 要請者が外国に在住する場合には、国内連絡先を記載すること。なお、印を署名に代えることができる。 |
様式2
年 月 日
厚生労働大臣殿
住所(法人にあっては、主たる事務所の所在地)
氏名(法人にあっては、名称及び代表者の氏名) |
印 |
食品衛生法第7条第1項の規定に基づき、食品衛生法施行規則別表第2において指定されている下記品目の使用基準を下記のとおり改正されるよう要請します。
記
(品名及び使用基準改正案)
(注意)
| 1. | 用紙の大きさは、日本工業規格A4とすること。 |
| 2. | 字は、墨、インク等を用い、邦文にあっては楷書ではっきり書くこと。 |
| 3. | 要請者が外国に在住する場合には、国内連絡先を記載すること。なお、印を署名に代えることができる。 |
ホーム > 政策について > 分野別の政策一覧 > 健康・医療 > 食品 > 食品添加物 > 保健機能食品であって,カプセル,錠剤等通常の食品形態でない食品の成分となる物質の指定及び使用基準改正に関する指針について > 保健機能食品であって,カプセル,錠剤等通常の食品形態でない食品の成分となる物質の指定及び使用基準改正に関する指針について(別添)