ホーム> 報道・広報> 報道発表資料> 2015年6月> Medical Device Single Audit Program Pilotに正式参加します
|
平成27年6月23日 【照会先】 医薬食品局医療機器・再生医療等製品担当参事官室 参事官 磯部 総一郎 (内線2911) 調整官 近藤 英幸 (内線2787) (代表電話) 03(5253)1111 (直通電話) 03(3595)2419 |
Medical Device Single Audit Program Pilotに正式参加します
~国際協力の下、医療機器の品質確保を推進~
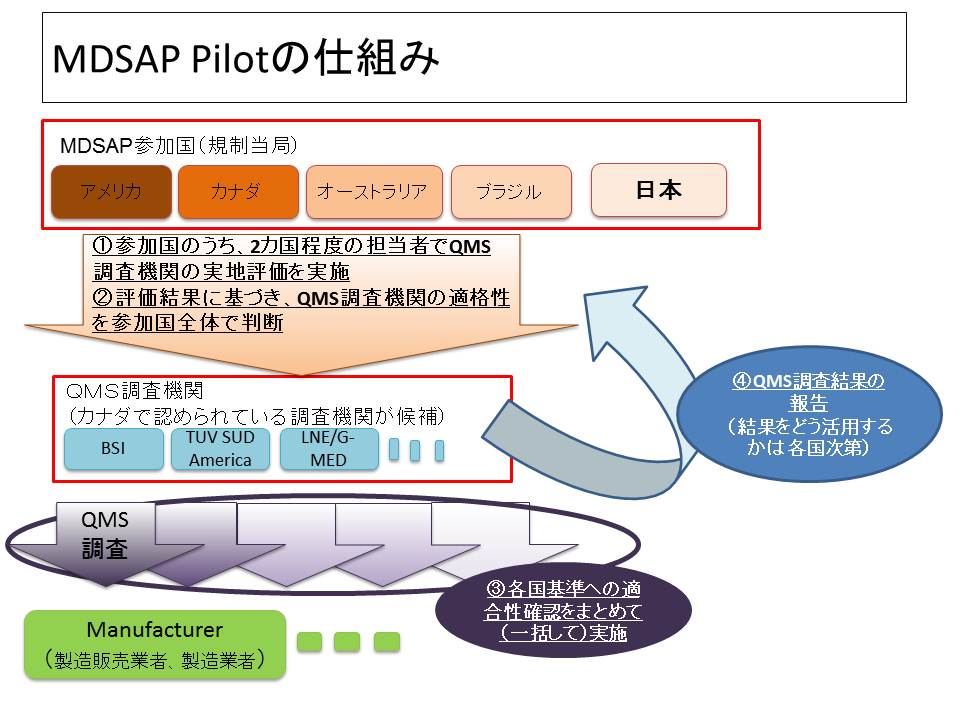
1.MDSAP Pilotとは
次の事項を実施することで、医療機器の品質確保を目指すものです:
(1)
参加国の規制当局全体で、医療機器の製造管理及び品質管理に関する基準(
QMS
)への適合性を確認する調査(以下「
QMS
調査」という。)を実施する民間機関(以下「
QMS
調査機関」という。)を評価する。
(2) QMS 調査機関は、 QMS 調査において、参加各国の基準への適合性確認を一度に(一括して)実施する。
(3) QMS 調査機関が実施した QMS 調査結果を参加国の規制当局が活用する。
(4) Pilot 期間中は、カナダで認められている調査機関( 12 機関)が QMS 調査機関の候補となる。
2.MDSAP Pilotへの正式参加により期待できる事項
本活動に正式参加することで、次のような事項が期待できます:
(1) 参加国の規制当局にとって、従来、各国独自で実施している QMS 調査機関に対する評価業務を協働して実施し、その評価結果を共有できる。
(2) 医療機器メーカーにとって、その都度対応していた各国ごとの実地による QMS 調査が QMS 調査機関により一括して 1 回で実施されることにより、負荷を軽減できる。
3.MDSAP Pilotに関する情報
本活動に関する最新情報は、以下から入手できます(英語のページ):
http://www.fda.gov/medicaldevices/internationalprograms/mdsappilot/default.htm
4.参考(MDSAP Pilotの仕組み)
ホーム> 報道・広報> 報道発表資料> 2015年6月> Medical Device Single Audit Program Pilotに正式参加します


