細胞は種々な物質を合成して、細胞外に分泌している。例えば膵臓の大部分の細胞は、消化酵素を合成し、これを導管を経て、十二指腸に分泌している。これが外分泌である。ところが、膵臓のランゲルハンス島という名の付いた細胞集団は、細胞で合成した物質を分泌するが、導管が無く、毛細管を経て血液中に分泌している。これを内分泌という。ホルモンは特定の内分泌腺(直接血流に放出する管構造をもたない腺組織)から流血中に分泌され、血行によって遠くに運ばれ、標的臓器に作用して、特異的な効果をあらわす物質と定義され、このような作用の仕方をエンドクリンという。最近では、標的細胞がホルモン産生細胞のすぐ隣にあったり(パラクリン)、ホルモン産生細胞自身であるような例(オートクリン)、ホルモンの前駆体を細胞に取り込んでホルモンに加工して分泌する(イントラクリン)などの作用の仕方も知られるようになり、また一方では脂肪組織や血管など本来内分泌腺ではない組織からもホルモンが分泌されていることが明らかにされたため、現在では、生体細胞で産生されて広く生体の調節機能に関与する物質を総称してホルモンと呼ぶ傾向にある。
ホルモンは、内分泌腺(下垂体、甲状腺、上皮小体(副甲状腺)、膵臓、副腎皮質及び髄質、雌雄性腺(精巣と卵巣)等)や視床下部など神経系の組織、脂肪組織、心臓・血管から分泌され、ホルモンの種類によってはそのままの形で、またあるものは独自の運搬タンパク質と結合して血流に運ばれ、標的器官でレセプターと呼ばれる細胞の特異的な蛋白質に結合して作用を発揮する。作用の結果として、エネルギー代謝、発育と成長、性の分化と生殖等の生体機能を支配するとともに、生体内部の環境の恒常性が維持されるよう調節している(ホメオスタシス)。また、内分泌系は、免疫系、神経系とも密接な関係を持つことが知られている。
ホルモンのあるものは、細胞膜にある受容体(これ自身が蛋白質である)に結合して作用するし、またあるものは、核に移行して、核内の受容体に結合して作用する。種々の内因性/外因性化学物質や抗体などが、ホルモンが血液中の輸送蛋白に結合する過程、膜受容体に結合する過程、そこから更に主として数段階のリン酸化により刺激が伝達される過程などに影響を及ぼして、異常や疾患を起こすことが知られている。また、ある種のホルモンは核内に移行して核受容体(これ自体が蛋白質であり、一つのホルモンに対して性質の異なる複数の受容体がある場合も多い)に結合し、更にこれが遺伝子のDNAの一部に結合し、多くの転写調節性蛋白の介在による作用を経て、特定の蛋白質の転写を変化させて作用するが、このホルモンと核受容体の結合、この結合物のDNAへの結合、介在する調節蛋白相互の結合などの部分に内因性/外因性化学物質の作用があることが知られている。
(1)内分泌とは何か
体内の細胞群の中には、細胞で蛋白質・ポリペプタイド・アミン・脂質を作り出し、これを分泌顆粒という状態で細胞質の中に持っているものが多く存在している。分泌とは、一般的に、細胞がその分泌顆粒内の生産物を細胞外に排出することを指しており、分泌経路によって外分泌と内分泌がある。例えば、膵臓の外分泌細胞は消化酵素や消化液のもとになる物質を作り、これを膵管から腸に分泌しており、代表的な外分泌の一つとされている。一方、膵臓にはランゲルハンス島と名付けられた細胞群があり、この細胞では分泌顆粒はあるものの、分泌物を作用の場所に導いていくための導管が存在していない。これらの分泌物は毛細血管から循環血液中に入り、標的器官に運ばれ、標的器官の機能を刺激してスイッチオンの状態にする。外界のどことも通じていない循環血液中という体内に分泌されるので、「内分泌=エンドクリン」と呼ばれる。このような遠くに運ばれて作用するのとは異なり、分泌する細胞のすぐ近くの細胞に作用するのものをパラクリン、分泌細胞自らの細胞に作用するものをオートクリンと分類することもある。内分泌腺から血中に分泌されて他の臓器・組織・細胞に作用する物質は、ホルモンと呼ばれる。ホルモンとは、原義は「呼び覚ます」という意味のギリシャ語で1902年W.M.BaylissとE.H.Starlingによって命名されたのが始まりで、最近では情報伝達物質と同じ意味で使われている。ただし、情報伝達物質の中でも、免疫系の細胞から分泌されるものは、サイトカインと呼ばれている。人の内分泌臓器については、以下のようなものがある。
-
(A)甲状腺
頸部正中の輪状軟骨の下にある、蝶が羽を広げたような形の臓器で、その形を外から触れることのできる内分泌臓器である。甲状腺ホルモンを産生し、このホルモンは胎生・幼少時期には種々の器官の形成や知能の発達に重要な役割を果たし、欠損するとクレチン症という重度の知能障害・成長障害を起こす。成人では代謝と熱産生に重要な役割を果たす。
(B)副甲状腺(上皮小体)
甲状腺に接する臓器であり、4個の米粒大の組織からなる。副甲状腺ホルモンを分泌して、骨中のカルシウムを動員して、血液中のCa濃度が正常になるように作用しており、不足するとテタニーを引き起こす。
(C)副腎
腎臓の上部にあり、ステロイドホルモンを産生する。副腎では、ステロイドホルモンのうち、グルココルチコイド、ミネラルコルチコイド、性ステロイド及びその前駆物質などが作られる。(A)グルココルチコイドは、生命を維持する代謝に不可欠であり、特にストレスや感染などのショックに生体が対応するのに必要で、不足するとアジソン病を引き起こす。(B)ミネラルコルチコイドは、ナトリウム、カリウムなど生体の塩分の調節や血圧の維持に必要である。(C)性ステロイドは性行動を支える基盤としてのみでなく、骨組織その他種々の組織の維持にとっても不可欠であることが明らかにされている。
(D)卵巣
卵胞、黄体、結合組織よりなる。卵胞は卵細胞とそれを取り囲む顆粒膜細胞よりなる。卵胞が発育している時期には顆粒膜細胞はエストロゲンを合成し、排卵された後は、黄体を形成してプロゲステロンを分泌する。また、卵胞からはインヒビンが分泌され下垂体のFSH分泌を抑制する。月経が正常であることは、卵巣のホルモン分泌が正常に子宮内膜に作用していることの最も確かな証拠である。
(E)精巣
精巣は精細管及び間質組織よりなる。精細管にはセルトリ細胞があり、この細胞に抱かれる形で精母細胞から精子に至るまでのいろいろな段階の細胞が存在する。セルトリ細胞はインヒビンを分泌してFSHを抑制する。間質のライディッヒ細胞からはテストステロンが分泌される。
(F)下垂体
脳の下側に突出する形のエンドウ豆大の器官であり、以上に述べたホルモン分泌を支配統合している。脳の一部である視床下部から、神経系と特殊な血管系(下垂体門脈)により結ばれている。視床下部は、脳からの情報と体の各部分の内分泌情報が統合される司令部のような場所であり、その情報が下垂体に伝達されて、下垂体から甲状腺・副腎皮質・性腺を刺激するホルモン(甲状腺刺激ホルモン: TSH、副腎皮質刺激ホルモン: ACTH、黄体形成ホルモン: LH、濾胞刺激ホルモン: FSH)が分泌され、それぞれの内分泌臓器から分泌されるホルモンの量を自動調節している。性腺に対してはFSHと LHの2種類のホルモンが分泌され、FSHは女性では卵胞に作用してエストロゲンを分泌し、男性では精細胞に作用し精子の形成を促進し、LHは女性では黄体に作用して、プロゲステロンを分泌し、男性ではライディッヒ細胞に作用してテストステロンを分泌する。
また、下垂体は成長ホルモンを分泌して正常な身長の発育を維持しており、不足すれば低身長症、逆に成長ホルモンを過剰に分泌する腫瘍により分泌が多くなりすぎると末端肥大症を引き起こす。
さらに、下垂体の後葉からは抗利尿ホルモン(ADH)が分泌され水分を腎臓から再吸収する。ADHが欠損すると、一日10リットル位の尿が出る尿崩症になる。(G)視床下部
下垂体の機能は更に上位の視床下部の影響を受けている。視床下部からは成長ホルモン分泌を刺激するGRH(成長ホルモン放出ホルモン)、甲状腺刺激ホルモン分泌を刺激するTRH(甲状腺刺激ホルモン放出ホルモン)、LH分泌を刺激するGnRH(生殖腺刺激ホルモン放出ホルモン)が分泌される。GnRHは約2時間に1回のパルスで分泌されるが、この間隔のパルス自体が下垂体のLH分泌にとって重要で、持続的に分泌させると、逆にLH分泌を抑制することが知られている。
このように甲状腺、副腎、性腺のホルモンは下垂体から、更に下垂体は視床下部から支配を受けているが、これらの内分泌臓器から分泌されるホルモンは下垂体や視床下部に作用して甲状腺ホルモンはTSH分泌の抑制、副腎皮質ホルモンはACTH分泌の抑制、エストロゲンやテストステロンはそれぞれ女性、男性でLHの抑制に作用して、内分泌臓器からのホルモンの分泌を適切に調節している。また、卵胞や精細胞からはインヒビンというホルモンがFSHの分泌を抑制するように作用している。インヒビンを結合する蛋白質であるフォリスタチンが血液中にあってインヒビンの作用を調節する役目もする。成熟した生体は、これらの調節作用のネットワークにより、ある程度の量のホルモンが外部から入ったとしても体内のホルモン分泌を抑制することにより濃度を調節するなど、ある一定の範囲内ではホルモン濃度を一定範囲に調節する能力を有している。(H)その他
これら古典的に知られている内分泌臓器のほか、脂肪組織からはレプチンが分泌されて食欲やエネルギー代謝を調節していることが知られているし、心臓・血管系からは心房性Na利尿ペプタイド(hANP)やエンドセリンが分泌されている。中枢神経系からもニウロペプタイドY(NPY)をはじめ多数のホルモンが分泌されている。
(2)性腺の分化と形成
性腺の分化と形成については、以下のとおりである。発生の初期に形成される生殖隆起という部位から男女の性腺が作られる。女性ではミュラー管から卵管・子宮が形成され、男性では男性ホルモンの支配の下に、精巣となる性腺が下降しウォルフ管から輸精管、外性器が誘導される。この過程が途中で障害されると停留精巣という状態が引き起こされる。外性器の形成については男性では男性ホルモンの支配下に皮膚が伸展してきて尿道を包み込み陰茎が形成されるが、この過程が途中で障害されると、尿道下裂という状態になる。この過程は男性ホルモンとそれが誘導する転写因子の影響下に支配されており、(A)男性ホルモンが不足しているか、(B)男性ホルモン作用を受け止める受容体がないか、(C)ホルモンが結合した受容体の作用を調節する共役蛋白質群(co-activator, co-repressorなど)に異常があるか、(D)またはこれらのほかの何らかの原因により器官の発生を誘導する蛋白質である転写因子が形成されない場合には、染色体はXYで男性であり、内性器は精巣であるのに、外性器、体型は女性であるという、男性ホルモン不応症となる。異常の程度が軽ければ尿道下裂などの異常が見られる。人は思春期になると性腺刺激ホルモンの分泌が亢進して性腺の発育が促進され、女性では排卵及びそれに伴う月経が始まり、男性でも精子の形成が始まる。性腺刺激ホルモンの分泌は思春期までの小児期には、神経・内分泌機構の成熟に直結した複雑なフィードバック機構により抑制されているのであり、この抑制が解除されて、性の成熟が引き起こされる。
(3)ホルモンの血中濃度、組織への移行、細胞への到達
ホルモンは、水溶性のものと、脂溶性のものに大別することができる。水溶性のホルモンの成分は、蛋白質・ポリペプタイド・アミン・アミノ酸であり、現床下部及び下垂体から分泌される全てのホルモンは蛋白質またはポリペプタイドである。蛋白質やポリペプタイドのホルモンは分子量が大きいので細胞膜を通過することができず、細胞表面の受容体(レセプター)蛋白に結合して作用を発揮することになる。アドレナリン/ノルアドレナリンはアミンで分子量は大きくないが細胞膜にある受容体に結合して作用を発揮する。甲状腺ホルモンは一種のアミノ酸であるが、細胞核に達して細胞核にある受容体に結合して作用する。受容体の構造もステロイドホルモン受容体とよく似ている。
一方、ステロイドホルモンは複雑な環状構造をもつ炭化水素であり、脂溶性で細胞膜を通過して最終的には核に到達し、その核内にある受容体蛋白に結合して作用を発揮する。
すなわち、ホルモンはそのホルモン固有の受容体蛋白に結合してはじめて作用を発揮することになる。この過程の詳細は後述する。
ホルモンの作用は血液中の濃度に比例して発揮されることが多いから、その血中濃度は多くの場合、負のフィードバックにより一定に調節されている。しかし、必要な高濃度に短時間に到達するための正のフィードバックの機構もある。例えば、下垂体からのLH分泌が急激に上昇して排卵を誘発するが、その際には卵胞から分泌されたエストロゲンの血中濃度が上昇し、これが逆にLH分泌を亢進させるという正のフィードバックを行うことが知られている。また、ホルモンが標的器官に与える情報はホルモン濃度のみではなく、ある場合には、一定時間内の分泌回数も情報となる。例えば、GnRHは約2時間に一回の分泌のスパイクがあるが、これが情報の一つとなってLHの分泌を刺激する。逆にGnRHを常に一定濃度で分泌させるとLH分泌の抑制が起こる。このように刺激ホルモンの分泌頻度が情報となってLHの分泌を制御している例もある。また、血液中、組織中には各種のホルモンの結合蛋白があって、適量のホルモンが組織に到達するように支配している場合もある(インスリン様成長因子結合蛋白群など)。
(4)ホルモン受容体との結合
ホルモンは、それぞれに固有な受容体に結合して作用を発揮する。ホルモン受容体蛋白に結合した後のホルモンの作用は、細胞にあらかじめプログラムされていた既存の反応を開始することで、新しい反応を作り出すことではない。
例えば、インスリンは受容体に結合すると、受容体にリン酸が結合し、受容体自体が IRSという蛋白質をリン酸化する酵素になり、これがさらにいろいろな蛋白質をリン酸化して形や機能を変化させ、ブドウ糖輸送蛋白(GLUT4)の回転を早めて筋肉などの細胞でブドウ糖の取り込みを高めるとともに、細胞の増殖を促進する。また、成長ホルモンによる刺激伝達の機構も同様の細胞内蛋白質のリン酸化によるものである。このほか、リン酸化された蛋白質が核内に移動して、核でDNAに結合して別の蛋白質を合成するため転写を高める仕組みも存在している。
一方、脂溶性ホルモンは細胞膜を容易に通過して、直接核に入って受容体に結合するか、または細胞質内の受容体に結合する。受容体蛋白は別の保護蛋白(例えばエストロゲンの場合には熱ショック蛋白質)に結合している場合もある。受容体にホルモンが結合すると、保護蛋白が離れて受容体のDNAに結合する部分が露出する。核内にある受容体蛋白にはホルモンに結合する部分と、特定の DNA部分に結合する部分がある(この部分が亜鉛を含む指状の構造になっている受容体蛋白も多い)。多くの場合ホルモンが結合した受容体2個が一組となってDNAに結合するが、ホルモンに特異的な受容体一個と別の物質に対する受容体一個(例えば、甲状腺ホルモンに対する受容体一個とレチノイン酸受容体一個)の組み合わせで特定の遺伝子の特定のDNA部分に結合する場合がある。これらのホルモンと受容体結合物にはco-activator, co-repressorなどの作用をもった多くの共役蛋白群が結合して、DNAとの結合の強さを変えたり、DNA鎖の形に変化を与えたりして、結果としてDNAの結合の転写を促進したり、抑制したりすることによって、コードされている蛋白質の合成を促進したり、抑制したりすることになる。一つのホルモンに対して複数の核受容体(α, βなど)があることが知られているものもある。例えば、甲状腺ホルモン受容体はα,βの別があって組織の分布が異なり、異なる作用を発揮している。エストロゲンの受容体にもα, β, γの別があって、それぞれ異なる作用を行っている可能性がある。
これまで既知のホルモンの受容体はほとんどが調査されているが、受容体であることが分かっているものの、受容体に結合する体内のホルモン(リガンド)が判明していないものがあり、「orphan receptor (みなしご受容体)」と呼ばれている。膜受容体にも、核受容体にも、このような「orphan receptor」は知られているが、これが現在もっとも活発に研究されている分野の一つになっていて、新しいホルモンの発見の糸口にもなっているのである。例えば、G-蛋白を結合する膜受容体の未知のリガンドに関する研究から、オレキシンという新しい食欲調節物質や、まだ命名はされていないが、TRHとは異なる、従来知られていなかったプロラクチン分泌ホルモンなど新しいホルモンがいくつも発見されている。 また、核内に存在するアリール炭化水素(Ah)受容体は、ダイオキシンと結合するが、体内のどのような物質がこの受容体に結合して、何をしているのか、正確には解明されていない。この解明はダイオキシンの生体に対する作用を明らかにする上で重要である。
また、正常では存在しない外的な因子が受容体やそれに引き続くシグナル伝達経路を介して正常なホルモン作用に影響を与える例として以下のようなものが知られている。バセドウ病は、TSH受容体に対する抗体が疑似TSHとして結合して作用するため引き起こされる。また、受容体に共役しているG-蛋白には百日咳毒素やコレラ毒素が結合して、それぞれの症状を引き起こすことが知られている。エストロゲン受容体に対してはタモキシフェン(乳がん治療薬)が、プロゲステロン受容体には薬剤 RU486が結合し効果を発揮することが知られている。
(5)ホルモン作用の発現
体内の細胞は、それぞれ特有の性質や機能を有しているが、どの細胞も染色体に同じDNAのコピーを持っている。細胞により性質や機能が異なるのは、それぞれの細胞がDNAの設計図のうち必要な部分を翻訳して、必要な蛋白質、酵素を生成した結果である。あるホルモンが新たな蛋白質合成を促進することがしばしば見られるが、この場合ホルモンとその核受容体が結合し、その蛋白質をコードする遺伝子の一定のDNA部分に結合することから、転写調節因子により基本転写因子が活性化され、RNAポリメラーゼの活性が促進され、DNAからmRNAへの転写が促進され、mRNAのコードに基づきアミノ酸が結合して、特定の蛋白質が合成される。この転写調節因子及び基本転写因子も蛋白質であるため、ホルモン作用と考えられているものには、ホルモンから誘導された転写因子の働きによるものも含まれている。例えば、性腺の分化過程では転写因子(AD4BP, DAX4)が次々と作用している。この転写因子を阻害するとホルモン不足と同様の結果をもたらすことが示されている。
ある器官が形成されるときには、順序よく新しい蛋白質や酵素が合成されることが必要である。このため多くの転写調節因子が、順序とタイミングを間違えずに発現しており、これらの転写調節因子の合成や発現の一部にはホルモンが関係している。ホルモンは、発生の過程では分泌時期や分泌量が厳密かつ正確に制御されている。仮に、外界から、これらの制御の網を乗り越えて、ホルモンに類似した物質が入ってきて、核内のホルモン受容体に結合したら、正常の器官発生を支配する転写や発現の順序を障害し、様々な異常が生まれる可能性が指摘されている。
2.内分泌かく乱化学物質の作用メカニズム
(1)定義
内分泌かく乱化学物質をどのように定義するかについては、その化学物質と内分泌系との相互作用が必ずしも明らかになっていないこと等から、国際的に科学的な議論が続けられてきている。第50回世界保健機関総会(1997年)においては、内分泌かく乱化学物質問題に対するリスクアセスメントと、その化学物質への暴露によって生じ得る健康影響の研究に対して、WHOのリーダーシップを補強するために必要な限りの手段を採ることを決議している(WHA 50.13 1997(*文献番号1))。「内分泌かく乱」の語義は、英語では"endocrine disruptor(s)"と表現されていることによっており、ある種の化学物質が、前述の内分泌系(endocrine)に対して、"disruption"、すなわち「崩壊、粉砕、あるいは混乱(研究社英和中辞典)」を引き起こすことを意味しているが、その「崩壊、粉砕、あるいは混乱」とは、人や野生生物の生殖、発生などの局面における“種の存続”に関わるような障害性の影響を指している。具体的にどのような物質がそうした概念に含まれるかについては定まらないものの、種々の概念付けが試みられている。現在、その定義としては、“種々の個体レベルで生殖、発生などに障害性の影響を与える内分泌環境の変化”を来す現象を中心にすることとし、次のように概念付けている。
●「内分泌かく乱化学物質とは」
内分泌系の機能に変化を与え、それによって個体やその子孫あるいは集団(一部の亜集団)に有害な影響を引き起こす外因性の化学物質又は混合物(世界保健機関・国際化学物質安全性計画[WHO/IPCS])(*文献番号2)
ただし、1997年2月のスミソニアン・ワークショップでは、内分泌かく乱化学物質とは「生体の恒常性、生殖、発生、あるいは行動に関与する種々の生体内ホルモンの合成、分泌、体内輸送、結合、そしてそのホルモン作用そのもの、あるいはそのクリアランスなどの諸過程を阻害する性質を持つ外来性の物質」と定義づけられており、内分泌機構の機能的な性質を考慮に入れて理解することの重要性が併せて強調されている。
(2)作用メカニズム
内分泌かく乱化学物質は通常、ホルモンの作用を模倣、増強又は阻害する天然生成物又は合成化学物質である。そのような化学物質の生体に対する作用メカニズムについては、種々の考え方があり、例えば、ホルモン受容体への作用機序をとっても、次のようないくつかの可能性が指摘されている。
受容体に作用し、正規のホルモンの受容体結合を修飾し、細胞のホルモンによる正常な機能に影響を与える。
(B)疑似ホルモンとしての機能の発現
ホルモンに類似した構造の化学物質が、ホルモン受容体との相互作用により、細胞に不必要で異常な機能発現を引き起こす。
(C)受容体の発現と機能の変異
化学物質が細胞の受容体の発現を引き起こし、若しくは抑制し、ホルモンの活性を通常状態と変質させる。
(D)生体内ホルモンとの相互作用による機能変異
化学物質がホルモンと相互作用を引き起こして、惹起するメッセージを変化させ、細胞機能を変質させる。
(E)ホルモンの産生障害と結果としての異常若しくは欠乏状態
化学物質のホルモンの産生、特にステロイド代謝障害と、その結果としてのホルモン異常又は欠乏状態
また、内分泌かく乱化学物質の作用には、 (A)同じ物質が異なった臓器に対して異なった影響を与えること、 (B)同じ物質が胎生期を含む異なった成長段階で異なった影響を与えること、 (C)個体環境、栄養、年齢その他の影響、 (D)他の化学物質などその他の要素との相互作用(相加性、相乗性など)、 (E)同じ物質が異種間での異なる反応を起こすことなど、様々の要素が関与してくる可能性が知られている。
3.物理化学的性質
これまでに種々の情報源が、内分泌かく乱化学物質と指摘されている化学物質を列挙している。これらの化学物質の中には、すべてのリストに掲げられているものもある反面、相互のリストにかなり取捨選択の上での差異が見られることも事実であり、現時点での個々の物質の内分泌かく乱作用の有無、種類、程度などについては未解明な点が少なくない。これらの物質には、農薬の有効成分、工業化学物質、医薬品等が含まれているが、それらの中には既に我が国では生産、使用、輸入等が禁止されているもの(PCB、DDT、クロルデン等)も含まれている。他方、内分泌かく乱化学物質の試験法は検討中であるが、調査研究の進行に伴って、かく乱作用が疑われる化学物質の数が変化することも予想される。
医薬品:合成ホルモン類は内分泌系への作用を期待して服用されるため、内分泌作用をもつのは当然のことであるが、これらの中には、妊娠期の投与によりいわゆる“DES娘”を生み出したdiethylstilbestrol(DES)をはじめプロゲストーゲン、アンドロゲン、エクジステロイド、ファルネシルホルモンなどの医薬品が含まれる。これら医薬品は、ヒトを経由した後の環境への放出も指摘されている。また、肉牛に対しては、エストロゲンがアナボリックステロイド(タンパク同化ステロイド)として作用することから、エストロゲン作用を有する薬物が投与されることがある。国際的には、FAO/WHO合同食品規格委員会(コーデックス委員会)において、天然型ホルモン剤については、通常の食肉中に存在していることから、残留基準値が設定されていない。また、合成型ホルモン剤であるゼラノール及びトレンボロンアセテートについて食肉中への残留基準値が設けられている。我が国では、ゼラノール及びトレンボロンアセテートについて食肉中への残留に関して規制されている。
有機塩素系の殺虫剤:内分泌かく乱化学物質として環境中への拡散が知られているものの代表的なものは、エストロゲン様作用を示す物質として以前より知られているDDT(*文献番号3)に代表される有機塩素系の殺虫剤であり、ジクロロジフェニルエタン系殺虫剤(DDTやその代謝物(DDD、DDE)等)、シクロダイエン系殺虫剤(クロルデン、オキシクロルデン、t-ノナクロール、ヘプタクロール、ヘプタクロルエポキサイド、アルドリン、ディルドリン等)、ヘキサクロロベンゼン、ヘキサクロルシクロヘキサン等が含まれている。これらの化合物の多くは分解しにくく、しかも生体内に濃縮され蓄積するので消失速度が極めて遅いことが知られている。少量の有機塩素系化学物質への長期にわたる暴露は、動物及びヒト組織への蓄積へとつながる(*文献番号4)。
ポリ塩化ビフェニル:熱交換媒体、粘着剤、耐炎剤、絶縁溶液などと工業用途から家庭生活にまで広く長期にわたって用いられてきたポリ塩化ビフェニル類(PCBs)と化学工業副産物のダイオキシン類は、その蓄積性と強い毒性ゆえに問題となっている。PCBsは209種類におよぶ多くの同族体からなるが、その多くが極めて安定なもので、生体蓄積性である(*文献番号5)。したがって、これらの環境への残留性は以前より特に指摘されてきた。1970年までに数十万トンのPCBsが製造されている(*文献番号6)。市販品は多くの同族体の混合物であり、このことは環境試料や生物試料の分析や結果の解析を困難にしている(*文献番号7)。欧州議会におけるPCBの現在の定義では0.005%以上のPCBsを含む流動体とされている。英国の環境衛生研究所のまとめたPCBsのエストロゲン様作用(*文献番号8)によれば、当初エストラジオールの百万分の一程度(*文献番号9)と考えられていたが、マウス子宮のエストロゲン受容体結合試験(*文献番号10)により、ヒドロキシ体がエストロゲン活性をもつ化合物であることが見出された(*文献番号11)。このようにして見出されたヒドロキシ体は、4-ヒドロキシ-2',4',6'-トリクロロビフェニル、4-ヒドロキシ-2',3',4',5'-テトラクロロビフェニル、4,4'-ジヒドロキシ-2'-クロロビフェニルなどで、エストラジオールの1/42〜1/90程度の活性を有していた。なお、Korachによれば、これらは親化合物より水溶性であり、易排泄性である。これらの物質の内分泌かく乱機序は、主にアリール炭化水素(Ah)受容体を介して発現することが明らかになっており、このことは、さらに未知の受容体を介して作用する内分泌かく乱化学物質が存在する可能性も示唆している。同じPCBの同属種で、エストロゲン作用と抗エストロゲン作用という相反した性質が観察されることがあるのもそうした背景を反映している(*文献番号12)。これによれば、3,4,3',4'-テトラクロロビフェニルの抗エストロゲン作用の場合、MCF-7ヒト乳がん樹立細胞での52KDaのタンパクの誘導を阻止することが解っている。
アルキルフェノール類:アルキルフェノール類は、非イオン性界面活性剤アルキルフェノールポリエトキシレート(APEs)の微生物分解物であり、APEsは、合成洗剤、塗料、除草剤、殺虫剤などとして広く大量に製造され、1998年における世界の生産量は年産30万トンを超えるものと予想されている(*文献番号13)。これらは、下水を通じて広く水環境に放出され、比較的安定性で、陸水系に入ると生体の脂肪中に取り込まれるとされている。基本化学構造はアルキルフェノールで、容易に分解されない。分解されず、残留物が河川に放出され、水棲生物への毒性が指摘されていることなどにより、20世紀末を目指した、逓減計画が立てられているとのことである(*文献番号14)。エトキシレートをもつ種々の化合物のうち、80%を占めるp-ノニルフェノール及びp-オクチルフェノールのエストロゲン活性は、MCF-7などヒト乳がん細胞の増殖活性、形質転換ニワトリ胚線維芽細胞における遺伝子転写活性、ニジマス肝細胞でのビテロゲニン遺伝子発現などを利用して調べられている。これらの反応系で測定される活性は、オクチルフェノールがノニルフェノールよりもやや高い活性を持つと同時に、エストラジオールに対しては、1/1000程度であったとされている。
植物性エストロゲン:植物に含まれる植物性エストロゲン(phytoestrogens)は、自然の産物である点で他の化学物質と異なっている。特に家畜を対象としたときに問題になる環境物質である。また、大豆製品等に含まれるものは日常の食生活を通じてヒトに摂取されている。主な活性成分は、イソフラボン(ゲニスタインとダイドゼン)及びクメスタン(クメステロール)であることが明らかになっている(*文献番号15)。ヒツジが大量のゲニスタインを含むムラサキツメクサを食べると、生殖異常を生ずることは古くから知られている(*文献番号16)。穀物のある種のカビ代謝産物、ゼアラレノンのような物質もエストロゲン作用物質である(*文献番号17)。これら外因性エストロゲンと呼ばれるものの他に、アンドロゲン作用物質などそれ以外の内分泌かく乱物質があるものと考えなければならないが、これらの物質についての系統的な整理はなされていない。
注:なお、ビスフェノールA、スチレンダイマー及びスチレントリマー、フタル酸エステルについては後述されている。
4.暴露経路
内分泌かく乱作用が疑われている物質は、農薬の有効成分、工業化学物質、医薬品、植物ホルモン等が含まれているが、農薬、工業用化学物質、環境中汚染物質など多種多様なものがあり、その暴露経路も複雑である。人への影響を評価し、その対策を講じる上で、人が個々の化学物質にどのように暴露しているかを解明することは特に重要である。現在、報告されている主な報告を基に暴露経路は概ね以下のように整理することができる。
(B)食品等からの暴露(経口)
(C)接触暴露(経皮)
5.人への影響
内分泌系は、様々な人の生体機能を複雑に制御しており、この系がかく乱された場合、種々の健康影響が生じる可能性がある。現在のところ、内分泌系への薬理作用を期待して使用されたDESのような例を除き、内分泌かく乱化学物質が与え得る人への健康影響について確たる因果関係を示す報告は見られない。しかし、一方では、野生動物の調査あるいは、一部の人の疫学調査等から、女性生殖器系、男性生殖器系、甲状腺、視床下部や下垂体等への多岐にわたる影響が指摘されている。また、その影響は、直接暴露される親の世代だけでなく、次の世代にも及ぶことが危惧されている。具体的には、子宮がん、子宮内膜症、乳がん、精子数の低下、前立腺がん、精巣がん、尿道下裂への影響等である。以下にその概要を示すが、原因となる物質や環境、作用メカニズム等は未解明なものが少なくない。仮に、内分泌かく乱化学物質との関連性を指摘する場合には、動物実験などにより、要因(化学物質の種類、作用の程度等)について明らかにしていく作業が必要である。
(1)女性生殖器系及び乳腺への影響
子宮がんは、頸部にできる子宮頸がんと体部にできる子宮体がんに分けられるが、ホルモンとの関連が密接なのは後者である。子宮頸がんは、日本では年間約1.2万人(1990年推定)が罹患しているが、ホルモンとの関連は薄いものと考えられている。子宮体がんは、日本では年間約3,000人(1990年推定)が罹患しており、子宮頸がんが減少しているのに対し、子宮体がんの年齢調整罹患率は増加傾向にある。しかしながら、国際的には、日本の子宮体がん罹患率は欧米などと比較すると、現状においても半分に満たない。
(B)子宮内膜症
子宮内膜症は、その診療技術の向上やおそらくその実際の発生数の増加により、その報告数は増加している。子宮内膜症の病因については、未解明な点が多いが、複数の原因が考えられている。人の研究では、少なくとも子宮内膜症の発生進行に関しては、エストロゲンが作用していることが必要であるとされているが、エストロゲン作用の程度が子宮内膜症の原因として決定的な役割を果たしているわけではない。
(C)乳がん
乳がんは40歳代後半と60歳代で多く発症し、発症年齢に2峰性のピークを持っている。日本では年間約2.7万人 (1992年推定)が罹患しており、その年齢調整罹患率は増加傾向にある。しかしながら、国際的には、日本の乳がん罹患率は欧米などと比較すると、現状においても半分に満たない程低値である。ただし、欧米に移住した日系人では時代的推移でのペースを上回る増加を示しており、食習慣の急激な変化との関連が指摘されている。
(D)その他
女児が胎内でDESに暴露されると子宮の先天奇形や後に膣がんを発生するリスクが高まることが知られている。DESは、強力な合成エストロゲン製剤であり、過去において医薬品として流産防止の目的で使用されていたものであり、一時期乳がんの治療薬としても使用されていたが、現在は乳がん治療薬として臨床の現場で用いられることはない。
ある種の化学物質は、実験動物において、エストロゲン作用、抗アンドロゲン作用を有し、精子生成能力、生殖管異常等の雄性生殖器系の異常を引き起こすことが報告されている。これらの実験動物の調査研究等は、人における精子数の減少や前立腺がんの増加等の様々な影響を懸念させている。
SharpeとSkakkebaek(*文献番号27)は1993年、環境中のエストロゲンとの関連で、精子数の減少や精巣がん、尿道下裂、前立腺がん、男性不妊症などといった生殖異変が増加しているという仮説をThe Lancetに発表した。エストロゲン作用のような内分泌かく乱作用を持つとされる化学物質は1993年のColbornら(*文献番号28)の論文で63物質が取り上げられているが、その数は増え続けている。代表的なものとしては、DDTやPCB、合成洗剤などに使われるノニルフェノール、プラスチックの原料及び可塑剤に使用されるビスフェノールAやフタル酸エステル、発泡スチロールに含まれるスチレン、工業製品の生成過程やゴミの焼却の際に発生するダイオキシン類などがある。医薬品として使用されるステロイドホルモン類や天然の植物エストロゲンも内分泌かく乱作用を生じると考えられる化学物質としてリストアップされている。ヒト精子への影響では、胎児期のDES暴露によって、あるいは農薬等の職業暴露やベトナム退役軍人のダイオキシン暴露によって精子数が低下したとの論文があるが、否定的な報告もある(*文献番号29)(*文献番号30)。これまでに因果関係が示されている内分泌かく乱化学物質のヒトへの影響はこうした事故による偶然の暴露例のみである。現在のところ、一般生活環境において内分泌かく乱化学物質の影響でヒト精子数の減少や精液の質の低下、生殖器の異常等が生じたことを示した報告例は見当たらない。
1974年、米国のNelsonとBungeは避妊目的で精管結紮手術を受ける前の男性386人の平均精子数が、それ以前の報告例(多くの例で100×10の6乗/ml以上)に比べて予想外の低値(48×10の6乗/ml)を示したことを発表し、あくまでも仮説であるとしながら、何らかの環境因子の関与を指摘した(*文献番号31)。それを米国コーネル大学の精子学の権威MacLeod(*文献番号32)が批判し、1979年の論文で、15,000人以上の男性を対象とした10年間の調査の結果、精子数に減少傾向は見られないと結論付けた。これにより論争は一旦静まり、その後も精子の質低下を示す論文は発表されたが、1990年代に入るまで議論が再燃することはなかった。
b)精子数が減少しているとの結論を出している報告
Carlsenらの論文は1940年から1990年の間に平均精子濃度は113×10の6乗/mlから66×10の6乗/mlへと42%も減少し、平均精液量は3.40mlから2.75mlと有意に減少していることが示された。Augerら(*文献番号34)によると、1973年から1992年にかけて19歳から59歳までの男性1,351人を調査した結果、精子濃度は1973年の89×10の6乗/mlから1992年の60×10の6乗/mlへと年間2.1%ずつ低下し、運動精子数及び正常形態精子数もそれぞれ有意に減少し、誕生年が上がるにつれて、つまり若い世代ほど、精子濃度、運動率、正常精子形態率は有意に低下していたことを観察し、彼らはパリの生殖能力のある男性の精液の質低下を認めたと結論している。Van Waeleghemら(*文献番号35)のベルギーからの報告では、20歳から40歳までの精液提供者416人の精液を過去19年間にわたって検査したところ、精子濃度は12.6×10の6乗/ml減少したが、1回の射精当たりの精子数は変化なかったと報告している。さらに1977-1980年と1990-1995年の期間を比較すると精子正常形態率は39.2%から26.6%に、前進精子運動率は52.7%から31.7%にそれぞれ低下していた。Irvineら(*文献番号36)はスコットランドにおいて1959年以前と1970年以降について比較し、精子濃度が50年代の98×10の6乗/mlから70年代の78×10の6乗/mlに減少していることを示した。また、Ginsburgら(*文献番号37)は1978年から1983年までと1984年から1989年までを比較したところ101×10の6乗/mlから96×10の6乗/ml に減少していると報告した。
c)精子濃度は低下していないあるいはむしろ増加しているとの論文
MacLeodら(*文献番号32)は1979年に、1966年から1977年の間の経時的変化を検討しているが、この期間に両グループとも精子濃度、精液量の減少傾向が見られなかったことから、彼らが最初に報告した1951年以来精子濃度は減少していないと結論している。Fischら(*文献番号38)は米国内3カ所について、1970年から1994年までの期間の3地域の比較では精子濃度と運動率においてカリフォルニアがそれぞれ72.7×10の6乗/ml, 51.4% と最も低値、次いでミネソタが100.8×10の6乗/ml, 56%で、最高値はニューヨークの 131.5×10の6乗/ml, 58.2% であった。彼らは調査の結果が3つの地域で有意に異なっていたことを示し、米国の3つの地域では過去25年間に精子数は減少していなかったと結論した。Paulsenら(*文献番号39)の1972年から1993年間におけるシアトル調査でも、精子数の減少は認められなかった。Bujanら(*文献番号40)の報告では、フランスのトゥールーズ地方においては1972年から1992年の20年間で精子濃度の減少は示されていなかった。1997年のイスラエルからの報告(*文献番号41)では、1980年から1995年の期間を通じて精子濃度、運動性ともに変動はなかったと結論している。
d)本邦での報告
本邦における最初の正常男性精子数の報告は1954年高島ら(*文献番号42)の57.6×10の6乗/mlである。 1982年に吉田(*文献番号43)は、1976年から2年間に調査したその結果は、精液量が3.0±0.9ml、無精子症の1例を除いた平均精子濃度が106×10の6乗/mlであった。1984年、生垣ら(*文献番号44)は1975年から5年間の結果を報告し精子濃度は70.9×10の6乗/mlであった。最近では、押尾ら(*文献番号45)が20歳代と40歳代の調査で、それぞれ平均精子濃度(45.8×10の6乗ml, 78.0×10の6乗/ml)、平均運動率(27.2%, 28.0%)であったことから20歳代の精子数、運動率の低下を指摘、岩本らの妊娠中のパートナーの調査では平均精子濃度82.6×10の6乗/ml、運動率54%との報告、吉村らの精液所見の経年変化を見た報告(*文献番号46)では精子数の低下の報告等を見るが今後の更なる分析が待たれる。
e)ヒト精子問題をめぐる問題点
精液所見は様々な因子によって病的にも生理的にも変動し得る。過去の多くの論文において禁欲期間が一定していない。マスターベーションによる精液の採取では慣れの問題も影響する。複数回にわたって精液を提供している例では、初回のみの検査結果あるいは数回の検査中の最も良い結果を採用している論文もある。検査を実施する技術者によっても結果は変わることがある。自動精子分析器は機械ごとに計測値にばらつきが生じやすく、精液所見の相対的な変化を知るには問題ないが、異なる機械を用いて得られたデータは、厳密には比較できない。
前立腺がんは、50歳以降に発症し、日本では年間約9,000人(1992年推定)が罹患している。その年齢調整罹患率は増加傾向にある。しかしながら、国際的には、欧米などと比較すると、現状においても約1〜2割程度の罹患率にすぎないが、欧米へ移住した日系人では明らかに増加し、食習慣の変化との関連が指摘されている。また、米国において1980年代後半より見られた急激な罹患率の増加は、血清PSA (prostate-specific antigen) や触診による前立腺がんスクリーニングの普及による発見数の増加の影響と考えられており、近年では減少に転じている。前立腺がんのリスク要因については確立されたものはないが、食事(脂肪・赤身肉の高摂取、野菜の低摂取)や性活動などの内因性ホルモン(テストステロン等)レベルに影響を与える要因が示唆されており、ホルモン関連性のがんと考えられている。
(C)精巣がん
精巣がんは、20〜30歳代の若年者に発症し、がんとしては異質な年齢的特性をもつ。日本では年間約800人(1992年推定)が罹患しており、その年齢調整罹患率は少数例で不安定であるが上昇傾向にある。欧米においても、各国一貫した上昇傾向が認められたが、近年では横ばいから低下傾向にある。また、米国では罹患率に5倍程度の人種差が存在し、低率な黒人では増加傾向は認められない。日本の罹患率は、他のホルモン関連がんと同様に、欧米などの諸国に比較して極めて低値である。精巣がんのリスク要因としては、低アンドロゲン状態に関連する停留精巣が確立されており、約2〜10倍のリスクの上昇が報告されている(*文献番号48)。また、母親の妊娠初期のエストロゲン剤使用との関連も少数の症例対照研究で報告されているが、DES及びプラセボを投与された妊婦の男児各250名の追跡研究では、精巣がん症例をいずれの群でも認めていない(*文献番号30)。
(D)尿道下裂
尿道下裂は男児の泌尿器科疾患では比較的頻度の高い先天奇形である。この異常は胎生8週から12週頃の外陰部の形態発生中に陰唇陰嚢ヒダの不完全な癒合に由来し陰茎腹側にあるいは陰嚢に尿道の異常開口をもたらす。この尿道発生過程は胎児精巣によるテストステロン(T)の分泌に依存している。
(E)その他の男性生殖器への影響
男性生殖器の発生を簡単に紹介すると、胎生7週目になるとsex-determining region (SRY)遺伝子が活発化し、精巣決定因子(testis determining factor: TDF)を産生する。これにより原始生殖腺にセルトリ前駆細胞が発生し、抗ミュラー管ホルモン(anti-Muellerian hormone: AMH)を分泌する。さらに胎児性ライディッヒ間細胞の発生を誘発し、テストステロン(T)の分泌が開始される。既に中腎管(ウォルフ管)の基部に尿管芽が発生する時期に、中腎管と並列に中腎傍管(ミュラー管)が発生している。ミュラー管は男性の場合、AMHによってすぐに退化する。9週間頃までに外性器は生殖結節、生殖隆起及び尿生殖洞を取り囲む生殖壁からできている。胎生12週までに精巣は深鼠径輪の近傍まで下降する。またその頃に左右の生殖壁、生殖隆起は融合して尿道海綿体、陰嚢となり、生殖結節は肥大して亀頭となる。胎生7ヶ月以降Tやその他のアンドロゲンの影響で精巣導帯の収縮が開始し、9ヶ月までに精巣は陰嚢底部に到達する(*文献番号61)。
(3)甲状腺系への影響
甲状腺はサイロキシン(T4)、トリヨードサイロニン(T3)を分泌する臓器で、T4やT3は身体の発育・知能の発達にとって重要なホルモンであることから、性腺に次いで、内分泌かく乱化学物質の影響が詳しく調べられている臓器である。環境に排泄されたPCBやダイオキシンは魚類に蓄積され、これが鳥類・海棲哺乳類・人間に種々な作用を及ぼすことが知られている。PCB類は母体血や乳汁中から乳幼児期の動物体内に入ると、血液中のT4輸送蛋白であるトランスサイレチンに結合してT4の神経系への供給量を少なくすること(*文献番号66)(*文献番号67)(*文献番号68)(*文献番号69)、肝臓に作用して甲状腺ホルモンの腸への排泄を促進することで、中枢神経系に甲状腺ホルモン欠乏を起こさせる一方(*文献番号70)、脳でT4から真に活性のある甲状腺ホルモンであるT3を誘導する脱ヨード酵素を増加させる(*文献番号70)。乳児期の動物に与えるとコリンアセチルトランスフェラーゼという酵素の活性を阻害するが(*文献番号71)、これがT4の投与により阻止されること等が実験動物で示されている。人間でもPCB類で汚染された魚の摂取量と、乳幼児期の神経発育の未発達度を示す指標の間に、関連があるとする報告が欧米から出されている(*文献番号72)(*文献番号73)(*文献番号74)(*文献番号75)(*文献番号76)。これが直接に甲状腺ホルモンに対する作用を介して生じているものかどうかに関して、オランダで105人の新生児と母親のペアで調べられ、PCB濃度の高い乳汁を出す母親の血中T4、T3の濃度が有意に低いこと、児の血中TSH濃度が有意に高いことが報告されている(*文献番号74)。日本及び台湾ではPCBが食用油に混入する事故「油症」を経験したが、台湾からの報告では油症の母親から産まれた子供について、7年後においても知能指数にわずかな遅れが見られることが報告されており(*文献番号77)、神経系の発育期における甲状腺ホルモン代謝との関連で注目されている。しかし、暴露を受けた成人でも、生まれて成長した小児でも、血中甲状腺ホルモン値に有意な低下があったとする報告は今のところ無く、甲状腺ホルモン不応症に似た状態があるのではないかと推測する研究者もいる(*文献番号78)(*文献番号79)。PCBの工場での職業暴露で甲状腺機能が低下したとの報告もあるが、甲状腺異常の原因は自己免疫性甲状腺疾患であり、PCBとの因果関係は明らかでない(*文献番号80)。
(4)その他
視床下部・下垂体への影響は、現在のところ確かなものは知られていない。
(B)野生生物への影響
米国フロリダのワニやいくつかの海洋無脊椎動物などに対して、環境中の化学物質が生殖機能に障害性の影響を与えているとの報告がなされている。例えば、中央フロリダのアポプカ湖におけるワニのペニスの矮小化、卵の孵化率の低下等と湖水中への化学物質の流出の関連が指摘されている(*文献番号81)。また、米国五大湖のセグロカモメの性比の変化は、環境中のDDT等のエストロゲン様物質が原因となっているとの仮説もある(*文献番号82)。我が国では、巻き貝のイボニシやレイシガイで、雌に対する雄の性徴(インポセックス)が出現しており、船底防汚塗料として用いられていたトリブチルスズ(TBT)の暴露により、インポセックスが誘導されたとの報告がある(*文献番号83)(*文献番号84)。
(5)人への健康影響についての評価
既に見てきたように、生体内ホルモンの分泌と代謝は高度に調節され、ホルモンの変動を制御する機構はホルモン濃度のフィードバック制御を含め、いわゆるホメオスタシス(恒常性)による調節機構の制御下にあって常時一定の適当な条件下にあるものと考えられる。
(1)我が国おける主な取組
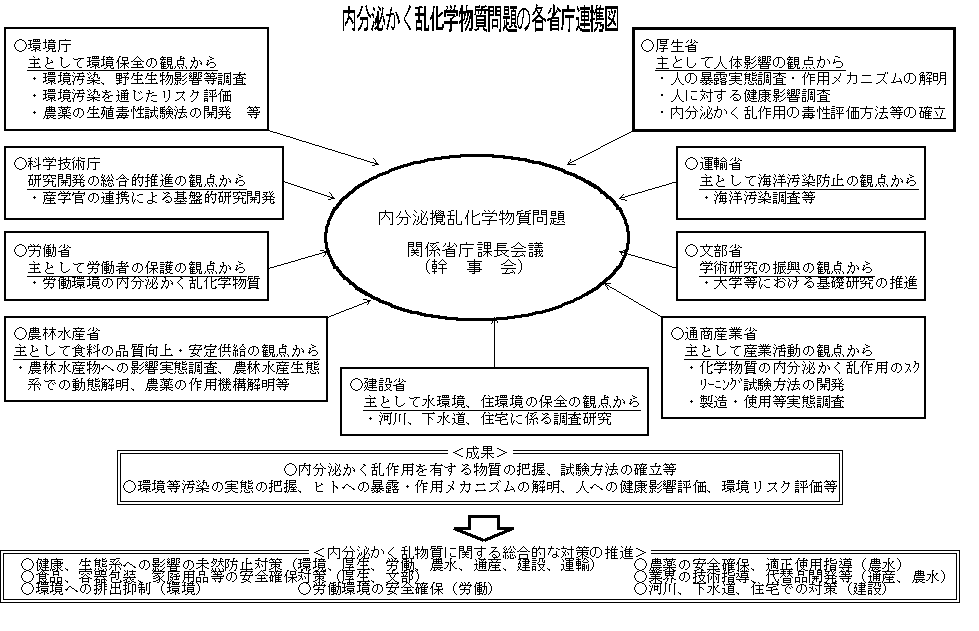
我が国における内分泌かく乱化学物質問題への取組は、関係行政機関を中心に始まっており、特に平成8年以降、調査研究など一連の取組が活発に進められている。厚生省では、平成8年に本問題に関する研究班が設けられ、人への健康影響の観点から検討が進められた。同様に、通商産業省は主として産業活動の観点から、また、環境庁は主として環境保全の観点から、それぞれ本問題に関する検討を開始している。平成9年には、厚生省、環境庁、通商産業省、農林水産省及び労働省による連絡会が設置され、本格的な各省庁の連携した検討体制が整備され、現在では、9関係省庁からなる「内分泌攪乱化学物質問題関係省庁課長会議」が設けられている(以下の図参照)。関係省庁間の有機的連携の下で調査研究を進めるとともに、行政的施策に反映させるための積極的な情報交換、各種の取組を推進している。本年5月、環境庁は、同庁としての今後の取組方針等についての報告を取りまとめた。また、本年4月、厚生省はこの問題を総合的に検討するため、「内分泌かく乱化学物質の健康影響に関する検討会」を設置し、国際的な動向を踏まえつつ、人の健康確保を図るための我が国における方針を明らかにすることとした。
(2)世界における最近の主な取組
内分泌かく乱化学物質の問題は世界共通の課題である。国際機関や我が国を含む加盟各国はそれぞれの立場で共同して種々の取組を行っている。1997年に開催された「化学物質の安全性に関する各国政府間フォーラム(IFCS)」では、内分泌かく乱化学物質の潜在的なヒトへの影響や環境に対する影響の可能性が指摘され、引き続く、第50回世界保健機関総会(1997年)においては、内分泌かく乱化学物質問題に対するリスクアセスメントと、それらの化学物質への暴露によって生じ得る健康影響の研究に対して、WHOのリーダーシップを補強するために必要な限りの手段をとることを決議している(WHA 50.13 1997)。国際化学物質安全性計画(IPCS)と経済協力開発機構(OECD)は、その中心的な役割を果たしている国際機関である。前者は本問題についての知見を国際的に収集し、2000年を目途に本問題についてのヒトへの潜在的な健康影響等について認識を取りまとめるとともに、進行中の研究情報を整理し、データベースの策定等を行うこととしている。また、後者は国際社会が共同で本問題について取り組むための基本戦略を検討するとともに、標準とすべき試験方法の開発等を進めつつある。
1)米国
1991年6月、ウィスコンシン州ウィングスプレッドに集まった環境医学生物学領域の専門家会合は、内分泌かく乱化学物質の野生生物並びにヒトへの影響についての詳細な調査研究の必要性について声明を出した。1996年3月にはこうした背景をまとめた著作がコルボーンらによって“Our Stolen Future”(邦題「奪われし未来」)と題して出版され、この問題が大きく取り上げられる契機となった。
2)欧州各国と経済協力開発機構(OECD)
イ)1996年12月に英国のウェイブリッジで欧州委員会が日本の出席者も招いて開催した「人の健康と野生生物に対する内分泌かく乱化学物質の影響についてのヨーロッパ・ワークショップ」は、同物質の定義を提案し、その後の取組を決める初めての世界会議となり、これを受けてOECDは1997年4月、そうした物質を検出する試験法を選択するための“試験法一覧”「内分泌かく乱化学物質のスクリーニングと試験法」を作成して専門家のピア・レヴューにかけた。
ウ)内分泌かく乱化学物質問題に関するOECDの方針は、加盟国に情報を提供し、その活動を調整すること、内分泌かく乱化学物質を検出するための新しい試験法の開発、もしくは既存の試験法ガイドラインの改定、加盟国間での内分泌かく乱化学物質に対するリスクアセスメント等の手法の統一などである。この方針に従って、1998年3月、試験法とアセスメントのための専門家会議(EDTA)を設置し、さしあたり次の各項の作業にあたっている。
1. EDTAの発足に先立って各国より求めていた「内分泌かく乱化学物質のスクリーニングと試験法」に対するコメントを整理する。
2. 試験法の開発もしくは改良については、(A)28日間反復投与毒性試験(TG407)の改良、(B)子宮肥大反応試験 (utero-trophic assay )、(C)去勢雄ラット反応試験(Hershberger assay )の標準化を、1998年11月を目途にまとめ、共同試験に移る。
3. 魚類など野生生物を念頭に置いた試験についても、準備を整える。
科学的な立場から化学物質の評価を実施しているIPCSは、運営委員会を設置し、下記のような方策を決定している。
内分泌かく乱化学物質に関するこれまでの様々な提案、具体的には、男性生殖機能とエストロゲン様作用物質に関するデンマーク環境・エネルギー省の1995年以降に発行された主要資料を検討することによって、内分泌かく乱化学物質の概念を設定する。
イ)グローバルな研究データベースの策定
内分泌かく乱化学物質による潜在的なヒトや生態系への影響に係る現在進行中の研究活動をグローバルにデータベース化することについての合意。そうした相互に情報交換可能な体制を整備することによって、研究の弱い領域、強化すべき課題を明らかにする。
ウ)内分泌かく乱化学物質のサイエンスアセスメント(science assessment)
内分泌かく乱化学物質問題ですでに人類が知っていることと、まだ未知のことを整理してまとめ、それらを通じて、将来の強化されるべき研究方向を明らかにする。このために、内分泌かく乱化学物質のヒトや生態系への影響に関する広範な研究を通覧・要約し、報告書として2000年を目途に出版することとし、その体制を早急に整備する。
内分泌かく乱化学物質問題は、人の健康影響、特に世代を超えた影響が指摘されている問題であり、早急にその調査研究を推進するとともに、必要に応じ対策を講じる必要がある。しかしながら、この問題は、科学的には従来の学際を超えた複雑な問題であり、また、化学物質が多種多様に及ぶため、関係者が今までの化学物質問題に例を見ないほど多岐にわたる。特に国民の一般生活にも多様な影響を与える可能性がある。このような状況を踏まえ、また、前章までの記載を踏まえ、この問題を円滑に解決するためには、総合的な内分泌かく乱化学物質問題の解決のための基本方針を早期に設定する必要がある。ここでは人の健康確保のための内分泌かく乱化学物質対策の基本方針を示す。
(1)化学物質の安全性についての考え方
化学物質の安全性については、古くは農薬の誤飲などによる急性毒性を防ぐことが重要な課題であって、動物実験などからの半数致死量が毒性の指標となっていた。しかし、危険性の高い化学物質が特定されるにつれ、毒物や劇物の表示を明確にすることにより、このような偶発的な事故は減少した。その後、腫瘍性疾患が人の死亡原因の上位を占めるようになり、毒性学や病理学などにおいて発がんと化学物質の因果関係の解明に努力が注がれてきた。現在も化学物質の安全性を語る上で、発がん性は重要な指標となっているが、医薬品サリドマイドなどによる催奇形性の発生などを踏まえて、催奇形性や繁殖試験も重要な指標となってきている。例えば、食品添加物の安全性評価に関する指針では、新たな食品添加物を指定する際には、1年間反復投与毒性試験、繁殖試験、催奇形性試験、発がん性試験、抗原性試験、変異原性試験などが必要なデータとされている。疫学調査については、食中毒のような急性的な中毒の場合、その原因究明に非常に有効な手段となり得るが、慢性的な毒性影響を評価する場合は、多種多様な要素が複雑に絡み合って原因となってくるため、疫学調査から化学物質の影響を直接評価することは非常に困難である。
(2)データベースを核とした情報管理、情報提供システムの整備
今後、本問題については国際的に科学的研究が推進されることが予想される。この問題を効率よく解決するためには、これらの調査研究を総合的に管理し、複数国で同様の調査研究を実施することを避けること等により、限られた時間や費用をできるだけ節約する管理システムを構築する必要がある。また、調査対象とする物質が極めて多種多様であるため、これらの物質に関連する情報を一元化し、それに基づいて、リスクアセスメントやリスクマネジメントを講じる必要がある。現在、国際的にはWHOを中心に情報管理のためのデータベースの整備が進められているところであり、我が国においても、これらの国際機関や諸外国と協調しつつ、データベースを核とした情報管理システムの整備を図っていく必要がある。また、このように整備された情報は、関係行政機関や国際社会だけでなく、行政機関−学術研究機関−民間団体間の情報交換を推進させるとともに、広く国民に提供することが肝要である。
(3)国際協力の推進
先に述べたように国際社会は、この問題を世界共通の課題として、WHO、OECDを中心とした国際的な枠組みの構築を進めている。また、アメリカ、ヨーロッパ諸国においては、それぞれの国において調査研究の推進や規制の在り方についての検討がなされている。日本も国際的な枠組みに積極的に参加し、二国間及び多国間における内分泌かく乱化学物質対策に係る協力の推進を図る必要がある。
(4)統合的な調査研究の推進
内分泌かく乱作用があることが既に指摘されており、国民が強い関心を示している化学物質については、有害性を詳細に調査研究する必要がある。この調査研究をもとに、現在、指摘されている健康影響について、その有無、種類、程度を明らかにし、未解明の状況から生じてくる国民の不安を払拭する必要がある。さらに必要に応じ、適切な対策を早急に講じていく必要がある。
3.人の健康を確保するための具体的な対応方針
日本で使用されている化学物質は、数万種類もあると言われており、多数の化学物質について、限られた時間、予算、労働力のなかで迅速に人の健康の確保を図っていくためには、具体的な対応方針を定め、これに従って効率的に調査研究及び評価を実施していく必要がある。
(1)内分泌かく乱作用が指摘されている化学物質の調査
化学物質による人への健康影響は、個々の化学物質がどの程度毒性を有しているか、また、どの程度暴露しているかによって決定される。このため、内分泌かく乱作用が指摘されている個々の化学物質について以下の調査を実施し、その危険性の評価(リスクアセスメント)を行う。
1)既存情報の収集
内分泌かく乱作用が指摘されるに至った背景となる既存情報の入手を行うとともに、以下の調査研究を行う上で必要とされる物理化学的性状等の情報をできるだけ収集する。
2)暴露経路調査の実施
個々の化学物質ごとに食品、食品器具容器包装、玩具、家庭用品、水、大気等からの暴露経路、暴露量を求める。また、環境中における化学物質の動態についても留意する。
3)代謝試験
化学物質は、生体内で代謝され、様々な代謝物となる可能性がある。本来の化学物質のみならず、代謝物の毒性にも留意する。また、生体内におけるこれらの化学物質の分布を把握し、内分泌かく乱作用発現の機序解明に努める。
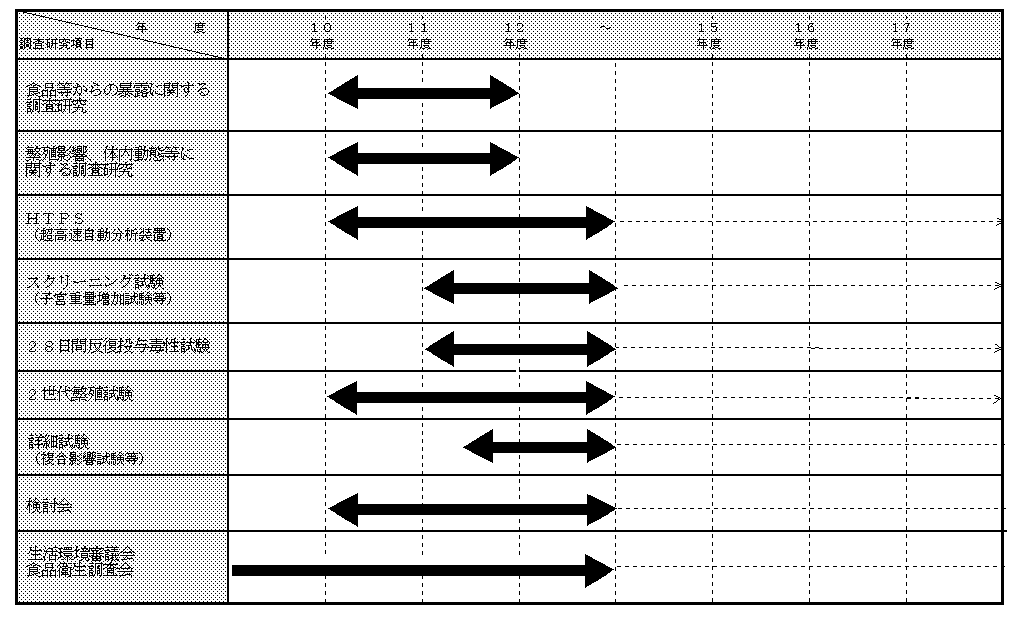
4)多世代繁殖試験
内分泌かく乱化学物質による胎児を含む健康への影響を調査するに当たっては、化学物質を投与しつつ、妊娠させ、子供及び孫までの影響を観察する2世代繁殖試験が、現在国際的に最も適当であると考えられている。1)から3)の結果を踏まえ、本試験を実施し、危険性の評価に資する。また、必要に応じ本試験の前に28日間反復投与毒性試験、子宮肥大反応試験 (utero-trophic assay )、去勢ラット反応試験 (Hershberger assay)等を実施する。
5)危険性の評価(リスクアセスメント)
1)〜4)を踏まえ、危険性の評価を実施する。
(2)その他化学物質の点検手順
日本で使用されている化学物質は、数万種類とも言われており、これらの物質が現在あるいは将来において内分泌かく乱作用を有し、人や野生動物に影響を与える可能性を否定することはできない。このため、知見が得られていない化学物質についてもその可能性の有無について早急に調査研究を推進する必要がある。その目的のために考案された試験系(現在、動物を用いた複数の系が必要と考えられている)によって検討することが考えられている。しかし、それらの試験は時間と費用がかかるものであり、すべての対象物質について同時に試験を行うことは少なくとも時間的に到底不可能である。そこで、何らかの指標を用いてこの試験系に供する優先順位を設定することが、効率的で経済的な検討を行うために必要である。このような手順の枠組みについては、多くの化学物質が世界的に流通していることに鑑み、国際的な整合性を踏まえて構築する必要があるというのが先進各国の考えであり、WHO、OECD等の機関を通じて、日・米・欧が主体となって協調して検討を進めている。
1)ハイスループット事前スクリーニング(High throughput pre-screening, HTPS)
ロボット技術を用いて、短期間に多くの化学物質について比較的簡単な測定を行うことにより生物活性情報を得るシステムであり、ここで得られた情報は、主に次の段階の試験系の対象品目とする化学物質の優先順位付けのために用いられる。具体的には、ホルモン受容体とその応答遺伝子を組み込んだ培養細胞株を用いた反応系を機械に操作させ、エストロゲン、アンドロゲン及び甲状腺ホルモンの各受容体に対する作用の有無を遺伝子転写活性として検出する系を用いる。
2)優先順位の設定
従来の疫学的及び実験的研究から、明らかにあるいはほぼ明らかに人の健康に対してリスクの大きな物質を優先的に次の段階の試験系に供するものであるが、そのような物質は非常に少ない。多数の化学物質のほとんどについては有用な生物影響データが入手できないため、1)のHTPSの結果を待って優先順位付けを行うこととなる。
3)試験の実施
内分泌かく乱作用を有する可能性のある物質であるか否かを分類するために必要なデータを得るための試験であり、HTPSの結果に応じて、28日間反復投与毒性試験、子宮肥大反応試験 (utero-trophic assay )、去勢雄ラット反応試験 (Hershberger assay)等を実施する。
(B)詳細試験
人における内分泌かく乱の性質、可能性、用量−反応関係を性格付けるための試験。化学物質が内分泌かく乱化学物質であるかどうかを決定するとともに、その作用が直接か間接かを検討する。また、人に対する危険性の評価を行う上で有用な情報を得る。また、最終的な評価のため、必要に応じ、追加的な試験が求められる。
4)危険性の評価(リスクアセスメント)
1)〜3)をもとに、最終的に危険性の評価を行う。
5)留意事項
これらの試験は、この問題が新しいものであることから、スクリーニングや多世代繁殖試験等の詳細試験の個々の段階における試験方法の評価等を十分に実施していく必要がある。また、効率的に正確な試験を実施するため、国際的な整合性を図りつつ進めていくべきである。
(3)その他の調査研究
(1)、(2)を実施する上で以下の関連する主な調査研究等を推進する必要がある。
1)暴露に関する調査研究
内分泌かく乱化学物質と指摘されている一部の化学物質については、食品や食品容器包装、玩具等からの溶出、材質試験方法を新たに開発する必要がある。溶出量は、溶媒、温度、時間などにより異なってくるため、実際の人の摂取量を反映した溶出量の評価手法が必要であり、簡便で国際的にも統一された方法が望ましい。また、人の血液や腹腔内貯留液等に含まれるこれらの化学物質の標準分析法についても開発していく必要がある。
(B)食品や食品容器包装、玩具等からの暴露に係る実態調査等
食品や食品容器包装、玩具等は、多種多様であり、これらを経由した化学物質の暴露を広範に調査する必要がある。水、大気等他からの暴露も併せて総合的な実態調査を行い、その結果と毒性試験の結果を比較評価し、必要があれば個々の化学物質の暴露の低減などの対策を講じる。また、内分泌かく乱化学物質の蓄積により健康への影響を指摘する報告もあることから、生体試料(血液、腹腔内貯留液、母乳等)を分析し、現に人が取り込んでいる化学物質の量を把握することもリスクアセスメントを行う上で重要な知見となる。特に、臍帯血の分析結果は胎児への暴露、母乳の分析結果は乳児への暴露を把握する上で貴重な情報である。
2)毒性に関する調査研究
毒性に関する試験法並びにその解釈について解決すべき問題点が指摘されている。特に次に挙げる3つの問題を始め、ここの試験法についてもそれらの評価項目が総合的見地から定められる必要がある。そのための調査研究を総合的に推進する。
・逆U字効果の解明(作用メカニズムの解明)
ある種の化学物質は、一部の実験動物や試験管内の試験において、高用量では正の用量反応性を示すのに加え、低用量では負の用量反応性を示す(この場合高用量での反応と低用量での反応が必ずしも同質のものではない)といういわゆる逆U字効果が認められるという報告(*文献番号87)がなされている。このような報告は生体内での成績についてはまだわずかにすぎず、再現性も必ずしも確認されているわけではないことから、信頼性については疑問の残るところである。しかし、従来の毒性実験及び評価が用量反応に基づき、閾値があることを前提に実施されており、このような逆U字効果についてはいわば盲点として検討されないままになっている。したがって、逆U字効果の存否の確認とともに、仮にその効果が存在する場合はそれに関わる作用メカニズムの解明を急ぐ必要がある。
・胎児期及び新生児期の暴露による影響発現の解明
ある種の化学物質を妊娠中の実験動物に投与した場合、その動物から生まれた子に奇形などのほか、その子が成長したのちに学習障害、発がん、免疫低下、生殖障害などの影響が発現する場合があると報告されている(*文献番号88)。発生のメカニズムが不明確であること、影響が発現するまでに長期間を要することなどから、多面的かつ総合的な観点でその機構解明に努める必要がある。
・定量的構造活性相関研究
構造活性相関研究は、化学物質の構造から数学的な解析を行うことによりコンピューター上でその化学物質の性質を把握しようと試みるものであり、化学物質のリスク評価を行う場合、コストの削減、時間の短縮、実験動物の節約等様々な利点があり、新医薬品の開発のための化学物質の選定などに多用されている手法である。他方、ステロイドホルモンのようにその側鎖の一部がわずかに変化することにより生物活性にその劇的な変化を及ぼす物質についてはこの手法の適用が難しいこと、人への直接的な健康影響についての情報が少ないことなどから、その信頼性、有用性は一部の化学物質に限られている。しかし、(1)の調査の結果、多数のスクリーニング試験結果が期待でき、既存の各化学物質についての物理化学的な性状に加え、その後、慢性毒性試験等詳細な試験結果が行われることとなることから、これらを統合して定量的構造活性相関研究を行えば、人への簡易な毒性影響の判断を行う有力な手法となる可能性がある。
(B)複数の内分泌かく乱化学物質による複合影響
一部の動物実験で、個々の化学物質単独では影響を与えないが、複数の化学物質を混合すると影響を与えることが報告されている。個々の化学物質の評価に加え、人への暴露量の多い物質あるいはその可能性が高い物質については、複合による影響への心配が生じる。この議論で重要な役割を果たしてきたJohn McLachlanらのグループによる複数の化学物質を混合すると約1,000倍の相乗性が認められたとの報告は、再現性が認められず、報告者自身により撤回されている(*文献番号89)。現在のところ、内分泌かく乱化学物質については、相加的な影響の可能性については指摘されているものの、相乗的な影響については確認されていない状況である。しかし、複数の化合物による相乗効果の可能性に関する指摘が完全に払拭されたわけではなく、引き続きこの可能性についても研究を継続していく必要がある。
(C)植物エストロゲン
先に述べたように植物エストロゲンは、合成の化学物質と比較して食事を経由してより多量に摂取される。これらの植物エストロゲンは、試験管内では一部の合成化学物質と比較して高いエストロゲン活性を有することも報告(*文献番号90)されており、植物エストロゲンが人の健康に影響を与えている可能性がある。しかし、私たち日本人が毎日のように食している大豆にも、ゲニスタインなどの植物エストロゲンが含まれているにもかかわらず、日本人の乳がん発生率は欧米人に比較して高くないことは興味深いことである。人類は長い歴史の中で植物エストロゲンを摂取してきており、ある種のエストロゲン様物質に対しては、体内のフィードバック作用や代謝排泄の作用により抵抗性をもつようになってきたとの説もある。種差の問題も含め、植物エストロゲンの生体内作用について明らかにしていくことが望ましい。
3)疫学調査
内分泌かく乱化学物質が環境中に存在し、一般的な生活をしている人でも何らかの暴露を受けていることは事実である。また、職業的に、より高用量の暴露を受けている集団が存在することも予想される。したがって、そのような暴露を受けている人が、暴露レベルに応じて、いかなる健康影響を受けているかを、日本人を対象として明らかにして行く必要がある。そのためには、綿密な疫学研究のデザインに基づいた人の健康影響に関する適切な調査研究を行う必要がある。
(4)調査研究体制の整備
この問題の解決のために必要な調査研究は、先述したように多岐にわたる。これらの調査研究を円滑に実施するためには調査研究基盤の整備が必要である。
1)新たな枠組みの構築
国内における人の健康被害防止の観点からの内分泌かく乱化学物質問題に関する研究は、平成8年度から厚生科学研究の枠組みを中心に産官学が協力して推進しているところである。さらに、調査研究を推進するためには、研究の企画・評価のための組織を拡充するとともに、この枠組みに、産業界の自主的な調査研究への協力、諸外国や関係各省の調査研究結果の提供等を加え、統合的な研究を推進していく必要がある。
2)人材の育成、確保
我が国においては、化学物質の安全性について評価を行うことのできる研究者は、諸外国と比較して少ない。また、この問題を総合的に取り組むには、従来の学際を超えた知識が必要とされる。化学物質の安全性問題に取り組むことのできる人材の育成システムの構築が必要である。
3)研究機器等の整備
我が国においては、人材育成が遅れていることと同様、研究機器の設備導入が遅れている。内分泌かく乱化学物質は、微量で人への健康影響が指摘されているため高感度の分析機器が必要とされており、新たに関係研究機関に機器の整備を図る必要がある。
4)効率的な調査研究
化学物質の数は数万種にのぼり、安全性を明らかにするための試験には多額の費用が必要である。最も取組が進んでいると言われている米国においても、今後、段階的に計画を立て対策を講じることとしている。我が国においても、人の健康を確保するため、長期的な視点に立って計画を立て、民学産官が緊密な連携を取りつつ効率的に調査研究を進めていく必要がある。
(5)データベースを核とした情報管理、情報提供システムの整備
厚生省では、内分泌かく乱化学物質の作用の有無を確認するため、各種の調査研究を実施する。関係省庁においても、環境モニタリング等調査研究を推進することとしている。産業界においては、自らの製品の安全性等の確認を行うための調査研究を開始している。研究者やNGOにおいても積極的に調査研究が進められることとなろう。国際機関、先進諸外国でも我が国と同様研究が加速的に推進されている。これらの調査研究の成果やそれに関連する情報は莫大なものになると予想される。これらの情報を整理、体系的かつ一元的に管理して、種々の行政目的、調査研究、情報公開等に役立てていく必要がある。このため、人の健康に係る事項については、既存の化学物質データベースを有していること等から厚生省において内分泌かく乱化学物質に係るデータベースの構築を図る。
(6)国際協力の推進
現在、本問題に取り組んでいる主な国際機関、諸外国と以下の点を中心に協力を図るとともに、国際的なリーダーシップをとっていく必要がある。
1)世界保健機関/国際化学物質安全性計画(WHO/IPCS)
本機関が中心となって2年後を目途に取りまとめを目指している内分泌かく乱化学物質に関する国際的なリスク評価に参加する。我が国で実施されている各種の調査研究の成果を適宜取りまとめ、評価を行った上で国際的なリスク評価に貢献する。また、本機関が中心となって作成を予定している国際的データベースと国内で作成するデータベースとの整合性を図り、相互のデータ交換等を円滑に行うことができるよう留意する。また、国内データベースの策定に当たってのノウハウを適宜提供することとする。
2)経済協力開発機構(OECD)
我が国の調査研究の成果等を基に本機関が進めている内分泌かく乱化学物質の評価システムの整備に積極的に貢献する。
3)米国
米国においては、日本と同様、内分泌かく乱化学物質の評価システムを検討し、取りまとめているところである。その評価システムの概要は、簡易スクリーニング(HTPS)−スクリーニング−詳細試験であり、日本とほぼ同じである。二国間において、評価システムの評価や試験結果の交換を推進するととともに、互いに調査対象項目を調整すること等により、試験の精度や効率の向上、経費の低減等を図って行くこととする。
"An endocrine disruptor is an exogenous substance or mixture that alters function(s) of the endocrine system and causes adverse health effects in an intact organism, or its progeny, or (sub)populations."
このように生体内の内分泌機能とその作用機構の様々な過程に影響を及ぼす可能性が想定され、また、そうした現象が指摘されている。生体内に存在するホルモンの種々の生体内作用は多岐にわたっているため、内分泌かく乱化学物質が同様に生体内に多岐な障害を惹起する可能性をもつこととなり、先に述べたスミソニアン・ワークショップでの定義を考慮に入れておく必要がある。さらに、化学物質が内分泌系のみならず、神経系、免疫系などの高次系にも影響を及ぼす可能性が指摘されている背景も、以上のような考え方を基礎としている。
以下に、平成8年度の厚生科学研究「化学物質のクライシスマネジメントに関する研究」で取り上げられたエストロゲン様化学物質の中から、主なものを列挙し、その性質の概略を述べる。
幅広い用途で使用される化学物質は、複数の暴露経路を有することが一般的である。例えば、プラスチックの可塑剤であるフタル酸エステル類の暴露経路は、空気(上記(A))、水((B))、食品((B))、接触((C))など幅広い。また、ダイオキシン類については、空気((A))、食品((B))、土壌((C))が主な暴露経路であることが報告されている。内分泌かく乱化学物質として指摘されている化学物質の健康影響への評価に資するため、化学物質に応じた暴露経路の推定、各暴露経路からの暴露量、総合的な暴露量の調査を進めていく必要がある。
室内空気、家庭用品、一般大気
食品(肉、牛乳、野菜、水等)、おもちゃ等(乳幼児の場合)
おもちゃ、家庭用品、土壌
(2)男性生殖器系への影響
子宮体がんのリスク要因は乳がんのそれと共通し、月経期間、出産、肥満など内因性ホルモンレベルに影響を与える要因が挙げられるほか、閉経後のエストロゲンの補充療法やエストロゲン−プロゲストーゲン周期的使用(sequential)の女性ホルモン配合剤がリスクを上昇させることが知られている(*文献番号18)。米国においては、1960年代後半より閉経後女性の子宮体がん罹患率が上昇し、1970年代半ばより減少に転じているが、エストロゲンのみを用いたホルモン補充療法の普及とプロゲストーゲンとの併用療法への転換と連動しているとの指摘がある。また、エストロゲンとプロゲストーゲンを同時併用(combinational)した女性ホルモン配合剤を使用した人では使用しなかった人と比較して、リスクが50%程度低下することが報告されている(*文献番号18)。即ち、プロゲストーゲンが同時に投与された場合は、その子宮腺細胞の増殖を抑制する作用により子宮体がんのリスクが下がる。内分泌かく乱作用が疑われている化学物質との関連についての文献は少ないが、そのほとんどは子宮体がんのリスクを下げており、ダイオキシンについては、その抗エストロゲン作用によるとの推察もある(*文献番号19)。
なお、乳がんのリスクを下げることが知られているタモキシフェンの投与は、子宮体がんに対してはリスクを上げることが無作為比較試験で示されている(*文献番号20)。
少数例の赤毛ザルを用いた研究では、ダイオキシン暴露と子宮内膜症との関連が示唆されている(*文献番号21)。しかしながら、同じ赤毛ザルを用いた最近の研究では、先の報告の10倍の濃度(テトラクロロジベンゾパラジオキシン(TCDD)換算)において、ポリ塩化ビフェニル(PCB)と子宮内膜症の関連がないことが示されている(*文献番号22)。
また、人においては、不妊女性のうち子宮内膜症を有する44例中8例で血液中にダイオキシンが検出されたが、子宮内膜症を伴わないと35例中1例のみでダイオキシンが検出されており、子宮内膜症患者の方がダイオキシン検出率が高いとの報告がある(*文献番号23)。一方、カナダの研究では、子宮内膜症例86名と非内膜症例70名とでダイオキシンを含む総有機塩素系化合物の血漿中濃度には差がないということが、最近報告されている(*文献番号24)。現時点では、子宮内膜症と内分泌かく乱化学物質を関連付けるのに、十分な知見が集積されていない。
現在、イタリアのセベソでTCDDに暴露された女性を対象に継続的な研究がなされている。内分泌かく乱化学物質と子宮内膜症の関連を解明するためには、今後、さらに研究を推進する必要がある。
乳がんのリスク要因として、早期の初潮、閉経の遅延、高齢での初産、未経産、肥満、食事(カロリーの過剰摂取や野菜の低摂取)など内因性ホルモンレベルに影響を与える要因が挙げられているが、日本における乳がん増加傾向や国際的に認められる地域較差の多くの部分もこれら要因の多少により説明し得るものと考えられている。閉経後のホルモン剤の補充療法についても、エストロゲン剤使用期間分の閉経年齢の遅延に相当するリスクの上昇をもたらすとの見解もあり、生体内における高濃度のエストロゲン環境は、乳腺細胞の増殖を促進することにより、乳がんの発生に密接に関与している。
また、一般的な女性ホルモン配合剤は、プロゲストーゲンとエストロゲンより成るが、乳がんのリスクを上昇させるという一致した見解はない。ホルモン量、使用するホルモン剤、使用期間、使用時期(閉経前後での使用)、使用者の特性(乳がん家族例保有者や未経産婦)により、異なる影響をもたらすようである。流産予防の目的で1940年代に使用されたDESについては、使用した母親から生まれた女児の思春期や性成熟期における膣の明細胞がんとの因果関係が確立しているが、母親自身についても、無作為比較試験参加者や使用者の追跡調査により、約30%の乳がんリスクの上昇をもたらすことが報告されている(*文献番号25)。一方、エストロゲン受容体に対してエストロゲンと競合的に結合する作用をもつ乳がん治療薬タモキシフェンの乳がん未発症者への数年間の継続投与は、乳がんのリスクを下げることが、近年の無作為比較試験で確認されている(*文献番号20)。また、大豆などに含まれる植物性エストロゲンは、血清中のエストロゲン濃度を低下させ、乳がんのリスクを下げる可能性が示唆されており、日本人の乳がんの少なさとも関連するとの指摘もある(*文献番号26)。
内分泌かく乱化学物質についても、現在指摘されている主な作用がエストロゲン様作用や抗エストロゲン作用であることから、乳がんの発生に何らかの影響を与える可能性が指摘されている。内分泌かく乱作用をもつ化学物質として疑われている塩素系農薬(DDTとその代謝物DDE)、燃焼副産物であるダイオキシン類(特にTCDD)、産業生産物であるポリ塩化ビフェニール(PCBs)の暴露と乳がんとの関連についても、いくつかの疫学研究で検討されている。TCDDやPCBsに職業的に高暴露を受けた女性の追跡調査や、症例対照間の脂肪組織や血清中のDDEやPCBを比較した調査などが報告されているが、現状では関連を積極的に支持する知見は得られていない(*文献番号19)。
以上のように、それ自体がエストロゲン作用を有するように合成された医薬品については、その用量や使用時期などによって乳がんのリスクを上昇させる可能性はあるが、環境を経由したエストロゲン様作用をもつ内分泌かく乱化学物質の低用量暴露が、日本人の乳がん発症のリスク要因になっているという証拠はほとんどなく、現状では可能性は低いものと考えられる。
DESに関しては広義には、内分泌かく乱化学物質と言えるが、他の物質の多くは間接的にホルモン作用に影響を与えるのに対し、これはむしろ最も強力なエストロゲン製剤であり、本剤による上述の異常は胎児期に不適当なエストロゲン作用を受けたことに起因すると考えられる。これは、いわば胎児に対するエストロゲンの薬理作用と言え、DESに特異的な作用ではない。なお、環境中の化学物質にはDESのような強力な作用を持つものは存在せず、DESの使用が制限されてからは、DESと関連していると考えられるような異常が少なくとも現在増加しているという事実は報告されていない。
人においては、(A)DESに胎児期に子宮内暴露した男性の観察から、発生期における外因性エストロゲンの生殖器系かく乱作用は、げっ歯類と比較して弱いことが知られている、(B)DES暴露集団における男性生殖器系がんの発生率の増加は見られていないなどのいくつかの調査研究がなされている。
具体的に指摘されている主な人への健康影響は以下のとおり。
ヒト精子に関する問題は、方法論的にも、基礎的な知見の蓄積においても、とにかく情報が不足しているというのが現状である。年齢や時系列による比較、地域差等を検討する必要が生じているにもかかわらず、健康な日本人男性の精液所見がどのような標準値を示すのか正確には把握できていない。
こうした状況の中で、1997年、Skakkebaekらを中心とする正常男性の生殖機能に関する国際共同研究が発足した。現在、デンマーク、フィンランド、スコットランド、フランス、日本などで調査が行われており、今秋より米国も開始する予定である。日本では岩本が中心となって1997年11月より、川崎・横浜地域での調査を進めている。今年度末から全国数ヶ所に拠点を置いた地域による差も検討される。生殖機能は、ヒトに限らず全ての生物にとって、種存続の鍵となるメカニズムである。生殖機能への影響の可能性は、それが想定される以上、証拠があっても無くても、また原因が何であれ、最優先課題の一つとして扱われるべき問題である。
一方、精巣がんの研究を続けていたコペンハーゲン大学のSkakkebaekはこの数十年にデンマークでは精巣がんが3〜4倍に急増し、英国、北欧、オセアニア、米国等でも同様の傾向が見られることを統計調査から知り、停留精巣、尿道下裂などの男性生殖器の異常が増加していることを示す報告との関連を重要視して、チームを組んでこの問題に本格的に取り組み始めた。ヒト精子の問題も男性不妊との関連から課題の一つと考え、過去の世界中の科学文献を調査し、健康男子の精子数のデータを洗い出すことを試みた。その結果は1992年にCarlsenら(*文献番号33)の論文としてBritish Medical Journalに掲載されたが、その内容は最近50年間でヒトの精子数が半減しているという衝撃的なものだった。直後より、各国から精子数の減少や精液の質低下を示す報告が相次いだこともあって、この報告は専門雑誌ばかりでなく、一般マスメディアも競って取り上げる話題の一つとなった。しかしCarlsenらの論文は、大きな反響とともに厳しい批判にもさらされた。引用文献の選択基準や統計法などの欠点が指摘され、実際の調査でも精液の質低下を否定する内容の報告が続いた。最近では、否定的な論文とともにヒト精液の質低下はやはり起こっているとする論文も出始め、論争は依然として続いているが、同時に、問題を整理して再び検証に努めようとする動きも出始めている。
Fisch(*文献番号38)は、Carlsenら(*文献番号33)のデータの地域的多様性について再分析し、世界の地域ごとに平均精子濃度はかなり異なること、及び初期に行われた研究の大部分に平均精子濃度の高いニューヨークからのデータが多く含まれていることを指摘し、データの地域的な偏りが早い時期におけるデータの数値を人為的に引き上げている可能性を示唆した。ニューヨークのデータが高い精子濃度を示すことは度々報告されているが、その理由は分かっていない。精子数の変化に関しては地球規模での全般的な減少が起こっているか否かを問題にする前に、特定の地域での変化に注目する必要がある。精液の質の低下はある地域では起こっていて、ある地域では起こっていないことも考えられるからである。地域差の問題は分析の結果を歪める要因として扱われることが多いが、精液の質に地域差が認められることは、それ自体、非常に興味深い現象と言える。地域差の問題は遺伝的要因、環境的要因の両面から検討すべきである。
内分泌かく乱作用が疑われている化学物質との関連については、除草剤散布やコークス炉排気などの職業的に暴露した人の少数の追跡調査において、リスクの上昇が報告されている(*文献番号47)が、乳がんなどに比べて疫学研究が少なく知見に乏しい。
内分泌かく乱作用が疑われている化学物質との関連についての報告は多くはないが、北欧での罹患率の上昇傾向に反して、母乳中のDDE濃度が1970年頃より減少していること、また、北欧4カ国の母乳中のDDE濃度が同レベルであるのに反して、罹患率に4倍の地域較差が存在すること(*文献番号49)などにより、少なくともDDTと精巣がんとの関連は薄いものと考えられている。
その発生原因は、現在のところ不明であるが、初産あるいは高年齢出産のような母親側の因子や胎生中の変異原への暴露などの環境因子と遺伝的要因の相互作用の結果として発生するのではないかと考えられている。臨床的な研究からは患児の中にT代謝物やTレセプターの欠損例も見られている。男性生殖器の発育に影響を及ぼす内分泌因子の異常の結果で尿道下裂が起こるとされている。
尿道下裂の発生動向を調べた報告によれば、ノルウエー(*文献番号50)、スウェーデン(*文献番号51)、デンマーク(*文献番号52)、英国(*文献番号53)、ハンガリー(*文献番号54)において1970年代と比較し80年代では上昇傾向にある。Matlaiら(*文献番号53)の調査によればイングランドとウェールズでの増加、ハンガリー(*文献番号51)では1971年と1983年の比較で12人から24人に増加している。スウェーデンでは1965年と1979年の比較で8人から12人に増加しているものの、その増加は1969年から1973年まででそれ以後は増加しておらず、この間調査方法は変えていないとKallenら(*文献番号55)は報告している。その後International Clearinghouse for Birth Defects Monitoring Systems(*文献番号56)による1993年までの調査ではデンマーク、ノルウェーは増加傾向を示し、一方、英国、スウェーデン、ハンガリーでは増加を示していないとのことである。また、European Registration of Congenital Anomaliesによる1980年から1992年までのヨーロッパ17地域の報告によれば増加傾向を示しているのはStrasbourgとMalta地方で、逆に減少傾向を示しているのがNorthern NetherlandsやGlasgow, Liverpool地方であった。オーストラリア(*文献番号57)では1985年頃より除々に増加傾向を示し、出産1万に対し21.5人で1990年から1992年の統計では地域差を認めるデータである。1997年Paulozziら(*文献番号58)が米国のthe Metropolitan Atlanta Congenital Defects programとthe Birth Defects Monitoring programの極めて綿密に調査されているデータをもとに尿道下裂の動向を分析したところ、1993年の発症率は1968年の約2倍有意に増加していたこと、この間、毎年2.9%の増加率で白人以外の人種では5.7%の増加を見ている。特に尿道が陰嚢あるいは会陰部に開口する高度の尿道下裂が1967年に比較して1990年では2.7倍、1993年では5.5倍増加しているとの報告である。米国内ではWest, Central, North East, South Eastの地域の順で増加率が高かった。
一方、本邦での動向は、日本母性保護産婦人科医会の先天異常モニタリングの集計を見るとやや増加傾向となっているが他の国々と比較すると最近では出産1万人に対し2人から3人弱と発生率は少ない。
1970年代の数論文は避妊薬や妊娠テスト薬あるいは妊娠の継続のために使われたprogestinの胎児への暴露が尿道下裂に導き、発生の上昇傾向と関係していると報告している。Sharpeら(*文献番号27)は過去30〜50年間に男性生殖器官の発育障害が2倍以上増加してその原因に食生活の変化、体脂肪の増加によって内因性のエストロゲンが増加したとの説、酪農製品の摂取量の増加、あるいは環境内のエストロゲン様化学物質等による影響を挙げている。また、Goodmanら(*文献番号59)によれば胎児ラットの実験結果から合成プロゲストーゲンの暴露は尿道下裂を引き起こすことを明らかにしている。
一方では、1995年のRaman-Wilmsら(*文献番号60)による報告ではそのような暴露と外生殖器の奇形との関係を見出していない。
前述の米国からの論文は特に高度の尿道下裂が増加しているとの今までになかった報告であるが、その増加傾向の原因については言及されておらず、危険因子についての研究の重要性を述べているに過ぎない。
以上のように動物実験からは合成progestinの暴露が尿道下裂の発生に関与するデータがあるものの、ヒトにおいて内分泌かく乱化学物質が尿道下裂を引き起こすとの証拠は、現在のところないと思われる。
このような生殖器の分化にはテストステロン(T)や活性型のDHT及びこれらのレセプターそしてアンドロゲン標的細胞内の5α-reductaseが重要な役割を演じているが、これらのどの過程に障害が起きても様々な生殖器奇形が発症する。
前述した尿道下裂とともに停留精巣も比較的多く見られる異常である。停留精巣はその位置によって腹腔内に留まっている高度のものから陰嚢部高位にある軽度のものまで4段階に分類される。尿道下裂が高度になるほど停留精巣の合併も多くなると言われている。その原因については諸説があり、複数の因子が関与していると思われるが、1945年から1971年の間にDESで治療された女性が出産した男児に多くの停留精巣、尿道下裂そして生殖機能の低下をもたらしたと報告されている。動物実験及びヒトへのDESの暴露データによると、高濃度のDES暴露が停留精巣をはじめとする雄性生殖器官への障害を引き起こすが、低用量の場合の影響については明らかにされていない。また、母体内のエストロゲン濃度と停留精巣の出現頻度との関連が指摘されている。これらの事実と過去40〜50年間の生殖器官の発育異常の増加減少がよく似ていることから、この異常は胎児の発育期間中でのエストロゲン暴露に原因があるとSharpeら(*文献番号27)は考えている。
出生時の停留精巣の羅患率に影響する胎児期における要因は、出生時の体重、妊娠期間、胎児の数など数多く知られている。また、停留精巣の出現は季節による変動や人種での差異があることが報告されている(停留精巣の発現頻度は黒人が白人より明らかに低く、精巣腫瘍の発現率も同じ傾向にある)(*文献番号62)。
停留精巣の発現動向を見ると、英国オックスフォードで生まれた男児7,500人の調査では、停留精巣の頻度を1950年代半ばと1980年代で比較すると、出生時では4.0%から5.4%へ、3ヶ月齢では0.96%から1.86%へとそれぞれ増加を示したと報告している(*文献番号63)(*文献番号64)。一方、ニューヨークのマウントサイナイ病院で生まれた6,935人の男児での最近の研究によると、停留精巣羅患率は出生時で3.7%、3ヶ月齢では1.0%に減少した。この百分率は数十年前と変わらなかったので停留精巣の増加についての証拠はないと結論している(*文献番号65)。それは、診断の基準や患者の確認法などに統一性がないことからくる人為的な理由による見かけ上の増加あるいは地域による差も考えられる。
本邦における停留精巣の増加の有無は診断上の問題もあり疫学的な調査が行われにくく明らかに増加しているとのデータは出ていない。
陰茎サイズの減少等他の外生殖器の異常についても前述したように生殖器系の発生過程のどの段階でもアンドロゲン作用を障害する因子が加わった時には起こり得るもののそれぞれが単独で発生してくることは少なく、内分泌かく乱化学物質との関係は不明である。
免疫系に対する影響は、特にTCDDやPCB暴露において示唆されている。この影響を媒介する受容体の一つにはアリール炭化水素(Ah)受容体が想定されている。
学習障害・精神障害に関する危惧は特にPCB暴露に関連して問題とされているが、統一した研究結果が得られていない状況にある。
このように野生生物への影響に関する報告が認められるが、人への影響を評価するに当たっては、動物種間の内分泌かく乱化学物質への感受性の違い等を十分に考慮に入れて、調査研究を進めていく必要がある。
したがって、内分泌かく乱化学物質の人への影響についても、(A)それらの多くは受容体に対する結合親和性が低いこと、(B)環境中の濃度も一般的には低いレベルのものが多いこと等により、一方では直ちに有害反応を引き起こす可能性を疑問視する声がある。実際に、反応性が極度に強く、しかも直接生体内に多量に投与がなされたDESのような事例を除けば、個々の物質の正確なリスク評価や暴露評価がなされれば、日常的な暴露レベルに対してはさしあたり必要な対応を取り得るものと考えられる。ただし、その対応に当たっては、(A)胎生期などを含め生体に、ホルモン制御のかく乱を生じやすい状態がないこと、(B)複数の化学物質による予想外の相乗効果がないこと、(C)低用量での反応性に用量相関性が導き出せないような未知の反応形態がないことなどを前提条件として考慮に入れなければならない。
内分泌かく乱化学物質の人への健康影響を示唆する実験動物での試験結果も報告されている。したがって、人への健康影響については、それが異常に過大ではないまでも、ある程度の健康影響を与えている可能性を念頭に置いて、慎重な調査研究と評価が進められる必要がある。特に胎児への影響については、成人と異なった不可逆性反応なども考慮され、総合的に調査する必要がある。
なお、現在のところ、内分泌かく乱化学物質の暴露と因果関係が指摘されている疾患群のうち、子宮内膜症、乳がん、男性生殖器の発育異常などについて、有意な因果関係を示す知見はない。
III.内分泌かく乱化学物質問題を解決するために
1.問題解決のための取組の現状
産業界においても、個々の化学物質や自社の製品の安全性について、情報の収集を始め、独自の溶出試験や毒性試験を行うなどの検討を進めている。消費者団体においては、食品用容器等からの溶出試験や、消費者の認識についての調査を行う等、独自の取組を進めている。
学会関係では、本問題についての新たな認識に立った研究が始まっている。これを契機として学際を超えた民学産官の協力連携による公開シンポジウムが開催されるなど本問題の解決のための努力がなされている。例えば、本年6月に開催された「内分泌攪乱化学物質をめぐる生活と食の安全についての国際シンポジウム」(主催:日本食品化学学会)では、経済協力開発機構(OECD)、世界保健機関(WHO)、米国環境保護庁(EPA)などのこの問題に携わる担当者を迎え、研究者、消費者、生産者、行政担当者のそれぞれの立場から、内外の調査研究や国際協調、行政の対応、消費者の視点と問題意識などについての掘り下げた議論が行われ、内分泌かく乱化学物質に関する現状における問題点の全体像が明らかにされた。
このように我が国おいても本問題に本格的に取り組むべき体制が整備されつつあるが、今後、これらを基盤として、人への健康影響を未然に防止するための取組を一層強化していく必要がある。
なお、これに並行して、米国では1997年2月に「環境内分泌かく乱作用に関する特別報告」(米国環境保護庁:EPA)(*文献番号85)をまとめ、内分泌かく乱化学物質による影響の評価と分析を行うとともに、本問題についての諮問委員会(EDSTAC)を設置し、この委員会の報告に基づき、さしあたり2003年の第1四半期以降までにわたる総合的な戦略を実行に移している。以下は、それぞれの機関のこれまでの主な動きと、それらが方針としている活動の概要である。
1995年、大統領府は、環境自然資源委員会(CENR)を設置し、内分泌かく乱化学物質に関する総合的な研究推進登録を開始、つづく1997年1月には、大統領府科学技術政策室は環境保護庁(EPA)と共同で、諸外国からの専門家を招きいわゆるスミソニアン・ワークショップを開催、その後の研究開発の方向性を明らかにした。
これに前後して、1996年8月、食品品質保護法(FQPA)及び飲料水安全法(SDWA)などが相次いで改正され、ヒトの健康に影響を与える可能性のある内分泌かく乱化学物質の検出法を1998年8月までに確立し、1999年8月までにはそれらの試験を実施し、2000年8月までに議会に報告することが決まった。
本問題についての諮問委員会、EDSTAC(「内分泌かく乱化学物質のスクリーニングと検査の方法に関する諮問委員会」(Endocrine disruptor screening and testing advisory comittee))は、これを効果的に推進するために1996年5月に設置されたもので、その報告書は、(A)内分泌かく乱化学物質の紹介、(B)その背景、(C)同物質に関する基本的な考え方、(D)試験検討の優先順位付け、(E)スクリーニングと検査に関する推奨すべき実施方法、(F)リスクコミュニケーションに関する問題、(G)これまでの章に示された勧告のまとめ、の7章からなり、今後の米国における本問題に係る基本方針等を示している(*文献番号86)。
3)国際化学物質安全性計画(IPCS)
2.基本方針
内分泌かく乱化学物質の問題については、近年提示された新たな課題であり、内分泌かく乱作用の有無、種類、程度等に未解明な点が多く、その評価手法も確立されていないため、我が国においても国際的にも手探りで調査研究を進めているところである。積極的に進められている調査研究により統一的な評価手法が確立されたときには、これから開発される新しい食品添加物や農薬などの化学物質の安全性評価に採り入れていくことも検討していく必要がある。
また、我が国は食品等の多くを輸入に依存しており、輸出国における化学物質の使用が国民の健康に与える影響は少なくないと考えられる。そのため、先進国における本問題の調査研究の結果を踏まえ、必要に応じて開発途上国へ情報提供に努めるなどの措置を講じる必要がある。これは、開発途上国の人々の健康被害の防止、環境保全の推進を図ることにもなる。
現在、内分泌かく乱作用が疑われている物質は、野生生物における影響や試験管内で細胞に生じた影響について、その原因を調査した結果、浮かび上がってきたものである。日本で使用されている化学物質は、数万種類ともいわれており、これらの物質が現在あるいは将来において内分泌かく乱作用を示し、人や野生動物に影響する可能性を否定することはできないことから、これらの影響を早急に把握し、未然防止につなげることが重要である。したがって、現在、内分泌かく乱作用に関する知見が得られていない化学物質についても統合的にその可能性の有無について調査・研究を推進する必要がある。
また、複数の化学物質の複合影響や低用量での反応性については、現在のところ、結論を出し得るだけのデータに乏しく、その評価手法について検討するとともに国際的な枠組みの中で多くの試験を積み重ねていくことが必要である。
人の健康被害防止の観点からの内分泌かく乱化学物質問題に関する日本国内における研究は、平成8年度から厚生科学研究の枠組みを中心に産官学が協力して推進しているところである。さらに、調査研究を推進するためには、この枠組みに、産業界の自主的な調査研究への協力、諸外国や関係各省の調査研究結果の提供等を加え、統合的な研究を推進していく必要がある。
まず、既存の毒性情報を用いて化学物質を分類し、既に内分泌かく乱作用が指摘されている化学物質について優先的に試験を実施していくこととする(1)。また、内分泌かく乱作用について十分な情報が得られない化学物質については、超高速自動分析装置を用いてスクリーニングを実施する(2)。
以下にそれぞれの具体的な実施方針を述べるが、既存の毒性情報やスクリーニング試験によって、優先的に詳細な試験を実施するかどうかを評価し、化学物質を選別していくことが重要である。
また、将来の検討のために現時点におけるこのようなサンプルの長期保管も検討すべきである。
具体的には、健康影響としては、男女生殖器・生殖機能への影響、ホルモン関連がんへの影響、体内ホルモン環境への影響などについて検討すべきであり、暴露量について生体試料測定などを含めて正確に推定するとともに、植物エストロゲンや内因性ホルモンレベルなどの(内分泌かく乱化学物質の暴露−健康影響関係に影響を及ぼす可能性のある)交絡要因についても充分考慮されるべきである。サンプリング方法、必要対象数、コントロールの設定、倫理的な側面などに注意を払い、一般地域住民や職業集団を対象として、症例対照研究、コホート研究、断面研究、エコロジカル研究(地域相関研究)、無作為比較試験などの適切な疫学研究の手法を用いた調査が望まれる。
また、内分泌かく乱化学物質に係るテストガイドライン策定プログラムに参加する。具体的には、内分泌かく乱化学物質の評価の観点から見直しが求められている28日間反復投与毒性試験、子宮肥大反応試験(utero-trophic assay)、去勢雄ラット反応試験(Hershberger assay)、多世代繁殖試験の改定案の作成に貢献するとともに、これに沿った評価試験を日本で行う。