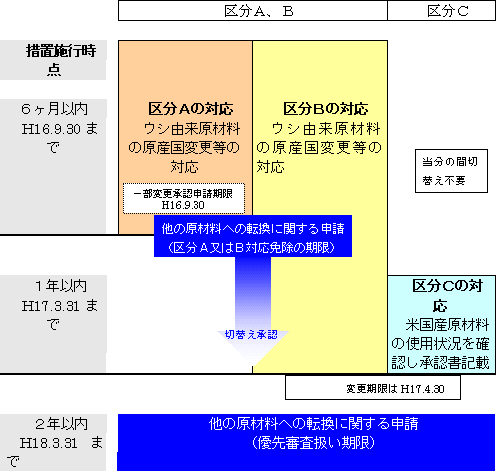
| ※ | 原料の切替えに不可避的に時間を要する場合は、切替え時期を明示し、製品の製造工程、使用方法等に関してリスク評価を個別に行い(要一部変更承認)、また、使用者に対して情報提供と理解を求める。 |
| 1 米国産のウシ等由来原材料の使用に係る件 |
| (1) | 前提
|
|||||||||
| (2) | 米国産のウシ等由来原材料の使用状況 ウシ等由来原材料の米国産原材料への高い依存度の現状(血清の45%、ゼラチンの30%等)を踏まえ、原材料の切替えに伴う医療上の影響を最小限にしながら速やかな他の原産国の原材料等への切替えを行わせることが必要である。 |
|||||||||
| (3) | 対策案 予防的な措置として、米国産のウシ等由来原材料の使用を禁止することとするが、製品中での製造工程による希釈・濃縮、処理、投与経路、使用期間を考慮した製品の相対リスク(平成15年7月同調査会におけるリスク評価法)に応じて、切替えについての経過期間を定めることとした。
|
|||||||||
| (4) | また、今後のBSE発生の拡大を懸念し、今後のリスクを分散させるためにウシ等由来原料から他の原料への切替えを行った製品を企業が開発し、承認申請されたものについては、優先的に審査を行うことされた(当面、今後2年間。また、6ヶ月以内に申請されたものについては、(3)の対応につき免除。)。ただし、調査会では、医薬品等においては、他の感染症や品質等における旧製品比較可能性等の精査が必要であり、性急ではなく慎重に対応するべきという意見があった。 |
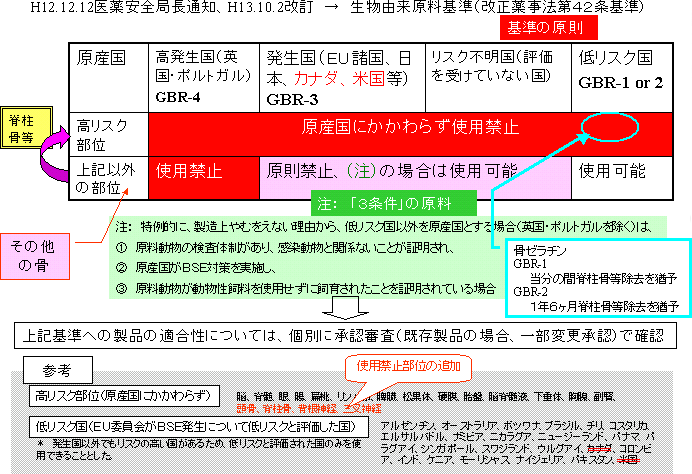
| 2 脊柱骨等を新たにリスクの高い部位に指定する件 |
| (1) | 前提 食品分野において、脊柱骨等が危険部位に指定されたことに伴い、医薬品、医療用具等についても、脊柱骨(脊柱骨、頭骨、三叉神経節及び背根神経節)を使用してはならない部位とする議論を行った。(OIEの基準に準拠) |
|||||||||
| (2) | ウシ等の骨の使用状況・規制等
|
|||||||||
| (3) | 医薬品、医療機器等における脊柱骨等の規制案
|
|||||||||
| (4) | ゼラチンのリスク評価 欧州委員会の運営委員会の2003年の報告書に掲載された実験(スクレイピー感染マウスの脳による添加回収実験)においては、アルカリ又は酸処理等により、異常プリオン伝播のリスク低減に一定の効果(4Log以上のクリアランス)があるとされ、製品におけるそのリスクはわずかである。 |
|||||||||
| (5) | 米国産ゼラチンの取扱い カプセル全体の30%を占める米国産ゼラチンについては、米国でのBSE発生における対応として、1に示したように、区分Bの経過措置1年とされた。 |
|||||||||
| (6) | その他
|
| 3 今後のスケジュール案 |
| (1) | 生物由来技術部会での審議の後、パブリックコメント・WTO通報。 |
| (2) | その後、薬事法第42条「生物由来原料基準」の一部改正 |
| 別添 |
| (1) | ウシ由来原材料の除去が困難な場合は、原材料−製造工程−投与経路−使用期間によるリスクを定量的に評価し、BSEの理論的伝播リスクが高いものから、すみやかに、米国産原材料からの原産国等(※)の切替えの措置を実施することとする。以下は、切替え期限。
|
| (1) | 1986年以前に採取されたウシ原料は、本措置の対象としない。 |
| (2) | 区分Bであっても、1年以内の切替え期間中は、原料動物に動物性飼料が使用されていないことを製造業者等においても、確認に努める。 |
| (3) | 原材料のすみやかな切替えを優先するため、改正予定の「生物由来原料基準」(法第42条)が担保される限り、承認書上の原産国記載等については、切替え事後での変更手続きを可とする。 |
| アルゼンチン、オーストラリア、ボツワナ、ブラジル、チリ、エルサルバドル、ナミビア、ニュージーランド、ニカラグア、パナマ、パラグアイ、シンガポール、スワジランド、ウルグアイ、バヌアツ※、ニューカレドニア※ |
| ※ | バヌアツ、ニューカレドニアについては別途原料基準の改定を行い、使用可能国となる予定 |
| コロンビア、コスタリカ、インド、ケニア、モーリシャス、ナイジェリア、パキスタン |
| ※ | 米国、カナダは我が国では発生国として取り扱っている。 |

| ※ | 原料の切替えに不可避的に時間を要する場合は、切替え時期を明示し、製品の製造工程、使用方法等に関してリスク評価を個別に行い(要一部変更承認)、また、使用者に対して情報提供と理解を求める。 |
| 4 医薬品等のリスク分類 |
| 区分 | 製品類別 | 牛原料の用途 ウシの成分 |
経路 | リスク値 | |
| リスクの目安 : 感染動物の危険部位 | 脳内 | 1 | |||
| 区分A 71品目 |
1 | 遺伝子組換え品(細胞培養) 例:血栓溶解剤、血液凝固因子 |
細胞培養培地等 血清、インスリン等 |
注射 | 1/10万〜 1/10億 程度 |
| 2 | 成分抽出製剤 例:コンドロイチン硫酸 |
抽出成分 気管軟骨、アプロチニン(肺)等 |
注射 | ||
| 3 | 植込み用具 例:組織補填コラーゲン |
成分・組織 骨由来コラーゲン |
植込 | ||
| 区分B1 1754品目 |
4 | ゼラチン使用製剤 例:HIV治療薬、インフルエンザ薬等を含む各種医薬品のカプセル基材 |
カプセル・安定剤 骨由来ゼラチン |
経口等 注射 |
1/100億以上 (脊柱骨リスクを加味) |
| 区分B2 306品目 |
5 | 成分抽出製剤 例: 胆汁末、臓器エキス |
抽出成分 胆汁、胆石、肝臓、心臓、気管軟骨等 |
経口等 | 1/100億 〜 1/1000億 程度 |
| 6 | 低分子製剤(*)例:コール酸類 | 粗原料 胆汁酸誘導体 |
注射 | ||
| 7 | 菌培養による製剤 例 ワクチン、ステロイド剤 |
培養培地 肉エキス、血清、肝臓エキス、乳等 |
注射 | ||
| 区分C 449品目 |
8 | 遺伝子組換え品(細胞培養)菌培養による製剤 例:血栓溶解剤、成長ホルモン、インスリン |
セルバンク・シード 血清等 |
注射 | 1/1000億 未満 |
| 9 | 菌培養による製剤 例 ホルモン剤、ステロイド、抗生物質 |
培養培地等 肉エキス、血清、肝臓エキス、乳等 |
経口等 | ||
| 10 | 低分子製剤(*)例:コール酸類 | 粗原料 胆汁酸誘導体 |
経口 | ||
| 11 | 外用製剤 例:抗生物質、ステロイド、消炎剤 |
基材、成分等 コラーゲン、肉エキス、血清、肝臓エキス、乳等 |
経皮 | ||
| *: | アルカリ・高温での製造工程をへるものであって不活化に十分な根拠のあるもの。 |
| 資料 |
| 区分 | 類別 | ウシ原料使用方法 | 投与 経路 |
リスク 合計値 |
|
| リスクの目安 : 感染動物のリスクの高い部位 | 脳内 | +7 | |||
| 区分A | 1 | 遺伝子組換え・細胞培養医薬品 | 細胞培養等(*1) | 注射 | +2 |
| 2 | 遺伝子組換え・細胞培養医薬品 | 親和性カラム(*1) | 注射 | -2 | |
| 3 | 成分抽出製剤 | 抽出成分 | 注射 | 0 | |
| 4 | 植込み用具 | 成分・組織 | 植込 | -1 | |
| 区分B1 | 5 | 経口製剤(ゼラチン) | カプセル等 | 経口 | 0〜−4 |
| 6 | 注射剤(ゼラチン) | 安定剤 | 注射 | 0〜−4 | |
| 区分B2 | 7 | 成分抽出製剤 | 抽出成分 | 経口 | -3 |
| 8 | 低分子製剤(*2) | 成分粗原料 | 注射 | -4 | |
| 9 | 菌培養医薬品/ワクチン | 培養 | 注射 | -4 | |
| 区分C | 10 | 細胞培養医薬品 | MCB/WCBのみ | 注射 | −4− |
| 11 | 菌培養医薬品/ワクチン | シードのみ | 注射 | -6 | |
| 12 | 菌培養医薬品/ワクチン | 培養 | 経口 | -7 | |
| 13 | 低分子製剤(*2) | 成分粗原料 | 経口 | -7 | |
| 14 | 外用製剤 | 基材、成分等 | 経皮 | −4< | |
| ※ | 上記のリスク計算は、原材料の中にプリオンが仮に存在した場合、プリオンが失われずに製品まで至ると仮定したもの。(平成15年7月開催伝達性海綿状脳症調査会資料を元に計算) |
| ※ | (*1)は製造工程で原材料の濃縮の可能性がある工程を含むもの |
| ※ | (*2)製造工程の一定のリスク減少効果が認められているもの |
| 区分 | 類別 | ウシ原料使用方法 | 経路 | 品目数 | ||
| 区分A | 1 | 細胞培養医薬品 | 培養(*) | 注射 | 48 | |
| 2 | 細胞培養医薬品 | アフィニティカラム(*) | 注射 | |||
| 薬 | 血栓溶解剤(遺伝子組換え) | 血液凝固因子製剤 | ||||
| 抗悪性腫瘍抗体医薬品(遺伝子組換え) | 再生不良性貧血治療薬(遺伝子組換え) | |||||
| 腎性貧血改善剤(遺伝子組換え) | インターフェロン(遺伝子組換え) | |||||
| 抗リウマチ薬(遺伝子組換え) | 免疫抑制剤(遺伝子組換え) | |||||
| G−CSF製剤(遺伝子組換え) | インスリン(遺伝子組換え) | |||||
| 3 | 成分製剤 | 抽出成分 | 注射 | 9 | ||
| 薬 | 抗悪性腫瘍剤 | 高カロリー輸液用微量元素製剤 | ||||
| 血栓溶解剤 | 組織接着剤 | |||||
| コンドロイチン硫酸(注射・点眼) | ||||||
| 4 | 植込み用具 | 成分・組織 | 植込 | 14 | ||
| 具 | 組織補填等コラーゲン | |||||
| ウシ心のう膜 | ||||||
| 区分B1 | 5 | 経口製剤 | カプセル | 経口 | 1749 | |
| 薬 | 抗生物質、抗菌剤 | 神経障害治療薬 | ||||
| 癌治療薬 | パーキンソン病治療薬 | |||||
| HIV治療薬 | 精神分裂病治療薬 | |||||
| 免疫抑制剤 | 抗うつ剤 | |||||
| 抗インフルエンザ薬 | 自律神経剤 | |||||
| 血栓溶解剤 | 抗てんかん薬 | |||||
| 不整脈薬 | カルシウム拮抗薬 | |||||
| 心房細動等治療薬 | 高脂血症改善薬 | |||||
| 虚血性心疾患治療薬 | 降圧剤 | |||||
| 狭心症治療薬 | 抗アレルギー薬 | |||||
| 不整脈薬 | 真菌症治療薬 | |||||
| 心不全治療薬 | 甲状腺機能検査薬 | |||||
| 強心配当体 | 利胆及び鎮痙 | |||||
| 循環改善薬 | ビタミン欠乏症 | |||||
| 微小循環系賦活剤 | 解熱鎮痛剤 | |||||
| 抗プラスミン剤 | 鎮痙薬 | |||||
| ウイルソン病 | 骨粗鬆症 | |||||
| 抗炎症薬 | 肝機能改善薬 | |||||
| 抗潰瘍薬 | 止しゃ薬 | |||||
| 代謝異常治療薬 | β作動薬 | |||||
| リウマチ薬 | 感冒薬 | |||||
| 子宮内膜症治療薬 | 滋養強壮剤 | |||||
| 6 | 注射剤 | 安定剤(ゼラチン) | 注射 | 5 | ||
| 薬 | 癌昇圧化学療法剤 | |||||
| 抗悪性腫瘍剤 | ||||||
| 区分B2 | 7 | 成分製剤 | 抽出成分 | 経口 | 249 | |
| 薬 | ゴオウ | 肝臓エキス | ||||
| 胆汁末 | 心臓エキス | |||||
| 胆汁エキス | 精巣エキス | |||||
| コンドロイチン硫酸 | ||||||
| 8 | 低分子成分製剤 | 成分原料 | 注射 | 9 | ||
| 薬 | G−CSF製剤 | |||||
| ウルソデソキシコール酸類(急性白血病治療薬、好中級減少治療薬) | ||||||
| 9 | 菌培養医薬品/ワクチン | 培養 | 注射 | 48 | ||
| 薬 | 肺炎球菌ワクチン | 抗悪性腫瘍溶連菌製剤 | ||||
| 乾燥弱毒生麻しんワクチン | 抗悪性腫瘍剤 | |||||
| 乾燥弱毒生風しんワクチン | ステロイド剤(リウマチ、抗炎症) | |||||
| 乾燥弱毒生おたふくかぜワクチン | 抗生物質 | |||||
| 日本脳炎ワクチン | ||||||
| 区分C | 10 | 細胞培養医薬品 | MCB/WCBのみ | 注射 | 15 | |
| 薬 | 抗生物質 | ゴーシェ病治療薬(遺伝子組換え) | ||||
| 眼瞼痙攣治療薬 | ファブリー病治療薬(遺伝子組換え) | |||||
| 血栓溶解剤(遺伝子組換え) | ||||||
| 11 | 菌培養医薬品/ワクチン | シードのみ | 注射 | 44 | ||
| 薬 | インスリン製剤 | 成長ホルモン | ||||
| 12 | 低分子成分製剤 | 成分原料 | 経口 | 167 | ||
| ウルソデオキシコール酸類 | ||||||
| 13 | 菌培養医薬品/ワクチン | 培養 | 経口 | 45 | ||
| 薬 | 子宮内膜症治療薬 | 薬 | 喘息薬(吸入) | |||
| ステロイド剤(経口、坐剤、点眼) | 合成ホルモン剤 | |||||
| 抗パーキンソン病薬 | 利尿薬 | |||||
| ヒアルロン酸(手術用) | ポリオワクチン | |||||
| 14 | 外用製剤 | 基材、成分等 | 経皮 | 178 | ||
| 薬 | ステロイド剤(抗炎症薬・クリーム等) | 化 | コンドロイチン硫酸 | |||
| 消炎鎮痛貼付剤 | 化 | コラーゲン | ||||
| 抗リウマチ薬 | ||||||