![]()
PPTA 安全性対策
2003年3月7日
製品の市販に向けた試み
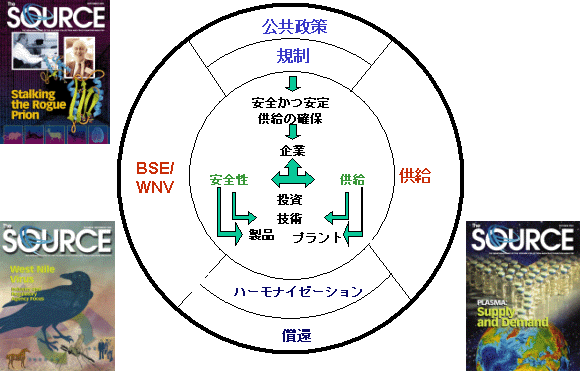
血友病コミュニティにおいて1980年代に発生したことは二度と起こしてはならない。事実、何らかの療法を通じてウイルス感染症が伝播される例は多い。これを予防するために、すべての関係者が責任を共有している。
|
安全対策を組合わせることによるリスク低下
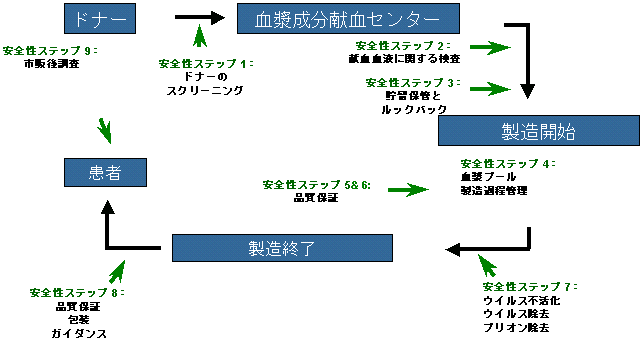
ウイルス感染のリスク低下を成し遂げるためには、PPTA加盟企業といくつかの規制当局による慎重な管理の下に、多くの重要なステップを踏むことが必要となる。
また、PPTA加盟企業では自主的に重要な基準を導入しており、製品の品質と安全性がさらに高められており、当局の規制基準よりはるかに良いものとなっている。どのようにして私たちがドナーを選択しているのかについて、重要な点を説明したい。
ドナー管理
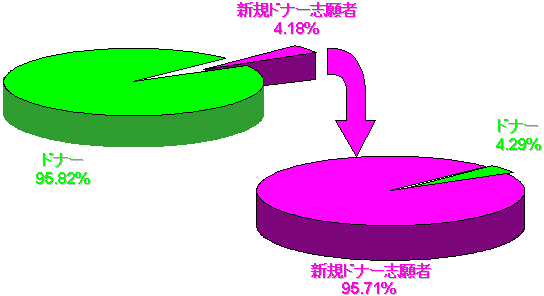
私たちの調査によると、献血のうち4〜10%は新規ドナー由来であると報告されている。この新規ドナーには全くはじめてという人と以前の健康状態またはドナー資格の記録がない人が含まれている。
私たちの調査では、病原物質陽性のドナーの割合は新規ドナーに非常に多い。事実、陽性ドナーのうち90〜95%が新規ドナー由来であることが判明している。この問題を解決するために、自主的に効果的な基準を開発した。
ドナー資格
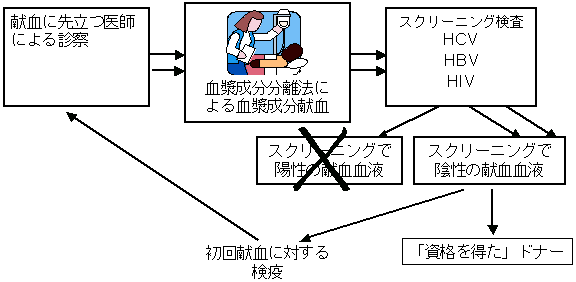
ドナー資格
ドナーとしての資格を得るためには、少なくとも健康状態と既往歴に関する2回の問診、および必要とされるパネルの2回のスクリーニング検査を受けて、これらに合格しなければならない。この基準は、新規ドナーと2回目以降(間隔が6ヶ月以上)のドナーに適応される。この基準によると、1回のスクリーニングのみのドナーに由来する血漿は製造に使用しないことになる。初回の血漿は検疫を受け、2回目の血液検査でも陰性であった場合にのみ製造に使用される。
この自主基準は類のないもので、最終製品の安全性を保証するための最初の重要なステップとなっている。
「資格を得たドナー」について
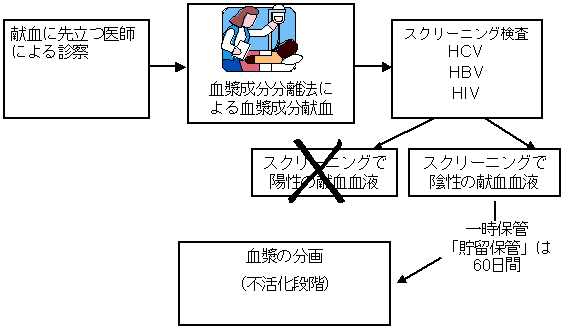
資格を得たドナーに由来するすべての献血血液は、HBV、HCV、HIVについて一連のスクリーニング検査が実施される。これらウイルス検査で陰性の献血血液のみ受理される。
献血血液は、「貯留保管」として60日間保管されるので、セロコンバージョンなどの献血後の情報が得られることとなる。これにより各社では、プールに先立って疑わしいユニットを除外することが可能となる。すべての献血血液がコンピュータによりコード化されているので、いつでも特定の献血血液の場所がわかり、必要に応じて引き出せる。
加盟企業が実施しているこの他の自主的ステップとして、すべての新規ドナーが、全国ドナー除外登録(NDDR)にて確認されている。この全国データベースにより、以前に除外されたドナーに関する迅速かつ効果的な鑑別が可能となる。以前にHIV、HBV、HCVの検査において陽性であったドナーを鑑別し、献血の申し出は生涯拒否される。NDDRは1991年に設立されており、献血を拒否される人数は1ヶ月あたり約600名となっている。
自主的基準
| ドナー管理 | 資格を得たドナー |
| ユニット管理 | 60日間の貯留保管 |
| プール管理 | NAT検査 |
| センター管理 | ウイルスマーカーの基準 NDDR(全国ドナー除外登録) |
PPTA加盟企業は、当局の規制に加えて、これらの自主的基準を遵守することによって、更なる安全な製品を目指して努力している。
世界の企業
NAT検査
| 欧州 | HCV | 陰性のプール 患者に焦点 |
| 米国 | HIV、HCV | IND ドナーに焦点 |
| 日本 | HIV、HBV、HCV | ドナー/製品に焦点 |
PPTA基準プログラムの一部として、加盟企業は、HBV、HCV、HIV、パルボウイルスB19に対するNAT検査を実施している。
NAT検査について調査したところ、規制当局によって実施に関する見解が異なっている点が注目された。しかし実際にはPPTA加盟企業は、どのような規制要件に対しても、選択するのではなくすべての規制要件に従っているので、どのような相違点があるのかについては問題とはならない。私たちは、すべての点で従うべき基準について選択することはできない。私たちは、各国の規制すべてを遵守しなければならない。このことは、すべての輸入製品は安全性に関する最高の基準に適合しているともいえる。私たちの製品は少なくとも2カ国の精査を受けており、時に3カ国(FDA、EMEA、厚生労働省)の精査も受けている。
血漿分画工程(図解)
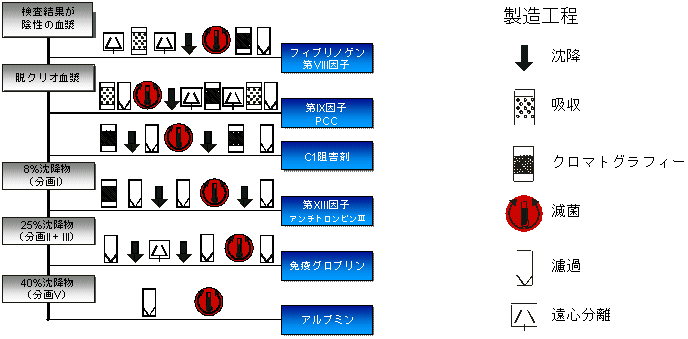
種々の血漿分画製剤は、それぞれの分画と製造の工程により製造されている。これに更なる安全対策として、その製剤に適した不活化・除去の工程が開発され導入されている。
現在一般に使用されている分画と製造の技術の多くは、PPTA加盟企業により開発されている。
分画に用いるヒト血漿:採漿−検査−加工−プール−製造
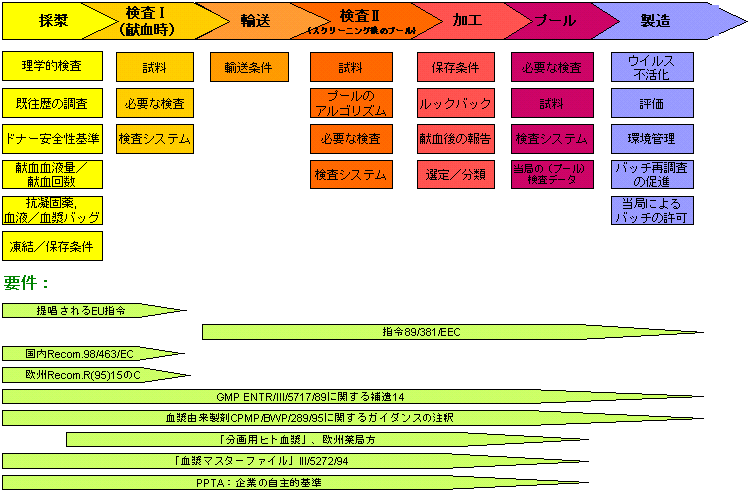
すでに述べたように、PPTA加盟企業はこれらのすべてを実施しなくてはならない。この図は、私たちの業界規制として、欧州において設定されているさまざまな要件の一例を示している。ここに示す通り、採漿から製造までのすべての範囲が網羅されている。出荷許可に先立ち、この情報のすべてが規制当局によって検証されることとなる。
これらが日本に輸入される時は、日本の基準も満たさなければならない。
ドナー母集団
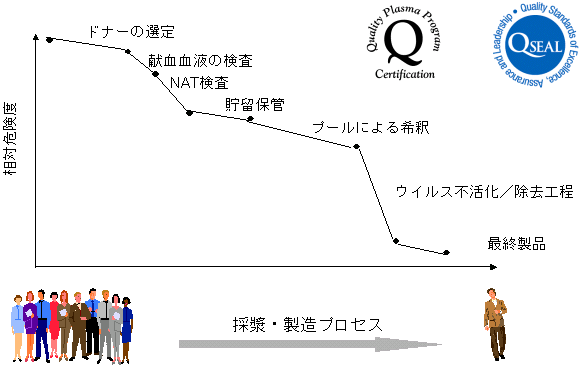
危険度を減少させるステップには、規制当局によって必要とされているものとPPTA加盟企業によって自主的に実施されているものとがあり、それらのすべてが機能することによって最も安全な製品が保証される。
推薦
血漿品質プログラム(IQPP)およびQuality Standards of Excellence Assurance and Leadership(QSEAL)などの自主的認定プログラムは、血漿療法の安全性を確保するために役立っている。事実、原料血漿の供給は、PPTA加盟企業により実施されてきたことにより、今日ではより安全なものとなっている。
IQPPプログラムとQSEALプログラムは、業界が自発的に取り入れたプログラムであり、過去10年間に患者と業界に対して顕著な価値を示してきた。また、これらプログラムから、米国と欧州における一連の品質基準が効果的に設定されることにもなっている。
IQPPは、最も高品質の血漿である証として患者と規制当局から認められている。米国内では、全米血友病財団の医療・安全性諮問委員会がIQPPの血漿のみを使用するとの決議を取り入れている。
欧州では、PPTAの認定プログラムが望ましい影響をもたらし、これが血漿の安全性に寄与していることをEMEAが公的に認めている。オーストラリアの規制機関は、分画に用いることを意図した、疫学的に適切な血漿ドナープロファイルについて保証する手段としてIQPPのウイルスマーカー基準を取り入れている。
センターでは、IQPP認定プロセスを通じて最高品質の血漿製剤を製造していることを示している。各基準により、直接的または間接的に血漿療法における安全性の向上がもたらされている。IQPPプログラムは終わりがあるものではなく、改善するためにプログラムの評価を絶え間なく実践している。
安全性システムの統合
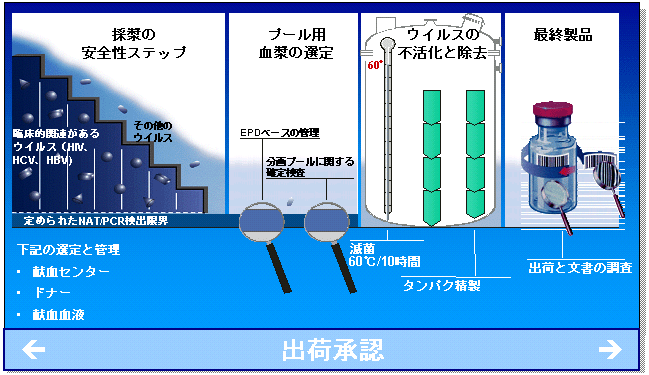
PPTA加盟企業は、最終製品の安全性を保証する最も良い方法は、採漿から最終製品までのそれぞれのステップにおいて細心の注意を払うことであると考えている。この統合する考え方には加盟企業が大きく貢献している。
私たちが日本の関係者に言えることは、現在入手できる製品は既知のウイルスに対して安全ということです。
また、私たちは信頼が得られるよう努力を続けます。