薬事・食品衛生審議会
会長 内山 充 殿
|
食品衛生分科会 分科会長 寺田 雅昭 |
平成14年6月11日に食品衛生分科会を開催し、平成13年7月27日付厚生労働省発食第181号をもって諮問された器具及び容器包装並びにおもちやの規格基準の改正について審議した結果、別添のとおり分科会報告をとりまとめ、下記のとおり決議したので報告する。
1 器具及び容器包装の規格基準の改正について
フタル酸エステル類を含有するポリ塩化ビニルに関し、以下の趣旨を器具及び容器包装の規格基準に規定することが適当である。
「油脂、脂肪性食品を含有する食品の器具及び容器包装には、フタル酸ジ(2−エチルヘキシル)を含有するポリ塩化ビニルを主成分とする合成樹脂を使用してはならない。ただし、フタル酸ジ(2−エチルヘキシル)が溶出又は浸出して食品に混和するおそれのない場合はこの限りでない。」
2 おもちやの規格基準の改正について
フタル酸エステル類を含有するポリ塩化ビニルに関し、以下の趣旨をおもちやの規格基準に規定することが適当である。
「合成樹脂製のもので、乳幼児が口に接触することをその本質とするおもちやには、フタル酸ジ(2−エチルヘキシル)あるいはフタル酸ジイソノニルを含有するポリ塩化ビニルを主成分とする合成樹脂を使用してはならない。
上記以外の合成樹脂製のおもちやには、フタル酸ジ(2−エチルヘキシル)を含有するポリ塩化ビニルを主成分とする合成樹脂を使用してはならない。」
I.はじめに
平成13年7月27日に、フタル酸エステル類を含有するポリ塩化ビニルに関し、器具及び容器包装並びにおもちやの規格基準を改正することについて、薬事・食品衛生審議会に対し厚生労働大臣より諮問があった。
本件の背景は以下のとおりである。
器具及び容器包装については、平成11年度の厚生科学研究等により市販弁当にフタル酸ジ(2−エチルヘキシル)(以下「DEHP」という。)が検出され、当該物質の弁当への移行の主たる原因が可塑剤としてDEHPを含有するポリ塩化ビニル製手袋の使用であることが判明したことから、当該手袋の食品への使用を避けるよう、平成12年6月14日付け厚生省生活衛生局食品化学課長通知による指導がなされた。その後、平成12年度の厚生科学研究により、油分を含む食品にDEHPを含有するポリ塩化ビニル製製品が接触する場合には、DEHPが食品に容易に移行することがより明確になったことである。
一方、おもちやについては、厚生科学研究等における乳幼児のMouthing行動の実態調査から、乳幼児は「おしゃぶり」を長時間Mouthingする場合があること、及びフタル酸ジイソノニル(以下「DINP」という。)を含むポリ塩化ビニル製試験片を成人がChewingした後の唾液中へのDINP溶出試験から、口腔内での溶出のばらつきが大きく、かつDINPが多量に溶出する場合があることが判明したこと等である。
今回、具体的な検討を行ったフタル酸エステル類は、平成11年度の厚生科学研究等により市販弁当中に多量検出された事例のあるDEHP及びおもちやに頻用されているDINPの2種類である。
なお、おもちゃに関する海外の状況として、欧州連合(EU)においては、平成11年12月に、3歳未満の子供が口に入れることを目的とするDEHP、DINP等6種類のフタル酸エステルを含有するポリ塩化ビニル製の玩具及び保育用品については流通を認めないとする規制措置(3カ月毎に更新される暫定的措置)を講じており、米国においては、米国消費生活安全委員会が、平成10年12月に、3歳未満の子どもが使用するフタル酸エステルを含有する玩具を流通させないよう業界団体に要請している。
II.DEHPとDINPの毒性評価について
1.DEHPについて
1)基本情報
| (1) | 構造式 |
| (2) | 分子量 390.56(C6H4(COOC8H17)2)(「14102の化学商品」による。) |
| (3) | CAS番号 117-81-7 |
| (4) | 用途 塩化ビニル、ニトロセルロース、メタクリル酸、塩化ゴムに良好な相溶性がある。特に塩化ビニル製品にはよく、主としてシート、レザー、電線被覆材、農ビ用フィルム、ペーストに適する。(「14102の化学商品」による。) |
| 2) | DEHPの耐容一日摂取量(TDI)の設定について DEHPについては、平成12年6月14日に開催された食品衛生調査会毒性部会・器具容器包装部会合同部会(当時)において、耐容一日摂取量(TDI)が設定されている。(別紙参照) 以下は、平成12年6月以降に整理した知見を主に、改めて毒性評価の概要を取りまとめたものである。 |
(1)体内動態
| ア) | 吸収 皮膚吸収について、ラットにおいて皮膚からの吸収は遅く(Elsisi et al1989, Melnick et al 1987)、皮膚適用7日後でも適用量の86%が適用部位に残っていた。プラスチックフィルム中のDEHPの吸収は更に遅く、7日後でも約0.010%にすぎなかった(Deisinger et al 1998)。ヒトでの皮膚吸収試験結果は見あたらない。なお、in vitroでの結果ではヒト皮膚よりラット皮膚の方が吸収が早かった(Barber et al 1992, Scott et al 1985)。モルモット皮膚を用いた試験においても極めてわずかしか吸収されなかった(Nget al 1992)。 消化管吸収について、吸収には大きな種差があるとされている。例えば、Ikedaら(1980)はDEHP(50mg/kg/day)をラット、イヌ及びミニブタに21-28日間投与し、最終日に14CでラベルしたDEHPを投与し、24日間の尿中に排泄された放射活性を測定したところ、それぞれ37%、20%、及び79%排泄であった。しかし、ラットやブタでの胆汁中排泄はないと推定されるが、それらの評価が十分ではないことから、これらの値をそのまま吸収率の差ととらえることはできない。 Williams and Blanchfield(1974)は2g/kg投与したラットにおいては90%以上が尿中に排泄されると報告している。Schulz and Rubin(1973)の報告においても投与量(250mg)の12.8%しか糞及び腸内容物から回収できなかった。Arther D. Little Inc.(1983)の報告によれば、餌に混ぜたDEHP(1,000-12,000ppm)のほとんどが吸収された。Danish EPA(1996)は14C-DEHPを用いた尿中排泄試験での結果を評価し、経口投与したもののうち40-80%がラットの消化管から吸収されると記述している。一方、F344ラットとRD-1マウスではいずれも500mg/kgあるいはそれ以下ではDEHPのままでの吸収は認められないが、B6C2F1マウスでは用量に比例してDEHPの吸収が増えてくる(Albro et al 1982, 1986)。マーモセットにおける吸収はラットと比べて少なく、100mg/kgで約45%と推定されている(Rhodes et al 1986)。また、一般に吸収率は投与用量が高くなると低下する。DEHPの加水分解産物であるmono(2-ethylhexyl)phthalate (MEHP)及び2-ethylhexanol(2-EH)を経口投与した場合、それらの約80%が吸収される。一方、phthalic acidを投与した時の尿中排泄量は投与量の24%と少ない(WHO 1992, Albro & Lavenhar1989, Woodward et al 1988)。多くの場合、DEHPは小腸内のリパーゼ(Lhuguenot and Cornu 1993)あるいは小腸組織内の加水分解酵素により加水分解され、MEHP及び2-EHとなった後に吸収されると考えられる。DEHPの加水分解酵素活性は膵液、消化管内容物、また消化管組織に存在している。消化管組織での活性はマウス>ラット>モルモット>ハムスターの順で高い(Albro and Thomas 1973)。また、消化管粘膜での活性はヒヒはラットと同程度、フェレットは低かった。例数は少ないがヒト消化管でもフェレットと同じかそれ以下の活性を有している(Lake et al 1977)。カニクイザルではラットやマウスと比較して消化管でのDEHPの分解活性は低い(Astill 1989)。従って、吸収に種差が生じた理由は腸内リパーゼ活性に差があることにより、DEHPの加水分解に差が生ずることによると考えられる。志願者に30mgのDEHPを経口投与したところ、24時間以内に投与したDEHPのうち約13%(11-15%)が代謝物として尿中に排泄された (Schmid and Schlatter 1985)。同じ志願者に10mgを4日間投与した場合も同様の結果が得られた。ただし、彼らは糞中への排泄量は調べておらず、胆汁中排泄も想定されることから、吸収率はこれ以上であると推定される。この結果はヒトでのDEHPの消化管吸収はラットより少ないが、マーモセットと同じ程度であることを示唆している。 吸入においては、100mg/m3 のDEHPに暴露されたラットにおいて速やかに吸収された(General Moters 1982)。ヒト試験の結果はないが、PVCチューブで人工呼吸を受けた新生児や職業暴露者の尿中にDEHPが検出された(Dirven et al 1993, Liss et al 1985)。 |
| イ) | 分布 ラットでは主にMEHPとして分布しており、DEHPが肝臓中に検出されるのは大量投与(>0.5g/kg)された時のみである。DEHP経口投与後15分でMEHP血中濃度が最高に達する(Garberg et al 1989)。また、血中に存在するMEHPの多くは血漿蛋白と結合している(Garberg et al 1989)。 経口投与されたDEHPとその代謝物は全身に広く分布するが、その存在形態は多くの場合明らかにされていない(Fed. Register Notice 11/19/99)。ラットに14C-DEHP 2,000mg/kg/dayを経口投与後24時間において、肝臓に205μg/g、腎臓に105μg/g、精巣に40μg/g及び血中に60μg/gのDEHP当量が存在していた。マーモセットでも同様の分布を示したが、存在量はラットの1/5から1/10であった(Rhodes et al 1986)。14C-DEHPを吸入したラットでは肺、肝、及び腎に多く分布していた(General Moters 1982)。 臓器や組織中への有意な蓄積性はいずれの種においても認められていない。また、ラットに14C-DEHP 2,000mg/kg/day経口投与4日後の組織中に残留したものは0.1%以下であった(Lake et al 1975)。Woodwardら(1986)及びWoodward(1988)は1,000ppmのDEHP(14C-carbonyl)を餌に混ぜてラットに反復投与したところ、5週間後には肝及び脂肪中濃度が定常状態に達しており、それぞれの組織中濃度は35-50ppm及び4-9ppmであった。一方、投与を停止すると3週間後には肝臓中には検出できなくなったが、脂肪組織中には3ppmの濃度で残っていた。DEHP及びそのモノエステル体代謝物は胎盤を通過する。また、母乳中へも移行する(Fed. Register Notice 11/19/99)。 |
| ウ) | 代謝(図1(PDF:52KB)参照) 先に述べたように、DEHPの代謝の最初の段階は主に腸内での加水分解によるMEHPと2-EHの生成である。その後の代謝過程は複雑であり、経口投与された後にo-phthalate部分を保持する代謝物として約20種が尿中から検出された。2-EH由来の代謝物も少なくとも7種同定された。なお、芳香環が代謝を受けたものや、DEHPの側鎖がそのまま酸化を受けた代謝物は検出されなかった(Albro et al 1983, Arbro 1986)。 DEHPはMEHPへと加水分解された後、ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)依存性の酸化酵素によるC-8側鎖のω-、ω-1あるいはω-2酸化反応により様々な位置に水酸基が導入される(Albro 1986)。この活性はラットでは肝及び腎皮質で高い。水酸化代謝物は更に酸化されケトン体やカルボキシ体へと代謝される。カルボキシ体は更にα及びβ酸化を受け側鎖が短縮する。多くの動物種において、MEHPの酸化代謝物はグルクロン酸抱合を受け排泄される(Albro 1986, Albro and Lavenhar 1989)。なお、高用量(500mg/kg)のDEHPあるいは MEHPを反復投与するとω-酸化代謝物が増加し、ω-1酸化代謝物が低下する(Astill 1989, Lhuguenot et al 1985)。代謝過程にも種差が認められる。ラットでは代謝物I及びVが主代謝物として尿中に排泄された(Albro 1986)。ラット及びモルモットではω酸化代謝が多いが、マウスやハムスター、ミドリザル、カニクイザル、及びマーモセットではω酸化は相対的に少ない(WHO 1992)。ハムスターはV, VI,IX代謝物が多く生成するが、ω-1酸化代謝物であるVI及びIXだけがグルクロン酸抱合体となる。ミドリザルやマーモセットでは主にMEHPとIXに代謝される(Lhuguenot & Cornu 1993)。なお、ラット肝細胞においてある種のω-1代謝物がペルオキシゾーム増殖作用を示した(Mitchell et al 1985)。 ヒトではω-及びω-1酸化がエチル側鎖の酸化とともに進行するが、ω-酸化は少ない。ヒトでもサルと類似した代謝経路で尿中に排泄される(Lhuguenot and Cornu 1993)。なお、グルクロン酸抱合体の尿中排泄はラットでは認められず、ハムスターでは少なく(15%)、マウスやモルモットでは比較的多く(60-65%)、ヒトを含む霊長類では高い(65-80%)(Huberet al 1996)。 |
| エ) | 排泄(表1(PDF:59KB)参照) 経口投与されたDEHPは速やかに尿及び糞中に排泄されるが、尿中からはDEHPの代謝物が検出され、DEHPそのものはいずれの種でも尿中からは検出されていない(Fed. Register Notice 11/19/99)。ラットでは経口投与量の最高60%が24時間以内に尿中に排泄され、引き続く7日間の間に更に1-15%が排泄され、残りは糞中に排泄される。また、投与量の約14%が胆汁中に排泄される。反復投与すると尿中排泄の割合が90-97%に増加した。ウサギでは最高65%が尿中に排泄された(Nielsen 1996, WHO 1992, ATSDR 1993, Garberg et al 1989, Woodward 1988, Woodward et al 1986)。 また、ラットに14C-DEHPを経口投与した結果では投与後5-7日の内に投与量の約80%が糞あるいは尿中に排泄された(Tanaka et al 1975)。排泄量は尿中の方が若干多かった。なお、胆汁中に排泄されたものは投与量の約5%であった。また、混餌投与されたときラットでの尿中排泄量は投与量に依存して多くなり、85mg/kg/dayで53%、500mg/kg/dayで64%、1,000mg/kg/dayでは67%が尿中に排泄され、このとき糞中にはそれぞれ36、28、26%が排泄された(Astill 1989)。イヌでは糞中排泄が多く(75%)、尿中排泄量は21%であった(Ikeda et al 1980)。2,000mg/kg/day、14日間投与されたマーモセットでは24時間以内に雄では投与量の62%、雌では76%が排泄された。この場合ほとんどが糞中排泄であり尿中排泄は1%にすぎなかった。また、糞中では98%がDEHPの形であり、DEHPが加水分解されないことから、あまり吸収されないものと思われた(Rhodes et al 1986, ICI 1982, Shell 1982)。なお、100mg/kg/day投与されたマーモセットについては、50%糞中に排泄され、尿中排泄は30%であった。また、100mg/kgを静注した場合でも投与量の18%が糞中に排泄された(Rhodes et al 1986)。カニクイザルに100mg/kg或いは500mg/kgを投与した場合においても24時間以内に排泄され、96時間後に残留した量は0.2%にすぎなかった。尿中排泄量は20-55%、高用量では4-13%であった。糞中排泄量はそれぞれ49-39%、69-56%であった(David et al 2000, Monsanto 1988)。 ラットでは多くがMEHPの酸化体として尿中排泄され、抱合代謝物としては検出されなかったが、マウス、ハムスター、モルモット、フェレット、ミドリザル及びマーモセットでは多くがグルクロン酸抱合体として尿中排泄された。MEHPとして尿中に排泄されたものはラットでは極微量であり、ハムスターでは4.5%と少ないが、マウスやミドリザルでは17-18%、モルモットでは72%を占めていた(WHO 1992, ATSDR 1993, Garberg et al 1989,Woodward et al 1986)。DEHP(9.75g/kg)を雄ラットに経口投与したときの消失半減期は血液では18.6時間、肝臓では28.4時間、脂肪組織では156時間であった(Oishi and Hiraga 1982)。また、14C-DEHP(2.8g/kg)を雄ラットに経口投与したときの尿中排泄物の半減期は7.9時間であった(Teirlynck and Belpaire 1985)。一方、志願者に30mgを経口投与した結果では11-15%が投与後2-3日の内にMEHP(代謝物の約35%)あるいは多くがグルクロン酸抱合を受けた酸化体として、尿中に検出された(Schmid and Schlatter 1985)。また、213mgのDEHPを単回投与した他の研究では尿中代謝物の99%がグルクロン酸抱合体であった。DEHPの血中半減期はヒトで28分と報告されている(Rubin and Schiffer 1976)。また、Lewisら(1978)は血清中DEHPの50%が32分で消失すると報告した。DEHPを18-38mg/dL含む血小板濃縮液を投与された患者の血漿中レベルは0.34-0.83mg/dLであり、24時間以内の排泄の60-90%が尿中に認められた。また、95-174mgのDEHPを注入されたがん患者では尿中代謝物の約80%がグルクロニドであった(Peck and Albro 1982)。なお、新生児では3ヵ月齢までグルクロン酸抱合活性が成熟しない(Cresteil 1998)ことに留意する必要がある。 |
| オ) | その他 食餌中2%のDEHPで10日間処理したラット精巣の可溶性分画のglutathionetransferase, phenol sulfotrasferase, catalase, quinone oxide reductase活性は有意に低下した。また、ミトコンドリア分画におけるquinone oxide reductase活性は50%低下した。 |
(2)精巣毒性(表2(PDF:71KB)参照)
| ア) | フタル酸エステル類の精巣毒性発現の構造依存性 一般にフタル酸エステル類の精巣毒性は特に幼若ラットで強く発現することから、ラットの4-6週齡から投与を開始した研究結果を表2(一部2世代試験を含む)にまとめた。 体系的な研究としては二つあり、Fosterら(1980)は同モル等量(1,400〜2,800 mg/kg/day)の直鎖(C1〜C8)フタル酸エステル類をSD雄ラットに4日間強制経口投与し、C4〜C6であるDBP、DPP及びDHP投与群で精巣重量の減少、激しい精細管萎縮、精原細胞及び精子細胞の欠落等を報告した。また、Gray & Butterworth(1980)は2,800mg/kg/dayでC1〜C8の直鎖型フタル酸エステル及びDEHPをWistar雄ラットに10日間強制経口投与の実験を行い、ほぼ同様の結果を得ている。精巣毒性はDIBPからDHpPまでのフタル酸エステル類に認められているものの、その毒性強度は直鎖型のC4〜C6で強く発現している。ただし、明確な無毒性量が求められているのはDEHPだけである。DEHPの構造については、2位の炭素側鎖が回転することによって、C4とC6の両方の直鎖型側鎖を有することになる。また、BBPは加水分解によってmonobenzyl phthalateとmono-n-butyl phthalate(C4)とを生じるが、前者は精巣毒性を示さず、後者はDBPの活性代謝物と同一である。 |
| イ) | DEHPの精巣毒性の発現機構について フタル酸エステル類はモノエステル体に加水分解された後吸収されると考えられているため、この分野の研究はDEHPのモノエステル体であるmono(2-ethylhexyl) phthalate (MEHP)を用いて行われている。 FSHはセルトリ細胞の膜受容体に結合し、G蛋白を介してadenylate cyclaseを活性化させ、cAMPを産生させることにより生理作用を発現すると考えられている。Heindel & Chapin(1989)は、ラットの培養セルトリ細胞において、MEHPがFSH刺激によるcAMPの蓄積を用量依存的に抑制したことから、MEHPの作用点は細胞膜またはFSH受容体そのものであると予測した。 Grassoら(1993)は、同セルトリ細胞をMEHPとインキュベーションしたところ、FSH結合性の低下が認められたが、MEHPとFSHの同時存在下ではFSH結合性の低下は認められなかったことから、MEHPの作用部位はFSH受容体よりむしろG蛋白であろうと推定している。しかし、その後、フタル酸エステル類のFSH-cAMP経路への作用に関する研究報告はない。 一方、フタル酸エステル類は精子形成阻害を引き起こすが、その作用機構の一つとしてセルトリ細胞からの原生殖細胞(genocytes)の遊離とその結果生じる原生殖細胞のアポトーシス誘導が考えられている。精巣では常にアポトーシスによる原生殖細胞の自発的な削除が行なわれており、この原生殖細胞のアポトーシスには、Fasシステムが重要な役割を果たしていると考えられている(Nagata & Golstein 1995, Nagata 1997)。Fasシステムとは原生殖細胞に存在する膜レセプター蛋白であるFas、セルトリ細胞に存在するそのリガンド(FasL)からなるパラクラインシグナリングシステムで、FasLのFasへの結合により、原生殖細胞のアポトーシスが引き起こされる(図2(PDF:52KB))。Richburg & Boekelheide(1996)は28日齢のラットにMEHPを単回経口投与し、3、6、12時間後にセルトリ細胞及び原生殖細胞への影響を解析した結果、原生殖細胞のアポトーシスが3時間後には一過性に低下したものの、6時間以後には著しく増加した。また、投与後3時間の時点からセルトリ細胞内で原生殖細胞の結合維持に重要な役割を果たしていると考えられているビメチンフィラメントの崩壊が観察された。 また、Leeら(1999)はMEHPのFasシステムへの影響を解析し、10週齡ラットの投与6時間後に精巣内Fas mRNA及びFasL mRNAの増加を示した。さらに、Richburgら(1999)はMEHPを投与した21日齢のラットの精巣において、セルトリ細胞膜上に発現したFasLが可溶型(sFasL)となって遊離すること、及び原生殖細胞細胞膜分画のFasが増加することを報告している。これらの結果に基づいて、Richburgら(1999)はMEHPの作用機構について図-2のBに示したような仮説を立てた。すなわち、MEHPはセルトリ細胞のビメチンフィラメントを崩壊させることにより、原生殖細胞をセルトリ細胞から分離させ、Fasシグナル伝達経路を崩壊させる。その後、sFasLの形成及び原生殖細胞膜でFas発現が増加し、sFasLがFasに結合することによって原生殖細胞のアポトーシスが起こるという考え方である。 しかしながら、精細管への影響について推測されるこれら二つのメカニズムの関連性については検討されていない。 DEHPは新生児期のラットセルトリ細胞に対して影響を及ぼす。Dostalら(1988)は6日齡のSDラットにDEHPを500mg/kg/day以上で5日間経口投与し、精巣重量の低下を伴ったセルトリ細胞数の減少を認めたが、200mg/kg/dayでは影響は見られなかった。セルトリ細胞は生後10-14日までに細胞分裂を終了するため、Liら(1998)は2日齢のSDラットの精巣から調製したセルトリ細胞及び原生殖細胞の共培養系を用いてMEHPの作用を検討した。MEHPは用量依存的なセルトリ細胞からの原生殖細胞の分離を引き起こすと共に、セルトリ細胞の増殖を抑制した。また、MEHPはFSH刺激によるセルトリ細胞の増殖を抑制したが、MEHPのセルトリ細胞の増殖抑制に対するcAMPの添加効果は認められなかった。これらのことから、新生児期にラットがMEHPに暴露されるとセルトリ細胞数の減少を招き、その結果成熟期での精子形成減少の生じることが推定される。さらに、Liら(2000)は3日齢のSDラットにDEHPを経口投与し、24時間後の観察で肥大した多核原生殖細胞が100 mg/kg以上の投与で見られたことを報告した。 |
| ウ) | DEHPの精巣毒性評価 DEHPのラットでの精巣毒性については、37.6mg/kg/dayでセルトリ細胞の空胞化が認められたため、無毒性量は3.7mg/kg/dayとされている(Poon et al 1997)。その後、104週間混餌投与発がん性試験結果が報告され、投与終了時の精子形成欠損動物数比(%)がそれぞれ58(0mg/kg/day)、64(5.8)、78(28.9)、74(146.6)及び97(789.0)で、28.9mg/kg群以上で有意差が認められたことから無毒性量は5.8mg/kg/dayが適切と判断される(David et al 2000)。また、Liら(2000)は3日齢のSDラットにDEHPを経口投与し、肥大した多核原生殖細胞が100mg/kg以上の投与で見られたが、20mg/kgの投与では見られないことを報告した。この結果は、新生児ラットにおけるDEHPの精巣毒性感受性は若齢ラットと同程度であるを示唆している。 一方、Pughら(2000)は2歳未満の若いカニクイザルにDEHPを500mg/kg/dayで14日間投与しても精巣に変化の見られないことを報告している。また、マーモセットにおいても精巣毒性が発現していないことから、ヒトにおいて精巣毒性が出る懸念は低いと考えられる。 しかし、サルで精巣毒性の発現しないメカニズムが充分解明されていないことから、現時点ではDEHPのTDIの根拠として無毒性量3.7mg/kg/dayを用いることもまた適切であると考えられる(小泉ら 2001)。 |
| (3) | 生殖・発生毒性 CD-1マウスを用いて行った二つの生殖発生毒性試験に関する論文(Lamb et al 1987, Tyl et al 1988)においてはラットに比べて低い投与量域での生殖発生毒性が示され、明確なLOAEL及びNOAELが記載されている。Lambら(1987)は雌雄のCD-1マウスに0.01、0.1または0.3%のDEHPを含む飼料を与えながら交配実験を行ったところ、0.1%投与群で出産回数、母体当たりの出産生児数及び生児出産率の低下を認めたことから、LOAELは144mg/kg/day(0.1%)、NOAELは14mg/kg/day(0.01%)としている。また、Tylら(1988)は、CD-1マウスの妊娠0-17日に0.025、0.05、0.1または0.15%のDEHPを含む飼料を与えたとき、0.1%(191mg/kg/day)以上の投与量で胚死亡の増加がみられ、0.05%(91mg/kg/day)以上の投与量で形態異常胎児の増加が認められことから、LOAELは91mg/kg/day(0.05%), NOAELは44mg/kg/day(0.025%)としている。 以上の結果、生殖発生毒性のNOAELは14mg/kg/dayが適切であると考えられる。 |
| (4) | TDIの評価について DEHPのTDIは、精巣毒性試験及び生殖発生毒性試験における無毒性量3.7〜14mg/kg/dayを踏まえ、不確実係数として100をとり、40〜140μg/kg/dayとする。 |
2.DINPについて
1)基本情報
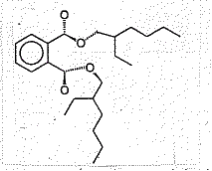
| (1) | 構造式 (代表的な構造)  |
| (2) | 分子量 418.62(C6H4(COOC9H19)2)(「14102の化学商品」による。) |
| (3) | CAS番号 68515-48-0、28553-12-0 |
| (4) | DINPの構造と製品 DINPはフタル酸とC9アルコールとのエステル体であるが、そのアルコール側鎖は多くの異性体からなり、混合物として製造、販売、使用されている。 CAS番号としては2つ与えられているが、製品としては3種ある。DINP-1と呼ばれているものはCASが68515-48-0で、主に3,4-、4,6-、3,6-、3,5-、4,5-及び5,6-dimethyl-heptanol、少量のmethyl octanolとiso-decanolとフタル酸とのエステル体である。DINP-2はCASが28553-12-0で主にdimethyl heptanolとmethyl octanol、少量のmethyl ethyl hexanolとn-nonanolとフタル酸とのエステルである。DINP-3もCASは28553-12-0でtrimethyl hexanolとdimethyl heptanolの比が約3:1の混合物とフタル酸とのエステルであるが、現在は製造されていない。 |
| (5) | 用途 高級レザー、フィルム、シート、電線、高級壁紙、ペーストゾルなど(「14102の化学商品」による。) |
2)DINPのTDIの設定について
(1)体内動態
| ア) | 吸収 皮膚吸収については、14C-DINPのラットにおける皮膚吸収は適応後7日間において2-4%であった(Midwest Research Institute M. 1983)。ヒト及びラットの皮膚を用いたin vitroの吸収性試験の結果ではヒトの皮膚の吸収はラットより遅い(Scott et al 1987)。プラスチックフィルム中のDEHPの吸収はDEHPそのものの場合より少ないと報告されており(Deisinger et al 1998)、DINPにもこれが当てはまると推定できる。約2,500mg/kgをラットに経口投与したときの結果では72時間以内に85%が糞中に、12%が尿中に排泄された。糞中排泄の殆どが24時間以内に認められたことから経口での吸収率は約12%と推定される(Hazleton 1972)。一方、50、150、500mg/kgを単回あるいは5日間雌雄のラットに連続投与した結果では低用量の単回投与では少なくとも49%が吸収されたが、高用量及び反復投与では吸収は低下した(Midwest Research Institute M. 1983)。 消化管吸収については、ラットに14C-DINPを経口投与した場合、尿中代謝物の多くはフタル酸あるいはモノエステルの側鎖が酸化されたものである(Midwest Research Institute M. NJ 1983)。用量が高くなるとフタル酸の存在比が低下する。モノエステルやDINP自身はほとんど尿中に現れない。 50mg/kgを投与したのちに糞中に現れる放射活性のうち8%が未変化体であった。500mg/kg投与時は41%であった。即ち、代謝における飽和があるものと思われる。肝及び精巣における主代謝物はモノエステルあるいはその側鎖が酸化されたものである。反復投与によってもこの代謝パターンは変わらない。 要約すると、DINPはモノエステル体へと脱エステル化されたのちにエステル基の側鎖が酸化を受けるかあるいは更に加水分解されフタル酸に変換する。また、用量が高くなると酸化体の割合は上昇し、フタル酸への加水分解は低下する。 |
| イ) | 分布 放射線でラベルしていないDINP(約2,500mg/kg)を4日間反復投与した後、同量の14C-DINPを経口投与したところ3日後で組織1g中に投与量の0.001%以上の14C-DINPを含む組織は無かった(Hazleton 1972)。なお、肝臓への分布が最も多かった。14C-DINPを経口投与した雌雄のラットでは放射活性は組織中から速やかに消失した。投与1時間目での分布量は肝で投与量の4.7%、腎で0.31%、及び血液中に1.62%であった。脂肪や精巣中にも代謝物が若干存在した。蓄積性は認められなかった。 |
| ウ) | 代謝 主たる排泄経路は尿と糞であり、低用量では両者ほぼ同程度であるが用量が高い場合には糞中排泄が多い。反復投与ではモノエステル体の側鎖の酸化体が多くなる(Midwest Research Institute M. 1983)。 |
| (2) | 一般毒性及び発がん性 Lingtonらの報告では、雌雄のF344ラットに0、0.03、0.3、0.6%(雄:0、15、152、307mg/kg bw;雌:0、18、184、375mg/kg bw)のDINP混餌食を2年間与えた結果、0.3及び0.6%群の雄で有意な体重減少、肝、腎の比重量の増加、0.6%の雄で貧血、0.3%以上の雄で軽度の肝機能障害が認められ、病理組織学的には0.6%群の雌雄で肝細胞肥大、雄で腎尿細管の色素沈着が観察されたが、ペルオキシゾームの増殖はみられなかった。また、単核球性白血病を除いては投与に起因する腫瘍あるいは前がん性病変の増加は認められなかった。論文では、肝機能障害や貧血は単核球性白血病による二次的な影響とみなしているが、肝機能障害についてこの評価を十分支持できる情報はない。単核球性白血病はF344ラットに特有の病変であり、自然発生的によく見られているものである。本試験のNOAELは15mg/kg bwである。 DINPによる肝ペルオキシゾームの増殖作用は、3ないし13週間の試験では0.6%以上の投与量で認められており、その作用には代謝物であるmonoesterが関与している。 Mooreらは雌雄のF344ラットに0、0.05、0.15、0.6、1.2%(雄:0、29、88、358、733mg/kg bw;雌:0、36、109、442、885mg/kg bw)のDINP混餌食を2年間与えた結果、0.6%以上で軽度の体重減少及び肝腎の比重量の増加、肝細胞肥大、尿細管上皮の色素沈着(雌雄)、腎乳頭の鉱質沈着(雄)の頻度が増加した。なお、DINPを78週投与後基礎食に切り替え、さらに26週間観察した結果、これらの病変は対照レベルまでに回復した。腫瘍性病変は1.2%の雄で肝細胞がん、雌雄で肝細胞腺腫の発生頻度が有意に増加し、雄の0.6%以上で腎腫瘍の増加がみられたが、腎腫瘍はalpha 2u-globulin 沈着による二次的な影響と考えられている。従って0.15%(108.6mg/kg/day)がNOEL、0.6%がNOAELと判断されている。しかし、雌ではこの用量でも有意な血液、血清生化学的変動(赤血球数、血糖値の減少、ヘマトクリット、MCH、AST、アルブミン、グロブリンの増加)、最低用量の0.05%(36.4mg/kg/day)雌でも血糖値の低下とビリルビンの増加が認められており、NOELの設定については議論の余地がある。 Mooreらは雌雄のB6C3F1マウスに0、500、1,500、4,000、8,000ppm(雄:0、90、276、742、1,560mg/kg bw;雌:0、112、336、910、1,888mg/kg bw)のDINP混餌飼料を2年間与えた結果、雌雄の4,000ppm以上で体重減少、体重増加の抑制、雄の4,000ppm以上及び雌の1,500ppm以上で肝細胞がん、肝の色素沈着が増加、雌雄の1,500ppm以上で腎重量の増加がみられた。これらの結果からNOAELは112mg/kg bwと判断されている。カニクイザルにDINP、DEHPそれぞれ500mg/kg、clofibrate 250mg/kg bwを14日間胃内投与した結果では、いずれの化合物も肝、腎重量、肝のペルオキシゾームベータ酸化、ギャップ細胞間連絡、複製DNA合成、その他肝、腎、精巣の病理所見に明らかな影響を与えなかった。DINPのエストロジェン活性については、エストロジェンレセプターへの結合性、E-screen(MCF-7細胞を用いた増殖試験)、及び子宮肥大試験では陰性であるが、recombinant yeast screenでは弱陽性(百万倍希釈のestradiolに対してその15%程度の反応性)である。 また、DINPはAmes assay、mouse lymphoma mutation assay、ラット初代培養肝細胞を用いたUDS試験、BALB/C-3T3マウス細胞を用いたmammalian cell transformation assayでいずれも陰性、マウス骨髄を用いたin vivoの染色体異常試験では最高用量が5mg/kg bwと低いが陰性であり、非遺伝毒性発がん物質と考えられている。 一般的にペルオキシゾーム(P)増殖剤による肝発がんにはP増殖に基づくacyl CoA oxidaseの誘導、脂肪酸の酸化並びに過酸化水素の増加に由来する酸化性ストレス、一過性あるいは持続的な細胞増殖作用、前がん細胞の成長(プロモーション)作用などが関与している。持続的な細胞増殖はWy-14,643では認められるが、DEHP、clofibrateやDINPでは発がん量でもみられていない。肝発がんの基礎となるPの誘導や細胞増殖作用にはステロイドホルモンレセプターファミリーの一つであるPeroxisome proliferator-activated receptor(PPAR)、特にPPARαが深く関連しており、一旦これが活性化されると、特異的なDNA response elementに結合しresponsive geneの転写活性が増加する。 Pの増殖活性には明確な種差がありラット、マウスは著しく感受性が高く、ハムスターはやや低く、モルモットは感受性がなく、アカゲザルやカニクイザルなどの霊長類及びヒトでは感受性が著しく低いことが知られている。この原因は主に霊長類ではPPARαの発現量が少ないためと考えられている。雄のPPARα KOマウス(-/-)及び野生型マウスに1.2% DEHPを24週間投与して毒性病変について比較したところ、野生型では肝、腎及び精巣に明らかな変化が観察された。一方、KOマウスでは肝臓に変化はみられなかったが、腎及び精巣には毒性変化が認められた。また、同じマウスにP増殖剤であるWy-14,643を0.1%の濃度で11ヵ月間混餌投与した結果、肝腫瘍はKOマウスには発生しなかったが、野生型マウスでは全例に認められた。ヒトにおいては、P増殖能を有する高脂血症剤を3年まで投与されてもP増殖は観察されておらず、15,000人を対象とした8年間の疫学的観察でも、高脂血症剤ががんを増加させたというような結果は得られていない。従って、P増殖によって発生する種々の毒性や発がん性は、ヒトには外挿出来ないものと考えられている。 |
| (3) | ホルモン受容体関連反応性について エストロジェンのリセプター結合試験について、Zacharewskiらによれば、DBP、BBP、DHPなどが弱い結合性を示す中で、DINPは、これに結合能を認めなかった。組換え酵母を用いたレポーター反応については、Harrisらによれば、DINPの反応性は、百万倍希釈のestradiolに対してその15%程度の反応性をもつ弱いエストロジェン様作用が検出されている。(相対活性は、同時に試験したBBP、DBP、DIBP、DEPに較べて弱かった)。 哺乳動物細胞系については、Sotoらの、ヒトの乳がん細胞由来のMCF-7を用いたE-スクリーンの結果によれば、DINPは反応をしなかった。 また、ZacharewskiらのGal-4ルシフェラーゼレポーター導入による一過性形質導入系での試験では、陰性であり、Hela細胞へのGal-4安定形質導入系でも陰性であった。 個体動物試験系については、Zacharewskiらによる動物を用いた試験 (SD系)でも子宮肥大 (子宮湿重量) や膣上皮角化反応を認めなかった。 |
| (4) | 精巣毒性 げっ歯類での毒性試験ではすべてDINP-1が用いられ、幼若F344ラットに混餌投与した21日試験(BIBRA 1985)あるいは2つの2年間試験(Lington et al 1997, Moore 1998a)、及びB6C3F1マウスに2年間混餌投与した試験(Moore 1998b)が行われているが、いずれも精巣に対する毒性は認められていない。一方、成熟マーモセットを用いた試験では、協和発酵製造の混合物成分不明のDINPを用い、2,500mg/kg/dayで13週間強制経口投与し(Hall et al 1999)、2才のカニクイザルを用いた試験ではDINP-1を500mg/kg/dayで2週間強制経口投与した(Pugh et al 2000)。これらの霊長類の試験でもいずれも精巣に対する毒性は認められていない。 以上のことから、DINPは通常の暴露ではヒトに対しても精巣毒性を発現する可能性は極めて低いと考えられる。 |
| (5) | 生殖毒性 パイロット試験として行われたDINPのSDラットにおける1世代試験は0.5、1.0及び1.5%の混餌投与で行われ、交配、受胎及び出産児数等の生殖指標にはいかなる影響も認められなかった。また、DINP-1 (CAS No. 68515-48-0,>99.7% pure, Exxon Chem. Co.) のSDラットにおける2世代試験は0.2、0.4及び0.8%の混餌投与で行われ、同様に全ての生殖指標への影響は認められなかった。したがって、生殖毒性に関する無毒性量は1世代試験では660-800mg/kg/day、2世代試験では950-1,650mg/kg/dayとなる。なお、両試験では発育中の体重増加抑制や、肝及び腎の組織学的変化が認められている(Waterman et al 2000)。 以上のように、DINPの生殖毒性に関しては、いずれの試験でも毒性発現は認められていない。 |
| (6) | 発生毒性 DINP-1 (CAS No. 68515-48-0, >99.7% pure, Exxon Chem. Co.) をSDラットの妊娠6-15日に100、500及び1,000mg/kg/dayで強制経口投与した実験では、胎児には骨格変異(はん痕様腰肋及び頚肋)及び腎盂拡張がみられ、著者らは母体毒性及び発生毒性の無毒性量はともに500mg/kg/dayと判断した(Waterman et al 1999)。しかし、CERHRの専門家会議では統計計算の再検討を著者らとともに行い、発生毒性の無毒性量を100mg/kg/dayと結論した(CERHR 2000)。この結論は骨格変異及び腎盂拡張の発現頻度から適切な結論と考えられる。 DINP-1 (CAS No. 68515-48-0, >99% pure, Commercial origin.)、DINP-2(CAS No. 28553-12-0)またはDINP-3(CAS No. 28553-12-0)をWistarラットの妊娠6-15日に40、200及び1,000mg/kg/dayで強制経口投与した実験において、母体毒性として1,000mg/kg群でDINP-1の投与により、妊娠ラットの摂餌量低下及び肝相対重量増加、DINP-3の投与により妊娠ラットの摂餌量低下、体重増加抑制及び肝相対重量増加が認められたが、DINP-2の投与では母体毒性は観察されなかった。胎児についてはDINP-1、DINP-2及びDINP-3のいずれの投与でも1000mg/kg群において骨格または内部器官の変異または化骨遅延を有する胎児の頻度の上昇がみられた。200mg/kg以下の投与ではいずれのDINP投与でも母体及び胎児に対する投与の影響は観察されなかった。 これらの結果から、母体毒性及び発生毒性の無毒性量をともに200mg/kg/dayと結論した(Hellwig et al 1997)。 上述のWatermanら(2000)の2世代試験の出生児の離乳前に全ての群で体重増加抑制が観察されている。低体重は低用量群の0.2%では生後21日の雌雄に一時的に認められたのみであるが、この用量を最小毒性量(143-285mg/kg/day)としている(CERHR 2000)。DINP-1(CAS No. 68515-48-0, Aldrich lot #03005TR, purity = technical)をSD母ラットの妊娠14日から分娩後3日まで与えたところ、750 mg/kgで低頻度ながら雄児に精巣萎縮、精巣上体萎縮及び乳頭保持等が観察され(Gray et al 2000)、1,500mg/kgで雄児の肛門生殖器突起間距離の短縮が観察されている(Ostby et al 2001)。 以上の情報から、DINPの発生毒性の無毒性量は100mg/kg/dayが適切であると考えられる。 |
| (7) | TDIの評価について DINPのTDIは、2年の混餌投与試験における無毒性量15mg/kg/dayを踏まえ、不確実係数として100をとり、150μg/kg/dayとする。 |
III.フタル酸エステル類を含有するポリ塩化ビニル製器具及び容器包装について
| 1. | 厚生科学研究の概要 平成12年度までの厚生科学研究により、以下の諸点が明確になった。 |
| 1) | ポリ塩化ビニル手袋から食品へのDEHPの移行について 5研究機関でポリ塩化ビニル手袋中のDEHPの測定を行った結果、研究機関間のDEHP含有量の標準偏差は平均値の5%以内となり、良好な結果が得られ、DEHPの測定法に問題がないことを確認した。 切り干し大根をポリ塩化ビニル製手袋でつかむ時間すなわち接触時間とDEHP移行量との関係を検討したところ、接触時間が長いほどDEHPの移行量も大きくなり、相関性が認められた(r2=0.9804)。 ポリ塩化ビニル製手袋で切り干し大根を3秒間つかみ、DEHP移行量を測定したところ、DEHPを40.4%含む手袋(以下、手袋1)で平均43.9ppmのDEHPが、また、DEHPを20.5%含む手袋(以下、手袋2)で平均28.0ppmのDEHPが、切り干し大根から検出された(ブランク値は平均0.367ppm)。 油で揚げたコロッケ1個を表面温度35〜40℃になった時点で手袋1及び手袋2でつかみ、DEHP移行量を測定したところ、手袋1で平均0.48ppmのDEHPが、また、手袋2で平均0.27ppmのDEHPが検出された。 ポリ塩化ビニル製手袋でコロッケをつかんだ後、再度コロッケをつかむ実験を行ったところ、手袋1で平均9ppmのDEHPが、手袋2で平均4.8ppmのDEHPが検出され、脂溶性のDEHPが手袋に付いた油を経由して食材に移行したと考えられた。 おにぎりで実験したところ、ごくわずかのDEHPしか食品に移行しなかったが(手袋1で平均0.076ppm、手袋2で平均0.069ppm)、消毒用アルコールの噴霧により、DEHPの移行量は、手袋1で平均1.45ppm、手袋2で平均0.55ppmと大きな移行が認められた。 消毒用アルコールの噴霧直後の手袋と30秒経過して乾燥した手袋の使用後のDEHPの移行量の比較では、手袋1では噴霧直後3.8ppm、30秒後0.43ppm、手袋2では、噴霧直後2.3ppm、30秒後0.37ppmであり、噴霧後の時間の経過によりDEHP移行量は大きく減少した。 切り干し大根はポリ塩化ビニル手袋との接触面積が大きいため、移行量が多かったものと考えられ、油分の少ないおにぎりではDEHPの移行は少なかった。 コロッケを2回つかむ実験から、脂溶性の媒体(油分)を経由して極めて短時間にDEHPが食品に移行することが明確になった。 |
| 2) | 市販食品中のフタル酸エステル類の分析結果等について 平成12年度に市販弁当10検体及び各種食品177検体に含まれるフタル酸エステル4化合物及びアジピン酸ジ(2−エチルヘキシル)、アジピン酸イソノニルの6化合物について分析したところ、市販弁当に含まれるDEHPの平均値は198ng/g(45〜517ng/g)であり、平成11年度の結果(803〜8,930ng/g、平均値は4,420ng/g)と比較して、平均値は約22分の1に減少した。 最も高い濃度が検出されたのは惣菜中のアジピン酸ジイソノニルで、20.2μg/g であったが、既報よりも高い値ではなかった。 DEHPについては、平成12年5月(手袋の使用自粛通知前)に製造されたレトルトベビーフード1検体から4,250ng/g 検出されたが、この製品の平成12年9月から12月製造のロットについては痕跡量〜0.099μg/g のDEHP濃度であった。製造会社は、手袋の使用自粛通知前までDEHPを含有するポリ塩化ビニル製手袋を使用していたとのことであり、このものが高かった原因は、DEHPを含有するポリ塩化ビニル製手袋の使用と考えられた。 平成11年度に、レトルト食品からDEHPが5,991ng/g(検出量平均)検出された事例があった。製造業者が製造工程を点検した結果、材料移送の段階でポリ塩化ビニル製配管(約24%のDEHPを含有)が使用され、80℃程度の高温で油性食品が通過しており、それをステンレス配管に交換した。平成12年度に調査した中でポリ塩化ビニル製配管を使用する可能性があるものは、レトルト及びフリーズドライ食品であり、これらの中には、DEHP濃度が比較的高い事例(レトルト食品で1,050ng/g、フリーズドライ食品で1,070ng/g、レトルト離乳食で1,570ng/g、フリーズドライ離乳食で1,840ng/g)が見られたが、これらは、1食でTDIに達するといった量ではない。 |
| 3) | ポリ塩化ビニル製器具・容器包装からの食品へのDEHPの移行について DEHPを異なる比率で含有する食品用器具・容器包装(ホース1(表示上DEHP41%含有、実測40.3〜40.8%含有)、ホース2(表示上DEHP21%含有、実測16.5%(部位により0.9〜25.5%))及びフィルム(表示上DEHP15%含有、実測12.4〜13.0%)の3製品)について、溶出試験を行い、DEHP含有量と溶出量の関係を2研究機関において検討したところ、3製品とも20%エタノール、水及び4%酢酸ではDEHPの溶出は少なく、最大でも0.184μg/cm2であり、20%程度の濃度のエタノールによるポリ塩化ビニル製品中からのDEHPの溶出は68%エタノール(消毒用エタノール)による溶出のような大きなものではないことが明確になった。 油分を想定した有機溶媒であるn-ヘプタンを使った場合、ホース1では、実験手技上の問題から切り口及び外側からの溶出を含む値ではあるものの8,840、8,260μg/cm2、ホース2では3,240、1,622μg/cm2、フィルムでは13〜24μg/cm2の溶出が認められた。 DEHPの含有量が低いと溶出も少なくなる傾向は認められたが、表示上DEHP15%含有のフィルムについても試験片中のDEHPの3%程度はn-ヘプタンでの溶出試験において溶出している。 通常の一日当たりの食事量を1kgと仮定した場合、体重50kgのヒトの食品からのDEHPの摂取がTDIの下限値(40μg/kg)を超えないようにするためには、単純計算では食品中の濃度は2ppm以下であるべきであるが、n-ヘプタン溶出試験結果は、最低でも6ppmであり、また、n-ヘプタンの溶出試験の結果、最も溶出の少ないフィルムにおいても13〜24μg/cm2の溶出があり、これは計算上約84〜154cm2からの溶出でTDIの下限値に相当する量となる。今回試験した3製品はいずれも油性食品に接触する形で使用することは不適当と考えられる。 |
| 2. | 規格基準(案)について 1.で述べたとおり、油分を含む食品にDEHPを含有するポリ塩化ビニル製製品が接触する場合には、DEHPが食品に容易に移行すること、食品との接触時間が長いとDEHPの移行量も多くなること、その一方で、20%程度の濃度のエタノールについてはポリ塩化ビニル製品中のDEHPに対して68%エタノール(消毒用エタノール)のような大きな溶出力を示さないこと等が明確になった。 また、DEHPの含量が13%程度のポリ塩化ビニル製製品であっても、油分を想定した有機溶媒であるn-ヘプタンによる溶出試験によりDEHPの溶出が確認されたことより、DEHPを含有するポリ塩化ビニル製の器具・容器包装を油性食品に対し使用することは適当とは考えがたいものであった。 なお、市販されている食品中の調査結果から、フタル酸エステルのうち、DEHP以外の食品中からの検出量は少ないことが確認されている。平成12年度の市販弁当中のDEHP濃度は平成11年度よりも大幅に減少しており、平成12年6月に発出した、DEHPを含有するポリ塩化ビニル製手袋の食品への使用を避けるよう指導する通知は一定の効果を上げたものと考えられるが、その後の調査結果等を勘案し、より一層の安全性確保を図る観点から、食品用の器具・容器包装から食品へのDEHPの移行が生じないよう食品用の器具・容器包装の規格基準を設定することが適当である。 すなわち、DEHPを含有するポリ塩化ビニルについては、油分を含む食品と接触する使用は適当でないことが明確になったものと判断され、食品衛生法第10条第1項の規定に基づき、以下の趣旨を規定することが適当と結論する。 「油脂、脂肪性食品を含有する食品の器具及び容器包装には、フタル酸ジ(2−エチルヘキシル)を含有するポリ塩化ビニルを主成分とする合成樹脂を使用してはならない。ただし、フタル酸ジ(2−エチルヘキシル)が溶出又は浸出して食品に混和するおそれのない場合はこの限りでない。」 なお、告示施行までの間、適当な猶予期間を設けることが適当である。 |
| 3. | その他 化学製品のみならず、有機溶媒等にもDEHPの汚染(コンタミネーション)が知られていることから、器具・容器包装の材質試験や溶出試験の実施に際しては、その点を考慮すべきである。 |
IV.フタル酸エステル類を含有するポリ塩化ビニル製おもちやについて
| 1. | 厚生科学研究の概要 食品由来の化学物質の暴露量は、食品中濃度の測定により評価が可能であるが、おもちや由来の化学物質の暴露量は、乳幼児を対象とした暴露試験の実施が困難であることから、直接的に測定することが出来ない。 このため、我が国の乳幼児のMouthing(ものを口に入れる)行動の実態把握、in vitroでのフタル酸エステル類の溶出、成人ボランティアによる口腔内でのフタル酸エステル類の溶出、市販玩具中の化学物質等について、厚生科学研究による調査・研究が行われた。 |
| 1) | 乳幼児のMouthing行動 乳幼児が、おもちやをどのくらいの時間、Mouthingするのかを把握するための調査研究が行われた。乳幼児のMouthing行動は育児環境により異なる可能性があることから、我が国における3〜12カ月児の Mouthing 行動の実態を把握するため、平成10年度には、ビデオ記録による調査と親の観察記録による調査が行われた。3〜12カ月児50名を対象として、母親による15分ずつ10回の家庭での観察記録から、1日当たりのMouthing時間は平均180分±87分、活動時間の31.5%、中央値161分、最小28分、最大389分と推計された。この値は数名のビデオ記録からも妥当な数値と考えられたが、オランダにおける3〜36ヵ月児42名を対象とした報告(1日当たりのMouthing時間:平均57.6分±62.0分)よりも顕著に長い時間Mouthingするという結果であった。 6〜10カ月児のMouthing時間が長いことが判明したため、平成11年度には、より正確にMouthing行動を把握するため、6〜10カ月児25名を対象にMouthing行動をビデオ記録して解析が行われた。その結果、1日の活動時間は平均615分±100.5分、1日当たりのMouthingの推計時間は平均105.3分±72.1分、活動時間の17.1%で、前年度の平均活動時間の31.5%よりは短時間であるが、オランダの報告よりは長い値であった。 おしゃぶりを除いた1日のMouthing時間の分布は、平均73.9分、最小11.4分、最大136.5分と極めて幅のある分布であった。 また、この調査において、対象物によりMouthing行動が相違すること、具体的にはおしゃぶりと他のものではMouthing行動が異なることが判明した。すなわち、おしゃぶりは多くの場合はぐずっているときなどに親が口にくわえさせ、親が口から外すまで子供はおしゃぶりを加えたままで、手は別の動作を並行して行っている。その一方で、ほかの対象物に対しては子供が自発的に手で持って口に入れ、手で持ったままなめたりかんだりしたり口から出したりしている。周囲で音や動きの変化があると、それに気をとられてMouthing行動が中断されるが、おしゃぶり使用時は周囲の変動に対しておしゃぶりを加えたまま視線を動かすのみのことが多く、Mouthing の中断に至ることは少なかった。「おしゃぶり」を使用する乳幼児が「おしゃぶり」を使用していないときに、他のものを口に入れる傾向があるわけでなく、「おしゃぶり」をしゃぶっている状態は他のMouthing状態とは異なっていた。 |
| 2) | おもちや中のフタル酸エステル類 平成10年度の厚生科学研究の調査において、おもちゃ中のフタル酸エステル(4種)とアジピン酸ジ(2−エチルヘキシル)の分析を行ったところ、ポリ塩化ビニル以外の材質部分からはフタル酸エステル等は検出されなかった。ポリ塩化ビニル製8部品からDINPが18.2%〜58.3%検出され、検出例としては、歯がため中35.9%、おしゃぶり中58.3%等があり、DEHPは17部品から0.2%〜39.1%検出され、検出例としては、ボール中35.5〜39.1%等があった。フタル酸ジブチルは14部品から0.3%〜22.3%(内13部品からは他のフタル酸エステルも検出)、フタル酸ジ(n−ノニル)は1部品から3.4%、アジピン酸ジ(2−エチルヘキシル)は7部品から0.6%〜1.5%検出された。 ポリ塩化ビニル製おもちゃのフタル酸エステル類の含有量については、平成10年10月に試験のため収集したポリ塩化ビニル製玩具中のDEHP及びDINPの検出率は、DEHP26%(15/58)、DINP83%(48/58)であり、DEHPの平均含有量は21%、含量の幅は3.3%〜38%、DINPの平均含有量は31%、含量の幅は1.5%〜59%であり、平成13年1月の調査では、DEHPの検出率は32%(9/28)、平均含有量は21%、含量の幅は0.5%〜39%であり、DINPの検出率は54%(15/28)、平均含有量は24%、含量の幅は0.6%〜40%であった。平成13年1月の調査では、フタル酸ジブチルが4検体から0.01%〜0.07%、アジピン酸ジ(2−エチルヘキシル)が6検体から0.02%〜2.4%、アジピン酸イソノニルが7検体から1.87%〜20.5%、クエン酸アセチルトリブチルが9検体から2.8〜24.3%、トリメリット酸トリ−(2−エチルヘキシル)が2検体から3.5〜32.5%、2,2,4−トリメチル−1,3−ペンタンジオールジイソブチレートが8検体から0.1〜3.7%検出された。 |
| 3) | おもちやからのフタル酸エステル類の溶出 成人ボランティアによるDINPを含むポリ塩化ビニルの試験片のChewing(試験片を口腔内に入れ、軽く噛んだり、動かしたりすること)による口腔内溶出試験の結果の概要は以下のとおり。 DINP39%を含む試験片をChewingした場合、ある機関の平成11年の調査では、平均109μg/10cm2/h、最小13.7μg/10cm2/h、最大240.4μg/10cm2/hの溶出であり、別の機関の平成10及び11年の調査では、平均68.5μg/10cm2/h、最小13.2μg/10cm2/h、最大137.3μg/10cm2/hであった。 DINP58%を含む試験片をChewingした場合、平成10年度の結果は、平均166.4μg/10cm2/h、最小40.6μg/10cm2/h、最大267.3μg/10cm2/hの溶出であったが、平成11年度の結果は、平均63.5μg/10cm2/h、最小28.4μg/10cm2/h、最大99.3μg/10cm2/hの溶出であった。 成人ボランティアによるDINPを含むポリ塩化ビニルの試験片のChewingによる口腔内溶出試験の結果、口腔内での溶出には、個人間でかなりのばらつきがあり、また、多量に溶出する場合があることが判明した。一方、同一人では試験間のばらつきは少ないデータも得られた。 平成11年度の厚生科学研究の調査結果は、平成10年度の調査結果よりも溶出が少ない結果であり、その原因としては、平成10年度の方が、注意深くChewingし、DINPが唾液へ良好に溶出するように行ったことが考えられるが、個人間でばらつきが大きい理由としては、唾液のpHは、6.9〜7.4とほぼ中性であって、DINPの溶出とは直接関係していないと考えられ、単位時間当たりの唾液の分泌量とDINPの総溶出量の比較をしても、唾液分泌量とDINPの溶出量に関連性は見られず、どういう状況でよく溶出するのか、その原因は不明である。 実際の使用状態を想定して歯がため全形を Chewingしたところ、試験片の約2倍高い溶出を示したという結果(歯がため全形(推定表面積10〜20cm2)では0.0429〜0.873μg/cm2/min、直径2cmの円形ディスク(表面積8.48cm2)では0.0230〜0.402μg/cm2/min)もあり、こういった事象はオランダの研究においても認められており、Chewingの方法や強さ等によって溶出するDINP量に差が生じる可能性が示唆されているが、いずれの実験においても被験者間には大きな違いがあり、溶出量にはかなりのばらつきがある。 一方、in vitro での溶出試験法の検討においては、ばらつきは約19〜30%であり、かなりばらつきの少ないデータが出ている。 |
| 4) | フタル酸エステル暴露量の検討 平成12年度の厚生科学研究において、口腔内溶出試験結果と乳幼児のMouthing時間のデータから暴露の算出がなされた。 幾つかの仮定を置いて、おしゃぶりを除いたMouthing時間から複数の方法で試算されたDINPの一日推定摂取量の平均値は14.3〜14.8μg/kg/dayであった。また、一日摂取量の95パーセンタイル値を計算したところ、35.7μg/kg/dayであり、DEHPのTDIの下限値である40μg/kg/day以上となる可能性は3.1%と推定された。 |
| 2. | おもちや由来のDEHPあるいはDINP暴露に関する推定 平成12年度までの厚生科学研究の結果は上記のとおりであるが、厚生労働省は、平成11年度の厚生科学研究の分担研究者から平成11年度の厚生科学研究と同じ手法で平成12年度に収集されたMouthingデータ15例を入手したので、同一施設のデータとして、平成11年度のMouthingデータにそれらのデータを加え、Chewingデータについては同一施設で最も参加数の多いデータを用いて、おもちや由来のDEHPあるいはDINP暴露に関する推定として、再度以下に示す検討を行った。(注) 再検討においては、データ数が、Mouthingデータ40例、Chewingデータ25例と限られていたが、一方で、長時間Mouthingする例やChewingにより多量に溶出する例があることに注目し、探索的な検討を実施した。
なお、暴露の推定に当たっての前提は以下のとおりとした。 |
| (1) | 乳幼児のMouthing行動 乳幼児のMouthing行動の実態調査について、オランダでは3〜36ヵ月齢を対象に調査が行われたが、日本での予備試験の結果6〜10ヵ月齢のMouthing時間が長いことが判明したことから、この月齢児をビデオ等を用いた詳細調査の対象とした。 平成11年度25例及び平成12年度15例の詳細調査のデータを整理した結果は表3のとおり。 |
| (2) | Chewingによるポリ塩化ビニル製品からのDINPの溶出 ポリ塩化ビニル製品からのChewingによる溶出試験成績中、最も参加数が多い試験(平成11年度実施:成人25例がDINP含量39%の8.48cm2の試験片を15分間Chewing)の成績を試算に用いた。 なお、オランダ、米国における小児の暴露量の推定においては、口腔中に含むおもちゃの表面積を10cm2としており、10cm2 のものを1時間Chewingした場合に換算してデ−タを整理した結果は表4のとおり。 |
| (3) | その他
|
| 1) | おしゃぶり等について (社)日本玩具協会によると、玩具のうち、日本で製造した「歯固め」、「おしゃぶり」には、ポリ塩化ビニルは用いられていないとのことであり、ポリ塩化ビニル製の「おしゃぶり」等が市場に多量存在しているというような状況ではないと考えられるが、「おしゃぶり」等は元来がMouthingされるように作られたものであり、長時間Mouthingされることが想定されるものである。 今回の検討においても、40例中11例が「おしゃぶり」をMouthingしており、Mouthing時間は平均73.9分、最小0.6分、最大314.1分で、30分以上のMouthing例は5例(314.1、163.9、132.7、90.4及び46.7分)あった。 成人のChewingによる溶出試験での平均値109.3μg/10cm2/hrからは183.8分以上のMouthingにより、及び溶出試験での最大値241.0μg/10cm2/hrからは83.3分以上のMouthingにより、DEHPのTDIの下限値(40μg/kg/day)以上の暴露が想定される。 また、溶出試験での最大値241.0μg/10cm2/hrから312.5分以上のMouthingにより、DINPのTDI(150μg/kg/day)以上の暴露が想定される。 |
| 2) | 玩具(おしゃぶりを除く)について 玩具(おしゃぶりを除く)、合成樹脂、指及びその他のMouthing時間の平均値でみると玩具のMouthing時間が25.8分と最も長い。 玩具のMouthing時間の最長例は69.2分であり、この値と成人のChewing試験でのDINPの溶出の最大値241.0μg/10cm2/hrから算出される暴露量は33.2μg/kg/day。 |
| 3) | 特定の仮定をおいた場合について 総Mouthing時間の最大値は351.8分、おしゃぶりのMouthing時間を除外した総Mouthing時間の最大値は136.5分であり、かなり長時間Mouthingする場合があること、また、成人のChewingによるポリ塩化ビニル製試験片からのDINPの唾液への溶出試験結果から、多量に溶出する場合があることが判明した。 このため、Mouthing行動による暴露という観点も含め、Chewingによる溶出が大きく、かつ、長時間Mouthingした場合の暴露量の推定試算を行った。 |
(1)検討その1(表6(PDF:45KB)参照)
| ア) | DEHPあるいはDINPの暴露の検討に際し、Mouthing時間の長い上位25%群を長時間群とすることとし、具体的には40例の中からMouthing時間の長い10例を長時間群とした。 なお、Mouthing時間については、「玩具のMouthing時間と合成樹脂のMouthing時間の合計」、「おしゃぶりのMouthing時間を除外した総Mouthing時間」及び「総Mouthing時間」の3通りについて試算した。
|
| イ) | 唾液中への溶出量のデータについても同様に、溶出量が多い上位約25%群を高溶出群とすることとし、具体的には25例の中から溶出量の高い6例(上位24%)を高溶出群とした。高溶出群の溶出の平均値は184.4μg/10cm2/hr。 |
| ウ) | 長時間群と高溶出群の条件が重なった場合を想定して暴露量を試算すると、
|
(2)
| ア) | 今回用いることができるMouthingのデータ中、「玩具のMouthing時間と合成樹脂のMouthing時間の合計」、「おしゃぶりのMouthing時間を除外した総Mouthing時間」及び「総Mouthing時間」の個々のデータ(n=40)と「唾液中への溶出量のデータ」の個々のデータ(n=25)との積(n=1,000)を求め試算すると、
|
| イ) | Chewingによる最大溶出例:241.0μg/10cm2/hrを除外した上で、同様に個々のデータの積(n=960)を求め、試算すると、
|
| (3) | 検討その3 今回用いることができるMouthingのデータ中、「総Mouthing時間」、「おしゃぶりのMouthing時間を除外した総Mouthing時間」あるいは「玩具のMouthing時間と合成樹脂のMouthing時間の合計」の個々のデータ(n=40)と「唾液中への溶出量のデータ」の個々のデータ(n=25)からそれぞれ無作為に値を抽出し、その積を10,000回求めて試算すると、
|
| (4) | その他:留意点 上記の試算等は、暴露を過大に見積もるいくつかの条件(仮定)を置いたものであるが、その一方で、以下のような点に留意する必要がある。
|
3.おもちやの暴露評価のまとめ
| ・ | Mouthing時間が長くなる傾向のある、元来しゃぶることを目的としているおしゃぶりといった玩具がDEHPを含有するポリ塩化ビニル製であった場合には、DEHPのTDIの下限値を超える暴露が生じる可能性がある。 |
| ・ | DINPについては、おしゃぶりに使用されたとしても、TDIを大きく超える暴露はまず生じないものと考えられるが、極端な条件を想定するとTDIを超える暴露が生じる可能性は否定しきれない。 |
| ・ | 通常は玩具以外のものもしゃぶる行動をとる乳幼児が、玩具ばかりをしゃぶると仮定した場合、その玩具がDEHPを含有するポリ塩化ビニル製であれば、暴露量はTDI値の下限値を超える暴露が生じる可能性がある。 |
| 4. | 規格基準(案)について フタル酸エステル類を含有するポリ塩化ビニルに関し、おもちやの規格基準を改正することについては、食品衛生法第29条第1項において準用する第7条第1項の規定に基づき、以下の趣旨を規定することが適当と結論する。
「合成樹脂製のもので、乳幼児が口に接触することをその本質とするおもちやには、フタル酸ジ(2−エチルヘキシル)あるいはフタル酸ジイソノニルを含有するポリ塩化ビニルを主成分とする合成樹脂を使用してはならない。 なお、告示施行までの間、適当な猶予期間を設けることが適当である。 |
| 5. | その他 化学製品のみならず、有機溶媒等にもDEHPの汚染(コンタミネーション)が知られていることから、おもちやの材質試験の実施に際しては、その点を考慮すべきである。 |
V.おわりに
他の可塑剤等の化学物質に関する調査・検討については、今後の課題として取り組むことが必要である。
厚生労働省は、前回の合同部会後に、規格基準案について、パブリックコメントの募集、WTO通報による海外からの意見聴取等所要の手続きを講じたところ、パブリックコメントとして137通の意見が寄せられ、WTO通報関係として10通の意見が寄せられ、その他コメントも寄せられたとのことである。
本合同部会においては、合同部会報告書の取りまとめに当たって、パブリックコメントで寄せられた意見等も考慮した。
| 照会先 : | 厚生労働省医薬局食品保健部基準課 坂本・平川 | |
| 電話 | 03−3595−2341 内線2483,2487 | |
| ファックス | 03−3501−4868 | |