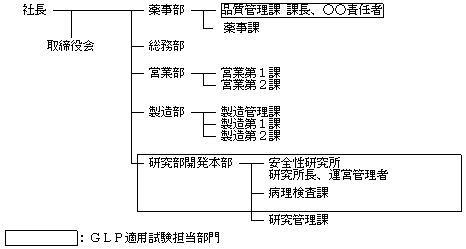
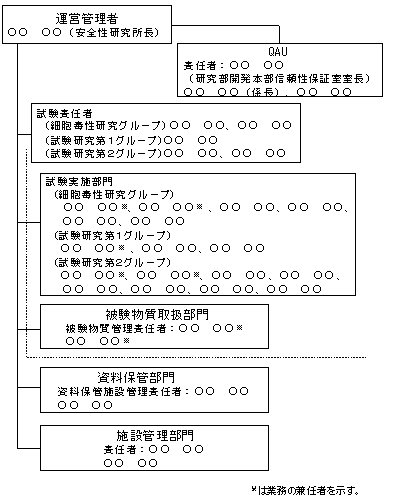
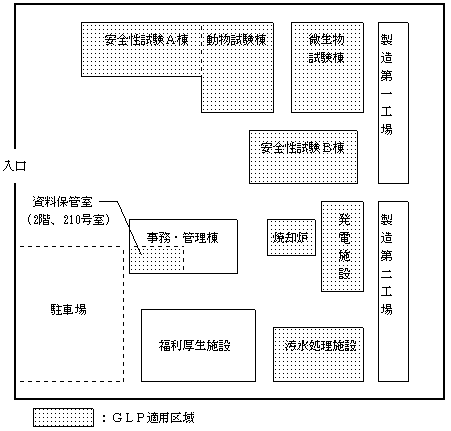
現行、GLP適合確認(調査)を受けるに際し当局に提出する資料は、ここに記されたものに限りません。また、ここに記された資料のすべてを提出する必要があるとは限りません。
ここに記された資料以外の資料の作成要領については、引き続き検討する予定です。
| ・ |
試験施設に関する基準適合確認申請書の添付書類又は査察(調査)前に提出していただく資料の作成要領です。事前に目をとおしますので、指定された日までに指定された部数を提出してください。 |
| ・ |
事前ヒアリング、査察(調査)初日の施設の概要説明、調査対象施設の巡察、運営管理者等へのヒアリング等に使用します。 |
| ・ |
用紙のサイズはA4判縦型左とじとしてください。 |
| ・ |
施設の配置図等、A4判縦型では見づらくなるものについても、なるべくA4判で作成してください。
(ただし、査察(調査)時にA4判で見づらいと判断した場合、別途、A3判横型の折り込みにして提出いただく場合があります。) |
| ・ |
記載内容は原則として資料作成時のものとしてください。 |
| ・ |
添付する写真はコピー等で構いませんが、写真と同程度に明瞭なものとしてください。 |
| ・ |
目次を添付し、全ページにわたって通しページをつけてください。なお、索引等の仕切は不要です。
(※現行、既に様式が一連で定められている場合があり、それに従って作成する場合は、目次の添付は不要です。) |
| ・ |
冗長にならない程度の詳細さで、かつ要点をまとめて記載してください。 |