| 1) | 赤血球輸血 基本的な適応基準 造血幹細胞移植後の造血回復は前処置の強度によって異なる。造血機能を高度に低下させる前処置を用いる場合は,通常,造血が回復するまでに移植後2〜3週間を要する。この間,ヘモグロビン(Hb)の低下を認めるために赤血球輸血が必要になる。この場合,通常の慢性貧血と同様にHb値の目安として7g/dLを維持するように,赤血球濃厚液(RCC)を輸血する。発熱,うっ血性心不全,あるいは代謝の亢進がない場合は安静にしていれば,それより低いHb値にも耐えられるので,臨床症状や合併症を考慮しRCの適応を決定する。 白血球除去赤血球濃厚液 輸血用血液中の同種白血球により,発熱反応,同種抗体産生,サイトメガロウイルス(cytomegalovirus;CMV)感染などの有害事象が生じるので,それらの予防のために原則的に白血球除去赤血球を用いる。特に患者が抗CMV抗体陰性の場合でも,白血球除去輸血により抗CMV抗体陰性の献血者からの輸血とほぼ同等に輸血によるCMV感染を予防できる。 最近の抗体陰性血と白血球除去血の輸血による感染の比較検討では,感染予防率はいずれの場合も90%以上であるが,抗体陰性血の方が高いことが報告されている1)。 |
| 2) | 血小板輸血 基本的な適応基準 出血予防 造血機能を高度に低下させる前処置を用いた造血幹細胞移植後は,患者血小板数が減少するので,出血予防のために血小板濃厚液(PC)の輸血が必要になる。血小板濃厚液の適応は血小板数と臨床症状を参考にする。通常,出血予防のためには血小板数が1〜2万/μL以下の場合が血小板濃厚液の適応になる。ただし,感染症,発熱,播種性血管内凝固などの合併症がある場合は出血傾向が増強するので注意する。血小板数を測定し,その結果で当日の血小板濃厚液の適応を決定し輸血することが望まれる。ただし,連日の採血による患者への負担を考慮し,また,定型的な造血幹細胞移植では血小板が減少する期間を予測できるので,週単位での血小板濃厚液輸血を計画できる場合が多い。この場合は,1週間に2〜3回の頻度で1回の輸血量としては経験的に10単位が使用されているが,さらに少量の投与でもよい可能性がある。 出血治療 出血症状が皮膚の点状出血や歯肉出血など,軽度の場合は,出血予防に準じて血小板濃厚液を輸血する。消化管出血,肺出血,頭蓋内出血,出血性膀胱炎などにより重篤な出血症状がある場合は血小板数が5万/μL以下の場合が血小板濃厚液の適応になる。 HLA適合血小板濃厚液の適応 抗HLA抗体による血小板輸血不応状態がある場合は,一般的な血小板輸血の適応に準じる。 白血球除去血小板濃厚液の適応 原則的に赤血球輸血と同様に白血球除去血小板濃厚液を用いる。ただし,日本赤十字社から供給される血小板濃厚液を用いる場合は白血球数が1バッグあたり1×106以下であるように調整されてあるので,使用時には白血球除去フィルターを用いる必要はない。 |
| 3) | 新鮮凍結血漿 通常の新鮮凍結血漿の適応と同様である。複合的な血液凝固因子の低下,及び血栓性血小板減少性紫斑病を合併した場合に適応になる。 |
| 4) | アルブミン 通常のアルブミン製剤の適応と同様である。 |
| 5) | 免疫グロブリン 通常の免疫グロブリンの適応と同様,抗生物質や抗ウイルス剤の治療を行っても効果が乏しい感染症に対し適応になり,抗生物質と併用し用いる。 |
| 6) | 輸血用血液製剤の血液型の選択 同種造血幹細胞移植において,患者血液型と造血幹細胞提供者(ドナー)の血液型が同じ場合と異なる場合がある。これは1.血液型一致(match),2.主不適合(major mismatch),3.副不適合(minor mismatch),4.主副不適合(major and minor mismatch),に分類される。1は患者血液型とドナーの血液型が同一である場合,2は患者にドナーの血液型抗原に対する抗体がある場合,3はドナーに患者の血液型抗原に対する抗体がある場合,4は患者にドナーの血液型抗原に対する抗体があり,かつドナーに患者の血液型抗原に対する抗体がある場合である。 移植後,患者の血液型は造血の回復に伴いドナー血液型に変化していくので,特にABO血液型で患者とドナーで異なる場合には,輸血用血液製剤の適切な血液型を選択する必要がある。以下に血液型選択のための基準を示す。 |
| 1. | 血液型一致 赤血球,血小板,血漿ともに原則的に患者血液型と同型の血液型を選択する。 |
| 2. | 主不適合(major mismatch) 患者の抗体によってドナー由来の赤血球造血が遅延する危険性があるので,これを予防するために血小板,血漿はドナー血液型抗原に対する抗体がない血液型を選択する。赤血球は患者の抗体に反応しない血液型を選択する。 |
| 3. | 副不適合(minor mismatch) ドナーリンパ球が移植後,患者血液型に対する抗体を産生し,患者赤血球と反応する可能性があるので,赤血球はドナーの抗体と反応しない血液型を選択する。血小板と血漿は患者赤血球と反応する抗体がない血液型を選択する。 |
| 4. | 主副不適合(major and minor mismatch) ABO血液型主副不適合の場合は,血小板,血漿がAB型,赤血球はO型になる。さらに,移植後ドナーの血液型に対する抗体が検出できなくなればドナーの血液型の赤血球濃厚液を,患者の血液型の赤血球が検出できなくなればドナーの血液型の血小板濃厚液,新鮮凍結血漿を輸血する。 Rho(D)抗原が患者とドナーで異なる場合には,抗Rho(D)抗体の有無によって異なるが,患者がRho(D)抗原陰性の場合には抗Rho(D)抗体があるものとして,あるいは産生される可能性があるものとして考慮する。また,ドナーがRho(D)抗原陰性の場合にも抗Rho(D)抗体があるものとして考慮する。 患者とドナーでABO血液型あるいはRho(D)抗原が異なる場合の推奨される輸血療法を表1にまとめて示す。 移植後,造血がドナー型に変化した後に,再発や生着不全などで輸血が必要になる場合は,ドナー型の輸血療法を行う。 移植前後から造血回復までの輸血における製剤別の選択すべき血液型を示す。 |
| 表1 | 血液型不適合造血幹細胞移植直後の輸血療法 |
| 血液型 | 不適合 | 血液型 | 輸血 | ||
| ドナー | 患者 | 赤血球 | 血小板,血漿 | ||
| ABO血液型 | 主不適合 | A | O | O | A(もしなければABも可) |
| B | O | O | B(もしなければABも可) | ||
| AB | O | O | AB | ||
| AB | A | A(もしなければOも可) | AB | ||
| AB | B | B(もしなければOも可) | AB | ||
| 副不適合 | O | A | O | A(もしなければABも可) | |
| O | B | O | B(もしなければABも可) | ||
| O | AB | O | AB | ||
| A | AB | A(もしなければOも可) | AB | ||
| B | AB | B(もしなければOも可) | AB | ||
| 主副不適合 | A | B | O | AB | |
| B | A | O | AB | ||
| Rho(D)抗原 | 主不適合 | D+ | D− | D− | D+ |
| 副不適合 | D− | D+ | D− | D+ | |
参考2 一般外科手術
術前の貧血,術中及び術後出血量や患者の病態に応じて,SBOEなどに従い術前輸血準備を行う。術前自己血貯血が可能な患者では,術前貯血を行うことが推奨される。しかし,自己血の過剰な貯血は患者のみならず,輸血部の負担となり,自己血の廃棄にもつながる。予想出血量に応じた貯血を行う必要がある。
重篤な心肺疾患や中枢神経系疾患がない患者において,輸血を開始するHb値(輸血トリガー値)がHb7〜8g/dLとする。循環血液量の20%以内の出血量でありHb値がトリガー値以上に保たれている場合には,乳酸リンゲル液や酢酸リンゲル液,生理食塩液などの細胞外液系輸液剤により循環血液量を保つようにする。細胞外液系輸液剤は出血量の3〜4倍を血圧,心拍数などのバイタルサインや,尿量,中心静脈圧などを参考に投与する。出血量が循環血液量の10%あるいは500mLを超えるような場合には,ヒドロキシエチルデンプンなどの人工膠質液を投与してもよい。ただし,ヒドロキシエチルデンプンは大量投与により血小板凝集抑制を起こす可能性があるので,投与量は20mL/kgあるいは1000mL以内に留める。循環血液量の50%以上の多量の出血が疑われる場合や血清アルブミン濃度が3.0g/dL未満の場合には,等張アルブミン製剤の併用を考慮する。
赤血球輸血を行う前に採血を行い,Hb値やHt値などを測定するとともに,輸血後はその効果を確認するために再び採血を行いHb値やHt値の上昇を確認する必要がある。
参考3 心臓血管外科手術
輸血量における施設間差
心臓血管外科手術における輸血使用量は施設間差が大きい。これは外科手技の差によるもののほか,輸血に対する考え方の差によるところが大きい2)。それは,少ない輸血量でも,患者の予後に影響することなく心臓血管外科手術が行えている施設があることから示唆される。人工心肺を用いないoff-pump 冠動脈バイパス術においては,一般に出血量も少なく,術中に自己血回収を行う場合が多いため,輸血量も少ない。しかし,人工心肺を用いたり,超低体温循環停止を要するような大血管手術における輸血量となると施設間差が大きくなる。これは,凝固因子不足や血小板数不足,血小板機能異常などによる出血傾向に対して治療が行われるのではなく,単なる血小板数の正常以下への減少,人工心肺を使用することによる血小板機能や凝固因子減少が起こるといった検査値,あるいは理論的問題に対して輸血が行われる場合がしばしばあるからであろうと考えられる。そのために,外科的な出血の処置に先立って,凝固因子や血小板補充が行われている場合もしばしばある。
人工心肺使用時には血液希釈が起こる。人工心肺中のHb値についての上限及び下限は明らかではない。人工心肺離脱後はHb値が7〜8g/dL以上(<10g/dL)になるようにすることが多い。
18〜26℃の低体温により血小板数は減少する。主として門脈系に血小板が捕捉sequestrationされることによる。80%以上の血小板は復温とともに循環血液中に戻る3)。したがって,低体温時の血小板数減少の解釈には注意を要する。また,低体温によりトロンボキサン合成酵素阻害によるトロンボキサンA2産生低下が起こり,血小板凝集能は大きく低下するほか4,5),血管内皮細胞障害も起こる。復温により血小板凝集能は回復するが,完全な回復には時間がかかる。最近よく用いられる常温人工心肺では血小板凝集能低下はない6)。
人工心肺を用いた手術において,検査所見に基づいた輸血を行うことで,経験的な方法に比べ出血量を増加させることなく,新鮮凍結血漿や血小板濃厚液などの輸血量を減少させることが出来たと報告されている7)。
止血のためには血小板数が5〜10万/μL,凝固因子が正常の20〜40%あれば十分であることをよく認識する必要がある。血小板輸血や新鮮凍結血漿を投与する場合,正常あるいはそれを上回るような補充は不要であることをよく認識すべきである。
術前の薬物療法が有効な貧血の是正
心臓手術において,術前の貧血は同種血輸血を必要とする重要な因子である。腎不全や,鉄欠乏性貧血もしばしばみられる8)。また,術前に冠動脈造影を受けた患者では貧血になりやすいので注意が必要である。また,鉄欠乏性貧血も存在するので,鉄剤などによる治療が必要なことがある。
血小板濃厚液や新鮮凍結血漿の予防的投与の否定
人工心肺症例における血小板濃厚液や新鮮凍結血漿の予防的投与は勧められない。
出血量に関係する因子
乳児心臓血管外科手術においては,低体温人工心肺中の核心温度が出血量と関係すると報告されている。1歳以上の小児心臓血管外科手術では,再手術,術前からの心不全,長時間にわたる人工心肺時間が出血量と同種血輸血量の多さと関係している9)。
同種血輸血を減少させるのに有用な薬物療法
アプロチニンやトラネキサム酸などの薬物を用いることにより,心臓手術における同種血輸血を減少さえることができる10)。アプロチニン投与により同種血輸血が減少するほか,出血に対する再開胸率が減少すると報告されている11)。アプロチニンの有用性は,人工心肺を用いる手術においても示唆されている12)。アプロチニンは冠動脈バイパス術の再手術例における出血量を減少させると報告されている13,14)。しかし,超低体温循環停止法を用いた場合には,アプロチニンによる出血量減少効果は期待できない15)。ε-アミノカプロン酸も心臓手術における出血量を減少させる16)。
同種血輸血量の減少には,術中の凝固検査のチェックが有用である。複雑な心臓手術において,トロンボエラストグラム(TEG)が同種血輸血を減少させるのに有用であると報告されている17)。
参考4 肺外科手術
肺切除術の多くは胸腔鏡下に行われようになった。肺外科手術においては一般に出血量や体液シフトも比較的少ない。肺切除術や肺全摘術においても,Hb値は8.5〜10g/dLでよいと考えられる18)。
参考5 食道手術
食道全摘術及び胃腸管を用いた食道再建術では,しばしば出血量も多くなるほか,体液のサードスペースへの移行など大きな体液シフトが起こる。輸血準備量は,患者の病態,体格,術前Hb値,術中および術後出血量などを考慮して決定する。
術前の栄養状態が良好で,貧血もない患者では自己血貯血も考慮する。同種血輸血を用いず自己血輸血のみで管理した症例では,癌の再発率が低下し,再発後の生存期間も長くなるという後ろ向き研究による報告がある19)。自己血輸血を行った方が免疫機能が保たれ,術後感染も低いという報告もある20,21)。輸血が必要であった患者では,輸血をしなかった患者に比べ予後が不良であったという報告もある22)。
食道癌患者はしばしば高齢であるが,全身状態が良好な患者における輸血を開始するHb値(輸血トリガー値)は,Hb値7〜8g/dLとする。冠動脈疾患などの心疾患があり循環予備力が減少した患者や,慢性閉塞性肺疾患などの肺疾患により術後の血液酸素化悪化が予想される患者,骨髄における血球産生能力が低下している患者では,輸血トリガー値はより高いものとするのが妥当である。ただし,10g/dLより高く設定する必要はない。
参考6 整形外科手術
膝関節全置換術や股関節全置換術において,等容積性の希釈式自己血輸血,術中回収式自己血輸血,さらに体温の積極的維持により同種血輸血量を減少させることができると示唆されている23)。過剰輸血に注意が必要である24)。
膝関節全置換術においては,術中はターニケットを使用するために,術中出血は比較的少ないが術後出血量も多い。術中に等容積性の希釈式自己血輸血により自己血を採取し,術後に返血したり25),術後ドレーン血を返血するという自己血輸血によっても同種血輸血量を減少させることができる26)。
脊椎外科手術においてはしばしば出血量が多くなり,赤血球濃厚液のほか,血小板濃厚液や新鮮凍結血漿などが必要になる場合がある。適宜,プロトロンビン時間,INR,部分トロンボプラスチン時間の測定を行い,使用指針に従って実施する27)。
低体温による血小板機能障害や凝固系抑制が起こるが,軽度低体温でも股関節全置換術では出血量が増加すると報告されている28)。外科的止血に加え,低体温のような出血量を増加させる要因についても注意が必要である。
参考7 脳神経外科手術
脳神経外科手術は,脳腫瘍手術,脳動脈瘤クリッピングや頸動脈内膜切除術などの血管手術,脳挫傷や硬膜外血腫,脳外傷手術など多岐にわたる。また,整形外科との境界領域であるが,脊髄手術も含まれる。
脳神経外科手術の基本は,頭蓋内病変の治療と,それらの病変による頭蓋内圧上昇などにより起こる二次的な損傷を防ぐことにある。したがって,脳神経外科手術においては,まず循環血液量を正常に保ち平均血圧及び脳潅流圧を十分に保つことが重要である。しかし,脳神経外科手術においては,循環血液量評価がしばしば困難である。脳脊髄液や術野の洗浄液のために,吸引量やガーゼ重量を測定しても,しばしば出血量の算定が難しい。また,脳浮腫の予防や治療,脳脊髄液産生量減少のためにマンニトールやフロセミドのような利尿薬を用いるために,尿量が循環血液量を反映しない。また,脳浮腫を抑制するために,血清浸透圧減少を防ぐことが重要である。正常血清浸透圧は295m Osm/Lであるのに対し,乳酸リンゲル液や酢酸リンゲル液などはやや低張液である。生理食塩水は308mOsm/Lと高張であるが,大量投与により高塩素性代謝性アシドーシスを起こすので注意が必要である。
脳浮腫を防ぐために膠質浸透圧が重要であるとしばしば信じられているが,それを示す科学的証拠は乏しい。ほとんどの開頭手術では膠質液の投与は不要である。しかし,脳外傷や脳動脈瘤破裂,脳血管損傷などにより出血量が多くなった場合(たとえば循環血液量の50%以上)には,ヒドロキシエチルデンプンなどの人工膠質液や,アルブミン溶液投与が必要なことがある。ただし,ヒドロキシエチルデンプン大量投与では凝固因子希釈に加え,血小板凝集抑制,凝固第VIII因子複合体への作用により出血傾向を起こす可能性がある。
参考8 泌尿器科手術
根治的前立腺切除術においては,術前の貯血式自己血輸血あるいは,術中の等容積性の希釈式自己血輸血により同種血輸血の投与量を減少させることができる29)。しかし,メタ分析では,希釈式自己血輸血による同種血輸血の減少については,疑問がもたれている30)。
根治的前立腺切除術において,術中の心筋虚血発作は,術後頻脈やHt値が28%未満では多かったという報告がある31)。
参考9 大量出血や急速出血に対する対処
大量出血は循環血液量よりも24時間以内における出血量が多い場合をいう。しかし,外科手術の場合,特に外傷に対する手術では,数時間という短時間の間に循環血液量を超えるような出血や,急速に循環血液量の1/3〜1/2を超えるような出血が起こる場合がある。
輸血準備の時間的余裕がある場合には,交差適合試験と放射線照射を行った赤血球濃厚液を投与する。また,大量輸血時の適合血の選択については,「輸血療法の実施に関する指針」のVの3を参照。
急速大量輸血では代謝性アシドーシスや高カリウム血症が起こる可能性がある。高カリウム血症は,輸血速度が1.2mL/kg/minを超えた場合に起こる32)。現在,輸血ポンプや加圧バッグを備えた血液加温装置などの技術的進歩により高速度の輸血が可能になり,心停止を招くような高度の高カリウム血症が起こる可能性がある34,34)。循環不全などによる代謝性アシドーシスも高カリウム血症を増悪させる要因となる。
大量出血患者では低体温になりやすいが,特に輸液剤や輸血用血液製剤の加温が不十分な場合にはさらに低体温となりやすい。低体温は術後のシバリングとそれによる酸素消費量の重大な増加を起こすだけでなく,感染症の増加などを起こすことが示唆されている。急速・大量輸血を行う場合には,対流式輸液・輸血加温器など効率のよい加温器を使用する必要がある。その他,温風対流式加温ブランケットなどの使用により低体温を防ぐよう努力するべきである。
MAP加赤血球濃厚液や新鮮凍結血漿にはクエン酸が含まれているため,急速輸血により一時的に低カルシウム血症が起こる可能性がある35)。しかし,低カルシウム血症は一時的なものであり,臨床的に重大な影響を持つことは少ない。大量輸血時に血圧低下,心収縮性減少がある場合や,イオン化カルシウム濃度測定により低カルシム血症が明らかな場合には,塩化カルシウムやグルコン酸カルシウムなどによりカルシウム補充を行う。
循環血液量以上の出血が起きた場合,新鮮凍結血漿により凝固因子を補ったり,血小板輸血により血小板を補う必要性は増加する36)。循環血液量以上の出血が起きても,新鮮凍結血漿を出血傾向予防のために投与することの有用性は否定されている37)。血小板輸血にあたっては,血小板回収率から考えてABO適合血小板濃厚液を用いることが望ましい。ABO不適合血小板濃厚液も使用は可能であるが,血小板回収率はABO適合血小板濃厚液に比べ低くなることに注意が必要である。
これは,大量出血に伴う出血傾向が,凝固障害によるものだけでなく,重篤な低血圧38),末梢循環不全による代謝性アシドーシス,低体温といったさまざまな因子に関係しているので注意深く観察して対処すべきである39)。
参考10 小児の外科手術
循環予備能が小さい小児患者において,成人の出血量による輸血開始基準を当てはめることは問題になる場合があり,出血が予想される緊急手術術前の貧血(8g/dL未満)も赤血球輸血の対象として考慮する。また,外傷・術中出血による循環血液量の15〜20%の喪失の場合も赤血球輸血を考慮する。いずれの場合も,臨床状態から輸血開始の判断をすべきである。
参考11 慢性貧血患者における代償反応
外科手術患者においてはしばしば術前に貧血が認められる。多くの慢性貧血患者においては,赤血球量は減少しているが,血漿量はむしろ増加しており,循環血液量は正常に保たれている。Ht値低下に伴う血液粘性減少により血管抵抗が減少するため,1回心拍出量は増加し,心拍出量は増加する。そのため,血液酸素含有量は減少するものの,心拍出量増加により代償されるため,末梢組織への血液酸素運搬量は減少しない。組織における酸素摂取率は上昇する。ただし,心疾患があり心機能障害がある患者や高齢者では,貧血となっても心拍出量の代償的増加が起きにくい。
慢性貧血では2,3-DPG※増加により酸素解離曲線の右方シフトが起こるため,末梢組織における血液から組織への酸素受け渡しは促進される40)。MAP加赤血球濃厚液中の2,3-DPG量は減少しているため,多量の輸血を行いヘモグロビン濃度を上昇させ血液酸素含有量を増加させても,組織への酸素供給量は増加しないため,直ちに期待すべき効果がみられないことがあることに注意する41)。
※2,3-DPG:2,3-ジホスホグリセリン酸
参考12 手術を安全に施行するのに必要と考えられるHt値やHb値の最低値
全身状態が良好な高齢者の整形外科手術において,Ht値を41%から28%に減少させても,心拍出量増加が起きなかったという報告42)はあるが,Ht値を27〜29%としても若年者と手術死亡率は変わらなかったという報告もある43)。循環血液量が保たれるならば,Ht値を45%から30%まで,あるいは40%から28%に減少させても,酸素運搬量は減少しないと報告されている44)。
正常な状態では全身酸素供給量は全身酸素消費量を上回っている。しかし,全身酸素供給量が減少してくると,全身酸素消費量も減少してくる。このような状態では嫌気的代謝が起こっている。この時点での酸素供給量をcritical oxygen delivery(DO2crit)という。冠動脈疾患患者ではDO2critは330mL/minであると報告されている45)。手術時に500〜2,000mL出血しHt値が24%以下になった患者では,死亡率が高かったという報告もある46)。急性心筋梗塞を起こした高齢者ではHt値が30%未満で死亡率が上昇するが,輸血によりHt値を30〜33%に上昇させると死亡率が改善するという報告がある。また,根治的前立腺切除術において,術中の心筋虚血発作は,術後頻脈やHt値が28%未満では多かったという報告がある47)。しかし,急性冠症候群において輸血を受けた患者では,心筋梗塞に移行した率や30日死亡率が高いことが報告されている48)。
冠動脈疾患患者においては,高度の貧血は避けるべきであるが,一方,Ht値を上昇させすぎるのも危険である可能性がある。Hb値10g/dL,Ht値30%程度を目標に輸血を行うのが適当であると考えられる49)。
全身状態が良好な若年者では循環血液量が正常に保たれていれば,Ht値が24〜27%,Hbが8.0〜9.0g/dLであっても問題がないと考えられる50,51,52)。生理学的にはHbが6.0〜7.0g/dLであっても生体は耐えられると考えられるが,出血や心機能低下などが起きた場合に対処できる予備能は,非常に少なくなっていると考えるべきである。
周術期の輸血における指標やガイドラインについては,米国病理学会や米国麻酔科学会(ASA)も輸血に対するガイドラインを定めている53,54,55)。実際,Hb値が10g/dLで輸血することは少なくなっている56)。
参考13 術中の出血コントロールについて
出血量の多少はあるにしろ,手術により出血は必ず起こる。出血量を減少させるには,外科的止血のほか,出血量を増加させる内科的要因に対処する必要がある55)。
出血のコントロールには,血管の結紮やクリップによる血管閉塞,電気凝固などによる確実な外科的止血のほか,高度の凝固因子不足に対しては新鮮凍結血漿輸注,高度の血小板減少症や血小板機能異常に対しての血小板濃厚液投与などが必要になる。アプロチニンやトラネキサム酸など止血効果を持つ薬物の投与が有用な場合もある。
また,出血を助長するような因子を除去することも必要である。整形外科手術などでは低血圧麻酔(人為的低血圧)による血圧のコントロールが有用な場合がある。また,低体温は軽度のものであっても術中出血を増加させる危険があるので,患者の保温にも十分に努めなければならない。
不適切な輸血療法を防ぐためには,医師の輸血に関する再教育も重要である56)。
参考14 アフェレシスに関連する事項について
置換液として膠質浸透圧を保つため,通常は等張アルブミン製剤等を用いるが,以下の場合に新鮮凍結血漿が用いられる場合がある。
| 1) | 重篤な肝不全に対して,主として複合的な凝固因子の補充の目的で行われる血漿交換療法 保存的治療もしくは,肝移植によって病状が改善するまでの一時的な補助療法であり,PTがINR2.0以上(30%以下)を開始の目安とする。必要に応じて,血液濾過透析等を併用する。原疾患に対する明確な治療方針に基づき,施行中もその必要性について常に評価すること。原疾患の改善を目的とする治療が実施できない病態においては,血漿交換療法の適応はない。 重篤な肝障害において,新鮮凍結血漿を用いた血漿交換を強力に行う場合,クエン酸ナトリウムによる,代謝性アルカローシス,高ナトリウム血症や,膠質浸透圧の急激な変化を来たす場合があるので,経時的観察を行い,適切な対応を行うこと。 |
||
| 2) | 並存する肝障害が重篤で,除去した止血系諸因子の血中濃度のすみやかな回復が期待できない場合。 | ||
| 3) | 出血傾向もしくは血栓傾向が著しく,一時的な止血系諸因子の血中濃度の低下が危険を伴うと予想される場合。このような場合,新鮮凍結血漿が置換液として用いられるが,病状により必ずしも置換液全体を新鮮凍結血漿とする必要はなく,開始時は,等張アルブミンや,人工膠質液を用いることが可能な場合もある。 | ||
| 4) | 血栓性血小板減少性紫斑病(TTP)*・溶血性尿毒症症候群(HUS) :TTPでは 血管内皮細胞由来の,通常よりも分子量の大きいVon Willebrand Factorが,微小循環で血小板血栓を生じさせ,本症の発症に関与している。また,Von Willebrand Factor Cleaving Protease(VWF-CP-ADAMTS13)の著減や阻害因子の出現が主要な病因とされ,新鮮凍結血漿を置換液として血漿交換療法を行い,VWF-CPを補充し阻害因子を除くことが最も有効である。血漿交換療法が行い難い場合や,遺伝性にVWF-CPの欠乏を認める場合,VWF-CPの減少を補充するために,新鮮凍結血漿の単独投与が効果を発揮する場合がある。一部の溶血性尿毒症症候群においても,新鮮凍結血漿を用いた血漿交換や血漿輸注が有効な場合がある。
|
参考15 赤血球濃厚液の製法と性状
現在頻用されている血液保存液には,ACD-A液(acid-citrate-dextrose :クエン酸ナトリウム22.0g/L ,クエン酸8.0g/L ,ブドウ糖 22.0g/L)及びCPD液(citrate- phosphate-dextrose:クエン酸ナトリウム 26.30g/L ,クエン酸3.27g/L ,ブドウ糖 23.20g/L,リン酸二水素ナトリウム二水和物2.51g/L)があり,赤血球保存用添加液としてはMAP液(mannitol-adenine- phospate:Dマニトール14.57g/L,アデニン0.14g/L,リン酸二水素ナトリウム二水和物0.94g/L,クエン酸ナトリウム 1.50g/L,クエン酸0.20g/L,ブドウ糖7.21g/L,塩化ナトリウム4.97g/L)がある。
MAP加赤血球濃厚液(MAP加RCC)
MAP加赤血球濃厚液は,ヒト血液200mLにつきACD-A液30mLを混合して採血した血液を強遠心(200mL採血は 4,000G・6分間,400mL採血は4,600G・6分間)して血漿と血小板・白血球層(バッフィーコート)を除き,ヘマトクリット(Ht)値を約 90%にした赤血球沈層に,200mL採血はMAP液を約46mL,400mL採血はMAP液を約92mL添加して調製したものである。
MAP加赤血球濃厚液の最終容量には,200mL全血由来(1単位)の約140mLと400mL全血由来(2単位)の約280mLの2種類がある。Ht値は約60%で,ヘモグロビン(Hb)含有量は200mL全血由来で29±2.7gである。CPD加赤血球濃厚液(CPD加RCC)と比較した場合,血小板とリンパ球は約1/10,血漿成分は約1/10しか含まれていないが,顆粒球は約60%前後含まれている。
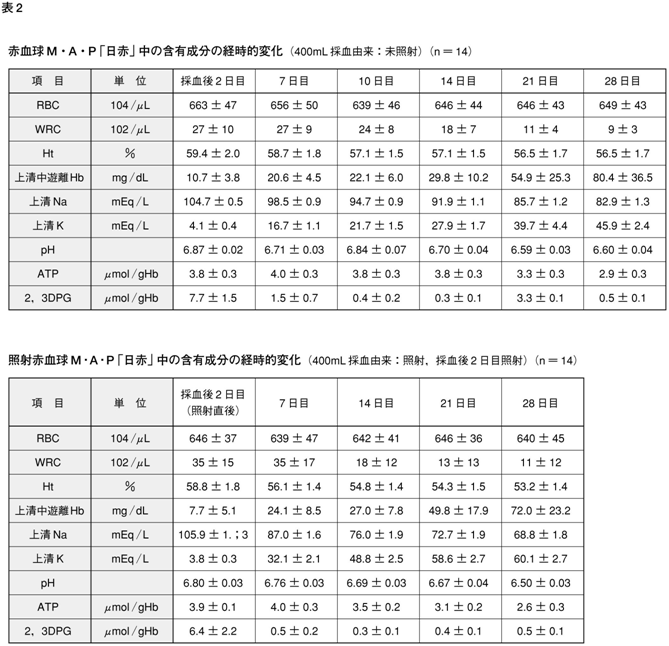
MAP加赤血球濃厚液の一部の成分は保存中に経時的な変化を示す(表2)57,58)。
日本赤十字社では,MAP加赤血球濃厚液「日赤」の製造承認取得時には有効期間を42日としていたが,エルシニア菌混入の可能性があるため,現在は有効期間を21日間としている。
なお,日本赤十字社はMAP加赤血球濃厚液を赤血球M・A・P「日赤」として医療機関に供給している。
参考16 血小板濃厚液の製法と性状
血小板濃厚液の調製法には,採血した全血を常温に保存し製剤化する方法と,単一供血者から成分採血装置を使用して調製する方法があるが、わが国では後者が一般的である。
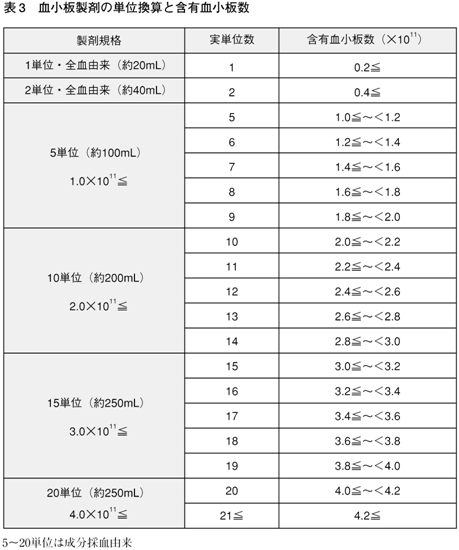
200mL全血採血から調製された血小板濃厚液は,血漿約20mL中に0.2×1011個以上の血小板を含む。これを1単位製剤と称する。400mL全血採血由来の血小板濃厚液は2単位(0.4×1011個以上)ある。
成分採血由来の血小板濃厚液の製剤規格,実単位数と含有血小板数との関係を表3に示す。
HLA適合血小板濃厚液には,成分採血由来の10,15,20単位の各製剤がある。
なお,これらの血小板濃厚液の中には少量の赤血球やごくわずかの白血球が含まれている。なお,平成16年10月より,保存前白血球除去技術が適用され製剤中の混入白血球数はバッグ当たり1×106個未満となった。
調製された血小板濃厚液は,輸血するまで室温(20〜24℃)で水平振盪しながら保存する。
有効期間は採血後72時間であるが,調製の過程で無菌閉鎖回路による操作が行えなかった場合には,採血後24時間である。
参考17 新鮮凍結血漿(FFP)の製法と性状
全血より分離された血漿あるいは成分採血装置により採取された血漿を採血後6時間以内に-20℃以下に置き,速やかに凍結したものである。その容量は,約80mL(1単位),約160mL(2単位)及び約450mL(5単位)がある。有効期間は採血後-20℃以下の凍結保存で1年間である。
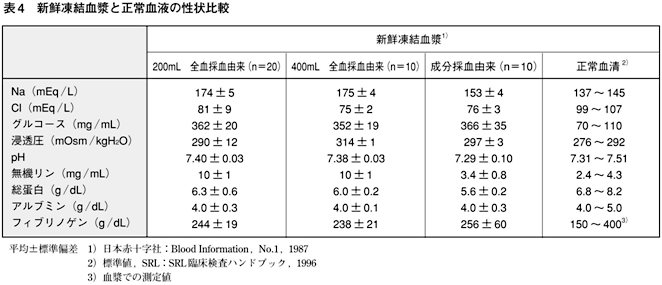
新鮮凍結血漿の組成は,採血時に混合した血液保存液(全血液由来はACD-A液又はCPD液,成分採血由来はACD-A液を使用)により異なる(表4)。含有成分は血液保存液により希釈されて,単位容積当たりの濃度は正常血漿と比較して,およそ10〜15%低下している。例えば,アルブミン濃度は約4.0g/dL(全量約3g/単位)と低くなっている。
また,血漿中の凝固因子活性の個人差は大きいが,新鮮凍結血漿中でもほぼ同様な凝固因子活性が含まれている。ただし,不安定な因子である凝固第V,VIII因子活性はわずかながら低下する。一方,ナトリウム濃度は血液保存液中のクエン酸ナトリウムの添加により増量している。凍結時には少量の血小板,赤血球及び白血球が混在しているが,凍結融解によりほとんどの細胞は破壊される。なお,正常血漿1mL中に含まれる凝固因子活性を1単位(100%)という。
また,新鮮凍結血漿を初めとした輸血用血液製剤は,感染性の病原体に対する不活化処理がなされていないことから,輸血感染症を伝播する危険性を有していることに留意する必要がある。
なお,血小板濃厚液10単位(200mL)中には不安定な凝固因子を除いて新鮮凍結血漿2.5単位に相当する凝固因子活性が含まれている。
参考18 アルブミンの製法と性状
| 1) | 製法・製剤 アルブミン製剤は,多人数分の血漿をプールして,冷エタノール法により分画された蛋白成分である。含有蛋白質の96%以上がアルブミンである製剤を人血清アルブミンといい,等張(正常血漿と膠質浸透圧が等しい)の5%溶液と高張の20,25%溶液とがある。また,等張製剤にはアルブミン濃度が4.4w/v%以上で含有総蛋白質の80%以上がアルブミン(一部のグロブリンを含む)である加熱人血漿たん白製剤もある。これらの製剤はいずれも60℃10時間以上の液状加熱処理がなされており,エンベロープをもつ肝炎ウイルス(HBV,HCVなど)やヒト免疫不全ウイルス(HIV)などの既知のウイルス性疾患の伝播の危険はほとんどない。しかしながら,これまでに感染例の報告はないもののエンベロープのないA型肝炎ウイルス(HAV),E型肝炎ウイルス(HEV)などやプリオン等の感染の可能性については今後も注視していく必要がある。 |
| 2) | 性状・代謝 アルブミンは585個のアミノ酸からなる分子量約66,500ダルトンの蛋白質である。正常血漿の膠質浸透圧のうち80%がアルブミンによって維持されており,アルブミン1gは約20mLの水分を保持する。アルブミンの生体内貯蔵量は成人男性では約300g(4.6g/kg体重)であり,全体の約40%は血管内に,残りの60%は血管外に分布し,相互に交換しながら平衡状態を保っている。生成は主に肝(0.2g/kg/日)で行われる。この生成はエネルギー摂取量,血中アミノ酸量,ホルモンなどにより調節され,これに血管外アルブミン量,血漿膠質浸透圧などが関与する。アルブミンの生成は血管外アルブミン量の低下で亢進し,増加で抑制され,また膠質浸透圧の上昇で生成は抑制される。その分解は筋肉,皮膚,肝,腎などで行われ,1日の分解率は生体内貯蔵量のほぼ4%である。また生体内でのアルブミンの半減期は約17日である。 |
文献
| 1) | Vamvakas EC:Is white blood cell reductionequivalent to antibody screening in preventing transmission of Cytomegalovirus by transfusion ? A review of the literature and meta-analysis,Transfusion.Med.Rev 2005;19(3):181-199 |
| 2) | Stover EP, et al:Variability in transfusion practice for coronary artery bypass surgery persists despite national consensus guidelines. Anesthesiology 1998;88:327-333 |
| 3) | Hessel EA, et al:Platelet kinetics during deep hypothermia. Journal of Surgical Research 1980;28:23-34 |
| 4) | Valeri CR, et al:Hypothermia-induced reversible platelet dysfunction.Annals of Surgery 1987;205:175-181 |
| 5) | Michelson AD, et al: Reversible inhibition of human platelet activation by hypothermia in vivo and in vitro. Thrombosis and haemostasis 1994;71:633-640 |
| 6) | Boldt J, et al:Normothermic versus hypothermic cardiopulmonary bypass:do changes in coagulation differ? Annals of Thorac Surg 1996;62:130-135 |
| 7) | Nuttall GA, et al:Efficacy of a simple intraoperative transfusion algorithm for nonerythrocyte component utilization after cardiopulmonary bypass. Anesthesiology 2001;94:773-781 |
| 8) | Karski JM, et al:Etiology of preoperative anemia in patients undergoing scheduled cardiac surgery.Can J Anesth 1999;46:979-982 |
| 9) | Williams GD, et al:Factors associated with blood loss and blood product transfusions:A multivariate analysis in children after open-heart surgery. Anesth Analg 1999;89:57-64 |
| 10) | Laupacis A, et al:MHA for The International Study of Peri-operative Transfusion(ISPOT)Investigators:Drugs to minimize perioperative blood loss in cardiac surgery:Meta-analyses using perioperative blood transfusion as the outcome Anesth Analg 1997;85:1258-1267 |
| 11) | Hardy JF:Pharmacological strategies for blood conservation in cardiac surgery: erythropoietin and antifibrinolytics Can J Anesth 2001;48/:S24-S31 |
| 12) | Mongan PD, et al:Tranexamic acid and aprotinin reduce postoperative bleeding and transfusions during primary coronary revascularization Anesth Analg 1998;87:258-265 |
| 13) | Sedrakyan A, et al:Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery:a systematic review and meta-analysis of randomized clinical trials. J Thorac Cardiovasc Surg 2004;128:442-448 |
| 14) | Levy JH, et al:A multicenter, double-blind, placebo-controlled trial of aprotinin for reducing blood loss and the requirement for donor-blood transfusion in patients undergoing repeat coronary artery bypass grafting Circulation.1995;92:2236-2244. |
| 15) | Mangano CTM, et al:Aprotinin, blood loss, and renal dysfunction in deep hypothermic circulatory arrest.Circulation 2001;104: (SupplI);276-281 |
| 16) | Munoz JJ, et al: Is ε-aminocaproic acid as effective as Aprotinin in reducing bleeding with cardiac surgery.Circulation 1999;99:81-89 |
| 17) | Shore-Lesserson, et al:Thromboelastography-guided transfusion algorithm reduces transfusions in complex cardiac surgery.Anesth Analg 1999;88:312-319 |
| 18) | Dougenis D, et al:Blood use in lung resection for carcinoma: perioperative elective anaemia does not compromise the early outcome.Eur J Cardiothorac Surg 2001;20:372-377 |
| 19) | Motoyama S, et al:Use of autologous instead of allogeneic blood transfusion during esophagectomy prolongs disease-free survival among patients with recurrent esophageal cancer. J Surg Oncol 2004;15:26-31 |
| 20) | Kinoshita Y, et al:Usefulness of autologous blood transfusion for avoiding allogenic transfusion and infectious complications after esophageal cancer resection. Surgery 2000;127:185-192 |
| 21) | Takemura M, et al:Immunologic effects of allogeneic versus autologous blood transfusion in patients undergoing radiacal oesophagectomy. Eur Surg Res 2003;35:115-122 |
| 22) | Dresner SM, et al:Prognostic significance of peri-operative blood transfusion following radical resection for oesophageal carcinoma.Eur J Surg Oncol 2000;26:492-497 |
| 23) | Schmied H, et al: The effects of red-cell scavenging, hemodilution, and active warming on allogenic blood requirements in patients undergoing hip or knee arthroplasty. Anesth Analg 1998;86:387-391 |
| 24) | McSwiney MM, et al:Blood transfusion in total hip arthroplasty: guidelines to eliminate overtransfusion. Can J Anaesth 1993;40: 3:222-226 25) Olfsger D, et al:Acute normovolemic haemodilution decreases postoperative allogenic blood transfusion after total knee replacement. Br J Anaesth 1997;7:79:317-321 |
| 26) | Thomas D, et al: Autologous blood transfusion in total knee replacement surgery.Br.J.Anaesth 2001;86:669-673 |
| 27) | Neilipovitz DT, et al:A Randomized trial of tranexamic acid to reduce blood transfusion for scoliosis surgery.Anesth Analg 2001;93:82-87 |
| 28) | Shmied H, et al:Mild hypothermia increases blood loss and transfusion requirements during total hip arhtroplasty. Lancet 1996;347:289-292 |
| 29) | Monk TG, et al:Acute normovolemic hemodilution can replace preoperative autologous blood donation as a standard of care for autologous blood procurement in radical prostatectomy. Anesth Analg 1997;85:953-958 |
| 30) | Bryson GL, et al:Does acute normovolemic hemodilution reduce perioperative allogeneic transfusion? A meta-analysis. Anesth Analg 1998;86:9-15 |
| 31) | Hogue CW Jr, et al:Perioperative myocardial ischemic episodes are related to hematocrit level in patients undergoing radical prostatectomy. Transfusion 1998;38:924-931 |
| 32) | Linko K, et al:Electrolyte and acid-base disturbances caused by blood transfusion.Acta Anaesthesiolo Scand 1986;30:139-144 |
| 33) | Brown KA, et al:Hyperkalemia during rapid blood transfusion and ohpovolaemic cardiac arrest in children. Can J Anaesth 1990;73:747-754 |
| 34) | Jameson LC, et al:Hyperkalemic death during use of a high-capacity fluid warmer for massive transfusion. Anesthesiology 1990;73:1050-1052 |
| 35) | Rock G, et al:Effect of citrate anticoagulations on factor VIII levels in plasma.Transfusion 1988;28:248-252 |
| 36) | Murray DJ, et al:Coagulation changes during packed red cell replacement of major blood loss.Anesthesiology 1988;839-845 |
| 37) | Consensus Conference:Fresh frozen plasma.Indications and risks. JAMA 1985;253:551-553 |
| 38) | Harke H, et al:Haemostatic disorders in massive transfusion.Bibl Haematol 1980;46:179-188 |
| 39) | Ferrara A, et al:Hypothermia and acidosis worsen coagulopathy in the patient requiring multiple transfusion.Am J Surg 1990;160:15-18 |
| 40) | Sunder-Plessman L, et al:Acute normovolemic hemodilution: change in tissue oxygen supply and hemoglobin-oxygen affinity. Bibl Haematol 1975;41:44-53 |
| 41) | Shah DM, et al:Failure of red blood cell transfusion to increase oxygen transport or mixed venous PO2 in injured patients.J Trauma 1982;22:741-746 |
| 42) | Rosberg B, et al:Hemodynamics following normovolemic hemodilution in elderly patients. Acta Anaesthesiolog Scand 1981;25:402-406 |
| 43) | Vara-Thorbeck R, et al:Hemodynamic response of elderly patients undergoing major surgery under moderate normovolemic hemodilution.Eur Surg Res 1985;17:372-376 |
| 44) | Messmer K:Hemodilution.Surg Clin North Am 1975;55:659-678 |
| 45) | Shibutani K, et al:Critical levels of oxygen delivery in anesthetized man.Crit Care Med 1983;11:640-643 |
| 46) | Carson JL, et al:Severity of anaemia and operative mortality and morbidity. Lancet 1988;1:727-729 |
| 47) | Hogue CW Jr, et al:Perioperative myocardial ischemic episodes are related to hematocrit level inpatients undergoing radical prostatectomy.Transfusion 1998;38:924-931. |
| 48) | Rao SV, et al:Relationship of blood transfusion and clinical outcome in patients with acute coronary syndromes.JAMA 2004;292:1555-1562 |
| 49) | Wu WC, et al:Blood transfusion in elderly patients with acute myocardial infarction. N Engl J Med 2001;345:1230-1236 |
| 50) | Stehling L, et al:The red blood cell transfusion trigger.Arch Pathol lab Med 1994;118:429-434 |
| 51) | Spence RK:Emerging trends in surgical blood transfusion. Semin Hematol 1997;34:48-53 |
| 52) | Task force on blood component therapy:Practice guidelines for blood component therapy. A report by the American Society of Anesthesiologists task force on blood component therapy.Anesthesiology 1996;84:732-747 |
| 53) | College of American Pathologists:Practice parameter fro the use of fresh-frozen plasma, crypprecipitate, and platelets.JAMA 1994;271:777-781 |
| 54) | Simon A, et al:Practice parameter for the use of red blood cell transfusions.Arch Pathol Lab Med 1998;122:130-138 |
| 55) | American Society of Anesthesiologists Task Force on Blood Component Therapy:Practice guidelines for blood component therapy:A report by the American Society of Anesthesiologists Task Force on blood component therapy. Anesthesiology 1996; 84:732-747 |
| 56) | Nuttall GA, et al: Current transfusion practices of members of the American Society of Anesthesiologists: A survery. Anesthesiology 2003;99:1433-1443 |
| 57) | 柴雅之,他:MAP加濃厚赤血球の製造と長期保存試験.日輸血会誌1991;37:404-410 |
| 58) | 笹川滋,他:長期保存MAP加濃厚赤血球の有効性について-Survival study- 日輸血会誌1991;37:411-413 |
| 参考資料1 | DIC診断基準 −1988年改正― |

参考資料2



