�@�ߔN�C���t���܂̈��S���͊i�i�Ɍ��サ�Ă������C�Ɖu���C�������Ȃǂ̕���p�⍇���ǂ�������댯�������܂��ɂ���C�y�ǂ̂��̂��܂߂���̕p�x�͌����ĒႢ�Ƃ͌������C�v���I�ȓ]�A���Ƃ邱�Ƃ��H�ɂ��邱�Ƃ���C���t���܂��{���I�ɗL����댯�������߂ĔF�����C���K���Ȏg�p�𐄐i����K�v������B
�@�܂��C���t���܂͐l�̂̈ꕔ�ł���C�L���ŋM�d�Ȏ����ł��錌�t�������Ă��邱�Ƃ���C���̎戵���ɂ͗ϗ��I�ϓ_����̔z�����K�v�ł���C���ׂĂ̌��t���܂ɂ��Ď������ł̎�����ڎw�����Ƃ����ۓI�Ȍ����ƂȂ��Ă���B�]���āC���t�̍������S�����̒B���̂��߂ɂ͌��t���܂̎g�p�K�����̐��i���s���ł���B
�@���̂��߁C�����Ȃł́C1986�N�ɁC�̌�����������Č��t�̗ʓI�m�ۑ���u����ƂƂ��ɁC�u���t���܂̎g�p�K������v��݂��C���t���܂̍��������̒B����ڎw�����ƂƂ����B����C1989�N�ɂ͈�Ë@�֓��ł̗A���������S���K���ɍs����悤�u�A���Ö@�̓K�����Ɋւ���K�C�h���C���v�����肵���B�܂��C1994�N�ɂ́u�������܂̎g�p��v�C1999�N�ɂ́u���t���܂̎g�p�w�j�v�y�сu�A���Ö@�̎��{�Ɋւ���w�j�v�����肳�ꂽ�B�����ɂ��C1992�N�ɂ͔Z�k�Ìň��q���܂̍����������B������C�A���u�~�����܁i�l�����A���u�~���C���M�l�������j�̎�������5���i1985�N�j����50���i2004�N�j�ցC�Ɖu�O���u�������܂̎�������40���i1995�N�j����87���i2004�N�j�ւƏ㏸�����B����C���t���܂̎g�p�ʂ͕���11�N����N�X�������Ă���C����15�N�ɂ͌������܂Ŗ�2/3�C�A���u�~�����܂Ŗ�3/4�ɂȂ��Ă���B
�@�������C�Ԍ����Z���t�y�ь����Z���t�̎g�p�ʂ͉����C�Ɖu�O���u�����͕���15�N�x�ɂ͂��߂Č����Ɍ������ȂǁC�\���Ȍ��ʂ��݂��Ă���Ƃ͌�����Ȃ��ƂȂ��Ă���B�܂��C���O���Ɣ�ׂ�ƁC�V�N�����������̌��t���܂̎g�p�ʂ���3�{�̏ɂƂǂ܂��Ă���C����Ȃ�k�����\�Ƒz�肳���B
�@����C����������������Ɍ��コ����ƂƂ��ɁC�����̉\�����팸���邽�߂ɁC�����̐��܂��܂ތ��t�̍������S�����C���S���̊m�ۋy�ѓK���g�p��ړI�Ƃ���C�u���S�Ȍ��t���܂̈��苟���̊m�ۓ��Ɋւ���@���v������15�N7���Ɏ{�s���ꂽ�B�ȏ�̊ϓ_����Ì���ɂ����錌�t���܂̓K���g�p����w���i����K�v������B
| I | �@���t���܂̎g�p�݂̍�� |
| 1�D | ���t���ܗÖ@�̌��� |
�@���̂悤�ȕ�[�Ö@���s���ۂɂ́C����̓��^���Ɋe�����̓��B���ׂ��ڕW�l��Տ��Ǐ�ƗՏ������l����\�ߐݒ肵�C�����ŕ�[���ׂ����t�����ʂ��v�Z���C����ɐ��̓��ɂ����錌�Ǔ��O�̕��z���ӑ��x���l�����ĕ�[�ʂ����C�ɉ����ĕ�[�Ԋu�����߂�K�v������B�܂��C����̓��^��ɂ́C�����̖ړI�C�ڕW���ǂ̒��x�B�����ꂽ���ɂ��Ă̗L�����̕]�����C�Տ��Ǐ�ƗՏ������l�̉��P�̒��x�Ɋ�Â��čs���C�����ɕ���p�ƍ����ǂ̔����̗L�����ώ@���C�f�Ø^�ɋL�^���邱�Ƃ��K�v�ł���B
| 2�D | ���t���g�p��̖��_�Ǝg�p�w�j�݂̍�� |
�@�܂��C�{�w�j�͕K��������t�̍ٗʂ𐧖���̂ł͂Ȃ����C�{�w�j�ƈقȂ����K���C�g�p���@�Ȃǂɂ��C�d�Ăȕ���p�⍇���ǂ��F�߂��邱�Ƃ�����C���̗Ö@�̑Ó��������Ƃ����\��������B���������āC���҂ւ̌��t���܂̎g�p�ɂ��Ă̐����Ɠ��Ӂi�C���t�H�[���h�E�R���Z���g�j���̎擾�ɍۂ��ẮC�����Ƃ��Ė{�w�j�܂������������邱�Ƃ��]�܂��B
�@����ɁC�{�w�j�͕ی��f�Ï�̐R����ƂȂ邱�Ƃ��Ӑ}������̂ł͂Ȃ����C���t���܂�p�����K���ȗÖ@�̐��i��ړI�Ƃ���ϓ_����C�ی��R���݂̍�����Č�������肪����ƂȂ邱�Ƃ����҂�����̂ł���B
| �@�� | �@��68����7�ŋK�肳��Ă���B |
| 3�D | ���܂��Ƃ̎g�p�w�j�̍l���� |
| �@1�j | �@�Ԍ����Z���t�ƑS���̓��^�ɂ��� �K���̌���Ɩ��_ �@�ꕔ�̊O�ȗ̈�ł́C���݂ł��S���̎g�p���邢�͑S���̑�ւƂ��Ă̐Ԍ����Z���t�ƐV�N���������̓��ʂ̕��p�������s���Ă���B�������Ȃ���C�����A������������āC����20�N�ȏオ�o�߂��C���̊ԁC�]���͐��S�����g���Ă����Ǘ�ɂ��Ă��C�Ԍ����Z���t���P�Ƃŗp������悤�ɂȂ�C�D�ꂽ�Տ����ʂ������邱�Ƃ��m�F����Ă������Ƃ���C���t�̊e�����̓��������������A���Ö@����w���i���邽�߁C�����ʂ̎�X�̕a�Ԃւ̎g�p�w�j�����肷�邱�ƂƂ����B�Ȃ��C�S���̓K���ɂ��Ă̓G�r�f���X�������Ă��Ȃ��C�S���̋������p�����邱�Ƃ́C���t�̗L�����p��W���邱�Ƃ��猌�t���ܑS�̂̋����̐��ɂ������Ă���B ���Ȍ��A���̐��i �@���파�A���̈��S���͔���I�Ɍ��サ�����C���܂��Ɋ������E�C���X�Ȃǂ̓`�d�E������Ɖu�w�I�ȍ����ǂ�������댯��������C�����̊댯�����\�Ȍ��������邱�Ƃ����߂���B���݁C�ҋ@�I��p�ɂ�����A���Ǘ��80�`90���́C2,000mL�ȓ��̏o���ʂŎ�p���I���Ă���B���������āC�����̎�p�Ǘ�̑����́C�p�O�������C���t��ߎ��C�p���E�p�������Ȃǂ̎��Ȍ��A�����\���Ɋ��p���邱�Ƃɂ��C���파�A�����s�����ƂȂ����S�Ɏ�p���s�����Ƃ��\�ƂȂ��Ă���B�A�����K�v�ƍl������ҋ@�I��p�̍ۂɁC�ߌ�A����ۊ������@�������̔����ɏ\���z������K�v��������̂́C���Ȍ��A���ɂ�铯�파�A������̉\�����������C���Ȍ��A����ϋɓI�ɐ��i���邱�Ƃ��K���g�p�����H���邽�߂ɂ����������B |
| �@2�j | �@�����Z���t�̓��^�ɂ��� �K���̌���Ɩ��_ �@�����Z���t�͌������ɂ������Ȃ��C�������̌����C���͌����@�\�̒ቺ�Ȃ����ُ�ɂ��C�d�ĂȁC���Ƃ��Ēv���I�ȏo���Ǐ�i�������o���j��F�߂�Ƃ��ɁC�����̐��Ƌ@�\���[���Ď~�����邱�Ɓi���ÓI���^�j��ړI�Ƃ���ꍇ�ƁC���������ɂ��N���邱�Ƃ��\�������d�Ăȏo���𖢑R�ɖh�����Ɓi�\�h�I���^�j��ړI�Ƃ���ꍇ�ɍs���Ă��邪�C����70�`80���͗\�h�I���^�Ƃ��čs���Ă���B �@�����Z���t�̎g�p�ʂ͔N�X�����X���ɂ��������A���̐��N�ԉ�����ԂƂȂ��Ă��邪�A�ēx��������\���������B���̔w�i�Ƃ��Ă͍���Љ�̓����ɂ�鈫����ᇂ̑������݂��邱�ƂƂƂ��ɁC�ߔN�C��ɑ������ᇂɑ��čs���Ă������͂ȉ��w�Ö@���Ō`��ᇂ̎��Âɂ��g�傳��C�܂��C�O�ȓI���u�Ȃǂɔ����g�p�������Ȃ������Ƃ���������B �@�������Ȃ���A�����Z���t�̋����̐��͎��Y�ł��邱�Ƃ���펞�K�v�ʂ��m�ۂ��ėA�����邱�Ƃ�����Ȃ��Ƃł���B �@���������āA�A���{���݂̍���ł��錌�������`�F�b�N���Ă���A�����邱�Ƃ����ۏ�͕s�\�ł���A���ɗ\�h�I���^�ł͌���������\�ߌ�����ŗA�����̌������ɊW�Ȃ�����I�ɍs�킴��Ȃ����Ƃ��������Ă���̂�����ł���B |
| �@3�j | �@�V�N���������̓��^�ɂ��� �K���̌���Ɩ��_ �@�V�N���������́C�������̕a���̂ɑ���s�����������Ȃ���Ă��Ȃ����߁C�A�������ǂ�`�d����댯����L���Ă��邱�Ƌy�ь����`���Z�x�͌��t�ۑ��t�ɂ���߂���Ă��邱�Ƃɗ��ӂ���K�v������B�������C�V�N���������̒����ۊǂ����{�ԏ\���Ђ̌��t�Z���^�[�Ō��ݍs���Ă���C����17�N10���ɂ�6�J���̒����ۊǂ����{�����\��ł���B �@���݁C�V�N���������𓊗^����Ă��鑽���̏Ǘ�ɂ����ẮC���^���O�̋ÌŌn�������ُ�ł���Ƃ����{���̓K���a�Ԃł��邱�Ƃ͏��Ȃ��C�܂��K���Ǘ�ɂ����Ă����^��ɂ����̌����l�ُ�̉��P���m�F����Ă��邱�Ƃ͂���ɏ��Ȃ��B�V�N���������̓K���Ɠ��^�ʂ̌��肪�C�K���ɍs���Ă���Ƃ͌�������Ƃ�[�I�Ɏ��������ł���B�܂��C�]�����V�N���������͒P�ƂŁC���邢�͐Ԍ����Z���t�Ƃ̕��p�ɂ��C�z�����ʂ̕�[�ɗp�����Ă����B�������Ȃ���C���̂悤�ȖړI�̂��߂ɂ́C�����S�ȍזE�O�t��[�t�i���_�����Q���t�C�|�_�����Q���t�Ȃǁj��l�H�P���t�iHES�C�f�L�X�g�����Ȃǁj���邢�͓����̃A���u�~�����܂�p���邱�Ƃ����������B���̂悤�Ȃ��Ƃ���C����̎w�j�ɂ����ẮC�V�N���������̓K���͂����ꕔ�̗�O�iTTP/HUS�j�������āC�����I�ȋÌň��q�̕�[�Ɍ����邱�ƂL�����B �������搻�܂̍����������i �@���ď����Ɣ�r���āC�䂪���ɂ�����V�N���������y�уA���u�~�����܂̎g�p�ʂ́C���܂��ɍۂ����đ����B�Ìň��q�ȊO�̌��������̍������������S�ɒB�����邽�߂ɂ́C���肠�鎑���ł��錌�������̗L�����p�C���ɐV�N���������̓K���g�p��ϋɓI�ɐ��i���邱�Ƃ��ɂ߂ďd�v�ł���B |
| �@4�j | �@�A���u�~�����܂̓��^�ɂ��� �K���̌���Ɩ��_ �@�A���u�~�����܁i�l�����A���u�~���y�щ��M�l�������j���C��h�{��Ԃւ̉h�{�f�Ƃ��Ă̒`�������̕⋋�ɂ��܂��ɂ����Ηp�����Ă���B�������Ȃ��瓊�^���ꂽ�A���u�~���͑̓��ő�ӂ���C�����͔M���ƂȂ�C�`�������ɂ͂قƂ�ǖ��ɗ����Ȃ��̂ŁC�`�������̕⋋�Ƃ����ړI�͒B�������Ȃ��B�`�������̕⋋�̂��߂ɂ́C���S�Ö��h�{�@��o���h�{�@�ɂ��h�{��Ԃ̉��P���ʏ�D�悳���ׂ��ł���B�܂��C��A���u�~�����ǂ͔F�߂�����̂́C����Ɋ�Â��Տ��Ǐ��Ȃ����C�y���ȏꍇ�ɂ������l�̕�݂̖̂ړI�ŁC�A���u�~�����܂������Ηp�����Ă��邪�C���̈�w�I�ȍ����͖�������Ă��Ȃ��B���̂悤�ɍ������ɖR���������̖��m�łȂ��g�p�͓K���ɂȂ�Ȃ����ƂY�g�p�w�j�ɖ��������B �A���u�~�����܂̎������i �@�킪���̃A���u�~�����܂̎g�p�ʂ́C�����������Z�ŁC�ߋ��̍ő�g�p�ʂ�384��L�i1985�N�j����174��L�i2003�N�j�ւƖ�55���}���������̂́C�Ԍ����Z���t�ɑ���g�p�䗦�͂��܂����ď����������Ȃ葽���ƂȂ��Ă���B���������āC�A���u�~�����܂̍���������B�����邽�߂ɂ́C�������t�ɂ�錴�������̊m�ۂƕ����āC�A���u�~���̓K�������K�ɍs�����Ƃ��d�v�ł���B |
| �@5�j | �@�����ɑ���A���Ö@�ɂ��� �@�����ȗ̈�ɂ����ẮC�g�p���錌�t���܂̐�Ηʂ����Ȃ����߁C���̓K���g�p�ɂ��Ă̌������s���Ȃ��X���ɂ��������C���q����Љ���}�����錻��܂���ƁC���̓K���g�p��ϋɓI�ɐ��i���邱�Ƃ��K�{�ł���B�������Ȃ���C������ʂɑ��錌�t���܂̓��^��ɂ��ẮC���܂��\���ȃR���Z���T�X�������Ă���Ƃ͌�����ɂ��邱�Ƃ���C���n���ɂ��Ă̑����n���ւ̐Ԍ����Z���t�̓��^���@�C�V�����ւ̌����Z���t�̓��^���@�y�ѐV�����ւ̐V�N���������̓��^���@�Ɍ��肵�Ďw�j�����肷�邱�ƂƂ����B |
| II | �@�Ԍ����Z���t�̓K���g�p |
| 1�D | �ړI |
�@�Ȃ��C�Ԍ����Z���t�̐��@�Ɛ���ɂ��Ă͎Q�l15���Q�ƁB
| 2�D | �g�p�w�j |
| �@1�j | �@�����n���ɑ���K���i��Ƃ��ē��ȓI�K���j �@���ȓI�ȕn���̑����́C�����I�ȑ����펾���ɋN��������̂ł���C���̑��C�����I�ȏ����Ǐo����q�{�o���Ȃǂ�����B�����ɂ����āC�Ԍ����A����v�����\�I�Ȏ����́C�Đ��s�ǐ��n���C�����ٌ`���nj�Q�C�����툫����ᇂȂǂł���B |
| �@�A | �@���t�����ɔ����n�� �@�n���̌����𖾂炩�ɂ��C�S���R�C�r�^�~��B12���R�C�t�_���R�C���ȖƉu���n�����n���ȂǁC�A���ȊO�̕��@�Ŏ��É\�ł��鎾���ɂ́C�����Ƃ��ėA�����s��Ȃ��B �@�A�����s���ړI�́C�n���ɂ��Ǐo�Ȃ����x��Hb�l���ێ����邱�Ƃł��邪�C���̒l���ꗥ�Ɍ��߂邱�Ƃ͍���ł���B�������Ȃ���CHb7g/dL���A�����s����̖ڈ��Ƃ���Ă��邪�C���̒l�́C�n���̐i�s�x�C�늳���ԁC���퐶����Љ���̊����C�����ǁi���ɏz��n��ċz��n�̍����ǁj�̗L���Ȃǂɂ��قȂ�CHb7g/dL�ȏ�ł��A�����K�v�ȏꍇ������C���ꖢ���ł��s�K�v�ȏꍇ������C�ꗥ�Ɍ��߂邱�Ƃ͍���ł���B�]���ėA���̓K�������肷��ꍇ�ɂ́C�����l�݂̂Ȃ炸�z��n�̗Տ��Ǐ�𒍈Ӑ[���ώ@���C�������̊��������Ă���K�v������B���̏�ŁC�Տ��Ǐ�̉��P��������Hb�l���X�ɐݒ肵�C�A���{�s�̖ڈ��Ƃ���B �@���x�̕n���̏ꍇ�ɂ́C�z�����ʂ��������Ă��邱�ƁC�S���ɕ��S���������Ă��邱�Ƃ���C��x�ɑ�ʂ̗A�����s���ƐS�s�S�C�x��������������Ƃ�����B��ʂ�1�`2�P�ʁ^���̗A���ʂƂ���B�t��Q���������Ă���ꍇ�ɂ́C���ɒ��ӂ��K�v�ł���B �@������̏ꍇ�ł��CHb�l��10g/dL�ȏ�ɂ���K�v�͂Ȃ��B�J��Ԃ��A�����s���ꍇ�ɂ́C���^�O��̗Տ��Ǐ�̉��P�̒��x��Hb�l�̕ω����r�����ʂ�]������ƂƂ��ɁC����p�̗L�����ώ@������ŁC�K���ʂ̗A�����s���B�Ȃ��C�p��̓��^�ɂ��S�ߏ��ԁiiron overload�j�𗈂��̂ŁC�s�K�v�ȗA���͍s�킸�C�o���邾�����^�Ԋu������B �@�Ȃ��C�������זE�ڐA�ɂ����闯�ӓ_�������i�Q�l1�j�Ɏ����B |
| �@�C | �@�����o�����n�� �@�����ǂ��A���B�킩��́C���ʒ����I�ȏo���ɂ�莞�ɍ��x�̕n���𗈂��B���̕n���͓S���R���n���ł���C�S�ܓ��^�ʼn��P���邱�Ƃ���C���퐶���Ɏx��𗈂��z��n�̗Տ��Ǐ�i�J�쎞�̓����E����C����Ȃǁj���Ȃ��ꍇ�ɂ́C�����Ƃ��ėA�����s��Ȃ��B�����I�n���ł���C�̓��̑㏞�@�\���������߂ɁC�����̏Ǐo�����邱�Ƃ͂܂�ł��邪�C�O�L�Ǐ���ꍇ�ɂ�2�P�ʂ̗A�����s���C�Տ������̉��P�̒��x���ώ@����B�S�g��Ԃ��ǍD�ȏꍇ�́C�w���O���r���iHb�j�l6g/dL�ȉ�����̖ڈ��ƂȂ�B���̌�͌������̎��ÂƓS�܂̓��^�Ōo�߂��ώ@����B |
| �@2�j | �@�}���o���ɑ���K���i��Ƃ��ĊO�ȓI�K���j �@�}���o���ɂ͊O�����o���̂ق��ɁC�����Ǐo���C���o���o���C�C�����o���Ȃǂ�����B�����Ǐo���̌����͈ݏ\��w����ᇁC�H���Ö�᎔j��C�}�����[���C�X�nj�Q�C������ᇂ���̏o���Ȃǂ�����C���o���o���̌��������ɂ͌��������邢�͓]�ڐ��̎�ᇁC�̑����B���Ȃǂ̎�������j��C�q�{�O�D�P�C�o�����X���C�����哮���⒰�Ԗ������̔j��Ȃǂ�����B �@�}���o���ł́CHb�l�ቺ�i�n���j�ƁC�z���t�ʂ̒ቺ���������Ă���B�z���Ԃ��猩��ƁC�z���t�ʂ�15���̏o���iclassI�j�ł́C�y���������ǎ��k���邢�͕p���������Əz���Ԃɂ͂قƂ�Ǖω��͐����Ȃ��B�܂��C15�`30���̏o���iclassII�j�ł́C�p���▬���̋������������C���҂͗����������Ȃ��Ȃ�s������悷��悤�ɂȂ�B����ɁC30�`40���̏o���iclassIII�j�ł́C���̏Ǐ�͍X�Ɍ����ƂȂ�C�������ቺ���C���_��Ԃ���������ꍇ������B�z���t�ʂ�40������o���iclassIV�j�ł́C�n���X���ƂȂ�C�����I�ɂ��댯�ȏ�ԂƂ���Ă���1)�B �@�n���̖ʂ���,�z���t������ȏꍇ�̋}���n���ɑ���ϐ��ɂ��Ă̖��m�ȃG�r�f���X�͂Ȃ��BHb�l��10g/dL����ꍇ�͗A����K�v�Ƃ��邱�Ƃ͂Ȃ���,6g/dL�ȉ��ł͗A���͂قڕK�{�Ƃ���Ă���2)�B���ɁC�}���ɕn�����i�s�����ꍇ�͂��̌X���͋����BHb�l��6�`10g/dL�̎��̗A���̕K�v���͊��҂̏�Ԃ⍇���ǂɂ���ĈقȂ�̂ŁCHb�l�݂̂ŗA���̊J�n�����肷�邱�Ƃ͓K�ł͂Ȃ��B |
| �@3�j | �@���p���̗A�� �@��ʓI�Ȏ��p���̗A���̓K���̌������ȉ��Ɏ����B�Ȃ��C�e�Ȃ̎�p�ɂ�����A���Ö@�̒��ӓ_�������ɕt����i�Q�l2�`10�j�B |
| �@�i1�j | �@�p�O���^ �@�p�O�̕n���͕K���������^�̑ΏۂƂ͂Ȃ�Ȃ��B���K�I�ɍs���Ă����p�O���^�̂�����10/30���[���iHb�l10g/dL�C�w�}�g�N���b�g�iHt�j�l30���ȏ�ɂ��邱�Ɓj�͋ߔN�ł͍����̂Ȃ����̂Ƃ���Ă���B���������āC���҂̐S�x�@�\�C�������̎�ށi�ǐ��܂��͈����j�C���҂̔N���̏d���邢�͓���ȕa�ԓ��̑S�g��Ԃ�c�����ē��^�̕K�v���̗L�������肷��B �@�Ȃ��C�����n���̏ꍇ�ɂ͓��ȓI�K���Ɠ��l�ɑΏ�����B �@��ʂɕn���̂���ꍇ�ɂ́C�z�����ʂ͑������Ă��邽�߁C���^�ɂ��}���ɕn���̐������s���ƁC�S�����̔x����������N�����댯��������B�p�O���^�́C��������o�����R���g���[���ł��Ȃ��ꍇ���͂��̋��ꂪ����ꍇ�̂ݕK�v�Ƃ����B �@�����n�����҂ɑ���A���̓K���f����ۂ́C�����n�����҂ɂ�����㏞�����i�Q�l11�j���l���ɓ����ׂ��ł���B�����āC��p�����S�Ɏ{�s���邽�߂ɕK�v�ƍl������Ht�l�̍Œ�l�i�Q�l12�j���C���҂̑S�g��Ԃɂ��قȂ邱�Ƃ𗯈ӂ��ׂ��ł���B �@�܂��C������n���̈�����ᇂ̑����䂪���ł́C�p�O�̊��҂͕n���ƂƂ��ɂ����Ήh�{��Q�ɂ���`�����ǂ��Ă��邪�C���̏ꍇ�ɂ͏p�O�ɉh�{�Ǘ��i���S�Ö��h�{�@�C�o���h�{�@�Ȃǁj��ϋɓI�ɍs���C���̐�����}��B |
| �@�i2�j | �@�p�����^ �@��p���̏o���ɑ��ĕK�v�ƂȂ�A���ɂ��āC�\�ߏp�O�ɔ��f���ď�������i�Q�l15�j�B����ɁC�����t�@�����Ȃǂ̍R�ÌŖ��^����Ă���ꍇ�Ȃǂł́C�p�O�̍R�ÌŁE�R�����Ö@�ɂ��āC���̎��_�Œ��f���邩�Ȃǂf���邱�Ƃ��d�v�ł���i�Q�l16�j�B �@�p���̏o���ɑ��ďo���ʂ̍팸�i�Q�l15�j�ɓw�߂�ƂƂ��ɁC�z���t�ʂɑ���o���ʂ̊����ƗՏ������ɉ����āC�����Ƃ��Ĉȉ��̂悤�Ȑ����A���ɂ��Ώ�����i�}1�j�B�S�g��Ԃ̗ǍD�Ȋ��҂ŁC�z���t�ʂ�15�`20���̏o�����N�������ꍇ�ɂ́C�זE�O�t�ʂ̕�[�̂��߂ɍזE�O�t��[�t�i���_�����Q���t�C�|�_�����Q���t�Ȃǁj���o���ʂ�2�`3�{���^����B �@�z���t�ʂ�20�`50���̏o���ʂɑ��ẮC�P���Z�������ێ����邽�߂ɁC�l�H�P���t�i�q�h���L�V�G�`���f���v���iHES�j�C�f�L�X�g�����Ȃǁj�𓊗^����B�Ԍ����s���ɂ��g�D�ւ̎_�f�����s�������O�����ꍇ�ɂ́C�Ԍ����Z���t�𓊗^�������B���̒��x�܂ł̏o���ł́C�����A���u�~�����܁i5���l�����A���u�~�����͉��M�l�������j�̕��p���K�v�ƂȂ邱�Ƃ͏��Ȃ��B �@���ʏ��20mL/kg�ƂȂ��Ă��邪�C�}���E���ʏo���͋~���̂��߂ɂ���ɒ����ʂ����邱�Ƃ��K�v�ȏꍇ������B���̏ꍇ�C�������ꂽ�l�H�P���t�̈ꕔ�͑̊O�ɗ��o���Ă��邱�Ƃ����Ă���ƁC20mL/kg���������ʂ��\�ł���B �@�z���t�ʂ�50�`100���̏o���ł́C�זE�O�t��[�t�C�l�H�P���t�y�ѐԌ����Z���t�̓��^�����ł͌����A���u�~���Z�x�̒ቺ�ɂ��x�����R�A���o������댯��������̂ŁC�K�X�����A���u�~�����܂𓊗^����B�Ȃ��C�l�H�P���t��1,000mL�ȏ�K�v�Ƃ���ꍇ�ɂ������A���u�~�����܂̎g�p���l������B �@����ɁC�z���t�ʈȏ�̑�ʏo���i24���Ԉȓ���100���ȏ�j������100mL/���ȏ�̋}���A��������悤�Ȏ��Ԃɂ́C�Ìň��q�⌌�����̒ቺ�ɂ��o���X���i��ߐ��̋Ìŏ�Q�ƌ��������j���N����\��������̂ŁC�ÌŌn�⌌�����̌����l�y�їՏ��I�ȏo���X�����Q�l�ɂ��āC�V�N���������⌌���Z���t�̓��^���l������i�V�N������������ь����̎g�p�w�j�̍����Q�Ɓj�B���̊ԁC�����E�������Ȃǂ̃o�C�^���T�C����A�ʁE�S�d�}�E���Z�C����Ɍ��t�K�X�Ȃǂ̏������Q�l�ɂ��ĕK�v�Ȍ��t������lj�����B���k��������90mmHg�ȏ�C���ό�����60�`70mmHg�ȏ�Ɉێ����C���̔A�ʁi0.5�`1mL/kg/���j���m�ۂł���悤�ɗA�t�E�A���̊Ǘ����s���B �@�ʏ��Hb�l��7�`8g/dL���x����Ώ\���Ȏ_�f�̋������\�ł��邪�C�����������Ȃǂ̐S�������邢�͔x�@�\��Q��]�z��Q�̂��銳�҂ł́CHb�l��10g/dL���x�Ɉێ����邱�Ƃ����������B �@�Ȃ��C�z���t�ʂɑ�������ȏ�̏o���ʂ�����ꍇ�ɂ́C�\�ł���Ή�������Ȍ��A�������݂�悤�ɓw�߂�B |
| �}1 | �@�o�����҂ɂ�����A�t�E�����A���Ö@�̓K�� |
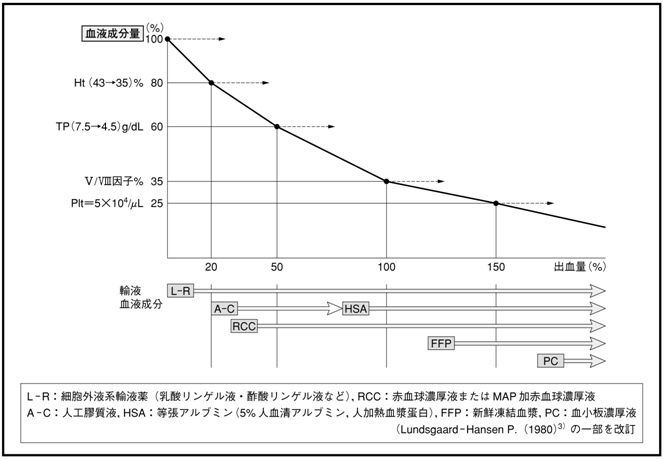
| �@�i3�j | �@�p�㓊�^ �@�p���1�`2���Ԃ͑n������̊Ԏ��t�̘R�o��`�����ى��̘��i�ɂ��C�זE�O�t�ʂƌ����A���u�~���Z�x�̌����������邱�Ƃ�����B�������C�o�C�^���T�C�������肵�Ă���ꍇ�́C�זE�O�t��[�t�̓��^�ȊO�ɐԌ����Z���t�C�����A���u�~�����܂�V�N���������Ȃǂ̓��^���K�v�ƂȂ�ꍇ�͏��Ȃ����C�����𓊗^����ꍇ�ɂ͊e�������܂̎g�p�w�j�ɂ����̂Ƃ���B �@�}���ɕn�����i�s����p��o���̏ꍇ�̐Ԍ����Z���t�̓��^�́C���}�ɊO�ȓI�~�����u�ƂƂ��ɍs���B |
| 3�D | ���^�� |
�@�\���㏸Hb�l�ig/dL�j
�@�@�����^Hb�ʁig�j/�z���t�ʁidL�j
�@�z���t�ʁF70mL/kg�o�z���t�ʁidL�j
�@�@���̏d�ikg�j�~70mL/kg/100�p
�@�Ⴆ�C�̏d50kg�̐��l�i�z���t��35dL�j��Hb�l14�`15g/dL�̌��t��2�P�ʁi400mL�R��MAP���Ԍ����Z���t1�o�b�O���̊ܗLHb�ʂ�14�`15g/dL�~4 dL =56�`60g�j�A�����邱�Ƃɂ��CHb�l�͖�1.6�`1.7g/dL�㏸���邱�ƂɂȂ�B
| 4�D | ���ʂ̕]�� |
| 5�D | �s�K�Ȏg�p |
| �@1�j | �@�Ìň��q�̕�[��ړI�Ƃ��Ȃ��V�N���������Ƃ̕��p �@�Ԍ����Z���t�ƐV�N���������p���āC�S���̑�ւƂ��ׂ��ł͂Ȃ��B���̗��R�́C���ۂɋÌňُ��F�߂�Ǘ�͋ɂ߂Č����Ă��邱�Ƃ�C���̂悤�ȕ��p�ł͗A���P�ʐ����������C�����ǂ̓`�d�⓯��Ɖu�����̊댯�������傷�邩��ł���i�V�N���������̎g�p�w�j�̍����Q�Ɓj�B |
| �@2�j | �@�������҂ւ̓��^ �@�������҂ɑ��ẮC���҂̎��R�ӎv�d���C�P�Ȃ鉄���[�u�͍T����Ƃ����l�������e�F�������B�A���Ö@�Ƃ����ǂ��C���̗�O�ł͂Ȃ��C���҂̈ӎv�d���Ȃ��P�Ȃ鎞�ԓI�����̂��߂̓��^�͍T����ׂ��ł���B |
| 6�D | �g�p��̒��ӓ_ |
| �@1�j | �@�����ǂ̓`�d �@�Ԍ����Z���t�̓��^�ɂ��C���t����銴���ǂ̓`�d�����Ƃ�����B |
| �@2�j | �@�S�̉ߏ蕉�� �@1�P�ʁi200mL�R���j�̐Ԍ����Z���t���ɂ́C��100mg�̓S���܂܂�Ă���B�l�̂���1���ɔr�������S��1mg�ł��邱�Ƃ���C�Ԍ����Z���t�̕p�^�͑̓��ɓS�̒����𗈂��C�S�ߏ�ǂ���B�܂��CHb1g�̓r�����r��40mg�ɑ�ӂ���C���̂قڔ��ʂ͌��NJO�ɑ��₩�Ɋg�U���邪�C�̏�Q�̂��銳�҂ł́C���^��̗V��Hb�̕��ׂ����t�̌����ƂȂ蓾��B |
| �@3�j | �@�A����ڐA�БΏh��a�iGVHD�j�̗\�h�� �@�̌���14���ȓ��̐Ԍ����Z���t�̗A���ɂ�锭�ǗႪ����Ă��邱�Ƃ���C�̌���̊��Ԃɂ�����炸�C�a�Ԃɉ����ĕ��ː��Ǝ˂������t���g�p����K�v������4�j�B �@���ː��Ǝˌ�̐Ԍ����Z���t�ł́C�ۑ�3���ォ��J���E���C�I�����}�㏸���C�ۑ�2�T�Ԍ�ɂ�1�P�ʁi200mL�R���j���̃J���E���C�I���̑��ʂ͍ō���7mEq�܂ő�������B�}���A�����C��ʗA�����C�t�s�S���҂��邢�͖��n���Ȃǂւ̗A�����ɂ͍��J���E�����ǂɒ��ӂ���B |
| �@4�j | �@�����������t�B���^�[�̎g�p �@�p��ɓ��^��K�v�Ƃ��銳�҂ɂ́C���M����n���������⌌���A���s����ԂȂǂ̖Ɖu�w�I�@���ɂ�镛��p�̗\�h�ɔ����������t�B���^�[���g�p���邱�Ƃ����������B |
| �@5�j | �@�n��������p �@ABO���t�^�̎��Ⴂ�ɂ��C�v���I�ȗn�����̕���p�𗈂����Ƃ�����B���^���O�ɂ́C���Ҏ����i�����������҂ł�ID�ԍ���N�����Ȃǁj�E���t�^�E���̑��̎����ɂ��Ă̏ƍ����C�K���e�o�b�O���ƂɍאS�̒��ӂ�����Ŏ��{����i�A���Ö@�̎��{�Ɋւ���w�j���Q�Ɓj�B |
�@����
| �@1) | �@American College of Surgeons:Advanced Trauma Life Support Course Manual. American College of Surgeons 1997;103-112 |
| �@2) | �@American Society of Anesthesiologists Task Force:Practice guideline for blood component therapy. Anesthesiology 1996;84:732-742 |
| �@3�j | �@Lundsgaard-Hansen P, et al:Component therapy of surgical hemorrhage:Red cell concentrates,colloids and crystalloids.Bibl Haematol 1980;46:147-169 |
| �@4�j | �@���{�A���w��u�A����GVHD�ψ���v�F�A���ɂ��GVHD�\�h�̂��߂̌��t�ɑ�����ː��Ǝ˃K�C�h���C��IV�D���{�A���w��VII�C���A��� 1999�G45�F47-54 |
| III | �@�����Z���t�̓K���g�p |
| 1�D | �ړI |
�@�Ȃ��C�����Z���t�iplatelet concentrate;PC�j�̐��@�Ɛ���ɂ��Ă͎Q�l16���Q�ƁB
| 2�D | �g�p�w�j | 1�`4�j |
�@���ɁC�������̌����͏d�v�ł͂��邪�C����݂̂�����ՂɈꗥ�Ɍ��肷�ׂ��ł͂Ȃ��B�o���Ȃ����o���X�����������̌������͋@�\�ُ�ɂ����̂ł͂Ȃ��ꍇ�i���Ɍ��Ǒ����j�ɂ́C�����A���̓K���Ƃ͂Ȃ�Ȃ��B
�@�Ȃ��C�{�w�j�Ɏ����ꂽ�������̐ݒ�͂����܂ł��ڈ��ł����āC���ׂĂ̏Ǘ�ɍ��v������̂ł͂Ȃ����Ƃɗ��ӂ��ׂ��ł���B
�@�����A�����s���ꍇ�ɂ́C�K�����O�Ɍ������𑪒肷��B
�@�����A���̓K�������肷��ɓ������āC�������Əo���Ǐ�̑嗪�̊W�𗝉����Ă����K�v������B
�@��ʂɁC��������5��/��L�ȏ�ł́C���������ɂ��d�Ăȏo����F�߂邱�Ƃ͂Ȃ��C���������Č����A�����K�v�ƂȂ邱�Ƃ͂Ȃ��B
�@��������2�`5��/��L�ł́C���ɏo���X����F�߂邱�Ƃ�����C�~������ȏꍇ�ɂ͌����A�����K�v�ƂȂ�B
�@��������1�`2��/��L�ł́C���ɏd�Ăȏo�����݂邱�Ƃ�����C�����A�����K�v�ƂȂ�ꍇ������B��������1��/��L�����ł͂����Ώd�Ăȏo�����݂邱�Ƃ����邽�߁C�����A����K�v�Ƃ���B
�@�������C�����Ɍo�߂��Ă��錌�������ǁi�Đ��s�ǐ��n���Ȃǁj�ŁC���ɏo���X���𗈂������ǂ��Ȃ��C�����������肵�Ă���ꍇ�ɂ́C��������5��`1��/��L�ł����Ă��C�����A���Ȃ��ŏd�Ăȏo���𗈂����Ƃ͂܂�Ȃ��Ƃ���C�����A���͋ɗ͔�����ׂ��ł��� (4�D3)f�D�i2�j�Q��)�B
�@�Ȃ��C�o���X���̌����́C�P�Ɍ������̌����݂̂ł͂Ȃ����Ƃ���C�K�v�ɉ����ċÌŁE���n�n�̌����Ȃǂ��s���B
| �@a�D | �@�������o�� �@���������ɂ��d�ĂȊ������o����F�߂�ꍇ�i���ɖԖ��C�����_�o�n�C�x�C�����ǂȂǂ̏o���j�ɂ́C�������̎��Â��\���ɍs���ƂƂ��ɁC��������5��/��L�ȏ�Ɉێ�����悤�Ɍ����A�����s���B |
| �@b�D | �@�O�Ȏ�p�̏p�O��� �@�ҋ@�I��p���҂��邢�͍��Ő��h�C�d���O�����C�o�C�ǎx�����C�̐����Ȃǂ̐N�P�����u�ł́C�p�O���邢�͎{�s�O�̌�������5��/��L�ȏ゠��C�ʏ�͌����A����K�v�Ƃ��邱�Ƃ͂Ȃ��B�܂��C�������h�┲���ȂNjǏ��̎~�����e�ՂȎ�Z�͌�������1�`2��/��L���x�ň��S�Ɏ{�s�ł���B���W���̎�p�̂悤�ɋǏ��ł̎~��������ȓ���ȗ̈�̎�p�ł́C7�`10��/��L�ȏ�ł��邱�Ƃ��]�܂����B �@��������5��/��L�����ł́C��p�̓��e�ɂ��C�����Z���t�̏������͏p���O�̌����A���̉ۂf����B���̍ہC�������̌����𗈂���b����������C�p�O�ɂ��̎��Â��s���B �@�����̐t����̑��̎����ŏo���X�������҂ł́C��p�ɂ���ʂ̏o�����݂邱�Ƃ�����B�o���X���̌������\���Ɍ������C�K�v�ɉ����Č����Z���t�̏������͏p���O����C�����A�����l������B |
| �@c�D | �@�l�H�S�x�g�p��p���̎��p���Ǘ� �@�S����p���҂̏p�O��Ԃɂ��ẮC�ҋ@�I��p���҂Ɠ��l�ɍl���đΏ�����B�l�H�S�x�g�p���ɂ݂��錌�������́C�ʏ�l�H�S�x�̎g�p���ԂƔ�Ⴗ��ƌ����Ă���B�܂��C���������͏p��1�`2���ōŒ�ƂȂ邪�C�ʏ��3��/��L�����ɂȂ邱�Ƃ͂܂�ł���B �@�p���E�p���ʂ��Č�������3��/��L�����ɒቺ���Ă���ꍇ�ɂ́C�����A���̓K���ł���B�������C�l�H�S�x���E��̗��_�v���^�~�����^��Ɍ��Z�y�ыÌŔ\��K�X�����C���f���Ȃ���C�K�v�ɉ�����5���^��L���x��ڏ��Ɍ����A���J�n���l������B �@�Ȃ��C���G�ȐS�匌�ǎ�p�Œ����ԁi3���Ԉȏ�j�̐l�H�S�x�g�p��C�Ď�p�ȂǂōL�͂Ȗ���������v�����C�y�і����̐t����̑��̎����ŏo���X�����݂��̒��ɂ́C�l�H�S�x�g�p��Ɍ����������邢�͋@�\�ُ�ɂ��ƍl������~������ȏo���ioozing�Ȃǁj���݂邱�Ƃ�����B�Ìň��q�̌��R�킸�C���̂悤�ȕa�Ԃ�悷��ꍇ�ɂ́C��������5��/��L�`10��/��L�ɂȂ�悤�Ɍ����A�����s���B |
| �@d�D | �@��ʗA���� �@�}�������ɂ��24���Ԉȓ��ɏz���t�ʑ����ʁC����2�{�ʈȏ�̑�ʗA�����s����ƁC���t�̊�߂ɂ�茌�����̌�����@�\�ُ�̂��߂ɁC���ǐ��̏o���𗈂����Ƃ�����B �@�~������ȏo���Ǐ�ƂƂ��Ɍ���������F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�B |
| �@e�D | �@�d�퐫���Ǔ��ÌŁidisseminated intravascular coagulation;DIC�j �@�o���X���̋��������\���̂���DIC�i��b�����������a�C���C�Y�ȓI�����C�d�NJ����ǂȂǁj�ŁC���������}����5��/��L�����ւƒቺ���C�o���Ǐ��F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�BDIC�̑��̎��ÂƂƂ��ɁC�K�v�ɉ����ĐV�N�������������p����B �@�Ȃ��C�����ɂ�鑟��Ǐ��������DIC�ł́C�����A���ɂ͐T�d�ł���ׂ��ł���B �@����DIC�ɂ��ẮC�����A���̓K���͂Ȃ��B �@�iDIC�̐f�f��ɂ��Ă͎Q�l����1���Q�Ɓj |
| �@f�D | �@���t���� �@�p��E���ʂ̌����A����v����ꍇ���������Ƃ���C����R�̂̎Y����\�h��������K�v�Ƃ���B |
| �@�i1�j | �@�������� �@�}�������a�E���������p��Ȃǂ̊����Ö@�ɂ����ẮC�}���Ɍ��������ቺ���Ă���̂ŁC����I�Ɍ������𑪒肵�C��������1�`2��/��L�����ɒቺ���Ă����ꍇ�ɂ͌�������1�`2��/��L�ȏ�Ɉێ�����悤�ɁC�v��I�Ɍ����A�����s���B�Ƃ��ɁC�}�������a�ɂ����ẮC���肵����ԁi���M��d�NJ����ǂȂǂ��������Ă��Ȃ��j�ł���C��������1��/��L�ȏ�Ɉێ�����Ώ\���Ƃ����5-7�j�B �@�RHLA�R�̂����݂��Ȃ��Ƃ��C���M�C�����ǁC�B���CDIC�C�Ɖu�����̂Ȃǂ̑��݂���ꍇ�ɂ́C�����̗A���������E�������͒ቺ����B�]���Č�������2��/��L�ȏ�ɕۂ��߂ɂ́C���p�邢�͑�ʂ̌����A����K�v�Ƃ��邱�Ƃ��������C���ɂ͌����A���s����ԂƂȂ邱�Ƃ�����B |
| �@�i2�j | �@�Đ��s�ǐ��n���E�����ٌ`���nj�Q �@�����̎����ł́C���������͖����Ɍo�߂��邱�Ƃ������C��������5��/��L�ȏ゠���ďo���Ǐ牺�o�������x�̌y���ȏꍇ�ɂ́C�����A���̓K���Ƃ͂Ȃ�Ȃ��B�����R�̂̎Y�����l�����C���ՂɌ����A�����s���ׂ��ł͂Ȃ��B �@�������C��������5��/��L�O��Ȃ�������ȉ��ɒቺ����ꍇ�ɂ́C�d�Ăȏo�����݂�p�x�������Ȃ�̂ŁC�����A���̓K���ƂȂ�B�����A�����s��,��������1��/��L�ȏ�ɕۂ悤�ɓw�߂邪�C�ێ�������Ȃ��Ƃ�����B �@�Ȃ��C�����ǂ��������Č������̌������݂�ꍇ�ɂ́C�o���X�����������邱�Ƃ������̂ŁC�i1�j�́u�������ᇁv�ɏ����Č����A�����s���B |
| �@�i3�j | �@�Ɖu������������ �@���������������������a�iidiopathic thrombocytopenic purpura;ITP�j�́C�ʏ�͌����A���̑ΏۂƂ͂Ȃ�Ȃ��BITP�ŊO�ȓI���u���s���ꍇ�ɂ́C�A���ɂ�錌�����̑����͊��҂ł��Ȃ����Ƃ������C�܂��X�e���C�h�܂��邢�͐Ò��p�Ɖu�O���u�������܂̎��O���^���s���B�����̖�܂̌��ʂ��s�\���ő�ʏo���̗\�������ꍇ�ɂ́C�����A���̓K���ƂȂ�ꍇ������C�ʏ��葽�ʂ̗A����K�v�Ƃ��邱�Ƃ�����B �@�܂��CITP�̕�e���琶�܂ꂽ�V�����ŏd�ĂȌ��������ǂ��݂�ꍇ�ɂ́C�����A���̂ق��C�X�e���C�h�ܖ��͐Ò��p�Ɖu�O���u�������܂̓��^�ƂƂ��Ɍ����A����K�v�Ƃ��邱�Ƃ�����B �@�������ٍR���̕ꎙ�ԕs�K���ɂ��V��������Ɖu�����������ǁineonatal alloimmune thrombocytopenia ; NAIT�j�ŁC�d�ĂȌ����������݂�ꍇ�ɂ́C�������ٍR�����^�̌����A�����s���B���̂悤�Ȍ����Z���t�����肵���Ȃ��ꍇ�ɂ́C��e�R���̌����̗A�����L���ł���B �@�A���㎇���a�iposttransfusion purpura;PTP�j�ł́C�����A���̓K���͂Ȃ��C�������ٍR�����^�̌����A���ł������ł���B�Ȃ��C���������Ö@���L���Ƃ̕�����B |
| �@�i4�j | �@���𐫌��������������a�ithrombotic thrombocytopenic purpura;TTP�j����їn�����A�ŏǏnj�Q�iHemolytic Uremic Syndrome;HUS�j �@TTP��HUS�ł́C�����A���ɂ��Ǐ�̈������݂邱�Ƃ�����̂ŁC�����Ƃ��Č����A���̓K���Ƃ͂Ȃ�Ȃ��B |
| �@�i5�j | �@�����@�\�ُ�� �@�����@�\�ُ�ǁi�������͏ǁC�R�����Ö@�Ȃǁj�ł̏o���Ǐ�̒��x�͏Ǘ�ɂ���ėl�X�ł���C�܂��C��������R�̎Y���̉\�������邱�Ƃ���C�d�Ăȏo���Ȃ����~������ȏꍇ�ɂ̂����A���̓K���ƂȂ�B |
| �@�i6�j | �@���̑��F�w�p�����N�������������ǁiHeparin induced thrombocytopenia;HIT�j �@�����A���͋֊��ł���B |
| �@g�D | �@�Ō`��� �@�Ō`��ᇂɑ��ċ��͂ȉ��w�Ö@���s���ꍇ�ɂ́C�}���Ɍ��������������邱�Ƃ�����̂ŁC�K�v�ɉ����ēK�X�������𑪒肷��B �@��������2��/��L�����Ɍ������C�o���X����F�߂�ꍇ�ɂ́C��������1�`2��/��L�ȏ���ێ�����悤�Ɍ����A�����s���B �@���w�Ö@�̒��~��ɁC���������A���̂��߂ł͂Ȃ�2��/��L�ȏ�ɑ��������ꍇ�ɂ́C���ɓ��������̂ƍl�����邱�Ƃ���C����ȍ~�̌����A���͕s�v�ł���B |
| �@h�D | �@�������זE�ڐA�i�����ڐA���j �@�������זE�ڐA��ɍ����@�\������܂ł̊��Ԃ́C��������1�`2��/��L�ȏ���ێ�����悤�Ɍv��I�Ɍ����A�����s���B �@�o���Ǐ���Ό����A����lj�����B |
| �@�� | �@�o���\�h�̊�{�I�ȓK��� �@�����@�\�����x�ɒቺ������O���u��p�����������זE�ڐA��́C����������������̂ŁC�o���\�h�̂��߂Ɍ����Z���t�̗A�����K�v�ƂȂ�B�����Z���t�̓K���͌������ƗՏ��Ǐ���Q�l�Ɍ��߂�B�ʏ�C�o���\�h�̂��߂ɂ͌�������1�`2��/��L�����̏ꍇ�������A���̓K���ƂȂ�B�������C�����ǁC���M�C�d�퐫���Ǔ��ÌłȂǂ̍����ǂ�����ꍇ�ɂ͏o���X���̑������邱�Ƃ�����̂ŁC�������𑪒肵�C���̌��ʂɂ�蓖���̌����Z���t�̓K���f���邱�Ƃ��]�܂����i�g���K�[�A���j�B�������C�A���̍̌��ɂ�銳�҂ւ̕��S���l�����C�܂��C��^�I�ȑ������זE�ڐA�ł͌���������������Ԃ�������x�\���ł���̂ŁC�T�P�ʂł̌����Z���t�̗A�����v��ł���ꍇ�������B���̏ꍇ�́C1�T�Ԃ�2�`3��̕p�x�ŗA�����s���B |
| �@i�D | �@�����A���s����ԁiHLA�K�������A���j �@�����A����Ɍ������̑������Ȃ���Ԃ������A���s����ԂƂ����B �@�������̑������Ȃ������ɂ́C����R�̂Ȃǂ̖Ɖu�w�I�@���ɂ����̂ƁC���M�C�����ǁCDIC�C�B���Ȃǂ̔�Ɖu�w�I�@���ɂ����̂Ƃ�����B �@�Ɖu�w�I�@���ɂ��s����Ԃ̑啔���͍RHLA�R�̂ɂ����̂ŁC�ꕔ�Ɍ������ٍR�̂��֗^������̂�����B �@�RHLA�R�̂ɂ�錌���A���s����Ԃł́CHLA�K�������Z���t��A������ƁC�������̑������݂邱�Ƃ������B�����a�C�Đ��s�ǐ��n���ȂǂŒʏ�̌����Z���t��A�����C�A�������̌������̑������݂��Ȃ��ꍇ�ɂ́C�A�������̌������𑪒肵�C������2��ȏ�ɂ킽���ĂقƂ�ǔF�߂�ꂸ�C�RHLA�R�̂����o�����ꍇ�ɂ́CHLA�K�������A���̓K���ƂȂ�B �@�Ȃ��C�RHLA�R�̂͌o�ߒ��ɉA�������C�ʏ�̌����Z���t���L���ƂȂ邱�Ƃ�����̂ŁC�o���I�Ɍ������邱�Ƃ��]�܂��B �@HLA�K�������Z���t�̋����ɂ͓���̋����҂ɑ���ȕ��S���ۂ����Ƃ���C���̓K���ɓ������Ă͓K���T�d�Ȕ��f���K�v�ł���B �@��Ɖu�w�I�@���ɂ�錌���A���s����Ԃł́C�����Ƃ���HLA�K�������A���̓K���͂Ȃ��B �@HLA�K�������Z���t�����肵���Ȃ��ꍇ�△���̏ꍇ�C���邢�͔�Ɖu�w�I�@���ɂ�錌���A���s����Ԃɂ���C�o����F�߂�ꍇ�ɂ́C�ʏ�̌����Z���t��A�����Čo�߂��݂�B |
| 3�D | ���^�� |
�\������������(�^��L)
�i�z���t�ʂ�70mL/kg�Ƃ���j |
�@�Ⴆ�C�����Z���t5�P�ʁi1�D0�~1011�ȏ�̌������ܗL�j���z���t��5,000mL�i�̏d65kg�j�̊��҂ɗA������ƁC����ɂ͗A���O�̌��������13,500/��L�ȏ㑝�����邱�Ƃ������܂��B
�@�Ȃ��C��^�ʂ́C�����Ƃ��ď�L�v�Z���ɂ�邪�C�����I�ɂ͒ʏ�10�P�ʂ��g�p����Ă���B�̏d25kg�ȉ��̏����ł�10�P�ʂ�3�`4���Ԃ����ėA������B
| 4�D | ���ʂ̕]�� |
�@�������̑����̕]���́C�����A�����1���Ԗ��͗�����24���Ԍ�̕�����������icorrected count increment�GCCI�j�ɂ��s���BCCI�͎����ɂ��Z�o����B
CCI(�^��L)
|
�@�ʏ�̍����ǂȂǂ̂Ȃ��ꍇ�ɂ́C�����A�����1���Ԃ�CCI�́C���Ȃ��Ƃ�7,500/��L�ȏ�ł���B�܂��C��������24���Ԍ��CCI�͒ʏ큆4,500/��L�ł���B
�@�������������A�����J��Ԃ��s���ꍇ�ɂ́C�Տ��Ǐ�ƌ������Ƃ̕]���Ɋ�Â��ĈȌ�̗A���v��𗧂Ă邱�ƂƂ��C���R�ƌp���I�Ɍ����A�����s���ׂ��ł͂Ȃ��B
| 5�D | �s�K�Ȏg�p |
| 6�D | �g�p��̒��ӓ_ |
| �@�i1�j | �@��ʓI�g�p���@ �@�����Z���t���g�p����ꍇ�ɂ́C�����A���Z�b�g���g�p���邱�Ƃ��]�܂����B �@�Ԍ����⌌�����܂̗A���Ɏg�p�����A���Z�b�g���������������A���Ɏg�p���ׂ��ł͂Ȃ��B |
| �@�i2�j | �@�����������t�B���^�[ �@����16�N10��25���ȍ~�C�����̌��R�������Z���t�͑S�Ĕ������������܂ƂȂ��Ă���C�x�b�h�T�C�h�ł̌����Z���t�p�̔����������t�B���^�[�̎g�p�͕s�v�ł���B�A���C�Ԍ����Z���t���g�p����ꍇ�́C�Ԍ����Z���t�p�̔����������t�B���^�[���g�p���ėA�����邩�C�����������Ԍ����Z���t���g�p����B |
| �@�i3�j | �@���ː��Ǝ� �@�A����ڐA�БΏh��a�iPT-GVHD�j�̔��ǂ̊댯�����l�����C���ː����Ǝˁi15�`50Gy�j���������Z���t���g�p���ׂ��ł���C�Ԍ����Z���t�p����ꍇ�ɂ����l�̔z����K�v�Ƃ���B |
| �@�i4�j | �@�T�C�g���K���E�C���X�iCMV�j�R�̉A�������Z���t �@CMV�R�̉A���̔D�w�C���邢�͍R�̉A���̔D�w���琶�܂ꂽ�ɏ����n���Ɍ����A��������ꍇ�ɂ́CCMV�R�̉A���̌����Z���t���g�p����B �@�������זE�ڐA���Ɋ��҂ƃh�i�[�̗��҂�CMV�R�̉A���̏ꍇ�ɂ́CCMV�R�̉A���̌����Z���t���g�p����B �@�Ȃ��C���݁C�ۑ��O���������������Z���t����������Ă���CCMV�ɂ��L�p�Ƃ���Ă���B |
| �@�i5�j | �@HLA�K�������Z���t �@3���@�Ɏ��������A���s����Ԃɑ��ėL���ȏꍇ�������B �@�Ȃ��C�����A���s����Ԃɂ́C�������ٍR�̂ɂ����̂�����B |
| �@�i6�j | �@ABO���t�^�ERh�^�ƌ����K�������i�Ԍ����j �@�����Ƃ��āCABO���t�^�̓��^�̌����Z���t���g�p����B �@���҂�Rh�A���̏ꍇ�ɂ́CRh�A���̌����Z���t���g�p���邱�Ƃ��]�܂����C���ɔD�P�\�ȏ����ł͐��������B�������C�Ԍ������قƂ�NJ܂܂Ȃ��ꍇ�ɂ́CRh�z���̌����Z���t���g�p���Ă��悢�B���̏ꍇ�ɂ́C���͉��RRh�l�Ɖu�O���u�����iRHIG�j�𓊗^���邱�Ƃɂ��C�RD�R�̂̎Y����\�h�ł���ꍇ������B �@�ʏ�̌����A���̌��ʂ��Ȃ��C�RHLA�R�̂��F�߂���ꍇ�ɂ́CHLA�K�������Z���t���g�p����B���̏ꍇ�ɂ��CABO���t�^�̓��^�̌����Z���t���g�p���邱�Ƃ������Ƃ���B |
| �@�i7�j | �@ABO���t�^�s�K���A�� �@ABO���t�^���^�����Z���t�����荢��ŁCABO���t�^�s�K���̌����Z���t���g�p���Ȃ���Ȃ�Ȃ��ꍇ�C�����Z���t���̍RA�C�RB�R�̉��ɒ��ӂ��A�n���̉\�����l������B�܂��C���҂̍RA�C�RB�R�̉����ɂ߂č����ꍇ�ɂ́CABO���t�^�s�K�������A���������̂��Ƃ������̂ŁC���ӂ��ׂ��ł���B �@�Ȃ��C�Ԍ������قƂ�NJ܂܂Ȃ������Z���t���g�p����ꍇ�ɂ́C�Ԍ����̌����K���������ȗ����Ă��悢�B |
�@����
| �@1) | �@British Committee for Standards in Haematology,Blood Transfusion Task Force:Guidelines for the use of platelet transfusions. Br J Haematol 2003;122:10-23 |
| �@2) | �@Schiffer CA, et al: Clinical Practice Guidelines of the American Society of Clinical Oncology. J Clin Oncol 2001;19:1519-1538 |
| �@3) | �@A Report by the American Society of Anesthesiologists Task Force on Blood Component Therapy:Practice Guidelines for Blood Component Therapy. Anesthesiology 1996; 84: 732- 747 |
| �@4) | �@�����ȖǁF�������܂̓K���g�p�ɂ���.1994,p.23-29 |
| �@5) | �@Wandt H, et al:Safety and cost effectiveness of a 10�~10 (9) / L trigger for prophylactic platelet transfusions compared with the traditional 20�~10 (9) / L trigger : a prospective comparative trial in 105 patients with acute myeloid leukemia. Blood 1998;91:3601-3606 |
| �@6) | �@Rebulla P, et al:The threshold for prophylactic platelet transfusions in adults with acute myeloid leukemia. Gruppo Italiano Malattie Ematologiche Mallgne dell'Adulto. N Engl J Med 1997;337:1870-1875 |
| �@7) | �@Heckman KD, et al:Randomized study of prophylactic platelet transfusion threshold during Induction therapy for adult acute leukemia:10,000 / microL versus 20,000 / microL. J Clin Oncol 1997;15: 1143-1149 |
| IV | �@�V�N���������̓K���g�p |
| 1�D | �ړI |
�@�Ȃ��C�V�N���������̐��@�Ɛ���ɂ��Ă͎Q�l17���Q�ƁB
| 2�D | �g�p�w�j |
| �@1�j | �@�Ìň��q�̕�[ |
| �@�i1�j | �@PT����с^�܂���APTT���������Ă���ꍇ�i(1)PT�́i�@�jINR 2.0�ȏ�C�i�A�j30���ȉ��^(2)APTT�́i�@�j�e��Ë@�ւɂ������̏����2�{�ȏ�C�i�A�j25���ȉ��Ƃ���j |
| �@i�D | �@�����^�Ìŏ�Q ���@�̏�Q�F�̏�Q�ɂ�蕡���̋Ìň��q�������ቺ���C�o���X���̂���ꍇ�ɓK���ƂȂ�B�V�N���������̎��Ì��ʂ�PT��APTT�Ȃǂ̋ÌŌ������s���]�����邪�C�����l�̐��퉻��ڕW�Ƃ���̂ł͂Ȃ��Ǐ�̉��P�ɂ�蔻�肷��B�������C�d�NJ̏�Q�ɂ�����~���n�ُ̈�́C�Ìň��q�̎Y���ቺ����ł͂Ȃ��C�������̌�����R�Ìň��q�C���n���q�C�R���n���q�̎Y���ቺ�C�ԓ��n�̋@�\�̒ቺ�Ȃǂ������ƂȂ蓾�邱�Ƃɗ��ӂ���B�܂��C�}���̕s�S�ɂ����ẮC�����Ώ���Ìŏ�Q�ɂ��V�N���������̕K�v���^�ʂ���������B�e�ʂ̉ߕ��ׂ����O�����ꍇ�ɂ́C���������Ö@�i1�`1.5�~�z������/��j�p����i�A�t�F���V�X�Ɋ֘A���鎖���́C�Q�l14���Q�Ɓj�B �@�Ȃ��CPT��INR 2.0�ȏ�i30���ȉ��j�ŁC���ό��I���u���s���ꍇ�������ĐV�N���������̗\�h�I���^�̓K���͂Ȃ��B�������C��p�ȊO�̊ό��I���u�ɂ�����d��ȏo���̔����́C�Ìŏ�Q������Z����Ȍ����ƂȂ�ƍl�����Ă��邱�Ƃɗ��ӂ���B ���@L-�A�X�p���M�i�[�[���^�֘A�F�̑��ł̎Y���ቺ�ɂ��t�B�u���m�Q���Ȃǂ̋Ìň��q�̌����ɂ��o���X�����݂邱�Ƃ����邪�C�A���`�g�����r���Ȃǂ̍R�Ìň��q����n���q�̎Y���ቺ�����������Ƃ���C�����ǂ��݂�ꍇ������B�����̏����q���ɕ⋋���邽�߂ɂ͐V�N����������p����B�A���`�g�����r���̉��������́C�A���`�g�����r�����܂p����B �@�~���n�ُ̈�̒��x�Əo�����������ɂ��L-�A�X�p���M�i�[�[�̓��^�v��̒��~�Ⴕ���͕ύX����������B ���@�d�퐫���Ǔ��ÌŁiDIC�j�FDIC�i�f�f��͎Q�l����1���Q�Ɓj�̎��Â̊�{�́C�����̏����i��b�����̎��Áj�ƃw�p�����Ȃǂɂ��R�ÌŗÖ@�ł���B�V�N���������̓��^�́C�����̏��u��O��Ƃ��čs����ׂ��ł���B���̍ۂ̐V�N�����������^�́C�Ìň��q�Ƌ��ɕs�����������I�ÌŁE���n�j�Q���q�i�A���`�g�����r���C�v���e�C��C�C�v���e�C��S�C�v���X�~���C���q�r�^�[�Ȃǁj�̓����⋋��ړI�Ƃ���B�ʏ�C�i1�j�Ɏ���PT�CAPTT�̉����̂ق��t�B�u���m�Q���l��100mg/dL�����̏ꍇ�ɐV�N���������̓K���ƂȂ�i�Q�l����1 DIC�̐f�f��Q�Ɓj�B �@�Ȃ��C�t�B�u���m�Q���l��100mg/dL���x�܂Œቺ���Ȃ����PT��APTT���������Ȃ����Ƃ�����̂Œ��ӂ���B�܂��C���ɃA���`�g�����r���������ቺ����ꍇ�́C�V�N�������������S�����ʓI�ȃA���`�g�����r���Z�k�������搻�܂̎g�p����ɍl������B ���@��ʗA�����F�ʏ�C��ʗA�����Ɋ�ߐ��Ìŏ�Q�ɂ��~������N���邱�Ƃ�����C���̏ꍇ�V�N���������̓K���ƂȂ�B�������Ȃ���C��ߐ��Ìŏ�Q���F�߂��Ȃ��ꍇ�́C�V�N���������̓K���͂Ȃ��i�}1�j�B�O���Ȃǂ̋~�}���҂ł́C����Ìŏ�Q���������Ă��邩���������C�Ìň��q���R�ɂ��o���X��������Ɣ��f���ꂽ�ꍇ�Ɍ���C�V�N���������̓K��������B�V�N���������̗\�h�I���^�͍s��Ȃ��B |
| �@ii�D | �@�Z�k���܂̂Ȃ��Ìň��q���R�� ���@���t�Ìň��q���R�ǂɂ͂��ꂼ��̔Z�k���܂�p���邱�Ƃ������ł��邪�C���t�Ìő�V�C��XI���q���R�ǂɑ���Z�k���܂͌��݂̂Ƃ��닟������Ă��Ȃ��B���������āC�����̗����q�̂����ꂩ�̌��R�ǂ܂��͂������܂ޕ����̋Ìň��q���R�ǂł́C�o���Ǐ�������Ă��邩�C�ό��I���u���s���ۂɐV�N�����������K���ƂȂ�B��VIII���q�̌��R�ǁi���F�aA�j�͈�`�q�g�݊����^���܂܂��͔Z�k���܁C��IX���q���R�ǁi���F�aB�j�ɂ͔Z�k���܁C��XIII���q���R�ǂɂ͔Z�k���܁C��V�����t�B�u���m�Q�����ǂɂ͔Z�k�t�B�u���m�Q�����܁C��VII���q���R�ǂɂ͈�`�q�g�݊���������VII���q���ܖ��͔Z�k�v���g�����r�������̐��܁C�v���g�����r�����R�ǁC��X���q���R�ǂɂ͔Z�k�v���g�����r�������̐��܁C����Ƀt�H�����B���u�����h�a�ɂ́C�t�H�����B���u�����h���q���܂�ł����VIII���q�Z�k���܂ɂ�鎡�Â��\�ł��邱�Ƃ���C��������V�N���������̓K���Ƃ͂Ȃ�Ȃ��B |
| �@iii�D | �@�N�}�����n��܁i�����t�@�����Ȃǁj���ʂً̋}��iPT��INR 2.0�ȏ�i30���ȉ��j�j ���@�N�}�����n��܂́C�̂ł̑�II�CVII�CIX�CX���q�̍����ɕK�{�ȃr�^�~��K�ˑ����y�f�����̑j�Q�܂ł���B�����̋Ìň��q�̌��R��Ԃɂ�����o���X���́C�r�^�~��K�̕⋋�ɂ��ʏ�P���Ԉȓ��ɉ��P���F�߂���悤�ɂȂ�B�Ȃ��C���ً}�ȑΉ��̂��߂ɐV�N���������̓��^���K�v�ɂȂ邱�Ƃ��H�ɂ��邪�C���̏ꍇ�ł������Ɏg�p�\�ȏꍇ�ɂ́u�Z�k�v���g�����r�������̐��܁v���g�p���邱�Ƃ��l������B |
| �@�i2�j | �@��t�B�u���m�Q�����ǁi100mg/dL�����j �@�䂪���ł͔Z�k�t�B�u���m�Q�����܂̋������\���łȂ��C�܂��N���I�v���V�s�e�[�g���܂���������Ă��Ȃ����Ƃ���C�ȉ��̕a�Ԃւ̃t�B�u���m�Q���̕�[�ɂ́C�V�N����������p����B �@�Ȃ��C�t�B�u���m�Q���l�̒ቺ�̒��x��PT��APTT�ɕK���������f����Ȃ��̂Œ��ӂ���i�O�q�j�B ���@�d�퐫���Ǔ��ÌŁiDIC�j�F�i�O��i�uDIC�v���Q�Ɓj ���@L-�A�X�p���M�i�[�[���^��F�i�O���@ L-�A�X�p���M�i�[�[���^�֘A�Q�Ɓj |
| �@2�j | �@�Ìőj�Q���q����n���q�̕�[ ���@�v���e�C��C�C�v���e�C��S��v���X�~���C���q�r�^�[�Ȃǂ̋ÌŁE���n�j�Q���q���R�ǂɂ����錇�R���q�̕�[��ړI�Ƃ��ē��^����B�v���e�C��C��v���e�C��S�̌��R�ǂɂ����錌���ǂ̔��ǎ��ɂ̓w�p�����Ȃǂ̍R�ÌŗÖ@�p���C�K�v�ɉ����ĐV�N���������ɂ�茇�R���q���[����B������ɂ͌o���R�ÌŗÖ@�ɂ�茌���ǂ̔�����\�h����B�A���`�g�����r���ɂ��Ă͔Z�k���܂𗘗p����B�܂��C�v���e�C��C���R�ǂɂ����錌���ǔ��ǎ��ɂ͊����^�v���e�C��C�Z�k���܂ɂ�鎡�Â��\�ł���B�v���X�~���C���q�r�^�[�̌��R�ɂ��o���Ǐ�ɑ��Ă̓g���l�L�T���_�Ȃǂ̍R���n��p���C���ʂ��s�\���ȏꍇ�ɂ͐V�N���������𓊗^����B |
| �@3�j | �@�������q�̕�[�iPT�y��APTT������ȏꍇ�j ���@���𐫌��������������a�iTTP�j�F���Ǔ���זE�ŎY������镪�q�ʂ̒������傫���iunusually large�j�t�H�����B���u�����h���q�}���`�}�[�iUL-VWFM�j���C�����z�Ō��������������C�{�ǂǂ���ƍl�����Ă���B�ʏ�CUL-VWFM�͓��זE���猌���ɕ��o�����ۂɁC�̑��ŎY�������VWF���ٓI���^���v���e�A�[�[�i�ʖ�ADAMTS13�j�ɂ��C�{���̎~���ɕK�v�ȃT�C�Y�ɕ��������B�������C��V��TTP�ł͂��̍y�f�ɑ��鎩�ȍR�́i�C���q�r�^�[�j���������C���̊������������ቺ����B�]���āC�{�ǂɑ���V�N����������u���t�Ƃ������������Ö@�i1�`1.5�z������/��j�̗L�p���́i1�j���C���q�r�^�[�̏����C�i2�j���y�f�̕⋋�C�i3�jUL-VWFM�̏����C�i4�j�~���ɕK�v�Ȑ���T�C�YVWF�̕⋋�C��4�_�ɏW���B����C��V��TTP�ł́C���̍y�f�����̌����Ɋ�Â��̂ŁC�V�N���������̒P�Ɠ��^�ŏ[���Ȍ��ʂ�����1�j�B �@�Ȃ��C���Ǐo�����咰��O�]157�F0H7�����ɑ�\������V���n�����A�ŏǏnj�Q�iHUS�j�ł́C���̑������O�L�y�f�����Ɉُ��F�߂Ȃ����߁C�V�N����������p�������������Ö@�͕K�������L���ł͂Ȃ�2�j�B |
| 3�D | ���^�� |
�@�z�����ʂ�40mL/kg�i70mL/kg�i1-Ht/100�j�j�Ƃ��C��[���ꂽ�Ìň��q�̌���������͖ړI�Ƃ���Ìň��q�ɂ��قȂ邪�C100���Ƃ���C�Ìň��q�̌������x�����20�`30���㏸������̂ɕK�v�ȐV�N���������ʂ́C���_�I�ɂ�8�`12mL/kg�i40mL/kg��20�`30���j�ł���B���������āC�̏d50kg�̊��҂ɂ�����V�N���������̓��^�ʂ�400�`600mL�C���Ȃ킿��5�`7�P�ʁi�V�N����������1�P�ʂ�80mL�j�ɑ������邱�ƂɂȂ�B���҂̑̏d��Ht�l�i�n�����j�C�c�����Ă���Ìň��q�̃��x���C��[���ׂ��Ìň��q�̐��̓��ւ̉�����┼�����i�\1�j�C���邢�͏���Ìŏ�Q�̗L���Ȃǂ��l�����ē��^�ʂⓊ�^�Ԋu�����肷��B�Ȃ��C�X�̋Ìň��q���R�ǂɂ����鎡�ÓI���^��ό��I���u���̗\�h�I���^�̏ꍇ�C���ꂼ��̋Ìň��q�̈��S�Ȏ��È惌�x�������Ă��ē��^�ʂⓊ�^�Ԋu�����肷��B
| 4�D | ���ʂ̕]�� |
| 5�D | �s�K�Ȏg�p |
| �@1�j | �@�z�����ʌ����̉��P�ƕ�[ �@�z�����ʂ̌������Ă���a�Ԃɂ́C�V�N���������Ɣ�r�����P���Z�����������C�����S�Ȑl�H�P���t���邢�͓����A���u�~�����܂̓K���ł���B |
| �@2�j | �@�`�������Ƃ��Ẳh�{�⋋ �@�A���ɂ���[���ꂽ�����`�����i�听���̓A���u�~���j�̓A�~�m�_�ɂ܂Ŋɏ��ɕ�������C���̑����͔M���Ƃ��ď����Ă��܂��C���҂̒`�������Ƃ͂Ȃ�Ȃ��B���̖ړI�̂��߂ɂ́C���S�Ö��h�{�@��o���h�{�@���K���ł���i�A���u�~�����܂̓K���g�p�F5-1�j�u�`�������Ƃ��Ẳh�{�⋋�v�̍����Q�Ɓj�B |
| �@3�j | �@�n�������̑��i �@�n���̎����Ɋ֗^���錌���`�����Ƃ��ẮC�}���������`�����ł���t�B�u���m�Q���C��XIII���q�C�t�B�u���l�N�`���C�t�H�����B���u�����h���q�Ȃǂ��l�����Ă���B�������Ȃ���C�V�N���������̓��^�ɂ��C������⋋���Ă��C�n�����������i�����Ƃ�����w�I�����͂Ȃ��B |
| �@4�j | �@�������҂ւ̓��^ �@�������҂ɑ��ẮC���҂̎��R�ӎv�d���C�P�Ȃ鉄���[�u�͍T����Ƃ����l�������e�F�������B�A���Ö@�Ƃ����ǂ��C���̗�O�ł͂Ȃ��C���҂̈ӎv�d���Ȃ��P�Ȃ鎞�ԓI�����̂��߂̓��^�͍T����ׂ��ł���B |
| �@5�j | �@���̑� �@�d�NJ����ǂ̎��ÁCDIC��Ȃ��M���̎��ÁC�l�H�S�x�g�p���̏o���\�h�C��㏞���̍d�ςł̏o���\�h�Ȃǂ��V�N�����������^�̓K���Ƃ͂Ȃ�Ȃ��B |
| 6�D | �g�p��̒��ӓ_ |
| �@1) | �@�Z��@ �@�g�p���ɂ�30�`37���̍P�������ŋ}���ɗZ�����C���₩�i3���Ԉȓ��j�Ɏg�p����B �@�Ȃ��C�Z�����ɍP�������̔�ŋۂ̉��������ڃo�b�O�ɕt�����邱�Ƃ������ƂƂ��ɁC�o�b�O�j���ɂ��ۉ������N�����\�����l�����āC�K���r�j�[���܂ɓ����B�Z����ɂ�ނ��ۑ�����ꍇ�ɂ́C�퉷�ł͂Ȃ�4���ۗ̕�ɓ��ɕۊǂ���B�ۑ�����ƕs����ȋÌň��q�i��V�CVIII���q�j�͋}���Ɏ������邪�C���̑��̋Ìň��q�̊����͔�r�I�����ԕۂ����i�\1�j�B |
| �@2�j | �@�����ǂ̓`�d �@�V�N���������̓A���u�~���Ȃǂ̌������搻�܂Ƃ͈قȂ�C�E�C���X�̕s�������s���Ă��Ȃ����߁C���t����銴���ǂ̓`�d���N�����댯��������B |
| �@3�j | �@�N�G���_���Łi��J���V�E�����ǁj �@��ʓ��^�ɂ��J���V�E���C�I���̒ቺ�ɂ��Ǐ�i��w�̂��т�C�q�C�Ȃǁj��F�߂邱�Ƃ�����B |
| �@4�j | �@�i�g���E���̕��� �@�V�N����������1�P�ʓ��^���邱�Ƃɂ��C��0.8g�̉����i�g���E���iNaCl�j�����ׂ����B |
| �@5�j | �@�A�����M�[���� �@���ɃA�����M�[���邢�̓A�i�t�B���L�V�[�������N�������Ƃ�����B |
| �@6�j | �@�A���Z�b�g�̎g�p �@�g�p���ɂ͗A���Z�b�g���g�p����B �@�m���n�o���ɑ���A���Ö@ |
| �@1�D | �@�~���@�\ �@���̂̎~���@�\�́C�ȉ���4�̗v�f���琬�藧���Ă���C����炪�����쓮���Ď~������������B�����̂����ꂩ�ُ̈�ɂ��a�I�ȏo�����N����B�A���p���t�ɂ���[�Ö@�̑ΏۂƂȂ�̂͌����ƋÌň��q�ł���B |
| �@a. | �@���ǕǁF���k�\ |
| �@b. | �@�����F���������`���i�ꎟ�~���j�C���Ȃ킿�����̔S���E�ÏW�\ |
| �@c. | �@�Ìň��q�F�ÌŌn�̊������C�g�����r���̐����C�����ōŏI�I�ȃt�B�u���������`���i�~���j |
| �@d. | �@���n���q�F�v���X�~���ɂ�錌���̗n���i�@�ۑf�n���j�\ |
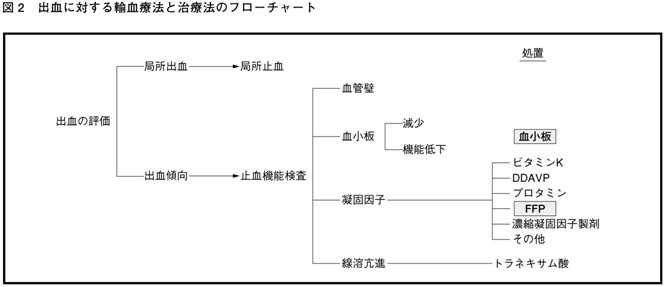
| �@2�D | �@��{�I�ȍl���� �@�V�N���������̎g�p�ɂ͎��ÓI���^�Ɨ\�h�I���^������B������Ìň��q�Ȃǂ̎~�����q�̕s���ɋN�������o���X���ɑ��鎡�ÓI���^�́C��ΓI�K���ł���B����C�o���̊댯���͌������C�o�����ԁCPT�CAPTT�C�t�B�u���m�Q���Ȃǂ̌����l����͕K�������\���ł��Ȃ��B�~���@�\�����l���ُ�ł������Ƃ��Ă��C���ꂪ�y�x�ł���C���Ƃ��ό��I���u���s���ꍇ�ł��V�N����������\�h�I�ɓ��^������K�v�͂Ȃ��B�ό��I���u���̗\�h�I���^�̖ڈ��͌�������5��/��L�ȉ��CPT��INR 2.0�ȏ�i30���ȉ��j�CAPTT���e��Ë@�ւ���߂Ă����l�̏����2�{�ȏ�i25���ȉ��j�C�t�B�u���m�Q����100mg/dL�����ɂȂ����Ƃ��ł���B �@�o�����Ԃ͌������̂̊��x�Ɠ��ِ����Ⴍ�C�p�O�̎~���@�\�����Ƃ��Ă͓K���ł͂Ȃ��C�{�������p�O�ɕK���s���K�v�͂Ȃ��B�ނ���C�o���̊������C���p���Ă����܂Ȃǂɑ��鐳�m�Ȗ�f���s�����Ƃ��K�v�ł���B �@�㌌�@�\�����Ōy�x�ُ̈킪���銳�ҁi�y�x�̌��������ǁC�̏�Q�ɂ��Ìňُ�Ȃǁj�ŋǏ��I�ȏo�����N�������ꍇ�ɁC�V�N�����������1�I���Ƃ��邱�Ƃ͌��ł���C�\���ȋǏ��I�~�����u���ł��L���ł���B�}2�̃t���[�`���[�g�Ŏ����Ƃ���C�V�N���������ɂ��~���\�ȏo���ƋǏ��I�ȏ��u�ł����~�������Ȃ��o�������݂��C���̊ӕʂ��ɂ߂ďd�v�ł���B �@�܂��C�V�N���������̓��^�ɑ����֎��Â���ɍl������B�Ⴆ�C�|�_�f�X���v���V���iDDAVP�j�͌y�ǂ̌��F�aA��t�H���r���u�����h�a�itypeI�j�̏o�����̎~���Ö@�⏬�O�ȓI���u�̍ۂ̏o���\�h�ɗL���ł���B |
�@����
| �@1�j | �@�����g���FVWF�ؒf�y�f �iADAMTS13�j�̓��ԉ�͂ɂ��TTP/HUS�f�f�@�̐i���D���{���Ȋw��G�� 2004�G93�F451-459 |
| �@2�j | �@Mori Y, et al: Predicting response to plasma exchange in patients with thrombotic thrombocyto-penic purpura with measurement of VWF-cleaving protease activity. Transfusion 2002;42:572-580 |
| �@3�j | �@AABB:Blood Transfusion Therapy;A Physician's Handbook (7th ed.) ,2002,p.27 |
| V | �@�A���u�~�����܂̓K���g�p |
| 1�D | �ړI |
�@�Ȃ��C�A���u�~���̐��@�Ɛ���ɂ��Ă͎Q�l18���Q�ƁB
| 2�D | �g�p�w�j |
| �@1�j | �@�o�����V���b�N�� �@�o�����V���b�N�Ɋׂ����ꍇ�ɂ́C�z���t�ʂ�30���ȏオ�r�������ƍl������B���̂悤��30���ȏ�̏o�����݂�ꍇ�ɂ́C�������ÂƂ��ẮC�זE�O�t��[�t�i���_�����Q���t�C�|�_�����Q���t�Ȃǁj�̓��^�����I���ƂȂ�C�l�H�P���t�̕��p����������邪�C�����Ƃ��ăA���u�~�����܂̓��^�͕K�v�Ƃ��Ȃ��B�z���t�ʂ�50���ȏ�̑��ʂ̏o�����^����ꍇ�⌌���A���u�~���Z�x��3.0g/dL�����̏ꍇ�ɂ́C�����A���u�~�����܂̕��p���l������B�z�����ʂ̕�[�ʂ́C�o�C�^���T�C���C�A�ʁC���S�Ö�����x�����������C�����A���u�~���Z�x�C����ɉ\�ł�����P���Z�������Q�l�ɂ��Ĕ��f����B�����C�t�@�\��Q�ȂǂŐl�H�P���t�̎g�p���s�K�ƍl������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B�܂��C�l�H�P���t��1,000mL�ȏ�K�v�Ƃ���ꍇ�ɂ��C�����A���u�~�����܂̎g�p���l������B �@�Ȃ��C�o���ɂ��s���������̑��̌��t�����̕�[�ɂ��ẮC�e�������܂̎g�p�w�j�ɂ��Ώ�����i���Ɂu�p���̗A���v�̍����Q�ƁG�}1�j�B |
| �@2�j | �@�l�H�S�x���g�p����S����p �@�ʏ�C�S����p���̐l�H�S�x�̏[�U�ɂ́C��Ƃ��čזE�O�t��[�t���g�p�����B�Ȃ��C�l�H�S�x���{���̌��t��߂ŋN��������A���u�~�����ǂ́C�����A���u�~���̑r���ɂ����̂ł͂Ȃ��ꎞ�I�Ȃ��̂ł���C���A�ɂ��p�㐔���Ԃʼn��邽�߁C�A���u�~�����܂𓊗^���ĕ����K�v�͂Ȃ��B�������C�p�O��茌���A���u�~���iAlb�j�Z�x�܂����P���Z�����̍��x�Ȓቺ�̂���ꍇ�C���邢�͑̏d10kg�����̏����̏ꍇ�Ȃǂɂ͓����A���u�~�����܂��p�����邱�Ƃ�����B |
| �@3�j | �@�̍d�ςɔ�����������ɑ��鎡�� �@�̍d�ςȂǂ̖����̕a�Ԃɂ���A���u�~�����ǂ́C���ꎩ�̂ł̓A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ��B�̍d�ςł̓A���u�~���̐������ቺ���Ă�����̂́C���̓��������͑㏞�I�ɉ������Ă���B���Ƃ��A���u�~���𓊗^���Ă��C�������ăA���u�~���̍������}������C���������i�����B��ʁi4L�ȏ�j�̕������h���ɏz�����ʂ��ێ����邽�߁C�����A���u�~�����܂̓��^���C�l������遖�B�܂��C���Ò�R���̕����̎��ÂɁC�Z���I�i1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂p���邱�Ƃ�����B
|
| �@4�j | �@����̕���C�x������l�t���[�[�nj�Q �@�l�t���[�[�nj�Q�Ȃǂ̖����̕a�Ԃ́C�ʏ�A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ��B�ނ���C�A���u�~���𓊗^���邱�Ƃɂ���ăX�e���C�h�Ȃǂ̎��Âɒ�R���ƂȂ邱�Ƃ��m���Ă���B�������C�}�����d�ǂ̖���������邢�͔x����ɑ��ẮC���A��ɉ����ĒZ���I�i1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂̓��^��K�v�Ƃ���ꍇ������B |
| �@5�j | �@�z���Ԃ��s����Ȍ��t���͓��̑̊O�z�{�s�� �@���t���͎��Ɍ����̈��肪�����ꍇ�ɂ����āC���ɓ��A�a���������Ă���ꍇ��p��ȂǂŒ�A���u�~�����ǂ̂���ꍇ�ɂ́C���͂ɍۂ��ጌ����V���b�N���N�������Ƃ����邽�߁C�z�����ʂ�������ړI�ŗ\�h�I���^���s�����Ƃ�����B �@�������ʏ�́C�K�ȑ̊O�z�̕��@�̑I���ƁC���̖Ö@�őΏ����邱�Ƃ���{�Ƃ���B |
| �@6�j | �@�Ìň��q�̕�[��K�v�Ƃ��Ȃ����ÓI���������Ö@ �@���ÓI���������Ö@�ɂ́C���ݗl�X�̕��@������B�L�Q���������肳��Ă��āC�I��I�Ⴕ���͏��I��I�L�Q���������̕��@���m������Ă���ꍇ�ɂ́C���̕��@��D�悷��B����ȊO�̔�I��I�L�Q����������C�L�p������[�̕��@�Ƃ��āC���������Ö@������B �@�M�����o���[�nj�Q�C�}���d�Njؖ��͏ǂȂNjÌň��q�̕�[��K�v�Ƃ��Ȃ��Ǘ�ł́C�u���t�Ƃ��ē����A���u�~�����܂��g�p����B�A���u�~�����܂̎g�p�́C�̉����ǂȂǂ̗A������p�̊댯���قƂ�ǂȂ��C�V�N�����������g�p���邱�ƂƔ�r���Ă����S�ł���B �@�P���Z������ۂ��߂ɂ́C�ʏ�́C�����A���u�~���������͍����A���u�~����d�����t�Ɋ�߂��Ēu���t�Ƃ��ėp����B�����A���u�~���Z�x���Ⴂ�ꍇ�ɂ́C�����A���u�~���ɂ��u���́C�x�������\�����L��̂ŁC�u���t�̃A���u�~���Z�x�߂��铙�̒��ӂ��K�v�ł���B���M�l�������́C�܂�Ɍ����ቺ���������̂ŁC�����Ƃ��Ďg�p���Ȃ��B��ނ��g�p����ꍇ�́C���Ɍ����̕ϓ��ɗ��ӂ���B1��̌����ʂ́C�z�����ʂ̓��ʂȂ���1.5�{�ʂ���Ƃ���B�J�n���́C�u���t�Ƃ��Đl�H�P���t���g�p���邱�Ƃ��\�ȏꍇ�������i���������̒u���t�Ƃ��ĐV�N�����������p������ꍇ�ɂ��ẮC�V�N���������̍��Q�ƁB�܂��C���ÓI���������Ö@�Ɋ֘A���闯�ӎ����ɂ��ẮC�Q�l14���Q�Ɓj�B |
| �@7�j | �@�d�ǔM�� �@�M����C�ʏ�18���Ԉȓ��͌����Ƃ��čזE�O�t��[�t�őΉ����邪�C18���Ԉȓ��ł����Ă������A���u�~���Z�x��1.5g/dL�����̎��͓K�����l������B �@�M�����ʂ��̕\�ʐς�50���ȏ゠��C�זE�O�t��[�t�ł͏z�����ʂ̕s�������邱�Ƃ�����ȏꍇ�ɂ́C�l�H�P���t���邢�͓����A���u�~�����܂őΏ�����B |
| �@8�j | �@��`�����ǂɋN������x����邢�͒����ȕ���F�߂���ꍇ �@�p�O�C�p�゠�邢�͌o���ێ�s�\�ȏd�ǂ̉����Ȃǂɂ���`�����ǂ����݂��C���Ò�R���̔x����邢�͒����ȕ���F�߂���ꍇ�ɂ́C���A��ƂƂ��ɍ����A���u�~�����܂̓��^���l������B |
| �@9�j | �@�z�����ʂ̒����Ȍ������}���X���Ȃ� �@�}���X���C���ǂȂǂŏz�����ʂ̒����Ȍ������V���b�N���N�������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B |
| 3�D | ���^�� |
�@�K�v���^�ʁig�j=
�@�@���ҏ㏸�Z�x�ig/dL�j�~�z�����ʁidL�j�~2.5
�@�������C���ҏ㏸�Z�x�͊��Ғl�Ǝ����l�̍��C�z�����ʂ�0.4dL/kg�C���^�A���u�~���̌��Ǔ��������4/10�i40���j�Ƃ���B
�@���Ƃ��C�̏d��kg�̊��҂̌����A���u�~���Z�x��0.6g/dL�㏸���������Ƃ��ɂ́C0.6g/dL�~�i0.4dL/kg�~��kg�j�~2.5=0.6�~�ԁ~1=0.6��g�𓊗^����B
�@���Ȃ킿�C�K�v���^�ʂ͊��ҏ㏸�Z�x�ig/dL�j�~�̏d�ikg�j�ɂ��Z�o�����B
�@����C�A���u�~��1g�̓��^�ɂ�錌���A���u�~���Z�x�̏㏸�́C�̏d��kg�̏ꍇ�ɂ́C�m�A���u�~��1g�~���Ǔ�������i4/10�j�n�ig�j/�m�z�����ʁn�idL�j���Ȃ킿�C
�@�u1g�~0.4/�i0.4dL/kg�~��kg�j=1/�ԁig/dL�j�v�C
�܂�̏d�̋t���ŕ\�킳���B
| 4�D | ���^���ʂ̕]�� |
�@���^���ʂ̕]����3���Ԃ�ړr�ɍs���C�g�p�̌p���f���C���R�Ɠ��^�������邱�Ƃ̂Ȃ��悤�ɒ��ӂ���B
�@�Ȃ��C�P���Z�����̌v�Z���ɂ��Ă͖{�������m���n�u�P���Z�����ɂ��āv�ɋL�ڂ��Ă���B
| 5�D | �s�K�Ȏg�p |
| �@1�j | �@�`�������Ƃ��Ẳh�{�⋋ �@���^���ꂽ�A���u�~���͑̓��Ŋɏ��ɑ�Ӂi�������͖�17���j����C���̂قƂ�ǂ͔M���Ƃ��ď����Ă��܂��B�A���u�~�����A�~�m�_�ɕ�������C�̑��ɂ�����`�����̍Đ����̌����ƂȂ�̂͂킸���ŁC���p�����ɂ߂ĒႢ���Ƃ�C�K�{�A�~�m�_�ł���g���v�g�t�@���C�C�\���C�V���y�у��`�I�j�����ɂ߂ď��Ȃ����ƂȂǂ���C�h�{�⋋�̈Ӌ`�͂قƂ�ǂȂ��B��p��̒�`�����ǂ∫����ᇂɎg�p���Ă��C�ꎞ�I�Ɍ����`���Z�x���㏸�������P���Z�������ʂ������ȊO�ɁC�h�{�w�I�ȈӋ`�͂قƂ�ǂȂ��B�h�{�⋋�̖ړI�ɂ́C���S�Ö��h�{�@�C�o���h�{�@�ɂ��A�~�m�_�̓��^�ƃG�l���M�[�̕⋋���h�{�w�I�ɒ`�����̐����ɗL���ł��邱�Ƃ�����ƂȂ��Ă���B |
| �@2�j | �@�]���� �@�]�������삠�邢�̓N�������o����̌��ǝ��k�ɑ���l�H�P���t���邢�̓A���u�~�����܂̓��^�ɂ��C�]�g�D�̏�Q���h�~�����Ƃ�����w�I�����͂Ȃ��C�g�p�̑ΏۂƂ͂Ȃ�Ȃ��B |
| �@3�j | �@�P�Ȃ錌���A���u�~���Z�x�̈ێ� �@�����A���u�~���Z�x��2.5�`3.0g/dL�ł́C�����̕���Ȃǂ̗Տ��Ǐ��悳�Ȃ��ꍇ�������C�����A���u�~���Z�x�̈ێ��⌟���l�̐����݂̂�ړI�Ƃ������^�͍s���ׂ��ł͂Ȃ��B |
| �@4�j | �@�������҂ւ̓��^ �@�������҂ɑ���A���u�~�����܂̓��^�ɂ�鉄�����ʂ͖��炩�ɂ���Ă��Ȃ��B �@���������̊ϓ_������s�K�v�ȓ��^�͍T����ׂ��ł���B |
| 6�D | �g�p��̒��ӓ_ |
| �@1�j | �@�i�g���E���ܗL�� �@�e���ܒ��̃i�g���E���ܗL�ʁm3.7mg/mL�i160mEq/L�j�n�ȉ��͓����ł��邪�C�����A���u�~�����܂̑�ʎg�p�̓i�g���E���̉ߑ�ȕ��ׂ��������Ƃ�����̂Œ��ӂ��K�v�ł���B |
| �@2�j | �@�x����C�S�s�S �@�����A���u�~�����܂̎g�p���ɂ͋}���ɏz�����ʂ���������̂ŁC�A�����x�߂��C�x����C�S�s�S�Ȃǂ̔����ɒ��ӂ���B�Ȃ��C20���A���u�~������50mL�i�A���u�~��10g�j�̗A���͖�200mL�̏z�����ʂ̑����ɑ�������B |
| �@3�j | �@�����ቺ �@���M�l�������̋}���A���i10mL/���ȏ�j�ɂ��C�����̋}���Ȓቺ���������Ƃ�����̂Œ��ӂ���B |
| �@4�j | �@���A �@���A��ړI�Ƃ���Ƃ��ɂ́C�����A���u�~�����܂ƂƂ��ɗ��A��p����B |
| �@5�j | �@�A���u�~�������\�̒ቺ �@�����̕a�Ԃɑ���g�p�ł́C�A���u�~���̍����\�̒ቺ���������Ƃ�����B���Ɍ����A���u�~���Z�x��4g/dL�ȏ�ł͍����\���}�������B �@�m���n�P���Z�����ɂ��� �@�P���Z�����i�j��pH�C���x�C�\������`�����̎�ނɂ��e������邽�߁C�����l�̕����M���ł��邪�C�������̒`���Z�x���Z�肷����@������B�����A���u�~���Z�x�C�������`���iTP�j�Z�x����̎Z�o�ɂ͉��L�̌v�Z����p����B |
| �@1�D | �����A���u�~���l�iCg/dL�j���̌v�Z���F �@��=2.8C+0.18C2+0.012C3 |
| �@2�D | �������`���Z�x�iCg/dL�j���̌v�Z���F �@��=2.1C+0.16C2+0.009C3 �v�Z��F |
| �@1�D | �A���u�~�����^�ɂ��Alb�l��0.5g/dL�㏸�����ꍇ���P���Z�����̏㏸�i1�����j�C �@��=2.8�~0.5+0.18�~0.52+0.012�~0.53 �@�@=1.45mmHg |
| �@2�D | TP�l��7.2g/dL�̏ꍇ���P���Z�����i2�����j�C �@��=2.1�~7.2+0.16�~7.22+0.009�~7.23 �@�@=26.77mmHg |
| VI | �@�V�����E�����ɑ���A���Ö@ |
| 1�D | ���n�������n���ɑ���Ԍ����Z���t�̓K���g�p | �P�j |
�@�Ȃ��C�����ł̗A���̑Ώێ��́C�o����28���ȍ~4�����܂łł���C�Ԍ����Z���t�̗A���͈ȉ��̎w�j�ɏ������邪�C���n���͑��l�ȕa�Ԃ��������ߌX�̏Ǘ�ɉ������z�����K�v�ł���B
| �@1) | �@�g�p�w�j |
| �@�i1�j | �@�ċz��Q���F�߂��Ȃ����n�� |
| �@�@�D | �@Hb�l��8g/dL�����̏ꍇ �@�ʏ�C�A���̓K���ƂȂ邪�C�Տ��Ǐ�ɂ���Ă͕K�������A���̕K�v�͂Ȃ��B |
| �@�A�D | �@Hb�l��8�`10g/dL�̏ꍇ �@�n���ɂ��ƍl�����鎟�̗Տ��ǏF�߂���ꍇ�ɂ́C�A���̓K���ƂȂ�B �@�������̕p���C�������̑��ċz�C���ċz�E�������ċz�C�s�����C�M�����̈Ք�J�C�̏d�����s�ǁC���̑� |
| �@�i2�j | �@�ċz��Q���������Ă��関�n�� �@��Q�̒��x�ɉ����ĕʓr�l������B |
| �@2) | �@���^���@ |
| �@�i1�j | �@�g�p���t �@�̌���2�T�Ԉȓ���MAP���Ԍ����Z���t�iMAP��RCC�j���g�p����B |
| �@�i2�j | �@���^�̗ʂƑ��x |
| �@�@�D | �@���������S�s�S���F�߂��Ȃ����n�� �@1��̗A���ʂ�10�`20mL/kg�Ƃ��C1�`2mL/kg/���� �̑��x�ŗA������B�������C�A�����x�ɂ��Ă͂���ȊO�̑��x�i2mL/kg/���Ԉȏ�j�ł̌����͏\���ɍs���Ă��Ȃ��B |
| �@�A�D | �@���������S�s�S���F�߂��関�n�� �@�S�s�S�̒��x�ɉ����ĕʓr�l������B |
| �@3) | �@�g�p��̒��� |
| �@�i1�j | �@�n���̖h�~ |
| �@�@�D | �@�����������t�B���^�[�̎g�p�� �@���t�o�b�O����������������C�����A���ŋz������Ɨn���̌����ɂȂ�B���������āC���t�����R�ɗ��������邩�C�z�����č̎悷��ꍇ�ɂ͊ɘa�ȉA���ɂ��s���B |
| �@�A�D | �@���ːj�̃T�C�Y �@�V�����ɑ���̌���2�T�Ԗ�����MAP���Ԍ����Z���t�̈��S���͊m������Ă��邪�C2�T�Ԉȍ~��MAP���Ԍ����Z���t����ː��Ǝˌ�ɔ����������t�B���^�[��ʂ��Ă���24G���ׂ����ːj��p���ėA���|���v�ʼn������ėA������ƁC�n�����N�����댯��������̂ŁC�A�����x��x�����C�n���̏o���ɏ\���Ȓ��ӂ��K�v������B |
| �@�i2�j | �@�����Ԃ�v����A�� �@���t�o�b�O�J�����6���Ԉȓ��ɗA������������B�c�]���͔j������B1��ʂ̌��t��A������̂�6���Ԉȏ��v����ꍇ�ɂ́C�g�p���t�ۓI�ɕ������ėA�����C���g�p�̕������͎g�p���܂�4���ɕۑ�����B |
| �@�i3�j | �@�@���̌� �@�@���̌��͈�w�I�ɓK��������C�u�A���Ö@�̎��{�Ɋւ���w�j�v��XII�̂Q�́u�K�v�ƂȂ�ꍇ�v�Ɍ���s���ׂ��ł��邪�C���{����ꍇ�́C�̌���i���S�Ȍ��t���܂̊m�ۓ��Ɋւ���@���{�s�K���j�ɏ]�����ƂƂ��C�Ƃ�킯�A����ڐA�БΏh��a�ɗ��ӂ���K�v������C���ː��Ǝ˂�15�`50Gy�͈̔͂Ƃ���B�܂��C�������̕���p���N����ꍇ�����邱�Ƃɂ����ӂ���K�v������B |
| 2�D | �V�����ւ̌����Z���t�̓K���g�p |
| �@1) | �@�g�p�w�j |
| �@�i1�j | �@���ǐ��̎����݂̂Ȃ����́C�o���Ǐ݂�ꂸ�C�S�g��Ԃ��ǍD�ȏꍇ�́C��������3��/��L�����̂Ƃ��Ɍ����Z���t�̓��^���l������B |
| �@�i2�j | �@�L�ĂȎ����Ȃ����͎����ȊO�ɂ����炩�ȏo���i�@�o���C���o���o���C�����Ǐo���C���W���o���Ȃǁj��F�߂�ꍇ�ɂ́C��������5��/��L�ȏ�Ɉێ�����B |
| �@�i3�j | �@�̑��̖��n���Ȃǂɂ��Ìň��q�̒������ቺ���ꍇ�ɂ́C��������5��/��L�ȏ�Ɉێ�����B |
| �@�i4�j | �@�N�P�I���u���s���ꍇ�ɂ́C��������5��/��L�ȏ�Ɉێ�����B |
| 3�D | �V�����ւ̐V�N���������̓K���g�p |
| �@1�j | �@�g�p�w�j |
| �@�i1�j | �Ìň��q�̕�[ �@�r�^�~��K�̓��^�ɂ�������炸�CPT����с^���邢��APTT�̒����ȉ���������C�o���Ǐ��F�߂邩�N�P�I���u���s���ꍇ |
| �@�i2�j | �@�z���t�ʂ�1/2����Ԍ����Z���t�A���� |
| �@�i3�j | �@Upshaw-Schulman�nj�Q�i��V�����𐫌��������������a�j |
| �@2�j | �@���^���@ �@�i1�j�Ɓi2�j�ɑ��ẮC10�`20mL/kg�ȏ��K�v�ɉ�����12�`24���Ԗ��ɌJ��Ԃ����^����B �@�i3�j�Ɋւ��Ă�10mL/kg�ȏ��2�`3�T�Ԗ��ɌJ��Ԃ����^����B |
| �@3�j | �@���̑� �@�V���������ǂɑ��镔�������A���ɂ́C�]���C�V�N�����������g�p����Ă������C�قƂ�ǂ̏ꍇ�͐����H�����ő�։\�ł���B |
�@����
| �@1�j | ���{�����Ȋw�V�����ψ���F���n�������n���ɑ���A���K�C�h���C���ɂ��āD������ 1995;99:1529-1530 |
������
�@����̎g�p�w�j�̌�������5�`10�N�Ԃ�ł��邪�C���̊Ԃɂ�����A����w���܂ވ�w�̊e�̈�ɂ�����i�����W�͖ڊo�����C�܂��C�u���S�Ȍ��t�̈���m�ۓ��Ɋւ���@���v�̐���Ɓu�@�v�̉������s���C���t���ƂƗA���Ö@�݂̍�����@�I�Ɉʒu�Â���ꂽ���Ƃ܂��Ẳ����ł���B�g�p�w�j�ł͍ŐV�̒m���Ɋ�Â����������s�����ق��C�v����쐬���C�`���Ɏ����ƂƂ��ɁC�a�ԕʂɓK�����������C�����Ɏ������B����ɁC�V�����ւ̗A���̍���݂��邱�Ƃɂ����B
�@�{�w�j���ł��邾�����}�ɁC���L�͂ɐZ������悤�C�W�Ҋe�ʂ̌䋦�͂����肢�������B����́C���ɐV���Ȏ��ؓI�Ȓm��������ꂽ�ꍇ�ɂ́C�{�w�j�𑬂₩�ɉ������Ă����\��ł���B

