(別紙)
第1回 次世代医療機器評価指標検討会(厚生労働省)/
医療機器開発ガイドライン評価検討委員会(経済産業省)合同検討会
議事概要
医療機器開発ガイドライン評価検討委員会(経済産業省)合同検討会
議事概要
| 日時 | : | 平成17年8月4日(木) 14:00〜16:20 | ||||||||
| 場所 | : | 中央合同庁舎5号館17階厚生労働省専用第21会議室 | ||||||||
| 出席者 | : | 吉田純委員(座長)、赤松幹之委員、菊地眞委員、佐久間一郎委員、澤芳樹委員、妙中義之委員、辻岡克彦委員、土屋利江委員、橋爪誠委員、平岡真寛委員、比留間潔委員、山口照英委員(五十音順)
厚生労働省医薬食品局審査管理課医療機器審査管理室 厚生労働省医政局研究開発振興課 経済産業省商務情報政策局医療・福祉機器産業室 | ||||||||
| 議事 | : |
| ||||||||
| 概要 | : |
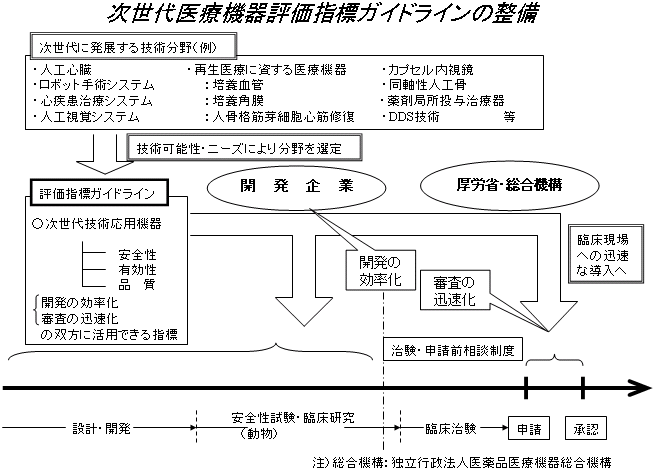
| ○ | (別添資料1参照) |
2.評価指標ガイドラインについて
(別添資料2参照)
| ○ | 評価指標、ガイドライン等は、1種類の医療機器につき網羅的ではなく開発上の隘路、審査上のクリティカルポイントのみについて作成する。 |
| ○ | 非臨床で問題がなくても、臨床で問題が出ることは日常茶飯事であるので、実用に供するものを作成するのであれば、少なくとも臨床上の有効性・安全性が関連学会等で認められていることが必要。 |
| ○ | あまり成熟してしまった技術を対象に硬直的で詳細な基準を作るのではなく、ある程度プロトタイプができた技術について、治験に入る前に最低限確認しておくべきことや臨床試験時の評価項目を示すことを考えている。 |
| ○ | 再生医療等の分野では、生物由来製品の確認申請のように臨床試験の前の段階で何を確認すべきかを示す必要もあるのではないか。 |
| ○ | 基本要件より具体的なものを作成する。 |
| ○ | 一旦完成したら改訂されないガイドラインではなく、日進月歩の技術革新についてゆけるよう、ある程度の柔軟性を持たせることも必要。 |
| ○ | 具体的に念頭に置いているのは例えば3年程度で実用化される技術である。 |
| ○ | 医療機器は、医薬品と本質的に異なるので、臨床試験なしで評価できる部分等、医薬品と比べて簡略化できる点がどこかを見極めるべき。 |
| ○ | 医療機器は臨床試験に入ってから設計変更するものもある点に留意する必要がある。 |
| ○ | 将来の発展性を選択する上での考慮点として挙げてあるが、普及性、汎用性といった医療経済性の観点を含めても良いのではないか。 |
| ○ | 既成事実を優先したガイドラインでは輸入超の実態のままになってしまうので、理想論に基づき戦略的に日本としてどの分野を重視すべきか決めるべきである。 |
| ○ | 許認可の判断に使用するガイドラインであるとすると、安全性に対し、検討会が責任をどこまで持つのか考えておく必要がある。 |
3.評価指標ガイドライン設定の対象候補について
| ○ | NEDOプロジェクトの対象等、企業による安定供給の見込みのある課題を採り上げるべきではないか。 |
| ○ | 再生医療の標準化等、既存の研究を活用し、無駄な重複は避けるべき。1研究班でできる程度のものでは物足りない。 |
| ○ | 医薬品医療機器総合機構で相談を受けたものを活用できないかとの提案については、守秘義務があり、困難。守秘義務がないとしても、医療機器の相談業務は開始したばかりで現時点ではまだ十分な数の相談を受けていないし、承認申請直前のものが多く、既に開発がほぼ終了しているものなので今回のガイドラインの対象としては不適当。 |
| ○ | 2〜3年で実用化されるものだけでなく、技術的に困難なものは、10年後に実用化されるような課題であっても対象に加えても良いのではないか。 |
| ○ | 毎年5分野程度選択し、1年限りの課題、何年か継続して行う課題、最初の年に落選したが次年度に採用される課題等を想定している。 |
| ○ | 人工赤血球は、感染の危険の少ない輸血を実現でき、HIVの蔓延するアフリカ等の国に対し日本が国際貢献もできるので課題としてふさわしいのではないか。 |
| ○ | 単独の機器についてのガイドラインだけでなく、システムとしての安全性にも配慮した組み合わせのガイドラインも必要。 |
| ○ | 画像診断機器の高度化、分子イメージング、高機能手術ロボット、低侵襲治療機器の分野に早く取りかかって欲しい。 |
| ○ | 完全体内植え込み式人工心臓、人工角膜移植、心筋再生なども注目すべき。 |
| ○ | 個別研究課題のレベルよりも上位の概念での議論や方向性を示すという考え方や、疾患群で捉え、循環器ガイドラインを作り、細部を変えて人工心臓ガイドラインと心筋再生ガイドラインを作るという考え方もあるのではないかとのご意見もあるが、より具体的なガイドラインとするため具体的な課題を選定していただきたい。 |
| ○ | 現実的な問題として、作業に熱意のある参加者のいる課題、学会協力の得られる課題を選定すべき。 |
4.その他
| ○ | 次回(9月13日に開催予定)は、対象とする具体的課題を決定したい。 |
(了)
| 資料1 |
次世代医療機器評価指標検討会(厚生労働省)/
医療機器開発ガイドライン評価検討委員会(経済産業省)
の合同による合同検討会の開催について
医療機器開発ガイドライン評価検討委員会(経済産業省)
の合同による合同検討会の開催について
平成17年8月4日
厚生労働省
経済産業省
厚生労働省
経済産業省
| 1. | 趣旨 厚生労働省及び経済産業省においては、新規技術を活用した次世代の医療機器について、開発の迅速化及び薬事法審査の円滑化に資する評価指標等を検討するため、厚生労働省に「次世代医療機器評価指標検討会」、経済産業省に「医療機器開発ガイドライン評価検討委員会」を設置したところである。 このたび、双方の第1回を開催するに当たり、両省の連携を図り、生物学的分野及び工学的分野からの意見を効果的、効率的に集約するため、ここに合同検討会を開催するものである。 | ||||
| 2. | 構成
| ||||
| 3. | スケジュール等
| ||||
| 4. | その他 合同検討会においては、委員各位による率直かつ自由な意見交換を確保する必要があることから非公開とするが、議事内容については合同検討会終了後、可能な限り早急に議事概要を作成し原則公表するものとする。 |
(別紙)
合同検討会名簿
| あかまつ もとゆき 赤松 幹之 | 産業技術総合研究所人間福祉医工学研究部門長 | |
| おかの みつお 岡野 光夫 | 東京女子医科大学先端生命医科学研究所教授 | |
| きくち まこと 菊地 眞 | 防衛医科大学教授(医用電子工学) | |
| さくま いちろう 佐久間 一郎 | 東京大学大学院教授(精密機械工学) | |
| さわ よしき 澤 芳樹 | 大阪大学医学部助教授(心臓血管外科) | |
| たえなか よしゆき 妙中 義之 | 国立循環器病センター人工臓器部長 | |
| つじおか かつひこ 辻岡 克彦 | 川崎医科大学教授(生理学・生体医工学) | |
| つちや としえ 土屋 利江 | 国立医薬品食品衛生研究所療品部長 | |
| はしづめ まこと 橋爪 誠 | 九州大学医学部教授(災害救急医学) | |
| ひらおか まさひろ 平岡 真寛 | 京都大学医学部教授(放射線医学) | |
| ひるま きよし 比留間 潔 | 東京都立駒込病院輸血・細胞治療科部長 | |
| やまぐち てるひで 山口 照英 | 国立医薬品食品衛生研究所遺伝子細胞医薬部長 | |
| ○ | よしだ じゅん 吉田 純 | 名古屋大学医学部教授(脳神経外科学) |
| ○は座長 | ||
| (五十音順) | ||
合同検討会の開催スケジュールについて
平成17年8月4日
第1回(8月4日)
| ・ | 合同検討会の趣旨説明 |
| ・ | 対象課題選定上考慮すべき点について |
| ・ | 評価指標等(医療機器開発ガイドライン)を作成する分野の検討 |
第2回(9月上旬〜9月中旬)
| ・ | 評価指標等(医療機器開発ガイドライン)を作成する分野の決定 |
| ・ | 分野ごとの作成体制について |
| ・ | 評価指標等作成についての方向性を検討(指針として提示等) |
第3回(12月)
| ・ | 分野ごとに中間状況報告 |
| ・ | 進捗状況に応じて、今後の作成方針等について助言 |
第4回(3月)
| ・ | 分野ごとに最終状況報告 |
| ・ | 平成17年度事業の評価と平成18年度への課題整理 |
| 資料2 |