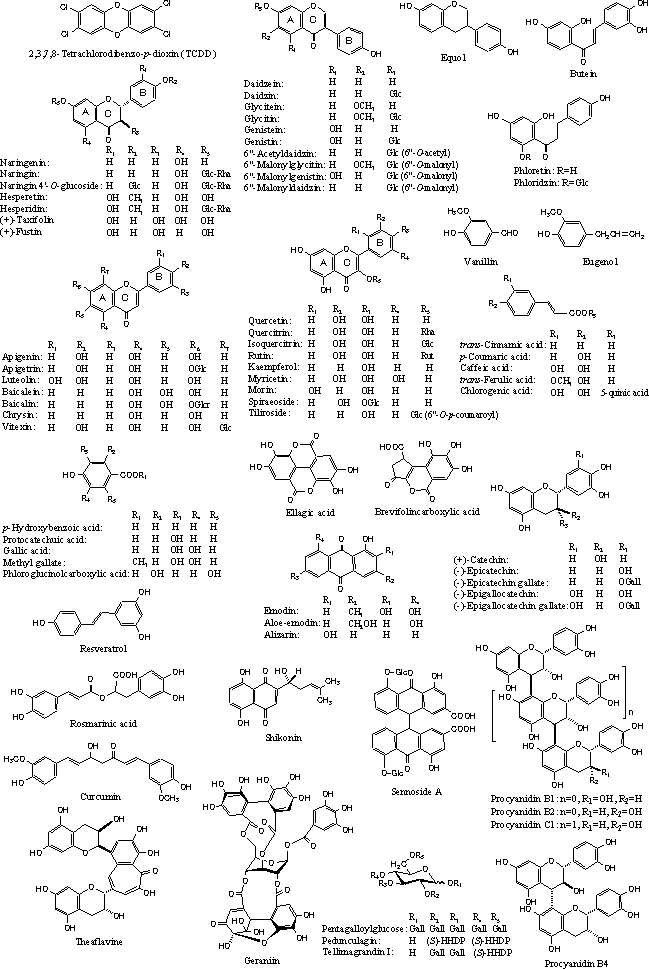
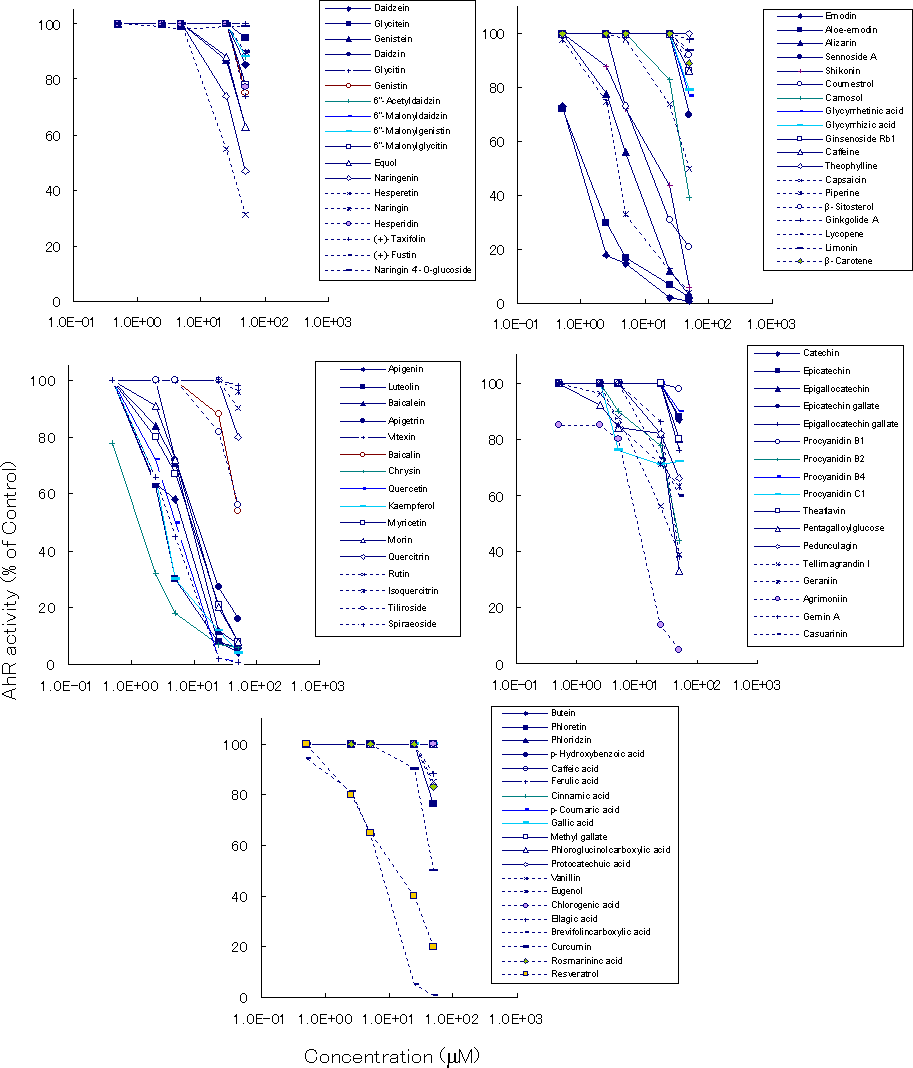
| |
EC70a)
(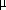 M) M) | |
EC70
(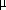 M) M) |
| Flavones |
Phloroglucinolcarboxylic acid |
nc |
| Apigenin |
1.9 |
Protocatechuic acid |
nc |
| Luteolin |
1.8 |
Vanillin |
nc |
| Baicalein |
5.1 |
Eugenol |
nc |
| Chrysin |
0.7 |
Chlorogenic acid |
nc |
| Apigetrin |
5.2 |
Ellagic acid |
nc |
| Vitexin |
ncb) |
Brevifolincarboxylic acid |
3.9 |
| Baicalin |
36.1 |
Curcumin |
35.4 |
| Flavonols |
Rosmarinic acid |
nc |
| Quercetin |
2.7 |
Resveratrol |
3.9 |
| Kaempferol |
2.1 |
Anthraquinones and naphtoquinones |
| Myricetin |
4.3 |
Emodin |
0.6 |
| Morin |
5.3 |
Aloe-emodin |
0.5 |
| Quercitrin |
nc |
Alizarin |
3.2 |
| Rutin |
nc |
Sennoside A |
nc |
| Isoquercitrin |
nc |
Shikonin |
5.6 |
| Tiliroside |
34.4 |
Condensed tannins |
| Spiraeoside |
2.1 |
(+)-Catechin |
nc |
| Flavanones |
(-)-Epicatechin |
nc |
| Naringenin |
27.7 |
(-)-Epigallocatechin |
nc |
| Hesperetin |
14.6 |
(-)-Epicatechin gallate |
nc |
| Naringin |
nc |
(-)-Epigallocatechin gallate |
nc |
| Hesperidin |
nc |
Procyanidin B1 |
nc |
| (+)-Taxifolin |
nc |
Procyanidin B2 |
nc |
| (+)-Fustin |
nc |
Procyanidin B4 |
nc |
| Naringin 4’-O-glucoside |
nc |
Procyanidin C1 |
nc |
| Isoflavones |
Theaflavin |
nc |
| Daidzein |
nc |
Hydrolyzable tannins |
| Glycitein |
nc |
Pentagalloylglucose |
29.6 |
| Genistein |
40.8 |
Pedunculagin |
42.0 |
| Daidzin |
nc |
Tellimagrandin I |
12.4 |
| Glycitin |
nc |
Geraniin |
27.3 |
| Genistin |
nc |
Casuarinin |
29.3 |
| 6”-Acetyldaidzin |
nc |
Agrimoniin |
6.4 |
| 6”-Malonyldaidzin |
nc |
Gemin A |
31.5 |
| 6”-Malonylgenistin |
nc |
Others |
| 6”-Malonylglycitin |
nc |
Coumestrol |
5.6 |
| Equol |
41.2 |
Carnosol |
30.7 |
| Chalcones |
Glycyrrhetinic acid |
nc |
| Butein |
nc |
Glycyrrhizic acid |
nc |
| Phloretin |
nc |
Ginsenoside Rb1 |
nc |
| Phloridzin |
nc |
Caffeine |
nc |
| Phenolcarboxylic acids and related compounds |
Theophylline |
nc |
| p-Hydroxybenzoic acid |
nc |
Capsaicin |
28.1 |
| Caffeic acid |
nc |
Piperine |
2.7 |
| trans-Ferulic acid |
nc |
β-Sitosterol |
nc |
| trans-Cinnamic acid |
nc |
Ginkgolide A |
nc |
| p-Coumaric acid |
nc |
Lycopene |
nc |
| Gallic acid |
nc |
Limonin |
nc |
| Methyl gallate |
nc |
β-Carotene |
nc |