�z�[�� > ����ɂ��� > ����ʂ̐���ꗗ > ������̎��g�� > �������� > �����J���Ȃ̌������ƂɊւ���\�Z�T�Z�v���O�̕]�� > �����Ɋւ���w�j�ɂ��� > ��`�q���×Տ������Ɋւ���w�j�ɂ���
��`�q���×Տ������Ɋւ���w�j�ɂ���
�Ȕ���0327001��
�����P�S�N�R���Q�V��
| �W���������@�ւ̒� �W��w�̒� �s���{���m�� �w��s�s�̒� ���j�s�̒� �W�c�̂̒� ���{��w�� |
�@�a |
�����@���Y
����@�i
�@��`�q���×Տ������ɂ��ẮA��`�q���×Տ������Ɋւ���w�j�i�����U�N�����ȍ�����Q�R���j�y�ё�w���ɂ������`�q���×Տ������Ɋւ���K�C�h���C���i�����U�N�����ȍ�����V�X���j�i�ȉ��u���w�j���v�Ƃ����B�j�ɂ��A���̓K���Ȏ��{��}���Ă����Ƃ���ł��邪�A���ʁA���w�j����p�~���A�V���ɁA��`�q���×Տ������Ɋւ���w�j�i�����P�S�N�����Ȋw�ȁE�����J���ȍ�����P���B�ȉ��u�w�j�v�Ƃ����B�j���߁A�����P�S�N�R���Q�V���ɍ��������Ƃ���ł���B�w�j�̐���̎�|�y�ы��w�j������̕ύX�_���͉��L�̂Ƃ���ł���̂ŁA�䗹�m�̏�A�W�҂ɑ�����m�����肢����B
��P�@����̎�|
�@���w�j���̍����A�����ɏ]���Ĉ�`�q���×Տ����������{����A���݂܂ŁA���i�̕���p�̕��Ȃ��A�܂��A�Ώێ����⓱����`�q������̌���������s����ȂǁA���̌������т������Ă����Ƃ���ł���B
�@�������Ȃ���A���w�j���ɂ����ẮA�ߋ��ɓ��l�̎�@�ɂ�錤�����Ⴊ�������Ƃ��Ă��A���ׂĂ̌����v��ɂ��Ĉꗥ�ɁA�����J����b�Ɂi��w���ɂ����Ă͕����Ȋw��b�ɂ������āj�ӌ������߁A����b�ɂ����ĊW�R�c��̐R�c���o�邱�Ƃ��K�v�Ƃ���A�܂��A���Y�������@��̎����ɊY������ꍇ�ɂ́A�����̎葱�ɉ����āA�����˗��҂ł����Ɠ����A���@�̋K��Ɋ�Â������͂������J����b�ɒ�o���邱�Ƃ��K�v�ł������B
�@���̐R���葱�Ɋւ��ẮA����11�N�T��18���̌����Ȋw�R�c��\�ɂ����āA������x���y������`�q���×Տ������ɂ��ẮA�v���Ȏ�g�݂��s����悤�A�R�������̐���Ǝ���R���̐��̏[�����������ׂ��ł���Ƃ̒��Ȃ��ꂽ�ق��A�K���ɘa���i�R�J�N�v��i�ĉ���j�i����12�N�R��31���t�c����j�y�ыK�����v���i�R���N�v��i����13�N�R��30���t�c����j�ɂ����āA�u���v���Ɏ��Â����{�ł���悤�Ȋw�I�E�ϗ��I�ȑ��ʂ���̐��Ƃɂ��R�c�܂��A����������������v���Ƃ��ꂽ�B
�@�����܂��A�����Ȋw�ȋy�ь����J���Ȃ́A��`�q���×Տ������̈�Ï�̗L�p���y�їϗ������m�ۂ��A�R���葱�̊ȑf���y�ѐv������}�邱�Ƃ��̑���`�q���×Տ������̓K���Ȑ��i��}�邱�Ƃ�ړI�Ƃ��āA���w�j����p�~���A�V���ɋ����ŁA��`�q���×Տ������Ɋւ���w�j�����肷�邱�ƂƂ������̂ł���B
��Q�@���w�j������̕ύX�_
�P�D�w�j�̖ړI�Ɋւ��鎖��
�@��`�q���×Տ��������u���Áv�̑��ʂ�L���錤���ł��邱�Ƃɂ��݁A��Ï�̗L�p���̊m�ۂ��w�j�̖ړI�Ƃ��Ė�������ƂƂ��ɁA���̎Љ�I�ȉe�����܂��A�����J�╁�y�[���̐��i���ɂ��A��`�q���×Տ��������A�Љ�ɊJ���ꂽ�`�Ŏ��{�����ׂ����Ƃ��K�肵���B
�Q�D�Ώێ����Ɋւ��鎖��
�i�P�j��`�������ɂ��ẮA�v�����̂��݂̂̂���`�q���×Տ������̑Ώێ����Ƃ��ċK�肳��Ă����Ƃ���ł��邪�A�������������������ΏۂƂȂ邱�Ƃ𖾂炩�ɂ��邽�߁A�d�ĂȈ�`��������Ώێ����Ƃ��ċK�肵���B
�i�Q�j�u�g�̂̋@�\�������Ȃ������v�ɂ��ẮA�Ⴆ�A�ǐ��������lj��Ȃǎl���̌����Ɏ���悤�Ȏ����A�����o�@�\�ɒ�������Q���y�ڂ��悤�Ȏ��������l������B
�R�D�i�����̊m�F�Ɋւ��鎖��
�@�l�̂ɓ��^������`�q�A�x�N�^�[���ɂ��āA���̕i���A�L�����y�ш��S���̊m�ۂ̂��߁A���Y��`�q���×Տ��������@��̎����ɊY�����邩�ۂ��ɂ�����炸�A���i�̗Տ������̎��{�̊�Ɋւ���ȗ߁i�����X�N�����ȗߑ�Q�W���j�Ɋ�Â��u������̐����Ǘ��y�ѕi���Ǘ���y�ю�����̐����{�݂̍\���ݔ���i������f�l�o�j�ɂ��āv�i�����X�N�R���R�P����S�W�O�������Ȗǒ��ʒm�j�����{�݂ɂ����Đ������ꂽ���̂łȂ���Ȃ�Ȃ����Ƃ������B
�S�D��`�I���ς��֎~���ׂ��זE�Ɋւ��鎖��
�@�]�����A��`�q���Â̑Ώۂ�̍זE�Ɍ��肷���|����A���B�זE�ɂ��Ă͈�`�I���ς��֎~���Ă����Ƃ���ł��邪�A���̎�|����薾�m�����邽�߁A���q�y�ї��q�݂̂Ȃ炸�A���y����ɂ��Ă��A��`�I���ς��֎~����邱�Ƃ��������̂ł���B�Ȃ��A��ɂ��ẮA�q�g�Ɋւ���N���[���Z�p���̋K���Ɋւ���@���i�����P�Q�N�@����P�S�U���j�ɂ�����Ɠ��`�ł���B
�T�D�팱�҂ɑ�������y�т��̓��ӂɊւ��鎖��
�i�P�j���w�j���ɂ����ẮA�팱�҂̓��ӂ͌����ɂ�邱�Ƃ��F�߂��Ă������A�q�g�Q�m���E��`�q��͌����Ɋւ���ϗ��w�j�i�����P�R�N�R�������Ȋw�ȁE�����J���ȁE�o�ώY�Əȍ�����P���j�ɂ�����C���t�H�[���h�E�R���Z���g�ɌW��K�蓙�܂��A�����ɂ�铯�ӂ͔F�߂��A���ׂĕ����ɂ�邱�ƂƂ����B
�i�Q�j����҂ɂ��ẮA�����I�ɔ팱�҂̈ӎv�y�ї��v���قł���ƍl������҂łȂ��Ă͂Ȃ�Ȃ����ƂƂ����B
�i�R�j�팱�҂ɑ�������ɂ��ẮA�팱�҂̏\���ȗ�����������悤�s��Ȃ���Ȃ�Ȃ��|�������B
�U�D���{�{�݂̒��̋Ɩ��Ɋւ��鎖��
�i�P�j��w�A��w�������p�@�ցA�����Ȋw��b�̏��ǂ������@�l�A�F�@�l�A�Ɨ��s���@�l�A���v�@�l���i�ȉ��u��w���v�Ƃ����B�j�ɌW��{�݂ɂ��ẮA��`�q���×Տ������̎��{�ɓ����蕶���Ȋw��b�̈ӌ������߂邱�Ƃ�s�v�Ƃ��A�����J����b�ɑ��Ă݈̂ӌ������߁A���̈ӌ������߂������̎ʂ����Ȋw��b�ɒ�o����݂̂ł悢���ƂƂ����B
�@�������A��w���ɂ����ẮA
-
(1)�@�K�v�ɉ����čs���i�s�y�ь��ʂ̕�
(2)�@�������̎ʂ��̒�o
(3)�@�d�厖�Ԃ���{�ɉe�����y�ڂ�������̂�����̕i���L�i�Q�j�Q�Ɓj�ɂ��ẮA�]���ǂ���A�����J����b�̂ق��A�����Ȋw��b�ɑ��Ă��s���K�v������B
�i�Q�j�팱�҂̎��S�A�d�Ăȕ���p�̔������̏d�厖�Ԃɂ��ẮA�]����������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ւ̕����߂Ă����Ƃ���ł��邪�A����ɉ����A���O�̏���`�q���×Տ������̎��{�ɉe�����y�ڂ��\���̂��鎡���������ꍇ�ɂ́A���Y�����Ƃ̈��ʊW�̗L���ɂ�����炸�A�����J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɕ��Ȃ���Ȃ�Ȃ����ƂƂ����B
�V�D�R���ψ���Ɋւ��鎖��
�i�P�j�R���ψ���ɂ����āA��蕝�L���ϓ_����̐R�����s�����Ƃ��ł���悤�A�q�g�Q�m���E��`�q��͌����Ɋւ���ϗ��w�j�ɂ�����戵���܂��A�V���ɁA�j���ψ��y�я����ψ��o������\������邱�Ƌy�ѕ����̊O���ψ��������邱�Ƃ�v���Ƃ����B
�i�Q�j�����J�𐄐i���邽�߁A�R���ψ���̎葱�Ɋւ���K��݂̂Ȃ炸�A�l����m�I���Y�����̕ی�ɔz�����A�R���̋L�^�����J���Ȃ���Ȃ�Ȃ����ƂƂ����B
�W�D�����J����b�̈ӌ��Ɋւ��鎖��
�i�P�j���{�{�݂̒�����`�q���×Տ������̎��{�Ɋւ������J����b�Ɉӌ������߂��ꍇ�A�����J����b�����ׂČ����Ȋw�R�c��Ɏ��₷��葱�����߁A�܂��͌����J����b�������̗L���҂̈ӌ����A���Y��`�q���×Տ������ɂ����āA�x�N�^�[�A��`�q���^���@���͑Ώێ��a���V�K����L���邩�ۂ��ȂLj�`�q���Â̕��@���V�K����L���邩�ۂ��A���̑��ʐR���̕K�v�Ȏ�����L���邩�ۂ��f���A�����L���Ȃ��ꍇ�͂R�O���ȓ��ɑ��₩�Ɉӌ����q�ׂ邱�ƂƂ��A�L����ꍇ�ɂ̂����Ȋw�R�c��Ɏ��₷�邱�ƂƂ����B
�@�Ȃ��A�����ł����V�K���Ƃ́A�C�O�ł͎g�p���т������Ă������ł͍ŏ��Ɏg�p�����x�N�^�[�ł��邱�Ɠ��A���{�����ɂ�����V�K�����������̂ł���B
�i�Q�j�����J����b�́A�i�P�j�̈ӌ����͏d��Ȏ��ԓ��Ɋւ���ӌ����q�ׂ��ꍇ�ɂ́A���̎ʂ����Ȋw��b�ɑ��t���邱�ƂƂ����B
�X�D�L�^�̕ۑ��Ɋւ��鎖��
�@��`�q���×Տ������Ɋւ���L�^�ɂ��ẮA�ۑ����Ԃ��߂Ă��Ȃ������Ƃ���ł��邪�A����͎��{�{�݂ɕK�v�ȏ�ɒ����Ԃ̕ۑ����`���Â��邱�ƂƂȂ�ߏ�ȕ��S�ƂȂ邱�Ƃ���A�f�Ø^�̕ۑ����ԓ��܂��A�����I���㏭�Ȃ��Ƃ��T�N�ԕۑ����邱�ƂƂ����B
10�D�閧�̕ی�Ɋւ��鎖��
�@�����ҁA�R���ψ���̈ψ��y�ю��{�{�݂̒��̂ق��A�����҂̕⏕�҂Ȃǂ������ΏێҌl�̔閧��m�肤�邱�Ƃ���A�l���̕ی�̓O���}�邽�߁A�����Ɍg���W�҂��ׂĂ����`�������Ƌy�т����̎҂��E��������������`�����p�����邱�Ƃm�ɂ����B
11�D�K�p���O�Ɋւ��鎖��
�@�@�ɒ�߂鎡���ɊY�������`�q���×Տ������́A�@�Ɋ�Â��K���Ɉς˂邱�ƂƂ��A��{�I�Ɏw�j�̑ΏۊO�Ƃ��Ď葱�̏d����r�������B �������A�w�j��P�͕��тɑ�U�͑�P�y�ё�R�̋K��́A�@�ɒ�߂鎡���ɂ��������K�p�����ׂ��ł��邱�Ƃ���A������K�p���邱�ƂƂ����B
��R�@�{�s�����y�ьo�ߑ[�u
�@�����P�S�N�S���P������̎w�j�̎{�s�ɔ����A���w�j���͔p�~����A�����Ɋ�Â��čs�����s�ׂł����Ďw�j�ɑ����̋K�肪������̂́A�w�j�Ɋ�Â��čs�������̂Ƃ݂Ȃ����B
�@���������āA�R���ψ���ւ̕t�c�ȂNJ��ɋ��w�j���Ɋ�Â����{�����葱���ɂ��ẮA���߂Ďw�j�Ɋ�Â����{����K�v�͂Ȃ��A�w�j�̎{�s���Ȍ�ɍs���s�ׂɂ��Ďw�j�ɏ]�����Ƃő������̂ł���B
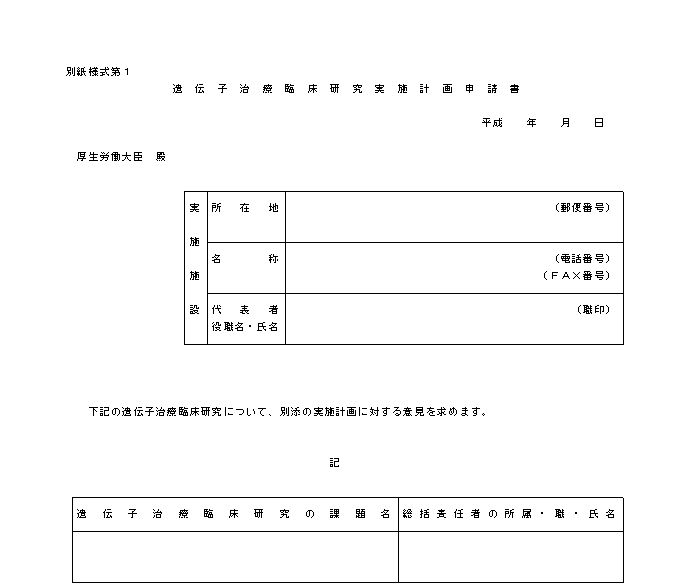
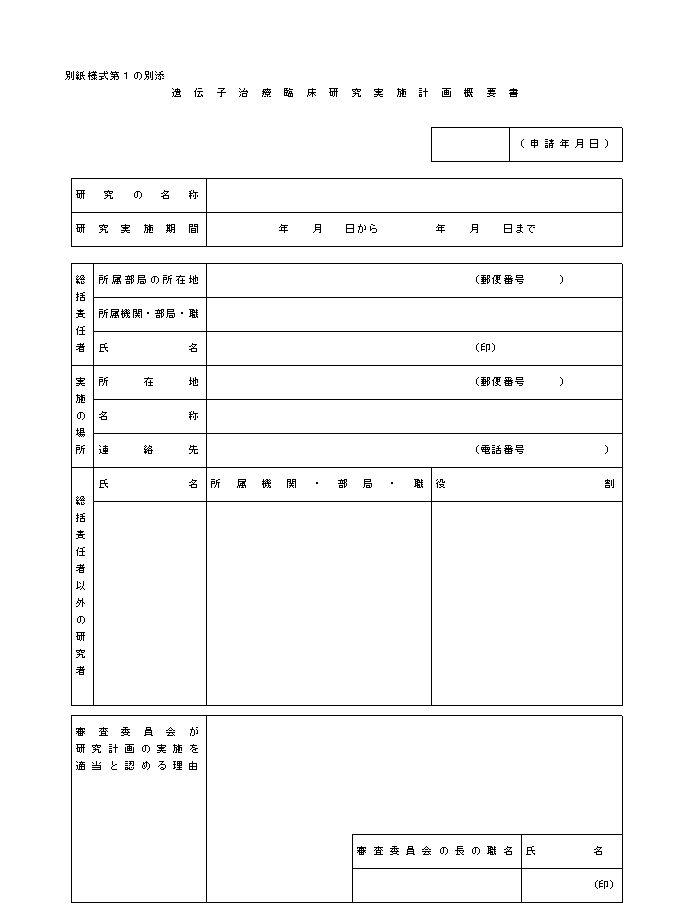
��S�@���{�v�揑�̋L�ڎ������Ɋւ��鎖��
�@�@���{�v�揑�̋L�ڎ������ɂ��ẮA���ɂ�邱�ƂƂ���B
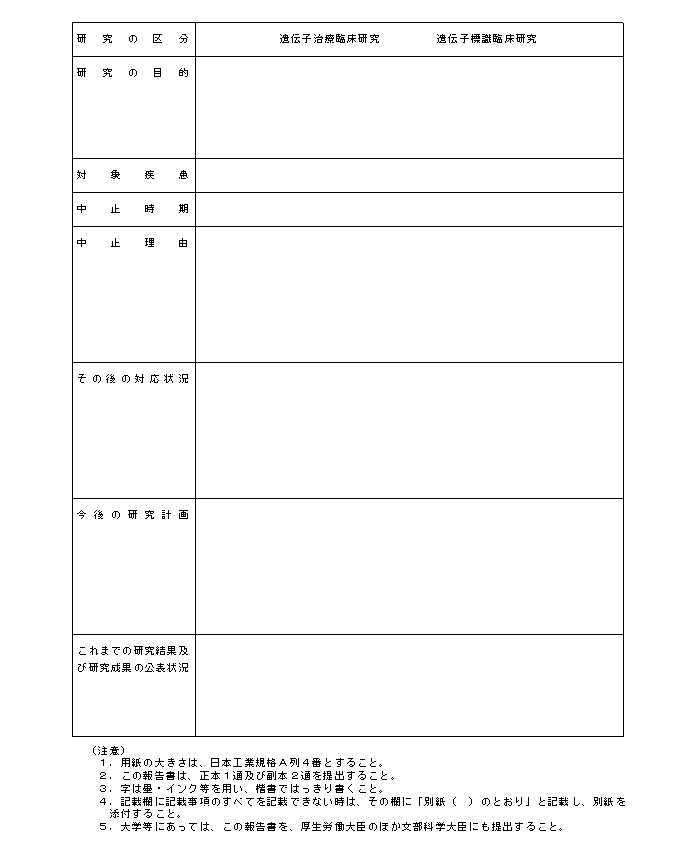
�i�P�j�w�j��S�͑�P�̂Q�y�тR�́u���{�v�揑�ɋL�ڂ��ׂ������v�y�сu���{�v�揑�ɓY�t���ׂ������v�̋�̓I�ȓ��e�́A�e�X�ʕ\�P�y�ѕʕ\�Q�̂Ƃ���ł���B
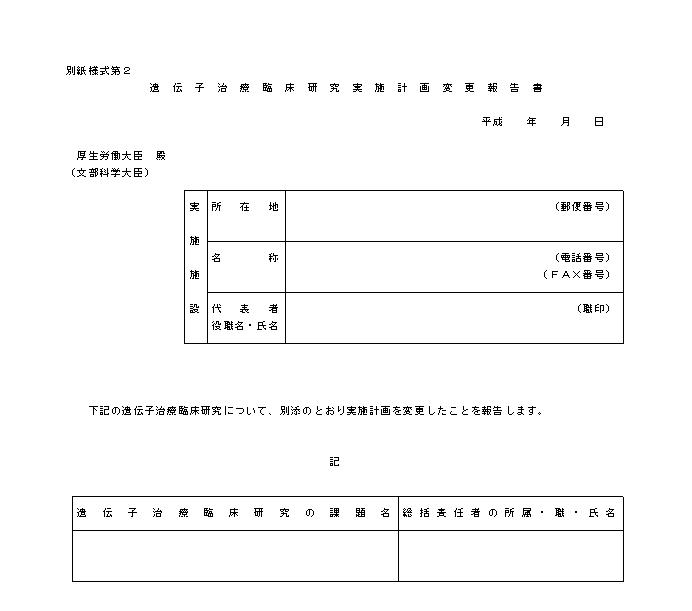
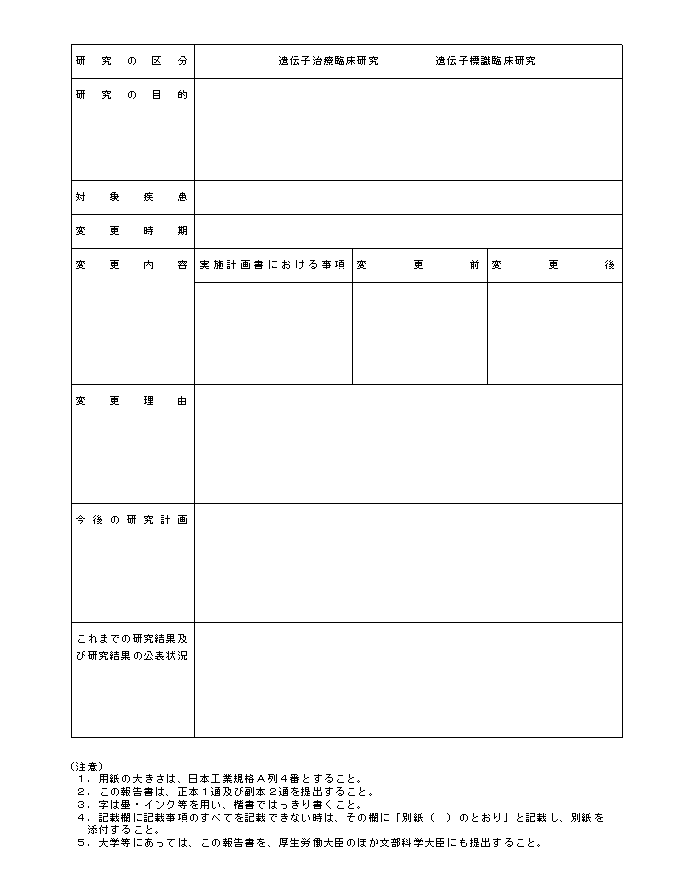
�i�Q�j�w�j��R�͑�S�̂P�ɂ����{�{�݂̒��������J����b�Ɉӌ������߂悤�Ƃ���ꍇ�́A�ʎ��l����P�ɁA�w�j��T�͑�P�̂Q�Ɍf���鏑�ނ�Y�t���Đ\�����邱�ƂƂ���B�Ȃ��A��w���ɂ����ẮA�����̏��ނ̎ʂ����Ȋw��b�ɂ����t����B
�i�R�j�w�j��R�͑�S�̂Q�ɂ����{�{�݂̒��������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɕ��s���ꍇ�́A������e�ɉ����Ď��̊e�X�̗l���ɂ�邱�ƂƂ���B
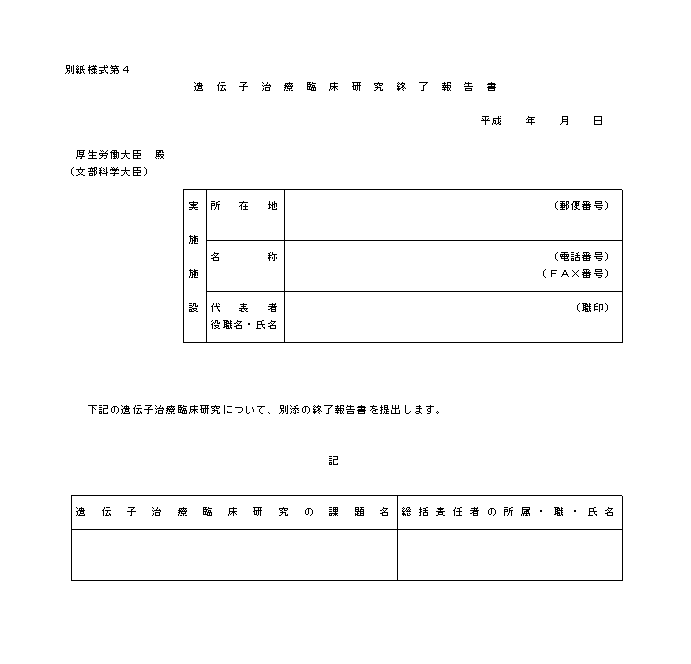
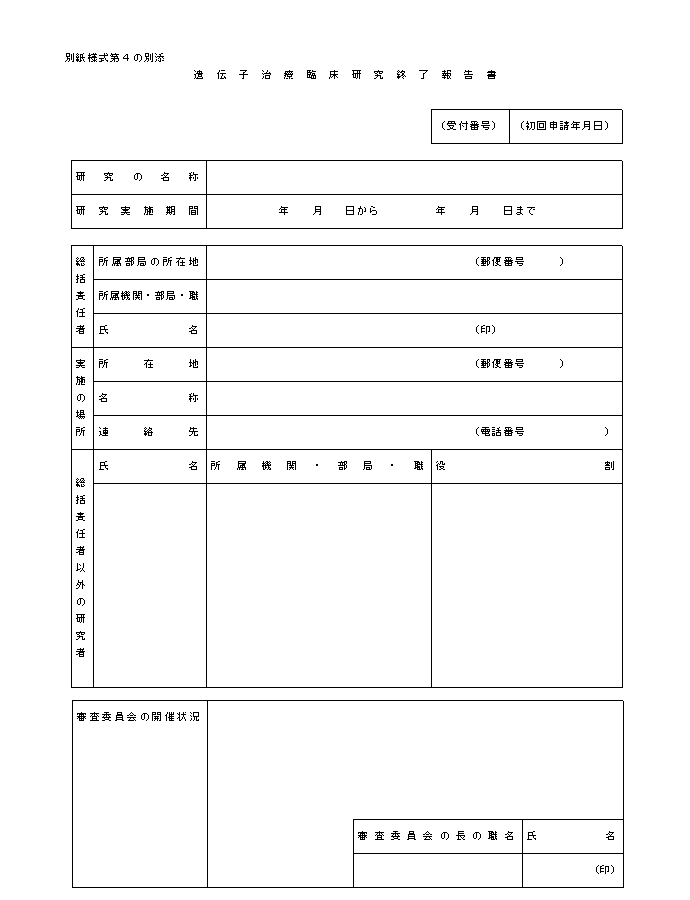
�i�S�j�w�j��R�͑�S�̂R�ɂ��A���{�{�݂̒��������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɑ������̎ʂ����o����ꍇ�ɂ́A��L�i�R�j�̌����̏I���̏ꍇ�̕i�ʎ��l����S�j�ɓ��Y�������̎ʂ���Y�t���邱�ƂƂ���B
�i�T�j�w�j��R�͑�S�̂S�ɂ��A���{�{�݂̒��������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɕ��s���ꍇ�́A�ʎ��l����T�ɂ�邱�ƂƂ���B
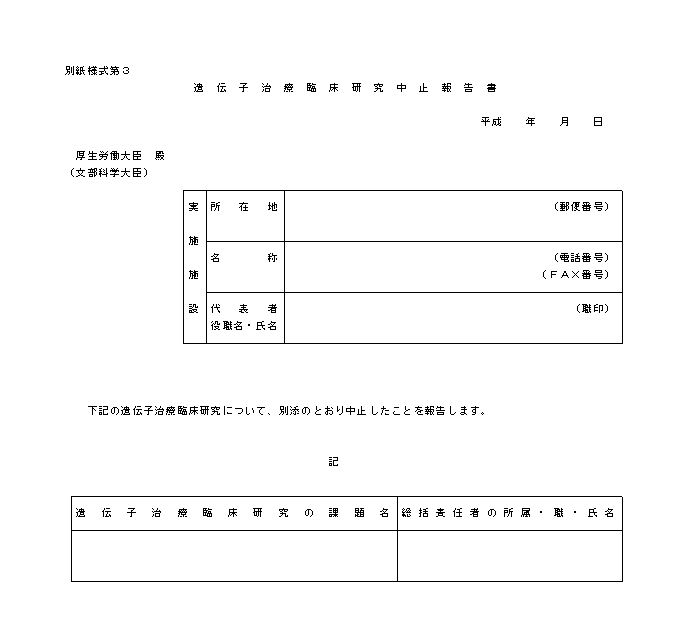
�@�Ȃ��A�d��Ȏ��Ԃ��A���͌����̎��{�ɉe�����y�ڂ������ꂪ���������肵�����߁A���Y��`�q���×Տ������𒆎~����ꍇ�́A�ʎ��l����R�ɂ�邱�ƂƂ���B
�i�U�j��L�i�Q�j����i�T�j�܂łɂ������J����b�ւ̈ӌ��Ɖ�A�����J����b�y�ѕ����Ȋw��b�ւ̕��̑��t��́A���L�̂Ƃ���ł���B
-
(1)�@�����J����
�@��b���[�����Ȋw��
�@��100-8916�@�����s���c������ւP�|�Q�|�Q
�@�d�b�@�O�R�|�R�T�X�T�|�Q�P�V�P
�@FAX�@ �O�R�|�R�T�O�R�|�O�P�W�R(2)�@�����Ȋw�ȁi��w���̏ꍇ�j
�@�����U���ǃ��C�t�T�C�G���X�ې����ϗ��E���S��
�@��100-8966�@�����s���c������ւP�|�R�|�Q
�@�d�b�@�O�R�|�T�Q�T�R�|�S�P�P�R
�@FAX�@ �O�R�|�T�Q�T�Q�|�S�P�P�S
��T�@���̑�
�P�D��`�q���×Տ������̎��{�ɓ�����A���̎����ɗ��ӂ��邱�Ƃ��K�v�ł���B
�i�P�j�����J����b�������x���Ȃ��|������`�q���×Տ������̎��{�v��ɏ]���A�K�Ɍ��������{���邱�ƁB
-
(1)�@�w�j��R�͑�Q�̂S�ɂ����āA�u�����ӔC�҂͈�`�q���×Տ����������{�v�揑�ɏ]���K�Ɏ��{����Ă��邱�Ƃ𐏎��m�F���邱�ƁB�v�Ƃ���Ă���Ƃ���ł���A�����ӔC�҂́A��`�q���×Տ��������K�ɍs���Ă��邱�Ƃ����I�Ɋm�F���邱�ƁB
�@�Ȃ��A���{�v�����E���Ĉ�`�q���×Տ����������{���Ă������Ƃ����������ꍇ�A�����ӔC�҂͎��{�{�݂̒����ɕK�v�ȕ��s���A���{�{�݂̒��͂��̎|����L�A����ɑ��₩�ɕ��邱�ƁB(2)�@���{�v���ύX����K�v���������ꍇ�́A�w�j��R�͑�S�̂Q�ɂ��A�����J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɑ����邱�ƁB
�i�Q�j��`�q���×Տ������̎��{�ɍۂ��������d��Ȏ��ԓ��Ɋւ��A���₩�Ɍ����J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɕ��邱�ƁB
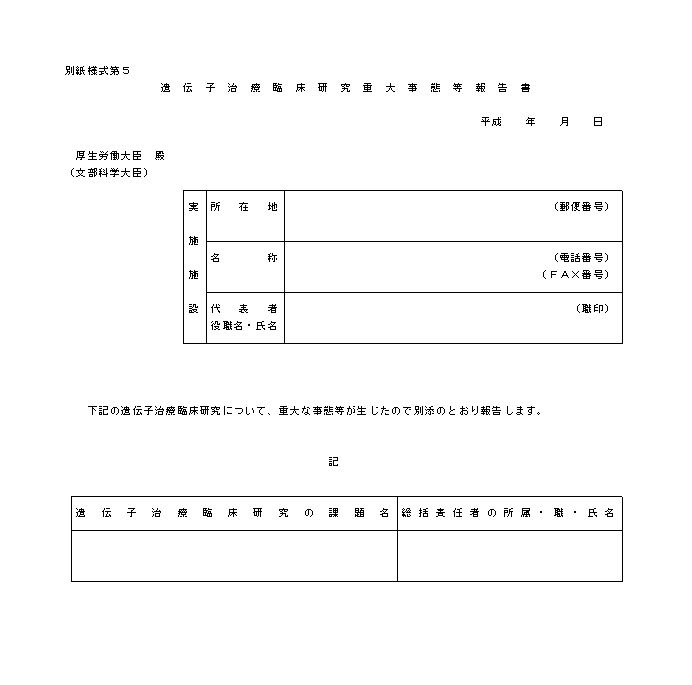
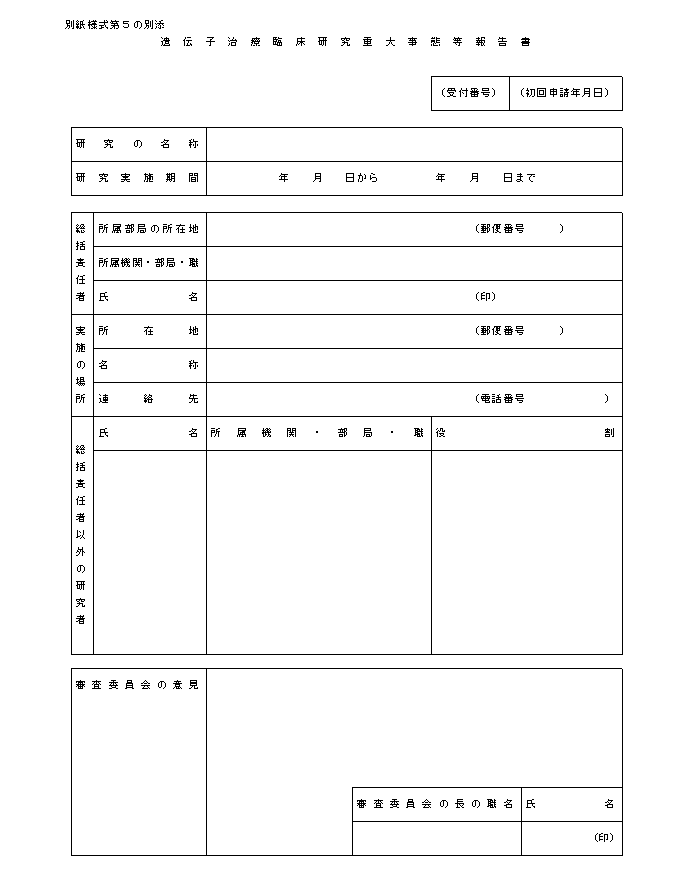
�@�w�j��R�͑�S�̂S�Ɋ�Â��A���{�{�݂̒��������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɑ����Ȃ���Ȃ�Ȃ����ԂƂ́A�팱�҂����S�����ꍇ�A�팱�҂ɏd�Ăȕ���p���������ꍇ�A���O�̏���`�q���×Տ������̎��{�ɉe�����y�ڂ��\���̂���m���������ꍇ�Ȃǂł���B����炪�������ꍇ�́A���₩�ɂ��̊T���y�ёΏ��̕��j�����Ƃ��ď�L�A����ɕ��A�P�T���ȓ���ڈ��ɁA�ʎ��l����T�ɂ������J����b�i��w���ɂ����ẮA�����J����b�y�ѕ����Ȋw��b�j�ɑ����邱�ƁB�܂��A�����ӔC�҂́A���{���Ă����`�q���ÂɊ֘A������O�̏����W�ɓw�߂邱�ƁB
�Q�D�����ʒm�̔p�~��
�i�P�j�u��`�q���×Տ������Ɋւ���w�j�ɂ��āv�i�����U�N�Q���W�����ȑ�T�S�������ȑ�b���[�����Ȋw�ے��ʒm�j�́A�����P�S�N�R���R�P���������Ĕp�~����B
�@�Ȃ��A��L��Q�ɋL�ڂ��鎖���������A���ʒm�Ɏ�����Ă���u��|�v�y�сu��{�I�l�����v�͎w�j�ɂ����p�������̂ł���̂ŁA�ʓY�̂Ƃ���A���ʒm�̊Y���������Q�l�܂łɓY�t����B
�i�Q�j�u��w���ɂ������`�q���×Տ������̃K�C�h���C���̐���ɂ��āv�i�����U�N�U���Q�P�����w����P�X�T�������Ȋw�p���ۋǒ��ʒm�j�́A�����P�S�N�R���R�P���������Ĕp�~����B
�ʓY
���u��`�q���×Տ������Ɋւ���w�j�ɂ��āv�i�����U�N�Q���W�����ȑ�T�S�������ȑ�b���[�����Ȋw�ے��ʒm�j��蔲��
��P�@��|
�@�ߔN�̑g�����c�m�`�Z�p�̐i���́A���i�̊J�����A�����̕ی���Â̕���֑傫���v�����Ă����B�{�Z�p�̐i���̉�������Ɉʒu���Ă����`�q���ẤA���ݗL���Ȏ��Ö@�̖R���������ɑ��ĉ���I�Ȏ��Ö@�ƂȂ�\�����߂Ă���A���̎��p���Ɍ����������̐��i�͏d�v�Ȉ�w�I���Љ�I�ȉۑ�ł���B
�@�������Ȃ���A��`�q���×Տ����������҂�ΏۂƂ��čs����ȏ�A���̈��S���y�їL�������m�ۂ��邱�Ƃ͍ł��d�v�ȑO��ƂȂ�B���̂��߈�`�q���×Տ������Ɏg�p������`�q���̑��̐l�ɓ��^����镨���̗L�����A���S���A�i���y�ѐ��̂ւ̓��^���@�̈��S���̊m�ۂ́A�ŐV�̉Ȋw�I�m���Ɋ�Â��Ċm�F�����K�v������B�܂��A�l��ΏۂƂ���Տ��������ʂ̉ۑ�Ƃ��āA�팱�҂̑I���K�Ȑ����Ɋ�Â��팱�҂̓��ӂ̊m�ۂ��Љ�I�ɑÓ��Ȏ葱�ōs���铙�̗ϗ��ʂ̔z�����K�v�ł���B
�@���̂悤�Ɉ�`�q���×Տ������̎��{�ɓ������Ă͔z�����ׂ������̏d�v�ȉۑ肪����A�����̉ۑ肪�\���Ɍ������ꂽ��ŁA�����������ɍs���邱�Ƃ��K�v�ł���B�܂��A���̂��Ƃ��L���m�F�ł���悤�ɂ��邱�Ƃ������̈�`�q���×Տ������ɑ��镝�L���������`�����A����ɂ͈�`�q���Â̊m���Ɏ����邱�ƂɂȂ�B
�@�w�j�́A���������ϓ_�����`�q���Â̊m����ړI�Ƃ���Տ��������A�����̕ی���Â̌����ړI�Ƃ��ĉȊw�I�A�Љ�I�ɑÓ��ȕ��@���ɂ��K���Ɏ��{�����悤�A��`�q���×Տ������̎��{�ɍۂ��Ĕz�����ׂ������ɂ��Ē�߂�ƂƂ��ɁA������b�ɑ��ӌ������߂�葱���ɂ��Ē�߂����̂ł���B
��Q�@��{�I�l����
�P�@��`�q���Â͈̔�
�@�w�j�ɂ������`�q���ÂƂ́A���a�̎��Â�ړI�Ƃ��Ĉ�`�q���͈�`�q�������זE��l�̑̓��ɓ��^���邱�Ƃ������B�܂��A���a�̎��Â�ړI�Ƃ��Ȃ���`�q�����͈�`�q���ÂƂ͂����Ȃ����A��O�I�Ɏ��Ö@�̊J����ړI�Ƃ��ĕW���ƂȂ��`�q���͕W���ƂȂ��`�q�������זE��l�̑̓��ɓ��^�����`�q�W���́A��`�q���ÂƂ��Ď�舵�����ƂƂ����B
�Q�@�Ώێ���
�@��`�q���×Տ������̑ΏۂƂȂ鎾���Ƃ��ẮA�v�����̈�`�������A����A��V���Ɖu�s�S�nj�Q���̐�����������������v�����ł͂Ȃ�����`�q���Âɂ�蓾���鎡�Ö��͗\�h���ʂ����̎��Ö@�Ɣ�r���ėD��Ă��邱�Ƃ��\���ɗ\�z����鎾��������B
�@�w�j�ł́A�������E�ɂ����Ĉ�`�q���×Տ��������J�n���ꂽ�Ƃ���ł���A�����Ȃ鎾���ɑ��Ă��K�p�\�Ȓi�K�Ɏ���܂łɂ͈�w�̌����̐ςݏd�˂��K�v�ł��邱�Ƃ��l�����A���ʁA�Ώێ������������������ł���A�����̑�։\�Ȏ��Ö@�Ɣ�r���Ĉ�`�q���×Տ����������{���闘�v���\���ɂ���Ɨ\�z�������̂Ɍ��肵���B
�@��`�q�����Z�p�̔��B�ɂ��A��L�̑Ώێ����ȊO�̎����̎��Â��s������A���̑��̖ړI�ň�`�q���͈�`�q�������זE�����邱�Ƃ����_�I�ɂ͉\�ł���B�������A���̂悤�Ȉ�`�q�����͉Ȋw�I�Ó�����ϗ�������݂Ė�肪���邱�Ƃ���A�w�j�̑Ώۂ��珜�O�����B
�R�@�L�����y�ш��S���̊m��
�@��`�q���×Տ������̎��{�ɓ������ẮA�g�p������`�q���̑��̐l�ɓ��^����镨���̗L�����A���S���A�i���y�ѐ��̂ւ̓��^���@�̈��S�����m�ۂ����ׂ����Ƃ͌����܂ł��Ȃ����A�����̕]���@���ɂ��Ă͊m�����ꂽ���̂����݂��Ă��Ȃ��̂�����ł���B���̂��߂����̗L�����A���S���̊m�F�́A�����_�ɂ�����ō��̒m���Ɋ�Â��čs���邱�Ƃ��K�v�ł���B�Ȃ��A�����̊m�F�͔|�{�זE�A�����������ŏ\���Ȏ������o�čs����K�v�����邱�Ƃ͌����܂ł��Ȃ��B
�S�@���B�זE�̈�`�I���ς̋֎~
�@��`�q���Âɂ͑̍זE��ΏۂƂ�����̂Ɛ��B�זE��ΏۂƂ�����̂Ƃ����邪�A���B�זE�ɑ�����̂́A�����_�ł́A�̂ɗ^����e���ɂ��ĉȊw�I�ɖ��𖾂̕������������ƁA�������ꂽ��`�q��������Ɏp�����\���������A���̉e�����팱�҂����ɂƂǂ܂�Ȃ����ꂪ�傫�����Ɠ�����A�X�ɐT�d�Ȏ戵�����K�v�ƍl������B
�@���������āA�w�j�͑̍זE��ΏۂƂ���Տ������Ɍ��邱�ƂƂ��A���B�זE�ɉe����^���鋰��̂�����͎̂��{���Ă͂Ȃ�Ȃ����ƂƂ����B
�T�@�K�Ȑ����Ɋ�Â��팱�҂̓��ӂ̊m��
�@�K�Ȑ����Ɋ�Â��팱�҂̓��Ӂi�C���t�H�[���h�E�R���Z���g�j�邱�Ƃ́A�䂪���ł���ʂ̈�Â̗̈�ɂ����Ă��̏d�v���ɂ��Ă̔F�������y������B��`�q���Â͖��m���̎��Ö@�ł��邱�Ƃ���A���̎��{�ɓ�����C���t�H�[���h�E�R���Z���g���m�ۂ���邱�Ƃ͕s���ł���B�܂��A���̎葱�ɂ��Ă����҂̐l���d����ϓ_����A���������i�Ȏ葱�����߂���B
�@���������āA�w�j�ɃC���t�H�[���h�E�R���Z���g�̊m�ۂ̕K�v���A�������ׂ������y�ё�O�҂ɂ��m�F���\�ȍۂ̎葱���ɂ��Ă̎����荞�ނ��ƂƂ����B
�U�@���O�q����̈��S�̔z��
�@��`�q���×Տ������͔팱�҂̎��a�����Â��A�Љ�A�����邱�Ƃ�ړI�Ƃ��Ă���B���̂��ߑg�����c�m�`�ł����`�q�Ⴕ���͑g�����̂ł���זE�𓊗^���ꂽ�팱�҂́A��ʎЉ�Ŏ��R�ɍs�����邱�ƂɂȂ�B
�@���������āA��`�q���ÂɎg�p����镨���i�g�����c�m�`���j�����ӂ̐l�y�ъ��ɗ^����e�����m�F����ƂƂ��ɁA�����w�I�������ߓ��K�ȑ���u���邱�Ƃ��K�v�ł���B
�V�@�����̗���
�@��`�q���×Տ������͉���I�Ȉ�ËZ�p�̊J���ł���A�l�ނ����Ƃ��Ă��邪��A��V���Ɖu�s�S�nj�Q���̒v�����̎����̐������\�ɂ�����̂Ɗ��҂���Ă���B
�@�������A��`�q���Â��ǂ̂悤�Ȉ�ËZ�p�ł��邩�ɂ��ẮA�K�����������ɏ\����������Ă��Ȃ��̂�����ł���A��`�q���Â̑Ώێ����₻�̌��ʓ��ɂ��Ă̐��m�ȏ��������ɒ��A���̗����邱�Ƃ��d�v�ł���A���̂��Ƃ������ɂ킽�錤���̐i���ɂ��傫����������̂ƍl������B���̂��߁A�����҂��n�߂Ƃ���W�҂́A���f�����`�q���ÂɊւ���Љ�I�A�ϗ��I���ɂ��Ă��c�����Ă����ɔz�������������v����{���A�X�̗Տ������̎���ɂ��Ĕ팱�҂ɏ\����������ƂƂ��ɁA�����ɑ��Ă���`�q���Â���₷���������A�K�ȏ��̌��J��}�铙�A�����̗����邽�߂̓w�͂�s�����K�v������B
�W�@���̑�
�@�w�j�ɒ�߂鎖���́A��`�q���×Տ������Ɋւ�����̑����A�m���̒~�ρA�V�����Z�p�̊J�����ɉ����ĉ����A�lj������ׂ����i�̂��̂ł���A�w�j����芮�S�Ȃ��̂Ƃ��邽�߂ɁA�e�����ɑ��鎩�R�Ȋw�I�A�Љ�Ȋw�I�����Ɋ�Â����ӌ����e���ʂ����N����邱�Ƃ��]�܂��B
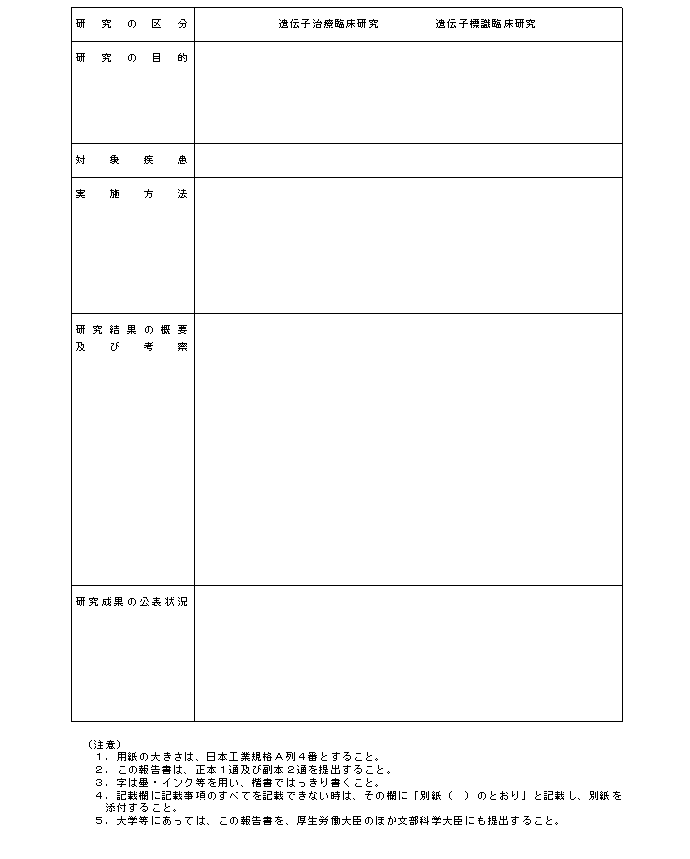
�ʕ\�P�@���{�v�揑�ɋL�ڂ��ׂ������y�т��̓��e
| ���� | ���e | ||||||||||||||||||||||
| �P�@��`�q���×Տ������̖��� | �@ | ||||||||||||||||||||||
| �Q�@�����ӔC�ҋy�т��̑��̌����҂̎������тɓ��Y��`�q���×Տ������ɂ����ĉʂ������� | (1)�����ӔC�҂̎��� (2)�����ӔC�҈ȊO�̌����҂̎����y�т��̒S��������� |
||||||||||||||||||||||
| �R�@���{�{�݂̖��̋y�т��̏��ݒn | �@ | ||||||||||||||||||||||
| �S�@��`�q���×Տ������̖ړI | �@ | ||||||||||||||||||||||
| �T�@��`�q���×Տ������̑Ώێ����y�� ���̑I�藝�R |
(1)���Âڂ̖ړI�Ƃ�����`�q���×Տ��������s���ꍇ
(2)���Ö@�̊J����ړI�Ƃ�����`�q�W���Տ��������s���ꍇ
|
||||||||||||||||||||||
| �U�@��`�q�̎�ދy�т��̓������@ | (1)�l�ɓ��������`�q�̍\���Ɛ���
(2)�{�v��Ŏg�p���邻�̑��̑g�����c�m�`�̍\���Ɛ��� (3)�W�I�זE�Ƃ����זE�̗R���y�ѐ����w�I�������тɓ��Y�זE��W�I�זE�Ƃ������R (4)��`�q�������@�̊T���y�ѓ��Y�����@��I���������R (5)�E�C���X�x�N�^�[��p���Ĉ�`�q�������s���ꍇ
(6)�E�C���X�x�N�^�[�ȊO�̕��@��p���Ĉ�`�q�������s���ꍇ
|
||||||||||||||||||||||
| �V�@���S���ɂ��Ă̕]�� | (1)��`�q�������@�̈��S��
(2)��`�q�Y���̈��S�� (3)�זE�̈��S��
|
||||||||||||||||||||||
| �W�@��`�q���×Տ������̎��{���\�ł���Ɣ��f�������R | �@ | ||||||||||||||||||||||
| �X�@��`�q���×Տ������̎��{�v�� | (1)��`�q���×Տ��������܂ޑS�̂̎��Ìv��
(2)�팱�҂̑I����y�я��O� (3)�팱�҂̓��ӂ̎擾���@ (4)���{���ԋy�іڕW�Ǘᐔ (5)��`�q���×Տ������̎��{���@
|
||||||||||||||||||||||
| �P�O�@���̑��K�v�Ȏ��� | �@ |
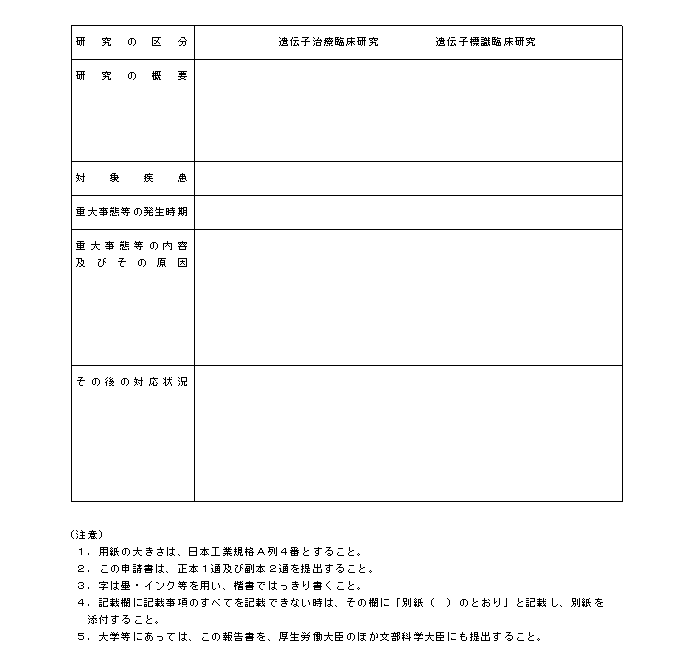
�ʕ\�Q�@���{�v�揑�ɓY�t���ׂ�����
| ���� | ���e | ||||||||||||
| �P�@�����҂̗����y�ь����Ɛ� | �@ | ||||||||||||
| �Q�@���{�{�݂̎{�ݐݔ��̏� | �@ | ||||||||||||
| �R�@���{�{�݂ɂ����铖�Y��`�q���×Տ������Ɋւ���|�{�זE�A����������p������������ | (1)�|�{�זE��p���������̐���
(2)����������p���������̐���
(3)�֘A���錤���̐��� |
||||||||||||
| �S�@��`�q���×Տ������Ɋ֘A������{�{�݈ȊO�̓��O�̌����� | �@ | ||||||||||||
| �T�@���̑��K�v�Ȏ��� | (1)�ގ��̈�`�q���×Տ������̐���
(2)���̑��K�v�Ȏ��� |
�z�[�� > ����ɂ��� > ����ʂ̐���ꗗ > ������̎��g�� > �������� > �����J���Ȃ̌������ƂɊւ���\�Z�T�Z�v���O�̕]�� > �����Ɋւ���w�j�ɂ��� > ��`�q���×Տ������Ɋւ���w�j�ɂ���