世界保健機関
遺伝子組換え食品
アレルギー誘発性評価
(仮訳)
FAO/WHO専門家会議報告書
イタリア・ローマ
| 本報告書に示された意見は本会議出席者の意見であり、FAOおよびWHOの意見を代表するものではない。 |
2. 背景
3. 目的
4. 食物アレルギーの概要
5. 遺伝子組換え食品のアレルギー誘発性評価に用いる判断樹の検討
- 5.1 序
5.2 FAO/WHO 2001年判断樹
5.3 アレルギー誘発性をもつ起源食品由来の遺伝子組換え食品
5.4 アレルギー誘発性の有無が不明である起源食品由来の遺伝子組換え食品
5.5 上市後サーベイランス
5.6 その他の基準の検討
- 6.1 アレルギー誘発物質データベースから得られるアミノ酸配列相同性
6.2 特異的血清スクリーニング
6.3 標的血清スクリーニング
6.4 ペプシン耐性
6.5 動物モデル
8. 勧告
9. 略語一覧
10. 参考文献一覧
付属文書1
- 出席者一覧
専門家
研究報告書著者
国際機関からのオブザーバー
コーデックス委員会バイオテクノロジー応用食品特別部会議長
コーデックス委員会食品表示部会議長
FAO/WHO事務局
- 会議資料一覧
- FAO/WHO2000年判断樹
- FAO/WHO2001年判断樹
1. はじめに
2001年1月22日から25日にかけてローマの国連食糧農業機関(FAO)本部で、バイオテクノロジー応用食品に関する第2回FAO/WHO合同専門家会議が開催された。この会議は2000年5月29日から6月2日にかけてスイスのジュネーブで開催された第1回FAO/WHO合同専門家会議に続くもので、主に遺伝子組換え食品のアレルギー誘発性について議論された。討議資料の著者を含む計28人の専門家が出席。出席者一覧表を付属資料Iとして掲載した。
世界保健機関(WHO)・国連食糧農業機関(FAO)の事務局長代理として、FAO経済社会局農業経済開発分析部長Jacque Vercueil氏が開会を宣言した。Vercueil氏はその発言の中で、遺伝子組換え食品の安全性に関する問題の中でもアレルギー誘発性は最も関心が集まるものの1つであると述べた。
さらに同氏は、遺伝子組換え技術によって生産される新規食品のアレルギー誘発性を的確に評価する方法を確立することは急務であるが、適切なリスク管理法を用いることによって、遺伝子組換え食品のアレルギー誘発性を軽減することが可能であると述べた。
会議の席上、議長としてDean Metcalf博士、副議長としてHarris Steinman博士、報告者としてSteve Taylor博士が任命され、前回の2000年FAO/WHO会議で採択した判断樹を出発点に議論を進めることで合意に達した(付属文書3)。また、二つの作業部会の立ち上げと、報告書の起草、作業部会の代表として議長と報告者を選出することが決議された。
第1作業部会では、議長として Carsten Bindslev-Jensen博士、報告者としてDavid Hill博士が任命され、アレルギー誘発性起源食品(付属文書3―2000年判断樹の左側)由来の遺伝子を使用した食品とその上市後サーベイランスについて検討した。
第2作業部会では、議長としてRob Aalbers博士、報告者としてRicki Helm博士が選ばれ、アレルギー誘発報告例がない起源食品(付属文書3―2000年判断樹の右側)由来の遺伝子を使用した食品について検討した。会議資料一覧を本報告書の付属文書2に掲載した。本会議において検討した方法論を適用した事例として「スターリンクとうもろこしに関する科学的情報の評価」と題する報告書(EPA、2000)が紹介された。
本会議ではさらに、FAO/WHO合同会議事務局がBiotech 01/02として提出した会議資料を取り上げ、意見交換した。
2. 背景
1990年および1996年に、FAOとWHOは遺伝子組換え食品の安全性と栄養価を検討するために合同専門家会議を開催した。1990年の会議ではバイオテクノロジーは従来の交配技術に遺伝子組換え技術などの最新技術が融合したものであり、遺伝子組換え食品が従来の遺伝子工学によって製造された食品と比べて、本質的な安全性の点で本質的に劣るものではないとの結論を出した(WHO、1991年)。1996年の会議では、食用として開発された遺伝子組換え植物に由来する食品や食品成分の安全性評価において実質的同等性は重要な要素であると勧告した(FAO、1996年)。コーデックス委員会とその関連部会では両会議の結果が反映されることとなった。
世界的レベルで、遺伝子組換え食品の安全性と栄養面に関する懸念が高まっていることをうけて、コーデックス委員会は1999年の第23回総会で、バイオテクノロジー応用食品またはバイオテクノロジーによって食品に導入される形質について、基準・指針・勧告を適宜策定するためにバイオテクノロジー応用食品に関する特別部会を設立することを決定した。この特別部会の第1回会合は2000年3月に日本で行われた。FAOとWHOはこの特別部会の業務を支援するために継続的に科学専門家会議を開催する意向を表明した。
2000年6月、FAO/WHO合同会議がジュネーブで開催された(WHO、2000年)。この会議では、遺伝子組換え植物に由来する食品の安全性が全般的に議論され、実質的同等性は科学的リスク評価の一般指針として適用できるのかという点が中心的に検討された。第2回となる今回の会議ではさらなる専門家会議が必要となる領域を特定し、FAO/WHOは遺伝子組換え食品と食品中に新たに発現するタンパク質のアレルギー誘発性評価を最優先事項として専門家会議を開くべきであると勧告した。
2000年会議では、判断樹が採択され(付属文書3)、これを用いて遺伝子組換え食品中に新たに発現するタンパク質のアレルギー誘発性評価を行うことになった。本会議は、新たな基準の追加も考慮しつつ、判断樹を用いた手法を用いることによって遺伝子組換え食品のアレルギー誘発性のリスク評価の信頼性を高めることができるという点で合意した。
3. 目的
専門家会議は、FAO、WHO、その加盟国に対して遺伝子組換え食品のアレルギー誘発性評価に関する科学的助言をするために召集された。この内容として、主なものを以下に挙げる。
・遺伝子組換え食品のアレルギー誘発性に関する包括的検討
- ・遺伝子組換え食品特有のアレルギー誘発性についての検討
- ・2000年6月のバイオテクノロジー応用食品に関するFAO/WHO合同会議において予備的に作成された遺伝子組換え食品のアレルギー誘発性評価に用いる判断樹の検討と修正
・コンセンサスに基づいた判断樹適用という観点に立ち、判断樹における使用基準に対する標準化された検討手順の策定
・上市後サーベイランスを判断樹に加える可能性と上市後サーベイランスの実施をバックアップするような技術に関する検討
- ・遺伝子組換え食品アレルギー誘発性評価におけるデータベースの使用。
・動物実験の使用について
・その他の関連事項について
4. 食物アレルギーの概要
食品または食品成分そのものは無害なものであっても、そこに含まれる特定のタンパク質に対して身体の免疫系が異常反応してしまうと食物アレルギーが起こる。真性食物アレルギーにはいくつかの免疫学的反応タイプがある(SampsonとBurks、1996年)。食物アレルギーの中でも最も典型的なのは抗原特異的免疫グロブリンE抗体(IgE)によっておこるものである1。IgEによる反応は即時型過敏反応として知られ、原因食品の摂取後数分から数時間で症状が現れる。IgEによるアレルギー反応は花粉・カビ胞子・動物のフケ・昆虫の毒液・その他の環境的刺激ならびに食品に対しておこる。先進諸国では人口の10〜25%程度はIgEによるアレルギー反応の経験があると思われるが(Mekori、1996年)、食物アレルギーは全てのアレルギー疾患のほんの一部に過ぎない。一般的に乳幼児の方が成人よりもIgEが誘発する食物アレルギーの影響を受けやすい。
3歳未満の乳児の罹患率は5〜8%程度である。(Bock、1987年、およびSampson、1990年a、および欧州委員会、1998年)。
真性食物アレルギーには遅延型過敏反応も含まれるが、反応機序についてはあまり詳しくわかっていない。これらの反応には、抗体ではなく組織中の感作リンパ球が関わる細胞性免疫反応も含まれる(Sampson、1990年b)。細胞性免疫反応においては、原因食品の摂取後8時間以上経ってから症状が現れる。細胞性免疫反応については未解明な部分もあるが(Burks and Sampson、1993年)、乳児が食品によるこれらの反応を起こしたという報告例は多い。牛乳・大豆およびそれより頻度は低いがその他のタンパク質を摂取した乳児の中に食品起因性の遅延型腸疾患が認められる。グルテン過敏性腸疾患として知られるセリアック病(小児脂肪便症)はどの年齢層にも起こりうる細胞性過敏免疫反応の代表例である。セリアック病は地域によっては300〜3000人に1人の割合で発生しているといわれている。
多様な食品が食物アレルギーの原因となりうる。コーデックス委員会表示部会は検討を重ねた結果、IgEアレルギー反応と関連をもつことが世界的に認知されているアレルギー誘発性食品のリストを作成し、その中ではピーナツ・大豆・牛乳・鶏卵・魚・甲殻類・小麦・木の実などが挙げられている。このリストはコーデックス総会に提出され、1999年の第23回総会で採択された。中〜重度のアレルギー症例の90%以上はこのような一般的に認知されているアレルギー誘発性食品によるものだが、散発性アレルギー反応に関与している食品は160品目以上にのぼることがさらなる文献調査によって明らかになっている(Hefle他、1996年)。理論的には、タンパク質を含む食品はすべてアレルギー反応を誘発しうるということになるが、食品がアレルギー感作を引き起こす可能性は広く多様化している。コーデックスの食品リストに加えて、生果実や野菜による口腔周囲アレルギー症候群(OAS)などのアレルギー反応も一般的である(Ortolani他、1988年)。
これらの食品による症状はそのほとんどが軽症で症状が口腔部位に限られるのが特徴である。これらの食品由来の最も代表的なアレルギー誘発物質の中には、加熱と消化に対して不安定なものもある。けれども、果実や野菜に対するOASは、患者によっては全身反応につながる場合もある(Ballmer-Weber他、2000年)。コーデックス委員会表示部会の作成したリストには、グルテン過敏性腸疾患を引き起こすグルテン含有穀物(小麦、ライ麦、大麦、オーツ、スペルト)も掲載されている。
IgEによる食物アレルギーでは、特定の食品または含有されるタンパク質を摂取することによって食物抗原特異的IgE抗体が生成される。こうしたIgE抗体は肥満細胞や好塩基球表面に結合し、その個体は過敏体質となり、それ以降患者が特定食品を摂取するたびに反応が起こる。つまり、原因となる食品を摂取したことによって過敏体質になるといえる。食品タンパク質の中には、他のものよりアレルギー誘発性が高いものがみられる。感作された患者にアレルギー感作を起こす食品の閾値量についてはほとんど未解明である。しかし、乳児は成人より感作する可能性がはるかに高く、比較的少量の原因食品を摂取しただけで感作する可能性がある。感作した患者はそれ以降に原因食品を摂取すれば、おおむねアレルギー反応を起こす。アレルギー誘発物質が肥満細胞や好塩基球表面のIgE抗体と交差結合することにより様々なアレルギー関与物質が放出される。こうした物質が組織や血液に放出され、多様なレセプターと相互に作用することによって特徴的なアレルギー反応症状が出現する。感作された高感受性の患者にアレルギー反応を引き起こすアレルギー誘発性食品タンパク質量、つまり閾値量は明確ではないが、マイクログラム単位から低ミリグラム量の範囲であると考えられる。
IgEによる食物アレルギーの症状は、軽微なものから重度、さらには生命を脅かすものまでと幅広い。原因食品の閾値量には個人差がある。しかし、ほとんどの過敏性食物アレルギー患者ではマイクログラムから低ミリグラム量またはそれ以下の原因食品に対する曝露で反応が起きると考えられる(閾値量については実験数が限られており、特定のアレルギー誘発性食品による認識可能なアレルギー反応が発現する閾値量を正確に知ることは困難である)。原因物質の摂取がごく少量でも重症反応につながることもあり、アレルギー反応がおきないという安全限界量は明らかではない。
グルテン過敏性腸症またはセリアック病は、もともと遺伝的にその素因をもっている患者がグルテン(グリアジン)に反応して引き起こされるT細胞性免疫反応である。この疾患で顕著なのは小腸の炎症で、罹患すると吸収不良を起こし体力消耗・貧血・下痢・骨痛その他の症状が現れる。患者は、一生を通じて小麦・ライ麦・大麦などの穀物に含まれるグルテンの摂取を避けなくてはならない。
セリアック病やその他の腸症は重要な疾患であると認められたが、この会議で討議された食品安全性評価プランに加えられることはなかった。
IgEのよるものかどうかに関係なく、食品に対するアレルギーは除去食療法で治療する。どちらの症例においても食品の閾値量は低く正確に把握できないため、除去食療法を遵守するために患者は大変な努力を強いられることになる。
タンパク質以外の食品成分がハプテンとして作用することもあるが2、食品アレルギー誘発物質はほぼすべてタンパク質である。同定され特徴がわかっている食品アレルギー誘発物質もあるが、多くは未だ解明されていない。既知の食品アレルギー誘発物質の多くはある程度、タンパク質の種類別に分類されているので、他の起源食品由来の未知のアレルギー誘発物質の同定にも役立つだろうと思われる。プロラミンタンパク質は小麦・ライ麦・大麦のいずれに含まれようと、同じようにグルテン過敏性腸症の誘発に関与する。主食となる穀物には多数の種類の異なるタンパク質が含まれるが、アレルギー誘発性をもつものは比較的少ない。これらのタンパク質の分布は植物の部位によって異なり、気候や疾病といった環境要因性ストレスの影響を受ける可能性がある。
伝統的な交配技術を用いることによって、食糧源として様々なタンパク質が作り出されている。
しかし、これらの改良によって食糧中に含まれるタンパク質の構成が変化したという例はなく、あったとしても我々が日常的に摂取している食品にアレルギー誘発性が発現した例はほとんどみられなかった。これに対し、食生活の嗜好の変化や食品製造・商品化行程の変化は食物アレルギー誘発性を大きく左右する可能性がある。例えば、ピーナツ(落花生)アレルギーは北米と西欧でかなり頻繁に起きているが、ピーナツ消費量がそれほど多くない他の国ではそれほどではない。
また、キウイフルーツなど近年流通するようになった食品がアレルギー誘発性起源食品であることが新たにわかっている。また商品に関していうと、ゴマを含む食品などある種の外来食品が広く流通するようになったことでこれらの食品に対するアレルギー誘発性過敏症が増加している可能性がある。これらのことから、食糧中に高いアレルギー誘発性が潜在しているというよりは、もともとアレルギー誘発性を有するものが新たに食品として市場に流通することがわかる。
ここまで述べてきたように、遺伝子組換えによって製造された食品の安全性評価をする際には、アレルギー誘発性に関して特に注意を払う必要がある。遺伝子組換え食品のアレルギー誘発性評価は、新たな遺伝子産物(タンパク質)の特徴と既知の食品・環境中のアレルギー誘発物質の比較によって行う。さらに、従来食品と比較した場合に、意図せざる新タンパク質の発現が判明した場合は、これらについても同様の手順でアレルギー誘発性評価を行わなければならない。
5. 遺伝子組換え食品のアレルギー誘発性評価に用いる判断樹の検討
5.1 序
1996年、国際食品バイオテクノロジー会議と国際生命科学研究所のアレルギー・免疫研究所(IFBC/ILSI)は判断樹を用いて、遺伝子組換え食品に含まれる新遺伝子産物(タンパク質)のアレルギー誘発性を評価する方法を提案した(Metcalfe他、1996年)。このアレルギー誘発性評価法は、農業バイオテクノロジー業界で広く応用されている。この方法は遺伝子の起源食品、発現タンパクと既知のアレルギー誘発物質間のアミノ酸配列相同性、そして組換え後の遺伝子産物に対してアレルギーを示す患者の血清中IgEと発現タンパクとの免疫学的結合性、発現タンパクの物理的化学的性質に焦点をあてたものである(Metcalfe他、1996年、およびTaylor、1997年)。
1996年のバイオテクノロジーと食品の安全性に関するFAO/WHO合同会議で、遺伝子組換え食品のアレルギー誘発性問題が初めて大きく取り上げられた。IFBC/ILSIが開発した評価方法と同様の方法が提唱され、判断項目としては、組換え遺伝物質の起源食品、分子量、アミノ酸配列相同性、加熱・加工に対する安定性、pH・胃液の影響(消化安定性)、食品中の含有量、などの事項が含まれる。1996年会議は、「遺伝子組換え生物のアレルギー誘発性評価のための合理的かつ科学的総合的な安全性評価法の一環として実施すべきものである」との結論を出した。さらに1996年会議は、遺伝子組換え食品のアレルギー誘発性に関していくつかの勧告を出した。
- ・一般的にアレルギー誘発性食品とされている食品からの遺伝子組換えは、組換えする遺伝子がアレルギー誘発性をもたないと証明されていない限り行うべきではない。
- ・遺伝子供与体からアレルギー誘発物質が移行したと判明した食品は、それが流通市場において明確に識別でき、流通と加工の過程で識別が確保されなければ、流通を承認するべきではない。付記するとこれらの状況においては表示制度は実用的ではないこともある。また消費者が表示を読めなかったり、表示がなかった場合には別の問題が生じることになる。
- ・関連諸機関は、たとえその遺伝子産物に対してアレルギー反応をおこす患者が報告されていない場合においても、アレルギー誘発物質の特性をもつと判断されるタンパク質を含有する食品については、その妥当性、もしくはとるべき措置を検討するべきである。
- ・アレルギー誘発性食品とそれらの免疫原性を決定するアレルギー誘発物質の特性の同定を進めることが望ましい。
植物由来の遺伝子組換え食品の安全性に関する2000年FAO/WHO合同会議では、遺伝子組換え食品のアレルギー誘発性問題について再び議論された。遺伝子組換え食品に導入された新タンパク質の評価法として、IFBC/ILSIが提案した判断樹による方法が多少の変更を加えたうえで採択された(付属文書3)。先の合同会議では、「遺伝子組換え食品中にアレルギー誘発性があると知られている起源食品由来の遺伝子産物が含まれている場合、アレルギー誘発性がないと証明されるまではその遺伝子産物をアレルギー誘発性を有するものだと仮定するべきである。アレルギー誘発性をもつことが一般的に知られている食品から遺伝子を組換える際には、導入する遺伝子がアレルギー誘発性をもたないことが証明されていないなら、行うべきではない。遺伝子組換え食品に発現した新タンパク質は付属文書3の判断樹に基づいてアレルギー誘発性を評価しなければならない」との結論を出した。
2000年会議では、FAO/WHOが採択したIFBC/ILSIの判断樹(付属文書3)の中で用いられている判断基準の確実性が疑問視されていることについて言及した。2000年会議はさらに、「組換えに用いる遺伝子の起源食品についてアレルギー性に関する情報がない場合は判断樹に新たな基準を付け加えることを考慮するべきである。新タンパク質の発現量と発現部位、新タンパク質の機能的特性などもこれらの基準となるであろう」と締めくくった。
2000年FAO/WHO合同専門家会議は、「FAO/WHOは遺伝子組換え食品とその中に含まれる発現タンパクのアレルギー誘発性評価について討議するため、積極的に専門家会議を召集すべきである。この会議では遺伝子組換え食品のアレルギー誘発性評価に用いる判断樹の改良と、例えば消化に対する安定性を的確に評価する検査方法、というような明確な基準を具体的に規格化・法制化することに主眼を置かなければならない」と勧告した。これらを背景として、今会議では2000年FAO/WHO会議で採択された既存のIFBC/ILSI判断樹を用いつつ、その評価手順を発展させることにつとめた(付属文書3)。
5.2 FAO/WHO 2001年判断樹
本会議では最新の科学的情報や詳細な協議の結果、新たな判断樹を開発した(付属文書4)。本報告書では以後、これをFAO/WHO 2001年判断樹とする。この新たな判断樹はアレルギー誘発性を判定するために、前回の判断樹をひな型とし、これに新たな方針をいくつか付け加えて作成されたものである。
5.3 アレルギー誘発性を有することが既知である起源食品由来の遺伝子を含む食品
アレルギー誘発性を有することが既知である食品由来の発現タンパクのアレルギー誘発性を分析する場合、FAO/WHO 2001年判断樹によって示された方法は、アミノ酸配列相同性評価と、遺伝子が由来する食品に対してアレルギーを示す患者血清を用いた発現タンパクのアレルギー誘発性評価の2つに主眼を置いている。(付属文書4)。アミノ酸配列相同性評価をまず最初に行う。アミノ酸配列相同性分析における陽性判定基準については6.1項で再検討する。
既知のアレルギー誘発物質とのアミノ酸配列相同性がみられる場合、その食品はアレルギー誘発性をもつと考えられ、通常はそれ以上の試験は行わない。既知のアレルギー誘発物質に対するアミノ酸配列相同性が示されない場合、発現タンパクを特異的血清スクリーニングにかける。この検査法は、起源食品に対してアレルギー反応を示す患者の血清を用いて発現タンパクのアレルギー誘発性を評価することが目的である(6.2項)。これらの患者の選定も国際指針にのっとって慎重に行わなければならない。血清を提供した患者の感作能が低い場合、発現タンパクに対する反応性については信頼度が低い。従ってアレルギー誘発性起源食品に対する感作能の目安として、IgE抗体価が10kIU/L以上である患者のみを対象とするのが望ましい。
それまでの判断樹と異なり、FAO/WHO 2001年判断樹では発症例が多いアレルギー誘発食品も、そうでないものもすべて特異的血清スクリーニングにかける。つまり血清が使用可能な限り、その食品に起因するアレルギー誘発例の多少に関係なく特異的血清スクリーニングを行なう(6.2項)。アレルギー誘発例が少ないからといって誘発例の多い食品よりも、過敏症をもつ患者にとって重篤性が軽減するとはいえず、文献資料も十分ではない。
特異的血清スクリーニング結果に対する信頼度は、分析に使用した血清数に左右される。検体としての条件を満たした血清6検体が陰性結果を示してはじめて、95%の信頼性に基づいて起源食品から主要アレルギー誘発物質が移行していないといえる。(物質に感作した患者の50%以上がIgE抗体価検査で反応を示すものを主要アレルギー誘発物質と定義する)。起源食品から主要アレルギー誘発物質が移行していないことについて99.9%の信頼性を得るためには、少なくとも8つの血清検体について陰性結果が得られなければならない。さらに血清検体を17検体用いると、感作血清のうち20%がアレルギー反応を示す食品由来の、一般的な認知度が低いアレルギー誘発物質でも95%の確率で検出することができる。(認知度が低いアレルギー誘発物質とはIgE抗体価検査において反応を示す感作検体数が50%未満であるものを指す)。感作血清を24検体用いた場合は、その確率は99%である。感作血清の入手がままならない場合には試行数を減らすという対処法も考えられるが、偽陰性判定をする危険が生じる。けれども試行数が多ければ抗体価検査における陰性結果の信頼性は高くなるので、可能な限り多試行数で行うことが望ましい。
また本会議では、詳しい履歴が得られる感作能が高い血清を少数用いるほうが、感作能が低い血清を多数用いるよりも望ましいと認識している。信頼性のある結果が得られるようなin vitro法を用いてIgE抗体価の測定を行うべきである(6.2項)。
結果が陽性の場合、その食品はアレルギー誘発性である可能性が高いと見なされ、通常は食品開発は中止される。特異的血清スクリーニングの結果が陰性の場合、標的血清スクリーニング(6.3項)・ペプシン耐性検査(6.4項)・動物モデルによる検査(6.5項)を用いて分析が進められる(付属文書4参照)。さらに、特異的血清スクリーニングにおける陽性結果の確認が必要な場合、もしくはin vivo・ex vivo試験において、詳しい履歴が入手できるアレルギー感受性の適切な被験者を用いた陽性結果よりも、in vivo・ex vivo試験で使用されたアレルギー性物質の性質がよくWかっており、適切に実施されたin vivo・ex vivo試験の陰性結果の方が特異的血清スクリーニングの陽性結果よりも信頼性が高い場合にはアレルギー患者によるin vivo・ex vivo試験もまた有用である3。ex vivo・in vivo法には、スキンプリック試験(Bruijnzeel-Koomen他、1995年)、好塩基球ヒスタミン放出試験(Bindslev-JensenとPoulsen、1996年)、経口試験などがある(Bock他、1988年、およびBruijnzeel-Koomen他、1995年)。これらの手法を用いるには倫理委員会(審査委員会)の承認が必要になると考えられる。従って、FAO/WHO 2001年判断樹ではヒトを被験者とするin vivo試験を必須の手法とはしていないが、ある状況ではこれらの使用も考慮される可能性がある。
特異的血清スクリーニングの結果が疑わしい場合、標的血清スクリーニング・ペプシン耐性試験・動物モデルを用いた試験(付属文書4参照)を用いたさらなる分析が必要になると思われる。また、起源食品に対しアレルギー反応を示す患者を被験者とするex vivo・in vivo試験を行う可能性もある。
FAO/WHO 2001年判断樹は、アレルギー誘発性を低くするために遺伝子産物の発現を抑制している食品の評価には用いない。この場合には、スキンプリック試験・一般試験・二重盲検・プラセボ試験などによるin vivo試験が必要である。
5.4 アレルギー誘発性の有無が不明である起源食品由来の遺伝子を含む食品
発現タンパクがアレルギー誘発性の有無が不明の食品に由来している場合、FAO/WHO 2001年判断樹では、
(1)既知のアレルギー誘発物質(食品または環境中の)とのアミノ酸配列相同性、
(2)遺伝子の起源食品と、その周辺食品に対してアレルギー反応を示す患者の血清を用いて、交差反応性を調べる標的血清スクリーニング
(3)ペプシン耐性試験
(4)動物モデルを用いた免疫原性試験(付属文書4)。ここでは相同性をもつアレルギー誘発物質の検出を二段階で行う。
まず最初に、6.1項に示した法則に従って、発現タンパクとアミノ酸配列相同性をもつようなアレルギー誘発物質をデータベースで検索する。この検索によって交差反応性があると考えられるレベルの既知アレルギー誘発物質とのアミノ酸配列相同性が確認できれば、発現タンパクはアレルギー誘発性をもっていると考える。さらなるアレルギー誘発性評価は定められていない。
このような相同タンパク質が見つからない場合に、次のステップに進む。
このようなケースでは、遺伝子起源食品とその周辺食品に対して特異的に高いIgE抗体価を示す一連の血清サンプルを用いて交差反応性を検査する(6.3項)。この「標的血清スクリーニング」では、酵母・菌糸類、単子葉植物、双子葉植物、無脊椎動物、脊椎動物、その他、という6群に起源食品を区分けする。関連群に含まれるアレルギー誘発物質に対して高いIgE抗体価を示す50の血清標本を用いて、発現タンパクと交差反応するIgE抗体を検査する。この血清のうち1検体でも陽性反応を示せば、発現タンパクはアレルギー誘発物質であると考えられ、これ以上のアレルギー誘発性評価は定められていない。遺伝子が細菌に由来するものであった場合、被検体は細菌性タンパク質に対して感作(IgE抗体産生)されていないことがわかっているため、標的血清スクリーニングはできない。
標的血清スクリーニングで陽性結果が得られた場合、標的血清スクリーニングの結果を確認する必要があれば、5.3項で述べたようにin vivo・ex vivo試験を用いてさらに評価を行うことも考えられる。in vivo・ex vivo試験の結果が標的血清スクリーニングの結果と異なった場合、in vivo・ex vivo試験の被験者が条件に適合した、履歴がはっきりしているアレルギー患者であるなら、標的血清スクリーニングの陽性結果よりも信頼性があるものとする。
交差反応性をもつ血清が見つからない場合には、6.4項および6.5項に示した手順に従って、ペプシン耐性と適切な動物モデルを用いた免疫原性の有無について発現タンパクを分析する。
5.5 上市後サーベイランス
本会議では、遺伝子組換え食品が市場流通する前のアレルギー誘発性評価が充分な安全性の保証になると認めている。しかしながら人種間の遺伝的多様性や地域的食習慣の違いを考慮すると、食品が市場に流通した後にも、遺伝子組換え食品の有害事象についてより評価を加えるべきであるとも認識している。これが実行されると、さらなる安全性を保証される。
理想的には、消費者と食品製造業者の両方が健康への悪影響について自己報告システムを備えるべきである。報告されたデータは以下の項目において根拠が明確でなければならない。
- ・アレルギー誘発性に関する臨床的報告
- ・報告された有害事象と特定の遺伝子組換え食品・食品成分摂取との因果関係
このような裏付けのとれたデータは記録・整理・発表しなければならない。こうしたシステムには既存の国家サーベイランスシステム(疾病対策センター、中毒センターなど)の経験が活かされる。
しかし、以下をはじめとする未処理の問題が山積しており、上市後サーベイランスシステムの実行性をさらに追究する必要がある。
- ・遺伝子組換え食品・食品成分の追跡可能性と表示
・食品関連アレルギーの流行と発生率を裏付けるデータの不足
・多くの食品・非食品関連要因の混在
・食習慣の変化
・主に発展途上国における訓練を受けた専門家と基礎設備の不足
5.6 検討されたその他の基準
5.6.1 症状の程度
アレルギー誘発性が高いタンパク質はしばしば、比較的重篤な症状を発現することが多い。しかし、アレルギー誘発物質はミリグラム未満の量、場合によってはマイクログラム未満の量で感受性の高い患者を感作することができる(Sorva他、1994年、およびJarvinen他、1999年)。
既に感作している患者において、アレルギー症状であることをはっきり示す症状の発現は低容量の曝露でも起こるが、500マイクログラム未満では報告されていない(RanceとDutau、1997年、およびHourihane他、1997年)。従って、アレルギー誘発性の観点から見て安全であると考えられるタンパク質の発現下限を定義するのは不可能である。つまり、遺伝子組換え食品のアレルギー誘発性の評価に発現タンパク量を基準として取り入れることはできない。
5.6.2 意図しない影響について
DNA配列の挿入によって宿主生物に特定標的形質(意図した効果)を導入することにより、理論的にはその他の形質が得られたり、既存の形質が失われたり促進されることもあり得る(意図しない影響)。一定しない場所への挿入などが要因となり、既存遺伝子の破壊やタンパク質発現の変化という意図しない影響を引き起こす可能性がある。意図しない影響は遺伝子組換え技術の使用に特異的なものではないが、こうした影響をできる限り同定して、遺伝子組換え食品のアレルギー誘発性に及ぼす影響を評価しなければならない。
アレルギー誘発性については、二通りの意図しない影響が想定できる。第1に、遺伝子挿入により既存の宿主遺伝子が異常な形で活性化または抑制され、特定タンパク質の発現過多または発現不足に至る場合がある。宿主植物に既知のアレルギー誘発性タンパク質が含まれる場合、安全性評価過程の一環としてこのアレルギー誘発性物質量が増加する可能性を考慮しなければならない。
第2に、遺伝子組換え食品と従来食品とを比較した結果、遺伝子の挿入によって新たなタンパク質が発現したことが判明したら、この中で示す技法を用いてそのタンパク質のアレルギー誘発性を評価しなければならない。
6. 方法論の標準化
6.1 アレルギー誘発データベースから得られるアミノ酸配列相同性
一般的に用いられるタンパク質データベース(PIR、SwissProtとTrEMBL)には、既知のアレルギー誘発物質については、大部分のものについてアミノ酸配列情報が掲載されている。しかし、こうしたデータベースも充分な更新が随時行われているとはいえない。アレルギー誘発物質に特化したデータベースが構築中である。
発現タンパクと既知のアレルギー誘発物質間のアミノ酸配列相同性の測定手順に関する提案
第1段階
タンパク質データベース(SwissProtとTrEMBLについては、http://expasy.ch/tools参照。PIRについてはhttp://www-nbrf.georgetown,edu/pirwww参照)中から全アレルギー誘発物質のアミノ酸配列をFASTAフォーマット(リーダー配列がある場合は無視して成熟タンパク質のみのアミノ酸配列を用いる)を入手する。これをデータセット(1)とする。
第2段階
発現タンパクに由来する80のアミノ酸配列の完全セットを作成する(リーダー配列がある場合は再び無視)。これをデータセット(2)とする。
第3段階
EMBLのURL(http:www2.ebi.ac.uk)を参照し、ギャップペナルティーと幅の初期設定を伴う位置合わせについてウエブサイトのFASTAプログラムを用いてデータセット(2)の配列とデータセット(1)の全配列と比較する。
発現タンパクと既知のアレルギー誘発物質間の交差反応性(タンパク質データベース上で検索可能な限りにおいて)は以下の場合において検討しなくてはならない。
- 1) 80のアミノ酸ウインドウと適切なギャップペナルティー(Clustal型位置合わせプログラムまたは同等の位置合わせプログラムを用いる)を用いた場合に、発現タンパクのアミノ酸配列(リーダー配列がある場合はそれ以外)の35%以上がアレルギー誘発物質のものと一致する場合。
- 2) あるいは6つの隣接アミノ酸が一致した場合。
一致度が35%以上である場合、この評価法ではかなりの相同性を示すとみなされる。遺伝子組換え食品において予測される交差反応性アレルギー誘発物質を同定するためにアミノ酸配列相同性を用いることについては、別の論文で詳細に論じられている(Gendel、1998年aと1998年b)。
かなりの割合でアミノ酸配列の同一性がみられた場合でも、その割合が35%未満である場合は、既知のアレルギー誘発物質との構造的な類似性がさらに重要である。この場合においては、顕著な交差反応性が認められる可能性は低い。しかし、タンパク質を構造的な相関性をもつもの同士で区分けしてみると、中にはアレルギー誘発物質を含むグループがある。いくつかの例を以下に挙げる。
- ・リポカリン
・非特異的脂質伝達タンパク質
・ナピン(種からの2Sアルブミン)
・パルブアルブミン
発現タンパクが構造的にこれらのグループに属している場合は、アレルギー誘発性タンパク質である可能性が高いと考えられる。
機能的には類似しているが構造的に類似していない場合場合、顕著な交差反応性が認められる可能性は低い。例えば、違うタンパク質グループに属するプロテアーゼ阻害因子が交差反応性であるという報告はない。同様に、病理学的な関連性をもっていても構造的な関連性をもたないタンパク質(PRタンパク質)同士に交差反応性があるかどうかは不明である。
連続する6個のアミノ酸の合致は偶然起きる危険性がかなり高いため、(1)の基準が陰性で(2)の基準が陽性である場合は、交差反応性の確認が必須である。この場合は適切な抗体(ヒトまたは動物由来)を用いて交差反応性の確認試験を行わなければならない。
6.2 特異的血清スクリーニング
起因物質などに対してアレルギーを示すことが既知である患者の、血清中IgE抗体の反応性は、適切なin vitro検査によって評価されなければならない。ここでは充分な科学的根拠を有する多様な免疫検定法を利用することができる。本会議は、これらの検定法のいずれかを使用することを認可している。
以上のスクリーニングに適した血清の選定については前述の注意点に加えて、グリコシル化と抗原決定基の重要性も考慮しなければならない。宿主植物に発現したタンパク質が遺伝子組換えによって発現したものならば、アレルギー誘発性への影響はありうる。グリコシル化の影響は以下の理由から特に考慮に値する。
- 1. グリコシル化の程度によってはタンパク質の消化・加工に対する感受性が影響をうける場合がある。
- 2. グリコシル化によって、タンパク質表面の一部がマスクされたり(特にグリコシル化が広範な場合)、他の多糖鎖の抗原決定基を取り込んだりすることによって、決定基の構造が変わる可能性がある。多糖鎖の抗原決定基は交差反応性が高いことがわかっている。
糖鎖にはN末端結合型またはO末端結合型がある。N末端結合部位は多少、正確に予測することができるが、O末端結合部位は正確に予測するのがむずかしい。
多糖類の抗原決定基に対するIgE抗体の交差反応性を重要視するのは、アレルギー症候学的な影響があるからではなく(多くの場合軽微だと考えられる)、この場合糖タンパク中のタンパク質部位の構造にほとんど関係なく、これらの多糖構造を持つタンパク質全てが交差反応性である可能性があるためである。標的糖タンパク質を交差反応性についてスクリーニングする場合、糖部位に対するIgE抗体とタンパク質部位に対するIgE抗体を明確に区別することが重要である。一般的には、多糖に対するIgEのない血清サンプルを選ぶか、同じ宿主由来のサンプルに含まれる目的外の糖タンパク質に対するIgE抗体は排除する、または例として細菌宿主で発現した非グリコシル化変異体を用いてこれらの試験を行うなどの方法が望ましい。
アレルギー発現に関わる多糖類の抗原決定基に関する知識はほとんど、植物由来の糖タンパク質と無脊椎動物由来の糖タンパク質を用いた研究によって得られた結果に基づくものである。イースト菌などの真核微生物の糖タンパク質についてはほとんどわかっていない。しかし、同様の注意を払う必要性が高いと思われる。
6.3 標的血清スクリーニング
発現タンパクとアレルギー誘発物質の間にアミノ酸塩基配列相同性が認められなくても、アレルギー誘発物質が存在しないとはいえない。問題となるアレルギー誘発物質に関して情報が不足しているだけかもしれない。アレルギー患者の血清標本の無作為スクリーニングは効率がよくないかもしれない。より標的を絞った方法ならば有用な場合もある。
- ・組換えタンパク質が単子葉植物に由来する場合、イネ科植物や米のような単子葉植物由来のアレルギー誘発物質に対するIgE抗体価の高い患者の血清標本を用いた検査がのぞましい。
- ・組換えタンパク質が双子葉植物に由来する場合、樹木花粉・草木花粉・セロリ・ピーナツ・木の実・ゴムなど双子葉植物由来のアレルギー誘発物質に対するIgE価が高い患者の血清標本を用いた検査がのぞましい。
- ・アレルギー誘発物質がカビに由来する場合、Alternaria・Cladosporiumなどのカビ・イースト菌・真菌に対するIgE価が高い患者またはアスペルギルス症・Trichophyton過敏症患者の血清標本を用いた検査がのぞましい。
- ・アレルギー誘発物質が無脊椎動物に由来する場合、ダニ・ゴキブリ・エビ・ユスリカ・蚕など無脊椎動物に対するIgE価が高い患者の血清標本を用いた検査がのぞましい。
- ・アレルギー誘発物質が脊椎動物に由来する場合、哺乳類のペット・実験動物・牛乳・魚・卵白・卵黄・血清タンパク質に対するIgE価が高い患者の血清標本をを用いた検査がのぞましい。
- ・アレルギー誘発物質が細菌などその他の起源に由来する場合は、標的血清を用いる通常のスクリーニングは有用ではない。
大規模血清プール(>5血清)は存在する交差反応性抗体が希釈されるため、使用は勧められない。感作限界については、個々の血清を試験しなければならない。
代表例としては、大気中に存在する特定のアレルギー誘発物質に対してIgE価の高い25検体と、(可能であれば、)特定の食品アレルギー誘発物質に対してIgE抗体を持つ25検体の血清標本をサンプルとして用いる方法が挙げられる。
6.4 ペプシン耐性
精製または濃縮された発現タンパク(非加熱・非加工)は、SOP(Standard Operating Procedures)/GLP(Good Laboratory Practice)の適用下におけるペプシン分解試験を行うべきである。さらに、発現タンパクを試験するにはペプシンによって分解し、通常、食用に供する形態にしてからでなくてはいけない。発現タンパクのペプシン耐性度を相対的に測定するために、非アレルギー誘発性でないことが既知である食品タンパク質と(大豆リポキシゲナーゼ、ジャガイモ酸ホスファターゼまたは同様のもの)、アレルギー誘発性をもつことが知られている食品タンパク質の(牛乳β―ラクトグロブリン、大豆トリプシン阻害因子または同様のもの)の両方を比較対照として用いるべきである。タンパク質濃度については、ウシ血清アルブミン(BSA)を標準物質とする比色定量法を用いた評価を行う(Bicinchoninic酸アッセイ(BCA)、Bradfordタンパク質アッセイ、または同様のタンパク質アッセイ)。ペプシン蛋白質分解の評価も行うべきである(Ryle)。pH 2.0の30mM/L NaCl中に0.32%のペプシン(w/v)200μLを加えた溶液に500μgのタンパク質を加えて酵素・タンパク質混合物を生成し、37℃の水浴中で60分間振とうする。ペプシン・タンパク質溶液を500マイクログラムずつ0・15・30秒、1・2・4・8・15・60分の段階でそれぞれ注入し、その都度、適切な緩衝液で中和する。中和したタンパク質溶液は、還元剤(DTTまたは2-ME)を加えた場合と加えない場合の両方についてSDS-PAGE緩衝液と混合し、90℃で5分間加熱する。5μg/cmのタンパク質ゲルを含む標本は、10〜20%の勾配のTricine SDS-PAGEゲルまたは同等のゲルを用いて、非還元電気泳動状態と還元電気泳動状態において評価しなければならない。ゲル中のタンパク質は銀またはコロイド状金染色過程によりバンドが見えるようにしなければならない。発現タンパクが分解を受けないか、または分解を受けていない3.5kDa以上のタンパク片部分が残っていれば、アレルギー誘発性タンパク質である可能性が考えられる。タンパク質片が3.5kDa未満であれば、タンパク質アレルギー誘発性についての問題にする必要はなく、そのデータを他の判断樹基準と照らし合わせて考慮する。起源食品における発現タンパクの検出については、実験室手順書に従ってポリクローナルIgG抗体免疫ブロット分析を行うべきである。免疫ブロット分析は銀またはコロイド状金染色SDS-PAGEゲルと比較し、同じ条件下において発現タンパクの染色状況を確かめなくてはならない。
実験者は以下の予防的措置について考慮しなければならない。食べられる起源食品には、タンパク質消化を促進または抑制するプロテアーゼ阻害因子またはその他の物質が含まれる可能性がある。生成されたタンパク片は多クローンIgGを含む抗体血清に対し反応しない可能性がある。結論として、ペプシン耐性またはタンパク質を完全に消化することによって新タンパク質のアレルギー誘発性を完全に予測できるという確証はなく、その他の判断樹基準と併せて考慮しなければならない。現在のペプシン耐性プロトコールはもちろん有用なものではあるものの、その他の酵素感受性プロトコールも存在することは周知の事実である。別のプロトコールを用いてその正当性を示すこともできる。食品生産者はこうした結果をその他の判断樹基準と併せて考慮することが求められる。
6.5 動物モデル
発現タンパクのアレルギー誘発性をさらに評価するために、開発された動物モデルを用いて有効なデータを出すことができる。Brown Norwayラットモデル(Knippels他、1998年)による経口感作法や、齧歯類モデルにおける腹腔内投与法、またそれに代わるような多くの動物を用いた実験モデルでアレルギー誘発性を相対的に測定することができると考えられている(Dearman他、2000年)。免疫原性・アレルギー誘発活性を評価するために、特徴的Th1/Th2抗体(アイソタイプ)の出現を確認する。被験動物モデルにおけるアレルギー誘発物質を投与する経路が異なると(経口または腹腔内)試験結果も異なる可能性がある。従って、ある投与経路による評価結果を他の投与経路の場合に適用できるわけではない。同一、または異なる動物種において2通りの感作経路の使用による検査結果を考慮することが望ましい。
発現タンパクのアレルギー誘発性は、動物を用いた実験モデルの中で、アレルギー誘発性のレベルがさまざまに異なる既知のアレルギー誘発物質や非アレルギー誘発物質のタンパクとの比較によって分類することが望ましい。動物を用いた実験モデルの投用によって有用な知識が増えれば、それに伴ってタンパク質のアレルギー誘発性評価に最適な条件下で行えるようにプロトコールを修正していかなくてはならない。
現行の動物実験によって新タンパク質のアレルギー誘発性について新たな情報は得られるが、ヒトにおけるIgE誘導型の食物アレルギーの全ての側面が解明されたわけではない。
7. 結論
1. 本会議は、バイオテクノロジー応用食品の安全性評価は包括的、段階的で、ケースバイケースのアプローチであり、この方法をバイオテクノロジー応用食品のアレルギー誘発性評価にも適用することで合意した。
2. 本会議は、バイオテクノロジー応用食品は全てアレルギー誘発性の可能性の評価を行うべきであると強調した。
3. FAO/WHO 2000年会議で策定された最初の判断樹をこの会議の基盤とした。
本会議は、最新の研究結果に従いこの判断樹を修正し、FAO/WHO 2001年判断樹を作成することで合意した。
4. 発現タンパクが既知のアレルギー誘発性の食品由来である場合、FAO/WHO 2001年判断樹では第1段階の調査として起源食品中の既知アレルギー誘発物質に対するアミノ酸配列相同性の分析をあげている。これが陰性の場合、次の段階として免疫検定法を用いた考えうるIgE結合検査を行う。遺伝子供与体食品に対してアレルギーを示す患者におけるin vivo試験をすることもある。
5. 発現タンパクがアレルギー誘発性が知られていない遺伝子供与体食品に由来する場合、FAO/WHO 2001年判断樹では第1段階は食品・環境中の既知アレルギー誘発物質に対するアミノ酸配列相同性の分析であるとしている。既知アレルギー誘発物質に対する有意な相同性が認められた場合、タンパク質はアレルギー誘発物質である可能性が高いと考えられる。有意なアミノ酸配列相同性が認められない場合、遺伝子が由来した食品に広く特異性をもつ高いIgE抗体価血清を用いて、標的血清スクリーニングを行う。標的血清スクリーニングが陽性である場合、タンパク質はアレルギー誘発物質である可能性が高いと考えられる。標的血清スクリーニングが陰性である場合、発現タンパクのペプシン耐性と適切な動物モデルを用いた発現タンパクの免疫原性評価を行い、タンパク質のアレルギー誘発性を判断する。
6. 本会議は、遺伝子の発現抑制によってアレルギー誘発性を減らした食品の評価にはFAO/WHO 2001年判断樹は適用されないことで合意した。
7. 本会議としては、交差反応の可能性を検出できる感受性と特異性でタンパク質のアミノ酸配列相同性を評価することが、発現タンパクのアレルギー誘発性評価における重要な部分であるという意見である。
8. 本会議は、アレルギー物質が(ヒトを)感作し、症状を誘発する量を決定するにはさらに研究が必要であることで合意した。
9. 本会議は、アレルギー誘発物質データベースを恒常的に更新していく必要性を確認した。
10. 本会議は、動物モデルは全ての食品アレルギー誘発物質につき評価されているわけではないが、こうしたモデルの使用がバイオテクノロジー応用食品のアレルギー誘発性評価に関する有用な情報をもたらすことについての科学的な裏付けがあると述べた。
11. 本会議は、ペプシン感受性はアレルギー誘発性の同定のための適切な評価項目であるが、提示されたプロトコールには生理学的な消化条件を模倣する目的はないという点で合意した。
12. バイオテクノロジー応用食品のアレルギー誘発性評価にヒト in vivo法を使用することについては、多くの場合に倫理的問題を生じる可能性が高い。その使用については事例毎に考慮する必要がある。
13. 上市後サーベイランスはバイオテクノロジー応用食品の有害性や長期摂取影響をモニターするのに有用であるが、その実施のいくつかの側面については実行可能性に関するさらなる検討が必要であると認めた。
14. 本会議は、今後アレルギーおよびバイオテクノロジー分野の科学的基盤が急速に拡大すれば、将来はFAO/WHO 2001年判断樹とそれに付随する文書の修正が必要となるであろうが、現在の我々の知識の範囲内においては適切なものであるとしてこれを受け入れることができるとした。
8. 勧告
1. 本会議は、FAO/WHO 2001年判断樹をバイオテクノロジー応用食品のアレルギー誘発性測定のために使用することを勧告する。
2. 本会議は、FAOとWHOが必要に応じて判断樹を更新する努力をすべきことを勧告する。
3. 食物アレルギー誘発物質とその免疫原性を決定するこうしたアレルギー誘発物質の特性の同定が奨励される。
4. バイオテクノロジー応用食品のアレルギー誘発性の評価のために必要なタンパク質と遺伝子データベースは適宜更新し、維持しなければならない。
5. 適切な動物モデル及びバイオテクノロジー応用食品のアレルギー誘発性評価手順については、その開発及びバリデーション(有効性確認)に関する研究がさらに必要である。
6. 本会議は、上市後サーベイランス導入の実施可能性についてさらに研究をすすめることを勧告する。
7. 本会議は、バイオテクノロジー応用食品のアレルギー誘発性評価を実施するために加盟国の能力とインフラ面でのを強化を目的としたFAOとWHOによる加盟国への技術支援を勧告する。
8. 本会議は、FAOとWHOに対して標準操作手順書、医薬品の非臨床試験の実施に関する基準(GLP)、医薬品の臨床試験(GCP)の実施に関する基準を改良することを目的とした専門家間の交流を促進・強化するネットワークを確立し、バイオテクノロジー応用食品のアレルギー誘発性の評価を容易にすることを勧告する。
9. 略語一覧
BCA bicinchoninic酸アッセイ BSA ウシ血清アルブミン DNA デオキシリボ核酸 DTT ジチオトレイトール EAACI 欧州アレルギー学・臨床免疫学学会 FAO 国連食糧農業機関 GM 遺伝子の修飾をほどこした〜 GLP 動物実験実施基準 IFBC 国際食品バイオテクノロジー会議 Ig 免疫グロブリン IgE 免疫グロブリンE IgG 免疫グロブリンG ILS I 国際生命科学研究所 kIU/L キロ国際単位/リットル kDa キロドルトン ME メルカプトエタノール OAS 口腔アレルギー症候群 PR-タンパク質 病因関連タンパク質 Th1 Tヘルパーリンパ球1、細胞毒性細胞の異化を助け、大食細胞を活性化する。大食細胞は活性化後、免疫反応のエフェクターとして働く Th2 Tヘルパーリンパ球2、Bリンパ球反応の拡大に主に関わる SCOOP/NUTR/ REPORT/2 科学協力プログラム/栄養/報告書/2 SDS-PAGE 硫酸ドデシルナトリウム-ポリアクリルアミドゲル電気泳動法 SOP 標準作業手順書 WHO 世界保健機関
10. References
1. Ballmer-Weber BK, Vieths S, Luttkopf D, Heuschmann P,Wuthrich B(2000) : Celery allergy confirmed by double-blind, placebo-controlled food challenge : a clinical study in 32 subjects with a history of adverse reactions to celery root. J Allergy Clin Immunol,106(2):373-8
2. Bindslev-Jensen C, Poulsen LK (1996): In vitro diagnostic tests. Chapter 7 In : Sampson HA, Simons E, Metcalfe DD: Food Allergy 2nd edition,Blackwell Scientific Publications:137-150
Bock SA(1987):Prospective appraisal of complaints of adverse reactions to foods in children during the first three years of life.Paediatrics,79:683-688
4. Bock SA,Sampson HA, Atkins FM, Zeiger RS, Lehrer S, Sachs M, Bush RK, Metcalfe DD(1988): Double-blind, placebo-controlled food challenge (DBPCFC) as an office procedure : a manual. J Allergy Clin Immunol,82(6) : 986-97
5. Burks AW, Sampson H (1993) : Food allergies in children. Current Problems in Paediatrics 23 : 230-252
6. Bruijnzeel-Koomen C, Ortolani C, Aas K, Bindslev-Jensen C, Bjorksten B, Moneret-Vautrin D, Wutrich B (1995) :Adverse reactions to food. Position Paper. Allergy, 50 : 623-635
7. Dearman RJ, Caddick H, Basketter DA, Kimber I (2000) : Divergent antibody isotope responses induced in mice by sustemic exposure to proteins : a comparison of ovalbumin with bovine serum albumin. Food Chem Toxicol,38:351-360
8. EPA(2000) : A Set of Scientific Issues Being Considered by the Environmental Protection Agency Regarding Assessment of Scientific Information Concerning StarLink Corn.FIFRA Scientific Advisory Panel Meeting, Environmental Protection Agency of the United States
9. European Commission(1998) : Consideration of the Epidemiological Basis for appropriate Measures for the Protection of the Public Health in Respect of Food Allergy, SCOOP/NUTR/REPORT/2, European Commission, Brussels
10. FAO(1996): Biotechnology and food safety, Report of a joint FAO/WHO consultation. FAO Food and Nutrition Paper 61, Food and Agriculture Organisation of the United Nations, Rome
11. General SM (1998a) : Sequence databases for assessing the potential allergenicity of proteins used in transgenic foods.Adv.Food Nutr. Res. 42: 63-92
12. Gendel SM (1998b): The use of amino acid sequence alignments to assess potential allergenicity of proteins used in genetically modified foods: Adv. Food Nutr. Res. 42: 45-62
13. Hefle SL, Nordlee JA,Taylor SL (1996): Allergenic foods. Critical Reviews in Food Science and Nutrition 36: S69-S89
14. Hourihane JO'B, Kilburn SA, Nordlee J, Hefle S, Taylor SL, Warner JO (1997) : An evaluation of the sensitivity of subjects with peanut allergy to very low doses of peanut protein: a randomized, double-blind, placebo-controlled food challenge study. J Allergy Clin. Immunol, 100: 596-600
15. Jarvinen KM, Makinen-Kiljunen S, Suomalainen H (1999): Cow's milk challenge through human milk evokes immune responses in infants with cow's milk allergy. J. Pediatr, 135: 506-512
16. Knippeles et al. (1998): Oral sensitization to food proteins: a Brown Norway rat model.Clin Exp Allergy, 28: 368-375
17. Mekori YA (1996): Introduction to allergic diseases. Critical Reviews in Food Science and Nutrition 36: S1-S18
18. Metcalfe DD, Astwood JD, Townsend R, Sampson HA, Taylor SL, Fuchs RL (1996): Assessment of the allergenic potential of foods derived from genetically engineered crop plants. Critical Reviews in Food Science and Nutrition 36: S165-S186
19. Ortolani C, Ispano M, Pastorello E, Bigi A, Ansaloni R (1988): The oral allergy syndrome. Ann Allergy 61(6 Pt 2) : 47-52
20. Rance F, Dutau G (1997): Labial food challenge in children with food allergy. Pediatr Allergy Immunol 8 : 41-44
21. Sampson HA (1990a) : Food Allergy. Current Opinion in Immunology 2: 542-547
22. Sampson HA(1990b) : Immunologic mechanisms in adverse reactions to foods.Immnology and Allergy Clinics of North America 11 : 701-706
23. Sampson HA, Burks AW (1996): Mechanisms of food allergy. Annual Review of Nutrition 16: 161- 177
24. Sorva R, Makinien-Kiljunen S, Juntunen-Backman K (1994): B-Lactogloburin secretion in human milk varies widely after cow's milk ingestion in mothers of infants with cow's milk allergy: J Allergy Clin Immunol 93: 787-792
25. Taylor, S. L. (1997) : Food from genetically modified organisms and potential for food allergy. Environ Toxicol Pharmacol 4 : 121-126
26. WHO (1991) : Strategies for assessing the safety of foods produced by biotechnology. Report of a Joint FAO/WHO Consultation, World Health Organization, Geneva
27. WHO (2000) : Safety aspects of genetically modified foods of plant origin. Report of a Joint FAO/WHO Expert Consultation, World Health Organization, Geneva
付属文書1
CALDAS, Luiz Q de A, Director, Poison Control Center, Antonio Pedro University Hospital, Fluminense Federal University, Rua Marcues do Parana, 353-3. andar- Centro-Niteroi-Rio de Janeiro,Brazil
Tel : +55-21-717-0148
Fax: +55-21-717-4459/ 717-0521
E-mail: ccilqac@vm.uff.br
EGWANG, Thomas, Med Biotech Laboratories, P.O.Box 9364, Kampala, Uganda
Tel : +256-41-268251/266445
Fax: +256-41-268251
E-mail:egwang@imul.com
KUIPER, Harry A., Head, Department of Food Safety and Health, State Institute for Quality Control of Agricultural Products (RIKILT) , Wageningen UR, PO Box 230, NL-6700 AE Wageningen, The Netherlands
Tel : +31 317 475 463
Fax: +31 317 417 717
E-mail: h.a.kuiper@rikilt.wag-ur.nl
LEE, Sang IL, Professor, SungKyunKwan University, School of Medicine, Department of Pediatrics, Samsung Seoul Hospital, #50 Ilwon-dong, Kangnam-ku, Seoul, Republic of Korea
Tel : +82-2-3410-3521
Fax: +82-2-3410-0043
E-mail: silee@smc.samsung.co.kr
MALMHEDEN YMAN, Ingrid, Senior chemist, National Food Administration, Research & Development, P.O.Box 622, SE-751 26 Uppsala, SWEDEN
Tel : +46 18 17 56 82
Fax: +46 18 10 58 48
E-mail: iyma@slv.se
METCALFE, Dean, Chief, Laboratory of Allergic Diseases,National Institute of Allergy and Infectious Diseases, National Institutes of Health Building 10, Room 11C205, 10 Center Dr. MSC 1881, Bethesda, MD 20892-1881 USA(Chairperson)
Tel :+1-301-496-2165
Fax:+1-301-480-8384
MOUSSA, Amel, Etablissement Publique de Sante, Charle Nicolle, Tunis, Tunisia
Tel : +216-1-575-575
Fax: +216-1-237-076
E-mail:sa.benecib@planet.tn
STEINMAN,Harris, Allergy Clinic, Red Cross Children's Hospital, University of Cape Town, c/o P.O. Box 565, Milnerton, 7435, South Africa
Tel / Fax: +27-21-551-2993
E-mail: harris@zingsolutions.com
TRYPHONAS, Helen, Toxicology Research Division, Bureau of Chemical Safety, Food Directorate, Health Products and Food Branch, Health Canada, Sir Frederick G.Banting Reseach Center PL2202D1, Ross Avenue, Tunney's Pasture, Ottawa, Ontario, Canada
Tel :+1-613-957-0996
Fax:+1-613-941-6959
E-mail: Helen_Tryphonas@hc-sc.gc.ca
AUTHORS OF WORKING PAPERS
AALBERSE, Rob4,Department of Immunopathology, CLB, Plesmanlaan 125, 1066 CX Amsterdam, The Netherlands
Tel :+31-20-512-3158
Fax:+31-20-512-3170
E-mail:aalberse@clb.nl
BECKER, Wolf-Meinhard5, Division of Allergology, Research Institute Borstel, Parkallee35, D-23845 Borstel, Germany
Tel :+49-4537-188-337
Fax:+49-4537-188-328
E-mail:wbecker@fz-borstel.de
BINDSLEV-JENSEN, Carsten6, Associate professor, Odense University Hospital, Dept. of Dermatology, DK 5000 Odense, Denmark
Tel :+45 65411343, secr +45 65412717
Fax:+45 66123819
E-mail: cbj@imbmed.sdu.dk
HELM,Ricki M.7, Associate Professor of Paediatrics, University of Arkansas for Medical Sciences, Arkansas Children's Hospital Research Institute,1120 Marshall Street, Little Rock, Arkansas, USA
Tel :+1-501-320-1060
Fax:+1-501-320-3173
E-mail:HelmRickiM@uams.edu
HILL, David J.8, Director, Department of Allergy, Royal Children's Hospital, 151 Flemington Road, NORTH MELBOURNE 3051,Australia
Tel :+61-3-9345-5701
Fax:+61-3-9326-6418
E-mail:allergy@cryptic.rch.unimelb.edu.au
PENNIBKS, Andre H.9, Department of Experimental Immunology, TNO Nutrition and Food Research Institute, Utrechtweg 48, P.O.Box 360, 3700 AJ Zeist, The Netherlands
Tel : +31 30 6944564
Fax:+31 30 6960264
E-mail: Penninks@voeding.tno.nl
TAYLOR, Steve10, Professor and Head, Department of Food Science and Technology, University of Nebraska, 143 Food Industry Complex, East Campus
PO Box 830919, Lincoln,NE 68583-0919, USA (Rapporteur)
Tel : +1 402 472 2833
Fax: +1 402 472 1693
E-mail: Staylor2@unl.edu
URISU,Atsuo11, Department of Pediatrics, Fujita Health University, The Second Teaching Hospital, 3-6-10, Otobashi, Nakagawa-ku, Nagoya, 454-8509 Japan,
Tel :+81-52-323-5670
Fax: +81-52-322-4734
E-mail:urisu@fujita-hu.ac.jp
WAL,Jean-Michel12, Directeur du Laboratoire d'Immuno-Allergie Alimentaire, Service de Pharmacologie et Immunologie (SPI), INRA-CEA SACLAY Bat 136,91191 Gif sur Yvette cedex, France
Tel : +33 1 69 08 92 24
Fax: +33 1 69 08 59 07
E-mail: wal@dsvidf.cea.fr
OBSERVERS FROM INTERNATIONAL ORGANIZATION
FERRAIOLO, Giovannni, Programme Officer, Biosafety Unit, International Center for Genetic Engineering and Biotechnology, Padriciano 99, 34012 Trieste, Italy,
Tel : +39-040-3757364
Fax: +39-040-226555
E-mail:ferraiol@icgeb.trieste.it
MAEKAWA, Testuya, Administrator, OECD, ENV/EHS2, rue Andre Pascal, 75775 Paris Cedex 16, France
Tel : +33-1-45-24-76-19
Fax: +33-1-45-24-16-75
E-mail:Tetsuya. MAEKAWA@oecd.org
CHAIRMAN OF THE CODEX AD HOC TASK FORCE ON FOODS DERIVED FROM BIOTECHNOLOGY
YOSHIKURA, Hiroshi, Food Sanitation Division Environmental Health Bureau Ministry of Health and Welfare1-2-2 Kasumigaseki, Chiyoda-ku, Tokyo 100-8045, Japan
Tel : +81 3 3595 2252
Fax: +81 3 3595 2251
E-mail:codexj@mhw.go.jp
CHAIRPERSON OF THE CODEX COMMITTEE ON FOOD LABELLING
MACKENZIE, Anne, Associate Vice-President, Science Evaluation Unit, Canadian Food Inspection Agency,59 Camelot Drive, Nepean, Ontario KIA 0Y9, Canada
Tel :+1-613-225-2342, ext. 4188
Fax:+1-613-228-6638
E-mail:+amackenzie@em.agr.ca
FAO/WHO SECRETARIAT
BOUTRIF, Ezzeddine, Senior Officer (Food Control and Consumer Protection), Food Quality and Standards Service, FAOViale delle Terme di Caracalla, 00100 Rome, Italy
Tel :+39 06 570 56156
Fax:+39 06 570 54593
E-mail:ezzeddine. boutrif@fao.org
TABATA, Makoto, Food Standards Officer, Joint FAO/WHO Food Standards Programme, Food and Nutrition Division, FAO
Viale delle Terme di Caracalla, 00100 Rome, Italy
Tel :+39 06 570 54796
Fax:+39 06 570 54593
E-mail:makoto.tabata@fao.org
LEE, Seoung-Yong, Associate Professional Officer, Joint FAO/WHO Food Standards Programme, Food and Nutrition Division, FAO
Viale delle Terme di Caracalla, 00100 Rome, Italy
Tel :+39 06 570 56243
Fax:+39 06 570 54593
E-mail:Seoung Yong.Lee@fao.org
SAHARA, Yasuyuki, Scientist, Programme of Food Safety, WHO, 20 Avenue Appia, 1211
Geneva 27, Switzerland
Tel :+41 22 791 4324
Fax:+41 22 791 4807
E-mail:saharay@who.int
EIJKEMANS, Gerry, Medical Officer, Department of Protection of Human Environment,WHO,20 Avenue Appia, 1211 Geneva 27, Switzerland
Tel :+41 22 791 3758
Fax:+41 22 791 4123
E-mail:eijkemansg@who.int
JERMINI, Marco, Acting Director and Food Safety Regional Adviser
WHO Regional Office for Europe-European Centre for Environment and Health
Via Francesco Crispi, 10 I-00187 Rome Italy
Tel :+39-06-487-7525
Fax:+39-06-487-7599
E-mail:maj@who.it
付属文書2
| Biotech 01/01 | Provisional Agenda and Timetable |
| Biotech 01/02 | Questions about the Assenssment of Allergenicity of Foods Derived from Modern Biotechnology |
| Biotech 01/03 | Topic 1: Overview of the Current Approach to Determine the Allergenicity of Genetically Modified Foods ( Dicision Tree Approach) |
| Biotech 01/04 | Topic 2: Commonly Known Allergenic Sources (IgE-Mediated and Non IgE-Mediated Food Allergens as well as Environmental Allergens) |
| Biotech 01/05 | Topic 3: Allergen Databases/Class of Proteins/Allergen Function |
| Biotech 01/06 | Topic 4: Sequence Homology and Allergen Structure |
| Biotech 01/07 | Topic 5: Stability of Known Allergens (Digestion and Heat Stability) |
| Biotech 01/08 | Topic 6: Solid phase Immunoassay, Immunoreactivity and Other Criteria |
| Biotech 01/09 | Topic 7: Prevalence of Allergen in Food and Threshold for Sensitization |
| Biotech 01/10 | Topic 8: Animal Model for Allergenicity Assessment |
| Biotech 01/11 | Topic 9: Post-market Surveillance of Allergenicity |
付属文書3
遺伝子組換え農作物に由来する食品のアレルギー誘発性の評価
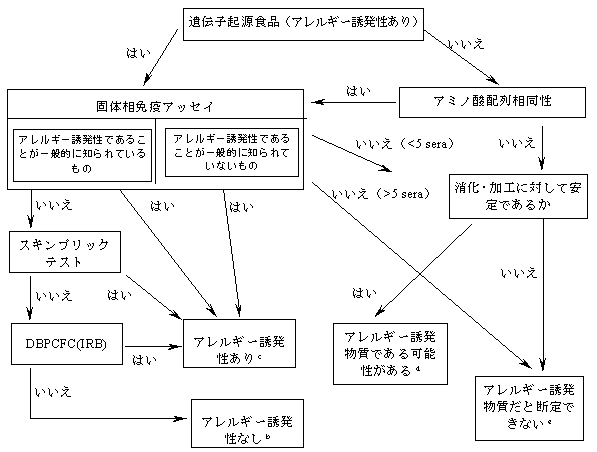
脚注
(a) この図は、国際食品バイオテクノロジー会議と国際生命研究所のアレルギー・免疫研究所が開発した判断樹から採用した(Metcalfe他、1996年)。
(b) アレルギー患者またはアレルギー患者の血清を用いた試験の組み合わせから、主要アレルギー誘発物質は移行しなかったという結果が高度の信頼性で得られた。ここで不確定要素となるのは、起源食品に対してアレルギー反応を示す被験者層のうち少数に影響を与える認知度の低いアレルギー誘発物質の存在である。
(c) アレルギー患者またはアレルギー患者の血清を用いた試験で陽性結果が得られた場合、新タンパク質がアレルギー誘発性であるという結果には高度の信頼性がある。こうした新タンパク質を含む食品は、アレルギー反応を示す消費者を保護するためにその旨を表示しなければならない。
(d) 既知のアレルギー誘発物質と構造類似性をもたず、あるいは少数の(5人未満)アレルギー患者から得た血清中IgEに対する結合能がないために一般的にアレルギー誘発性が低いと考えられる新タンパク質でも、消化・加工に対して安定であればアレルギー誘発物質である可能性はある。
この不確実性をなくすためのさらなる評価が必要となる。どのような検査法を用いるかは事例ごとに判断する。
(e) 既知のアレルギー誘発物質との構造類似性がなく、消化・加工に対して不安定な新タンパク質は、アレルギー誘発物質といえる証拠がない。同様に、新タンパクが一般的にアレルギー誘発性がみられない起源食品由来の遺伝子によって発現し、少数のアレルギー患者(5人以上14人未満)から得た血清中IgEに対する結合能がないと判明した場合は、アレルギー誘発物質である証拠がない。安定性試験がこの例に含まれる場合がある。しかし、2種類の決定基準のみでは結果の確実性もあいまいになってしまう。本会議は、新タンパク質の発現程度などその他の基準も考慮すべきであるとしている。
付属文書4
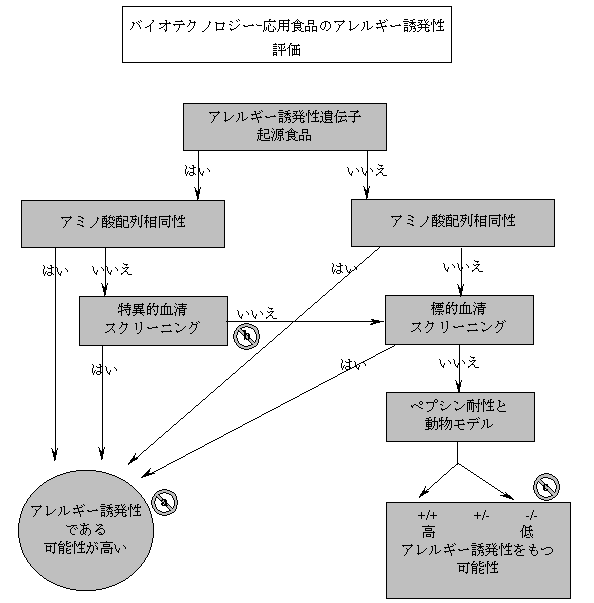
| 6.1〜6.3項の指針に基づいて試験し、データベースに掲載されている既知アレルギー誘発物質とのアミノ酸配列相同性と血清スクリーニング検査について陽性を示した場合、発現タンパクがアレルギー誘発物質である可能性が高い。 | |
| 5.3項で示された通り、多試行数によるスクリーニングが可能な場合は少試行数でのスクリーニングは避けるべきであると示しており、試行数を増やして検査することによって特異的血清スクリーニングによる陰性結果の信頼性が高まる。 | |
| ペプシン耐性試験および動物実験の両方で陽性を示した場合、発現タンパクはアレルギー誘発物質である可能性が高い。両試験で陰性を示した場合は、発現タンパクがアレルギー誘発物質である可能性は低い。両試験の結果が異なる場合はアレルギー誘発性の有無は不明だが、理論的な解釈が可能な場合もある。 |