|
PDFファイルを見るためには、アクロバットリーダーというソフトが必要です。 アクロバットリーダーは無料で配布されています。 (次のアイコンをクリックしてください。) |
|
厚生労働省食品安全部基準審査課 中垣 基準審査課長 担当:宮川、鶴身 (内線:2486,2488) |
厚生労働省では、本年5月に公布された改正食品衛生法に基づき、食品中に残留する農薬、動物医薬品及び飼料添加物(以下「農薬等」という。)について、いわゆるポジティブリスト制(基準が設定されていない農薬等が一定量以上含まれる食品の流通を原則として禁止する制度)を公布後3年以内に導入することとしており、薬事・食品衛生審議会食品衛生分科会農薬・動物用医薬品部会において、制度導入の具体化について御審議いただいた結果を踏まえ、今般、基準が設定されていない農薬等について、国際基準であるコーデックス基準等科学的な評価に基づき残留基準が設定されている農薬等の基準を参考に設定する暫定的な基準(以下「暫定基準」という。)の第1次案をとりまとめました。
つきましては、ポジティブリスト制の円滑な導入のため、当該暫定基準(第1次案)について広く意見を募集いたします。御意見のある場合には、下記の要領により提出して下さい。なお、いただいた意見に対して個別の回答はいたしかねますので、その旨御了承願います。
| 1. | 募集期間 平成15年10月28日(火)〜平成16年1月27日(火)(必着) | ||||
| 2. | 資料の入手方法 厚生労働ホームページの「ご意見・標語等の募集」から入手可能です。 | ||||
| 3. | 提出方法 意見は、理由を付して、以下に掲げるいずれかの方法で提出して下さい(様式は別紙参照)。電話での受付はできませんので、御了承下さい。 また、意見には必ず「残留農薬等の暫定基準(第1次案)について」と明記の上、提出して下さい。
| ||||
| 4. | 意見の提出上の注意 意見等は日本語に限ります。また、個人の場合は住所・氏名・職業を、法人の場合は法人名・所在地を記載して下さい。なお、寄せられた御意見については、住所、電子メールアドレスを除き、全て公開される可能性があることを予め御了承願います。 農薬等のポジティブリスト制導入に係る薬事・食品衛生審議会における検討の経緯等についてお知りになりたい方は、以下に(参考)として掲げた厚生労働省ホームページを御参照下さい。 なお、現行基準に関する意見は、今回の意見募集の対象外ですので御注意下さい。また、試験法については、現在開発中であり、別途お示しすることとしています。
(参考) | ||||
| 5. | 今後の予定 寄せられた意見を参考に、暫定基準(第2次案)の作成を含め薬事・食品衛生審議会食品衛生分科会農薬・動物用医薬品部会で必要な審議を行うこととしています。 その後、改めてパブリックコメントの募集やWTO通報など所要の手続を行うこととしています。 |
|
PDFファイルを見るためには、アクロバットリーダーというソフトが必要です。 アクロバットリーダーは無料で配布されています。 (次のアイコンをクリックしてください。) |

|
I 経緯
「食品衛生法等の一部を改正する法律」(平成15年法律第55号、平成15年5月30日公布)により、農薬、動物用医薬品及び飼料添加物(以下「農薬等」という。)について、いわゆるポジティブリスト制(基準が設定されていない農薬等が一定量以上含まれる食品の流通を原則禁止する制度、以下に(参考)として掲げる改正後の食品衛生法第11条第3項)を導入することとしている。なお、当該制度は「食品衛生法等の一部を改正する法律」の公布の日から起算して3年を越えない範囲内において政令で定める日から施行される。
(参考)改正後の食品衛生法法第11条第3項(新設)
|
同制度が導入されると、残留基準が設定されていない農薬等が一定量以上含まれる食品の流通が原則禁止されることとなる。しかしながら、現在設定されている残留基準のままでポジティブリスト制を導入した場合、不必要に食品の流通が妨げられることも想定されることから、農薬取締法により使用が認められている農薬や国際基準であるコーデックス基準等科学的な評価に基づき残留残留基準が設定されている農薬等については、それらの基準を参考に暫定的な基準(以下「暫定基準」という。)を設定することが必要である。
暫定基準の設定については、本年6月27日から3回にわたり薬事・食品衛生審議会の担当部会において審議し、次の方法により暫定基準案を作成したうえで広く関係者に意見を求めることが了承された。
II 暫定基準第1次案の設定
1. 暫定基準の作成
| (1) | 作成方法 暫定基準の設定にあたっては、(1)国際基準であるコーデックス基準、(2)国内の農薬取締法に基づく登録保留基準(動物用医薬品にあっては、薬事法に基づく承認時の定量限界等)のほか、(3)JMPR(FAO/WHO合同残留農薬専門家会議)及びJECFA(FAO/WHO合同食品添加物専門家会議)で科学的な評価に必要とされている毒性試験結果などのデータに基づき残留基準を設定している諸外国(米国、カナダ、欧州連合(EU)、オーストラリア及びニュージーランドの5ヶ国(地域)(平成15年4月11日に開催された食品輸入円滑化推進会議において在京各国大使館へ通知し協力の申し出があった国))の基準を参考に、図の設定フローに基づき、農薬、飼料添加物及び動物用医薬品の暫定基準を作成した。 なお、農薬等に該当するものであって食品に残留する成分が、いわゆる汚染物質等と同じものである場合には、自然に含まれるものについて過剰な規制とならないように必要な措置を講じた。また、農薬等に該当する場合であって、かつ、添加物規制の対象となる場合については、暫定基準策定の対象としなかった。その他、次を暫定基準の設定に際しての留意事項とした。
|
| (2) | 暫定基準の性格 暫定基準は、改正後の食品衛生法第11条第1項に基づく規格として、ポジティブリスト制の導入(「食品衛生法等の一部を改正する法律」の公布の日から起算して3年を越えない範囲内において政令で定める日)と同時に施行する。なお、農薬、動物用医薬品及び飼料添加物は、それぞれ区分することなく、一つにまとめたものとして告示する。 |
| 2. | 参考とした基準に関する情報 基準作成に際し、参考とした基準については以下のとおり。
|
| 3. | 基準設定対象食品分類について 従来の農作物分類についても「上記以外の○○○」の中から比較的摂取量が多い作物(1日摂取量が1g以上のもの)であって、コーデックスにおいて分類があるものについては、分類として独立させるものとする。なお、分類の追加については、ポジティブリスト制の施行に合わせる。
| ||||||||||||
| 4. | 加工食品に係る基準設定について コーデックスにおいて基準を設けているものは、暫定基準を設定する。それ以外の加工食品については、個別に基準を設けず、原則として、規格基準に適合した原材料を用いて製造され又は加工された食品は、流通を可能とする。 |
| 5. | 暫定基準の見直し 今回設定する暫定基準については、ポジティブリスト制施行後、5年程度ごとに参考とした基準の変更に伴う見直しを行う。 これに加え、マーケットバスケット調査による農薬摂取量の実態調査等の結果に基づき、優先順位を付した上で、安全性試験成績を収集し、リスク評価に基づく基準の見直しを行うこととする。 |
| 6. | その他
|
図
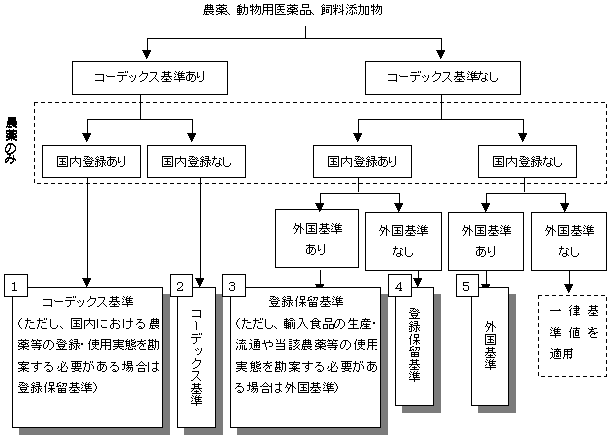
| ※ | 登録保留基準 | : | 農薬取締法に基づく登録申請の際に登録の可否を判断する基準 |
| ※ | 外国基準 | : | 申出があった国(米、EU、オーストラリア、ニュージーランド、カナダ)の基準 |
| ※ | : | 暫定基準として採用する基準 |
(類型)
| 1-1 | コーデックス基準と登録保留基準があり、コーデックス基準を採用したの |
| 1-2 | コーデックス基準と登録保留基準があり、登録保留基準を採用したもの |
| 2 | コーデックス基準を採用したもの |
| 3-1 | 登録保留基準と外国基準があり、登録保留基準を採用したもの |
| 3-2-1 | 登録保留基準と外国基準があり、外国基準を採用したもの |
| 3-2-2 | 登録保留基準と外国基準があり、外国基準を採用するが、その平均値につき特別の取扱いをしたもの |
| 4 | 登録保留基準を採用したもの |
| 5-1 | 外国基準を採用したもの |
| 5-2 | 外国基準を採用するが、その平均値につき特別の取扱いをしたもの |
| 6 | 各分類ごとの食品の基準の整合性に配慮したもの |