| 薬食安発第0824003号 平成17年8月24日 |
| 各 | ┌ │ │ └ |
都道府県 保健所設置市 特別区 |
┐ │ │ ┘ |
衛生主管部(局)長 殿 |
厚生労働省医薬食品局安全対策課長
ディートを含有する医薬品及び医薬部外品に関する安全対策について
ディート(化学名:ジエチルトルアミド)を含有する医薬品及び医薬部外品の安全対策について、平成17年8月15日に開催された「ディート(忌避剤)に関する検討会」において、薬事・食品衛生審議会の専門委員による検討を行い、別紙の検討結果が得られたところであるが、今般、下記の措置を講じることが適当であると判断したので、ご了知の上、貴管下のディートを含有する医薬品及び医薬部外品の製造販売業者(以下、「製造販売業者」という。)並びにこれらの製品を取り扱う薬局、販売業者、一般小売業者等に対して指導方ご配慮をお願いする。
記
| 1. | 製造販売業者は、以下の(1)又は(2)により、「使用上の注意」等を改訂すること。 なお、本通知に基づき改訂を行った添付文書等を、独立行政法人医薬品医療機器総合機構安全部医薬品安全課(以下、「医薬品安全課」という。)にすみやかに提出すること。
| ||||||||||||||||||||||
| 2. | 製造販売業者は、ディートを含有する製品の「使用上の注意」等が改訂された旨が消費者等に理解されるよう情報提供すること。また、ディートを含有する製品を取り扱う薬局、販売業者、一般小売業者等においては、消費者に対し、ディートを含有する製品の「使用上の注意」等が改訂された旨の情報提供に努めること。 | ||||||||||||||||||||||
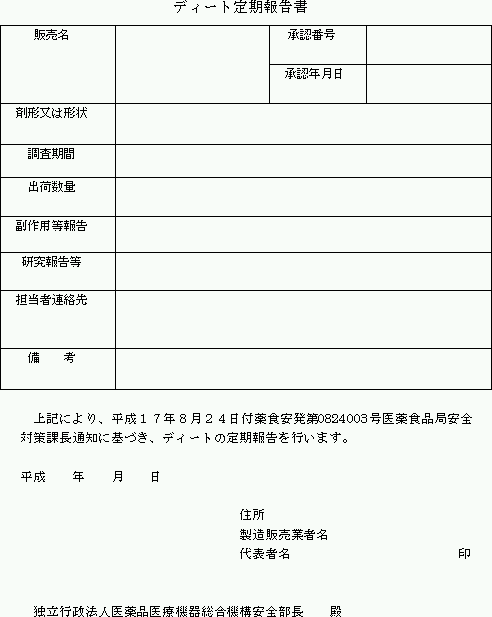
| 3. | 製造販売業者は、平成17年から当面の間、毎年9月30日締めで過去1年間の、国内における副作用等の発生状況、安全性に関する国内外の研究報告等を、別添「ディート定期報告書記載要領」に従い、別紙様式1「ディート定期報告書」により、同年11月30日までに医薬品安全課に定期的に報告すること。なお、該当する報告事項がない場合においても、その旨報告すること。 | ||||||||||||||||||||||
| 4. | 製造販売業者は、ディートの神経系への影響に関する試験を実施し、その結果について当課に報告すること。 なお、試験の実施等については、別途指示する。 |
別紙
〔検討結果の概要〕| (1) | ・ | ディートを含有する医薬品等は、我が国において多くの人が40年以上使用してきているにもかかわらず、現在まで薬事法に基づく副作用報告はない。 |
| ・ | 米国、カナダ、英国などにおいて、販売停止等の措置を講じている国はない。 | |
| ・ | デューク大学の研究グループが行ったラット皮膚塗布試験に関する報告については、関係する他の報告に比べ低用量でディートの神経系への影響が認められているが、試験方法等の不備が見られるため、現時点では評価は困難である。 |
| (2) | このような状況において、ディートを含有する医薬品等について、現時点では、販売停止等の措置を講ずるだけの科学的根拠はないと考えられる。 |
| (3) | 現在、国内で流通している製品については、使用方法等の記載が不明確なものが多いことから、適正使用を推進する観点から、製品中のディート濃度を明記させるとともに、カナダにおける記載(6か月未満には使用しない、6か月から2歳は1日1回、2歳から12歳は1日3回)を参考に、使用方法の目安等を明記させる必要がある。 |
| (4) | デューク大学の研究グループが報告している低用量において認められた神経毒性については、再現性等を確認するために追加試験を行う必要がある。また、ディートの神経毒性について、今後も同様な研究報告に注目していく必要がある。 |
別添
| ○ | 製造販売承認を得ているディートを含有する製品すべてについて、製造販売業者ごとに、別紙様式1に基づき作成すること(記載例参照)。なお、複数の製品を有する場合は、「販売名」と「剤形又は形状」を相互に照合できるよう、対応する通し番号を付すこと。 |
| ○ | 様式の記載欄に記載内容のすべてを記載しきれない場合には、当該欄に「別紙( )のとおり」と記載し、別紙を添付しても差し支えないこと。 |
| ○ | 「副作用等報告」については、調査期間内の件数を記載の上、別紙様式2の副作用等報告ラインリストを添付すること。 |
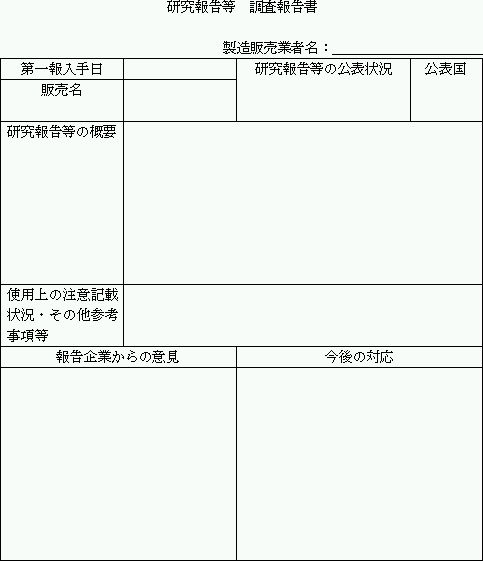
| ○ | 「研究報告等」(研究報告、措置報告)については、既に薬事法第77条4の2に基づき独立行政法人医薬品医療機器総合機構理事長あて報告したものはその識別番号を記載し、報告していないものについては、別紙様式3の研究報告等調査報告書を添付すること。 |
| ○ | 報告に際しては、製造販売承認を得ているディートを含有する製品すべてについて、最新の添付文書又は製品の外部の容器の写しを添付すること。 |
別紙様式1
記載例

別紙様式2

別紙様式3
| 平成17年8月24日 照会先:厚生労働省医薬食品局安全対策課 担当:鬼山、井上(内2753) |

