平成19年11月1日
※このQ&Aについては、現状に即したものとなるよう、追加、修正を含め適宜見直しを行っていく予定です。 (新規追加質問:下線)
|
| Q1−1 | 患者から得た検体から分離した細菌、カビ、ウイルス等の微生物についての研究は本指針が適用されますか。医療機関等で採取された細菌等を収集し、研究を行う場合、本指針が適用されますか。喀痰から培養した細菌を使用する場合(培養に2,3日かかる)など、患者が既に退院しインフォームド・コンセントの取得が困難な場合がほとんどです。(喀痰等の採取は診療のために行うので、採取の際に研究に用いる旨の説明はしないのが通常。)。 なお、細菌・微生物学分野では、細菌等とともに診療情報を収集することはありませんが、感染症学分野では、診療情報を収集することはあり得ます。 |
||||||||||||||||
| A1−1 | 分離した微生物そのものの分析等を行うのみで、提供者の健康に関する事象を研究対象としない場合は、指針「第5 用語の定義」(1)に規定されているとおり、本指針でいう疫学研究に該当せず、指針の対象外となります。 また、喀痰調査によって得られた診療情報を用い、他の診療情報と合わせて観察研究を行う場合は、指針「第3 1 研究対象者からインフォームド・コンセントを受ける手続等」(2)[2]に該当し、必ずしもインフォームド・コンセントを要するものではありませんが、喀痰そのものを使用する場合は、指針「第4 2 資料の保存等」(2)により原則としてインフォームド・コンセントが必要となります。 |
||||||||||||||||
| Q1−2 | 市民を対象としたイベントで、参加した市民の「手指の細菌検査」を実施しました。検査項目は黄色ブドウ球菌で、被検査者は検査を希望する市民です。被検査者には検査の目的、黄色ブトウ球菌、手洗いの方法等の説明をし、検査結果については啓発文書を添えて郵送で本人に通知しました。 このときに被検査者から分離した黄色ブドウ球菌について、調査研究として薬剤耐性を試験しMRSAを分離しました。採取した菌の管理はナンバーにより行い、個人名では管理していません。 この結果について、毒素型、コアグラーゼ型、MRSAの保有率等について外部(学会、研究発表会等)に報告する場合、本指針の規定が適用されますか。 なお、被検査者の市民には分離した菌株について調査研究に使用する旨の了解は取っていません。また、当然発表の際には個人は特定されません。 |
||||||||||||||||
| A1−2 | 分離した微生物そのものの分析等を行うのみで、健康に関する事象を研究対象としないならば、指針「第5 用語の定義」(1)に規定されているとおり本指針でいう疫学研究に該当しません。ただし、病原菌の保有率を分析するのであれば、疫学研究に該当するものと考えられます。この場合、既に得られたデータを用いて分析を行うのであれば、指針「第3 1 研究対象者からインフォームド・コンセントを受ける手続き等」(2)[2]に該当し、研究の実施についての情報を公開する必要があります。なお、資料採取時に、当初の目的以外に当該資料を用いて研究を行うことがあらかじめ計画されているのであれば、資料採取の際に本人の同意を得ておくことが望ましいと考えます。 なお、採取した菌にナンバーのみを付して研究・保管しており、研究の時点では、採取された者の氏名、住所等の個人を識別できる情報を一切保管していないのであれば、連結不可能匿名化されており、指針「第1 2 適用範囲」[3]に該当し本指針の対象外となります。 |
||||||||||||||||
| Q1−3(1) | 単独の病院内で、診療(手術、投薬を含む)で得られた患者のデータを用いる行為は診療の一環又は疫学研究のいずれに該当しますか。 |
||||||||||||||||
| A1−3(1) | 自施設内で収集・集計した診療記録など人の健康に関する情報を用いる行為のうち、行為の結果が公表されない(自施設内での発表、報告などにとどまる)場合には診療の一環であり疫学研究指針の対象外であると考えられます。こうした行為の具体的な例には、次のようなものが挙げられます。
また、以下に挙げたような例についても、自施設における調査であって、学会等における発表を目的としない(年報、機関のHP、機関外の医師同士の勉強会など)場合は、疫学研究指針の対象外と考えられます。
次に、行為の結果が公表される場合には、診療の一環、疫学研究の仕分けは、[1]収集・集計された情報に対する解析の複雑さ、[2]公表される場、[3]公表の目的、を総合的に勘案して判断されるべきものであると考えられます。 診療の一環 疫学研究
単純集計、 複雑な処理
年報、機関のHP、 ― (公表の場) ― 学術論文、学会発表、
患者、他機関(行政機関など)
なお、院内で行った検討会において検討された事例(例:高血圧に対する薬剤の降圧効果の比較検討など)で、その時点において公表を意図していなかったものについて、学会発表を意図した場合には、疫学研究指針等の適用対象に該当する可能性があることに留意して下さい。 |
||||||||||||||||
| Q1−3(2) | (1)のような事例が生じ、診療の一環か疫学研究かの判断が困難である場合、その判断を誰に委ねるべきですか。 |
||||||||||||||||
| A1−3(2) | 診療の一環と疫学研究の仕分けが困難な場合には、その判断は各機関に設置された倫理審査委員会(倫理審査委員会があらかじめ指名する者)の判断によるべきものであると考えます。 なお、自施設内で収集・集計した診療記録など人の健康に関する情報を用いる行為のうち、診療の一環と疫学研究との判断が困難であると考えられものは、指針「第1 4 研究機関の長の責務」(3)により、倫理審査委員会への付議を要しない場合があります。 |
||||||||||||||||
| Q1−3(3) | ある医療機関において、退院した患者も含めた患者の予後を調査することとしています。この場合、本指針が適用されますか。 |
||||||||||||||||
| A1−3(3) | 退院した患者も含めた患者の予後を調査する場合、特定の患者を対象に、必要に応じ当該患者の予後を調査する行為は、臨床医としての責務であり、診療の一環と判断されます。 特定の患者を対象とせずに、患者の予後を調査する行為の場合には、(1)と同様に、診療の一環、疫学研究の仕分けは、[1]収集・集計された情報に対する解析の複雑さ、[2]公表される場、[3]公表の目的、を総合的に勘案して判断されるべきものであると考えられます。 これらの要素により、診療の一環であると考えられる具体的な例としては次のようなものがあります。
|
||||||||||||||||
| Q1−4 | 以下は全て手術で切除された多数(100例程度)の腫瘍標本を用いて行う研究ですが、本指針が適用されますか。
|
||||||||||||||||
| A1−4 | 指針「第1 2 適用範囲」及びその細則において、対象外とされているものに該当しないのであれば、1)〜3)は、腫瘍の病態に関する疫学研究と考えられ、本指針が適用されます。また、4)は、がん抑制遺伝子の発現有無は、「ヒトゲノム・遺伝子解析研究に関する倫理指針」(平成16年文部科学省・厚生労働省・経済産業省告示第1号)第6の16 用語の定義(3)ヒトゲノム・遺伝子解析研究<本指針の対象とするヒトゲノム・遺伝子解析研究の範囲に関する細則>により、原則として「ヒトゲノム・遺伝子解析研究に関する倫理指針」の対象としない、とされていますが、「ただし、このような研究であっても、子孫に受け継がれ得るゲノム又は遺伝子に関する情報を明らかにする目的で研究が実施される場合には、本指針の対象とする。」とされており、その調査については「ヒトゲノム・遺伝子解析研究に関する倫理指針」の適用範囲の可能性があります。 |
||||||||||||||||
| Q1−5 | 保健所が、保健事業により得た健診データや届出を利用して、ADLに影響を与える生活要因を検討したり、集計したものを管内の疾病の実態(地域特性)として学会等で公表する場合、本指針が適用されますか。 |
||||||||||||||||
| A1−5 | まず、ADLに影響を与える生活要因を検討したり、集計して管内の疾病の実態(地域特性)を把握する行為が、保健事業として行われるものであるかどうかを整理する必要があります。保健事業を超えて行われるのであれば、本指針の施行通知(平成14年6月17日付け「疫学研究に関する倫理指針の施行等について」)の参考資料(別添3「疫学研究に関する倫理指針」とがん登録事業の取扱いについて」)において、がん登録事業における考え方を整理しているとおり、保健事業で得られたデータを分析して仮説を立て、検証する場合には、本指針が適用されます。 |
||||||||||||||||
| Q1−6 | がん検診など検診の精度管理のために、医療機関、検診機関、市町村、がん登録室などの間で個人が特定された情報をやり取りすることに対して、本指針が適用されますか。 |
||||||||||||||||
| A1−6 | 保健事業として行う検診について、精度管理のための事業を行う場合、当該精度管理の事業は検診事業に含まれるものであり、指針「第5 用語の定義」(1)細則により、本指針の対象外となります。 |
||||||||||||||||
| Q1−7 | 医療機関など臨床の場において行われる研究のうち、疫学研究指針の対象となる研究にはどのようなものがあるか教えて下さい。 |
||||||||||||||||
| A1−7 | 臨床の場における疫学研究のうち、疫学研究指針の対象となるものとして、「診断・治療等の医療行為について、当該方法の有効性・安全性を評価するため、診療録等診療情報を収集・集計して行う観察研究」とし、対象とはならないものとして、「新たな治療方法の有効性・安全性を調べる目的で、被験者に対して行う介入研究」(指針「第1 2 適用範囲」<適用範囲に関する細則 表>)を例示しており、このことは下図のように表されます。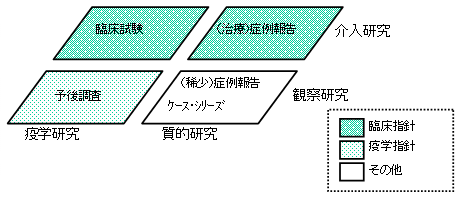
このうち、疫学研究指針の対象となる「診断・治療等の医療行為について、当該方法の有効性・安全性を評価するため、診療録等診療情報を収集・集計して行う観察研究」の具体的な例は、以下に掲げるとおりです。
|
||||||||||||||||
| Q1−8 | ある事業所において、当該事業所での産業保健活動に役立てるために、その事業所内での特定の疾患の発生、予後の収集・集計を行う場合、本指針が適用されますか。 |
||||||||||||||||
| A1−8 | 労働安全衛生法に基づく産業医の職務等は、労働安全衛生規則第14条に規定されているところですが、この中に、労働者の健康障害の原因の調査及び再発防止のための措置に関すること(同条第1項第7号)とされています。よって、ご照会の行為は、指針における「保健事業等」と判断され、指針の対象外となります(指針「第1 2 適用範囲」)。 ただし、産業医の職務等により得られたデータを、労働安全衛生法に基づく業務外に、分析して仮説を立て、検証する段階を含む個々の疫学研究に用いる場合には、本指針の対象となります(「疫学研究に関する倫理指針」とがん登録事業の取扱いについて」平成14年6月17日付け通知「疫学研究に関する倫理指針の施行等について」の参考資料(別添1)において示された整理と同様の考え方)。 |
||||||||||||||||
| Q1−9 | ある地域において、生活習慣病の改善を目的とした運動療法について高齢者を対象として行うことを予定しています。この場合、本指針が適用されますか。 |
||||||||||||||||
| A1−9 |
疫学研究の定義に関する細則において、疫学研究の最低限の要件を、
当該行為が本指針の対象となるか否かについては、この要件から判断すべきであると考えられます。例えば、運動療法が既に一定の効果があるものとして確立され、一定のプログラムにより行われるのであれば、研究には該当せず指針の対象とならないと考えられますが、既知の知見の検証を目的とする場合は、対象になるものと考えられます。 |
||||||||||||||||
| Q1−10 | 多施設から情報を収集し、単に症例数等の集計のみを行い、それ以上の解析及び解析結果に基づく結果の考察を行わない調査等も、指針の対象となるのでしょうか。 |
||||||||||||||||
| A1−10 | 疫学研究は「明確に特定された人間集団の中で出現する健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を明らかにする科学研究をいう。」と定義されているところであり(第5 用語の定義(1)疫学研究)、この定義に該当する調査等は当然指針の対象になるものと考えられます。 こうした調査等の具体例としては、特定疾患の全国調査及びその集計などが挙げられます。 なお、院内がん登録などの統計を所属医療機関のホームページや年報などに掲載する行為は診療の一環であり、本指針の対象外と考えられます。 |
||||||||||||||||
| Q1−11 | テレビや新聞雑誌において、ある食品が健康に与える影響を調べることを目的として、被験者を2群に分け、一方の群は通常の食事を行い、他方の群に特定の食品を摂取させることとしています。この場合、本指針が適用されますか。 |
||||||||||||||||
| Q1−11 | 大学や病院以外の機関であっても、本指針に定義する疫学研究を実施する場合には、当然、本指針に従って疫学研究を遂行する必要があります。ご質問の行為は、疫学研究に該当することから、本指針に従う必要があります。 |
||||||||||||||||
| Q1−12 | 医療従事者の医療倫理に関する意識調査を、医療従事者自身及び一般市民に対して実施する場合に、指針の対象となるのでしょうか。 |
||||||||||||||||
| A1−12 | 疫学研究は「明確に特定された人間集団の中で出現する健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を明らかにする科学研究をいう」と定義されているところであり(第5 用語の定義(1)疫学研究)、健康観や主観的健康度などを含む意識調査の中には、本指針の対象となる場合がありますので、実施に当たっては、倫理審査委員会(倫理審査委員会があらかじめ指名する者)の判断を仰ぐことが望まれます。なお、このような調査が研究であると判断され本指針の対象となった場合であっても、指針「第1 4 研究機関の長の責務」(3)の規定により、倫理審査委員会への付議を要しない場合があります。 |
|
| Q2−1 | 県内のA市医師会では,1980年代に加盟医療機関等の医療従事者約2,000人を対象に,本人同意を得て血液を採取しB型肝炎の罹患状況に関する疫学調査を実施しました。ただし,同意事項はB型肝炎の調査のみかその他の疾病を含むかは不明です。 当医師会はその後,凍結血漿の検体及び問診票を現在まで保存してきましたが,今般,この資料を利用して過去の医療従事者のE型肝炎罹患状況に関する疫学研究を実施することを検討しています。 なお,対象者は検体採取から相当の年月が経過しているため,死亡,退職及び転居等により追跡が困難であり,再度,本人同意を取ることは事実上不可能です。 <事業実施に当たっての2案>
|
||||||||||||||||
| A2−1 | <[1]について> 1つ目の「・」について 研究開始前に人体から採取された試料を今回の研究に利用するにあたって、同意を受けることが原則ですが、同意を得ることが出来ない場合は、指針「第4 2 資料の保存等」(2)の要件を満たす必要があります。 2つ目の「・」について A市医師会に倫理審査委員会を設置するか、指針「第1 4 研究機関の長の責務」(2)に示されているとおり、公益法人、学会等他の機関に設置された倫理審査委員会に審査を依頼することもできます。 <[2]について> 指針「第1 3 研究者等が遵守すべき基本原則」(1)及び「第1 4 研究機関の長の責務」(3)において、研究者等は研究計画について研究機関の長の許可を受けること、研究機関の長は許可を決定する際に倫理審査委員会の意見を聴くこととされています。本件の場合、研究を実際に行う機関において倫理審査委員会の意見を聴くこととなり、また、県においては、研究結果を活用するのみで、県職員が研究を行うのでなければ、指針上は、県においてさらに倫理審査委員会の意見を聴く必要はありません。 |
||||||||||||||||
| Q2−2 | 指針第1の3(1)<研究計画書に記載すべき事項に関する細則>において、「指針において記載することとされている事項及び倫理審査委員会の審査を受けることとされている事項」とは具体的にどのような事項ですか。 |
||||||||||||||||
| A2−2 | 細則に示した事項は必ずしも全て網羅する必要はなく、これらの事項を参考に、研究の内容に応じて必要な事項を記載する必要があります。しかし、例えば指針「第1 3 研究者等が遵守すべき基本原則」(3)[2]のインフォームド・コンセントの手続に関する事項や指針「第3 1 研究対象者からインフォームド・コンセントを受ける手続等」の研究対象者からインフォームド・コンセントを受けないで試料を利用する場合又は指針「第3 2 代諾者等からインフォームド・コンセントを受ける手続」の代諾者等の同意により試料を利用する場合の理由や妥当性などの事項については、研究計画書に記載し、倫理審査委員会で審査を受けることが求められます。 |
||||||||||||||||
| Q2−3 | 指針第1の3(1)<研究計画書に記載すべき事項に関する細則>の「研究に参加することに伴う不快な状態」とはどういう状態のことをいうのですか。 |
||||||||||||||||
| A2−3 | 例えば、研究実施のために、研究対象者の身体的拘束が必要であり、その状態が不快な状態となり得る場合などが考えられます。 |
||||||||||||||||
| Q2−4 | 指針第1の3(1)<研究計画書に記載すべき事項に関する細則>の「当該研究に係る資金源、起こりうる利害の衝突及び研究者等の関連組織との関わり」とありますが、具体的に何を指すのですか。 |
||||||||||||||||
| A2−4 | 利害の衝突とは、研究者等が研究の実施や報告の際に、金銭的な利益やそれ以外の個人的な利益のためにその専門的な判断を曲げてしまう(もしくは曲げたと判断される)ような状況を示します。 この利害の衝突は、金銭的な利害の衝突とそれ以外の利害の衝突に分類されます。 金銭的な利害の衝突とは、研究者等が資金提供や研究依頼のあった者・団体(政府、財団、企業等)から、当該研究に係る資金の他に機器や消耗品等の提供を受けること、実施料を受け取ること、その株式を所有(未公開株やストックオプションを含む)すること、特許権を共有・譲渡されること、講演料や著述料の支払いを受けていること等です。 それ以外の利益の衝突とは、研究者等が資金提供や研究依頼のあった者・団体との間に顧問等の非常勤を含む雇用関係があることや、親族や師弟関係等の個人的関係あるなど、研究者等の関連組織との関わりについての問題などが考えられます。 これらの事項について、どの範囲まで記載すべきかについては、研究者のおかれた立場、その所属団体の公的な性格の度合い等により様々なケースが考えられるため、倫理審査委員会等で判断する必要があります。そのため、あらかじめ想定されうる事項については、その基準を各倫理審査委員会等で決定しておくことが望ましいと考えます。上記の様な利害の衝突の中でも、明示的に確認することが出来る、[1]金銭的な利害の衝突、[2]研究者等の関連組織との関わりについては少なくとも記載すべきと考えます。 |
||||||||||||||||
| Q2−5 | 指針第1の3(3)<インフォームド・コンセントの受領に関する細則>において、説明内容として、共同研究の場合に共同研究であること等の項目がありますが、これらの事項はなぜ説明する必要があるのですか。 |
||||||||||||||||
| A2−5 | 本項は、個人情報保護法の第三者提供の制限を踏まえ規定したものです。個人情報を機関間で共同で利用する場合には、その旨並びに共同で利用される個人情報の項目、利用する者の利用目的及び当該個人情報の管理について、あらかじめ、提供者に通知し、または提供者が容易に知り得る状態にすることが求められています。 |
||||||||||||||||
| Q2−6 | 共同研究を行う場合は、[1]共同研究であること、[2]共同して利用される個人情報の項目、[3]共同して利用する者の範囲、[4]利用する者の利用目的及び[5]当該個人情報の管理について責任を有する者の氏名又は名称」とありますが、[2]は具体的にどのようなものを示すのですか。また、[3]及び[5]については、個々の研究者の名前を網羅する必要がありますか。 |
||||||||||||||||
| A2−6 | [2]の個人情報の項目については、例えば、アンケート等で入手し、匿名化せずに用いる氏名、年齢、性別、病歴といった情報です。 [3]及び[5]については、研究機関名でも足りうるものと考えます。 |
||||||||||||||||
| Q2−7 | 研究計画書の改訂の際、共同研究者のみの変更などで、目的の変更は無く、提供者に影響が少ないと思われる場合でも、インフォームド・コンセントを取り直す必要がありますか。また、この必要性を判断するのは、倫理審査委員会ということでよろしいでしょうか。 |
||||||||||||||||
| A2−7 | 研究計画書の変更により、インフォームド・コンセントの説明文書に変更があれば、取り直すことが必要です。説明文書の変更を伴うかどうかについては、最終的には研究を行う機関の長が倫理審査委員会の意見を踏まえ、判断することとなります。 |
||||||||||||||||
| Q2−8 | 乳幼児を対象としてコホート研究を行う場合、本人からのインフォームド・コンセントの取得は困難であると考えられますが、どのような手続きを行う必要がありますか。また、取得したインフォームド・コンセントに有効期限はありますか。 |
||||||||||||||||
| A2−8 | 研究対象者が未成年者である場合には、代諾者からインフォームド・コンセントを受けることができます(研究対象者が16歳以上であって、有効なインフォームド・コンセントを与えることができると判断される場合を除く。指針「第3 2 代諾者等からインフォームド・コンセントを受ける手続」)。 ただし、この場合でも、本人の意思及び利益が十分に反映されているかという観点から、代諾の有効性について十分検討すべきです(例:親の虐待とはなっていないなど)。 また、研究対象者が16歳未満であって、代諾者からのインフォームド・コンセントにより研究を開始した場合において、研究対象者が16歳に達した以降も研究を継続する場合には、研究対象者が16歳に達し有効なインフォームド・コンセントを与えることができると客観的に判断された場合において、原則として当該研究対象者からインフォームド・コンセントを受ける必要があります(指針「第3 2 代諾者等からインフォームド・コンセントを受ける手続」<代諾者等からのインフォームド・コンセントに関する細則>[2]) |
||||||||||||||||
| Q2−9 | 研究計画書及び研究対象者に対する説明の内容に、「危険及び必然的に伴う不快な状態が起こりうる場合の、当該研究に伴う補償等の対応」を記載することとされています(指針「第1 3 研究者が遵守すべき基本原則(1)及び(3))。この補償等の範囲には個人情報が漏えいした場合も含みますか。 |
||||||||||||||||
| A2−9 | 個人情報が漏えいした場合の補償等までは含みません。しかしながら、個人情報の保護については指針「第4 個人情報の保護等」においてその漏えい、滅失又はき損がないよう安全管理措置を講じるよう定めているところであり、こうしたことがないよう、研究を行う機関の長及び研究責任者において十分に注意を払う必要があります。 |
||||||||||||||||
| Q2−10 | あるコホート研究を実施するに当たって、住民基本台帳より研究対象者を選定することを考えています。この場合、住民基本台帳の閲覧は可能ですか。 |
||||||||||||||||
| A2−10 | 住民基本台帳法第11条の2では、「統計調査、世論調査、学術研究その他の調査研究のうち、総務大臣が定める基準に照らして公益性が高いと認められるものの実施」については、個人又は法人の申出による住民基本台帳の一部の写しの閲覧を認めており、この総務大臣が定める基準として、「大学その他の学術研究を目的とする機関もしくは団体又はそれらに属する者が学術研究の用に供する場合であっては、その調査結果又はそれに基づく研究が学会等を通じて公表されることによりその成果が社会に還元されること。」(「住民基本台帳の一部の写しの閲覧についての公益性の判断に関する基準」(平成18年9月15日総務省告示第495号))としています。 したがって、行おうとする研究が上記基準を満たしていれば閲覧は可能であると考えられます。しかしながら、個人情報の管理の一層の強化が求められている状況において、上記基準を満たす研究については住民基本台帳の閲覧が認められている意味をよくわきまえた上で研究を実施する必要があります。また、入手した個人情報については、指針が規定する個人情報の保護に関する規定により、その管理を適切に行う必要があります。 |
|
| Q3−1 | 倫理審査委員会の構成について、
|
||||||||
| A3−1 | <[1]について> 可能です。 ただし、「研究機関の長は、研究計画がこの指針に適合しているか否かその他疫学研究に関し必要な事項の審査を行わせるため、倫理審査委員会を設置しなければならない。」(指針第1 4(2))のであり、実際に審査を行えるかどうかを考えて構成を決めて頂くこととなります。 なお、委員会の最小構成は医学・医療専門家、人文・社会科学有識者、一般の立場の代表者の3名であると考えます。 <[2]について> 「いずれかに加えて」という表現が例えば外部の法律の専門家など一人で複数の要素が重なることを意図しているとすれば、その構成は認められます。 また、外部委員は最低1名で構いません。 ただし、倫理審査委員会の委員構成及び議事要旨は公開されなければならないとされていること(指針第2 1(2)[2])から、常に外部の目にさらされていることを意識し、外部の意見を適正に反映した運営となるように工夫してください。 <[3]について> 倫理審査委員会の設置は「研究機関の長」の責務です。したがって貴学で実施する研究については学部長が研究機関の長であるのであれば、学部に設置することとなります。なお、「研究を行う機関」として例えば大学共通の倫理審査委員会を設置し、審査を行うことは可能です。ただし、この場合、共通の倫理審査委員会の当該機関における位置づけ等、研究を行う機関において整理した上で実施する必要があります。 <[4]について> 「機関内倫理審査委員会は、多様な側面から検討を行うこと、機関内部の考え方だけではなく、外部の考え方も取り入れること、などから、当該研究の専門家、法律や生命倫理の専門家、一般の立場の者、外部の者、両性が含まれるべきである。」(「機関内倫理審査委員会のあり方について」平成15年3月20日科学技術・学術審議会生命倫理・安全部会より抜粋) 上記を参考として、ふさわしい構成を検討してください。 |
||||||||
| Q3−2 | 共同研究を行う場合、各施設の倫理審査委員会で審査する必要がありますか。 |
||||||||
| A3−2 | 各研究機関の長は、当該機関における研究計画の許可にあって、指針「第1 4 研究機関の長の責務」(3)に基づき、倫理審査委員会の意見を聴く必要があります。この場合、指針「第2 1 倫理審査委員会」(2)[4]<迅速審査手続に関する細則>[2]に従い、迅速審査を適用することも可能です。なお、指針「第1 4 研究機関の長の責務」(2)のとおり、当該機関内に倫理審査委員会を設置できない場合は、共同研究機関等に設置された倫理審査委員会に審査を依頼することができます。 |
||||||||
| Q3−3 | 複数の研究機関が共同して研究を行う場合、「主たる研究機関において倫理審査委員会の承認を受けたことにより、迅速審査手続による審査に委ねる。」ことが可能とされています(指針「第2 1 倫理審査委員会」(2)[4]<迅速審査手続に関する細則>[2])。上記の迅速審査手続きを、主たる共同研究機関でない研究機関が受ける場合、
|
||||||||
| A3−3 | 倫理審査委員会における迅速審査に際して、審査と別に事前手続きを要するかどうかについては、本指針においては、こうした手続きを求めていません。なお、こうした場合において、各倫理審査委員会が、審査に先立つ何らかの手続きが必要と判断されるのであれば、その判断に従ってください。 |
||||||||
| Q3−4 | 研究責任者は、研究実施状況報告書や、研究結果の概要等を倫理審査委員会へと報告しなければならないとされています(指針「第2 2 疫学研究に係る報告等」)。 一方、複数の共同研究機関が共同して研究を実施する場合、共同研究機関等に設置された倫理審査委員会に審査を依頼することが可能とされているところです(指針「第1 4 研究機関の長の責務」(2)倫理審査委員会の設置)が、この場合、報告の対象となる倫理審査委員会はどこの機関に設置された委員会となりますか。 |
||||||||
| A3−4 | 共同研究機関等に設置された倫理審査委員会に審査を依頼した場合、指針「第2 2 疫学研究に係る報告等」の規定に基づく報告の対象となる倫理審査委員会をどこに設置された委員会とするのかは、機関の長により判断されるべきと考えます。 |
|
| Q4−1 | 指針第3の1(2)観察研究を行う場合の[1]イの 「試料の採取が侵襲性を有しない場合」と考えられるのは具体的にはどのような試料ですか。手術等で切除された標本(パラフィンブロック等)、毛髪・つめ、咽頭うがい液、胎盤は全てこれに該当し、採取に侵襲性を有しない試料と判断してよいですか。 |
| A4−1 | 「ア 試料の採取が侵襲性を有する場合」は、採取を目的とした侵襲性を示します。したがって、『手術等で切除された標本、毛髪・つめ、咽頭うがい液、胎盤』は、この要件には当てはまらず、「イ 試料の採取が侵襲性を有しない場合」に該当すると考えられます。ただし、手術の目的が試料の採取の為であれば、アが適用されます。なお、研究開始前に人体から採取された試料を利用するにあたっては、指針「第4 2 資料の保存等」(2)に定めるとおり、研究対象者から試料の利用に係る同意を受けることを原則としています。 |
| Q4−2 | 指針第3の1(2)観察研究を行う場合 [2]人体から採取された試料を用いない場合において、「この場合において、研究者等は、当該研究の目的を含む研究の実施についての情報を公開し、」とあるが、「公開」とは具体的にどのようなことを指すのですか。 |
| A4−2 | 平成14年6月17日付け通知「疫学研究に関する倫理指針の施行等について」の参考資料(別添2)において、インフォームド・コンセント等の具体的方法について示されているので、参照してください。 |
| Q4−3 | 研究対象者から調査票により情報を得た後に、その疫学的研究による調査結果を基にして、更に同じ研究対象者から新たに試料を得て、遺伝子解析を行うことを一連の研究として予定していますが、研究開始時点でインフォームド・コンセントについてどのように対処すればよいですか。 |
| A4−3 | 段階的に行われる研究計画においてインフォームド・コンセントを受ける際には、その研究計画の一部である将来的に行われる研究の内容についても、研究対象者に知らせることが必要です。 したがって、疫学研究等の調査の開始時に同時に遺伝子解析研究に係るインフォームド・コンセントを受ける、又は遺伝子解析研究に係るインフォームド・コンセントを改めて受けることを明確に説明すべきと考えます。 |
| Q4−4 | インフォームド・コンセントを受ける際、自由意志に基づく文書による同意とありますが、文書は電子的方式、磁気的方式その他人の知覚によっては認識できない方式によるものでもよいですか。 |
| A4−4 | 自由意思に基づく文書による同意には、原則として、電子的方式、磁気的方式その他人の知覚によって認識できない方式によるものは想定していません。しかしながら、本人の意思を確認するための社会的需要、研究現場におけるニーズを踏まえ、その方式の必要性について今後検討されるべきものと考えます。 |
| Q4−5 | 入院時や手術時に、具体的な研究内容を記載しないまま、「診療データや摘出した臓器、検体などを今後の研究に用いる場合があります」と説明し、同意を得た資料の研究に利用することは可能ですか。 |
| A4−5 | 本指針では、研究対象者に対して、研究の目的、意義及び方法、期間についてインフォームド・コンセントを取得すること、また、個人情報を取扱う場合には、その利用の目的をできるかぎり特定しなければならないことを定めています。したがって、具体的な研究内容等を示さないまま、研究に利用する場合があると説明して同意を得たとしても、特定の研究に当該データ等を用いることに対して同意を得たことにはなりません。 なお、本指針では、当該疫学研究が指針「第3 1 研究対象者からインフォームド・コンセントを受ける手続等」<インフォームド・コンセントの簡略化等に関する細則>に規定するすべての要件を満たすことについて、倫理審査委員会の承認を得て研究機関の長の許可を受けた場合に、インフォームド・コンセントの簡略化や免除、原則と異なる方法によることを可能としています。 また、研究開始前に人体から採取された試料を利用する場合には、指針「第4 2 資料の保存等(2)」の要件に該当するときに限り、研究対象者から試料の利用に係る同意を受けることなく試料を利用することができます。 |
| Q4−6 | 指針第3の1(2)<インフォームド・コンセントを受けない場合において、当該研究の実施について公開すべき事項に関する細則>について、これらの事項全てについて情報公開する必要がありますか。 |
| A4−6 | 当該細則に規定する事項すべてについて情報公開する必要があります。個人情報保護法第24条第1項等を踏まえ、研究の目的(指針第4 1(5)[1]ア、イ、ウ、エに該当する場合を除く)、研究機関名、開示等に求めに応じる手続き等について、本人の知り得る状態に置かなければならないとされている事項であり、情報公開により本人の知り得る状態に置くことを求めたものです。また、開示できない事項及びその理由については、あらかじめ公開しておくことにより、開示手続きの簡素化が図れるものと考えます。 |
|
| Q5−1 | 未成年者の場合は、代諾者等のインフォームド・コンセントを受けるとありますが、例えば、指針「第3 1 研究対象者からインフォームド・コンセントを受ける手続等」において、必ずしもインフォームド・コンセントを要しない場合が示されていますが、このような場合であっても、未成年者の場合は代諾者からインフォームド・コンセントを受ける必要がありますか。 |
| A5−1 | ここでは、研究対象者からインフォームド・コンセントを受けることができない場合に、代諾者等からインフォームド・コンセントを受けることができることを規定したものです。従って、研究対象者本人からインフォームド・コンセントを受けることを要しない場合は、代諾者等からもインフォームド・コンセントを受けることを要するものではありません。 |
|
| Q6−1 | 指針第4の1(2)の「変更前の利用目的と相当の関連性を有すると合理的に認められる範囲」とはどのような範囲ですか。 |
| A6−1 | 変更後の利用目的が変更前の利用目的からみて全く想定できないものではなく、社会通念上妥当であると客観的に認識される範囲です。社会的な誤解を招かないよう、利用目的を変更する場合は、指針「第4 1 個人情報の保護に関する措置」(3)[1]による本人の同意を要するか慎重に対応する必要があると考えます。 |
| Q6−2 | 指針第4の1(6)に、個人情報を正確かつ最新の内容に保つとありますが、常に新たな情報に更新し続ける必要があるのですか。 |
| A6−2 | 本規定は、利用(研究)目的に応じて、その達成に必要な範囲内で、適宜個人情報を正確かつ最新の内容に保つことを求めているものです。 |
| Q6−3 | 研究者等は、具体的に個人情報の漏えい、滅失又はき損の防止その他個人情報の管理のためにどのような安全管理措置を講じる必要があるのでしようか。 |
| A6−3 | 研究者等は、研究を行う機関の長が定めた安全管理措置に従って、個人情報を取り扱うことが求められます。また、研究を行う機関の長は、研究者等に個人情報を取り扱わせるに当たり、個人情報の安全管理措置が図られるよう、研究者等に対する必要かつ適切な監督を行う必要があります。 |
| Q6−4 | 個人情報の共同利用に際して、その安全管理措置は一機関内に適応される規定で十分ではないと考えます。個人情報の機関間又は研究者間の移動における安全管理措置について、明示的に示す必要があるのではないでしょうか。 |
| A6−4 | 個人情報を取り扱う際には、共同研究機関の各々が安全管理措置に基づいて措置を行うこととなります。なお、個人情報の機関間の移動等の際の情報の受け渡しにおける留意事項も安全管理措置の中に含まれると考えられます。 |
| Q6−5 | 具体的にはどのような安全管理措置を講じなければならないのですか。 |
| A6−5 | 具体的にどのような安全管理措置を講ずるかは、取り扱う個人情報の性質に応じて、研究を行う機関の長の責務として定めることとなります。 |
| Q6−6 | 指針第4の1(7)<安全管理措置に関する細則>に、組織的、人的、物理的及び技術的安全管理措置に含まれる事項が記されていますが、この「含まれる事項」を全て実施しなければならないのですか。 |
| A6−6 | 機関として組織的、人的、物理的及び技術的安全管理措置が講じられていることが必要であり、一般的には細則に示した「含まれる事項」の措置を講じるものと考えられます。ただし、「含まれる事項」に示された措置内容については、取り扱う情報の性質に応じて、研究を行う機関の長が十分に検討した上で、一部の項目を講じない場合でも、個人情報の漏えい、滅失又はき損の防止その他個人情報の安全管理が図られるものと判断できる場合は、「含まれる事項」のすべては実施しないケースもあると考えます。 |
| Q6−7 | インフォームド・コンセント取得時に個人情報の第三者提供が想定されていませんでしたが、研究途中に個人情報を第三者提供することが生じた場合には、改めて研究対象者から同意を得る必要がありますか。 |
| A6−7 | 原則として、改めて提供者から同意を得る必要があります。ただし、本規定に示された例外に該当する場合は、この限りではありません。 |
| Q6−8 | 既存資料等のみを用い、人体から採取された試料を用いない観察研究で、倫理審査委員会の承認を得て、本人の同意なしに実施している研究については、例えば病名告知を受けていない患者が開示によって病名を知り得る可能性があること、また、開示要求が削除要求につながる場合もあり、全数調査の場合など研究に支障を及ぼす可能性があることから、開示しないことに関して倫理審査委員会において承認されれば、開示しなくてよいですか。 |
| A6−8 | 開示が病名告知につながり、患者が精神的苦痛を受けるおそれがある場合は、指針「第4 1 個人情報の保護に関する措置」(11)[1]アに該当すると考えられます。また、全数調査の場合に開示により研究に支障を及ぼす可能性があるとの点については、開示することが必ずしも削除要求に結びつくものではなく、個人情報の開示請求が行われた場合は、基本的には開示を行うべきものと考えます。 |
| Q6−9 | 研究対象者から、個人情報の内容が事実でないとして、その訂正等をもとめられましたが、研究に支障を及ぼすために訂正等ができない場合もあります。この場合はどのように取り扱えばよいですか。 |
| A6−9 | 個人情報の内容が事実でないという理由によって訂正等をもとめられた場合には、内容の訂正に関して他の法令の規定により特別の手続きが定められている場合を除き、利用(研究)目的の達成に必要な範囲内において、遅滞なく必要な調査を行い、その結果に基づき訂正等を行わなければなりません。ただし、当該情報を用いた評価等の結果まで訂正を義務づけているものではありません。しかしながら、訂正された事実に関する情報に基づいて、評価等の結果等まで訂正を行うか否かは、機関において適切に判断すべきことと考えます。 |
|
| Q7−1 | 指針第4 2(2)[1]の「連結可能匿名化であって対応表を有していない場合をいう。」とありますが、対応表を有している場合はなぜ除外されているのですか。また、「対応表を有していない」とは、例えば、研究担当部署において有していなければ良いのですか。 |
| A7−1 | 連結可能匿名化された情報の場合で、研究を行う機関において対応表を有している場合は、当該情報は個人情報に該当するためです。従って、同一法人内で対応表を保有している部署と研究担当部署が分かれている場合であっても、対応表を有している場合に該当します。また、別法人に匿名化された情報のみを提供し、提供機関で対応表が保管される場合は、提供を受けた法人において当該情報は個人情報に該当しません。 |
| Q7−2 | 資料の保存期間中に研究責任者が異動する場合、異動に伴い資料を廃棄する必要がありますか。 |
| A7−2 | 廃棄する必要はありませんが、資料に保存期間が設けられている場合又は保存期間を過ぎた場合には、研究対象者等の同意事項を遵守し、匿名化して廃棄する必要があります(指針「第4 2 資料の保存等」(1)[2])。 また、保存期間中又は保存期間が設けられていない場合には、資料の管理責任者の変更について機関の長に速やかに届ける必要があります(指針「第4 2 資料の保存等」(1)[3])。さらに、研究責任者の異動に伴い資料の管理がおろそかにならないように十分注意して下さい。 なお、一般的には、異動とともに所属していた機関から資料を持ち出すことはできないものと考えられます。 |
|
| Q8−1 | 前向きコホート研究の場合は、追跡調査が必要となりますが、当初のデータ取得時のインフォームド・コンセントが得られていれば、追跡調査時に改めて同意を得ることなく資料の提供を受けることは可能ですか。 |
| A8−1 | 前向き研究において、追跡情報を取得する場合、取得の目的が、研究開始にあたって策定された研究計画に基づいて実施されるもので、すでにインフォームド・コンセントを受けている者からの情報を得る場合は、追跡調査の都度、同意を得る必要はありません。なお、この場合は、研究開始にあたってインフォームド・コンセントを受ける際に、追跡調査を実施することについて説明の上、同意を得ておくことが必要です。また、新たな研究目的で追加情報を得る場合は、改めてその研究に対してインフォームド・コンセントを受ける必要があります。 |
| Q8−2 | 指針第4 3(1)及び(2)に「所属機関外」とあるが、この機関は「研究を行う機関」と「研究機関」のどちらの単位ですか。 |
| A8−2 | ここでいう「所属機関外」の機関の単位は、個人情報保護法第23条の第三者提供の制限の規定等を踏まえ、「研究を行う機関」です。 |
|
| Q9−1 | 指針第5(4)において、「資料」とは「疫学研究に用いようとする血液、組織、紬胞、体液、排泄物及びこれらから抽出したDNA等の人体から採取された試料並びに診断及び治療を通じて得られた疾病名、投薬名、検査結果等の人の健康に関する情報その他の研究に用いられる情報をいう」と定義していますが、研究対象となる情報で、個人を識別できない場合は「資料」にはあたらないと考えてよいですか。 |
| A9−1 | 個人を識別できない(匿名化された)ものであっても、本指針にいう「研究に用いられる情報」すなわち「資料」に該当します。 |
| Q9−2 | 平成16年12月28日の改正において、「研究機関の長」とは別に「研究を行う機関の長」が新たに定義されましたが、「研究機関の長」とは何が異なるのでしょうか。 |
| A9−2 | 個人情報保護の関係については、個人情報保護法において事業者(法人等)単位で個人情報保護を図ることとしていることから、指針において、法人の長を意味するものとして「研究を行う機関の長」を新たに定義し、個人情報保護の最終的な責任者とし、安全管理措置等の個人情報保護に対する責務を課しました。なお、指針「第4 1 個人情報の保護に関する措置」(1)[2]により、当該機関により定められる規程により、指針「第4 個人情報の保護等」に定める権限又は事務を当該機関内の適当な者に委任することができるとしています。また、「研究機関の長」は、倫理審査委員会の設置や研究計画の許可など、研究の実施における責務を負う者として、「研究を行う機関の長」とは別に定義しています。 |
| Q9−3 | 長期にわたるコホート研究において、ある研究対象者から研究開始後数年間にわたって、研究対象者の定期健康診断データの提供を受けることとしています。この資料は既存資料等に該当しますか。 |
| A9−3 | ご質問の資料は「疫学研究の研究計画書の作成時以降に収集した資料であって、収集の時点においては当該疫学研究に用いることを目的としていなかったもの」(指針「第5 用語の定義」(18)[2])に該当することから、既存資料等と判断されます。 |
|
| Q10−1 | 改正された指針の施行は平成19年11月1日からとありますが、改正前の指針により実施している研究についても改正された指針は適用されますか。また、当該研究に改正された指針を適用する場合に、倫理審査委員会へ再申請する必要はありますか。 |
| A10−1 | 施行日から改正された指針の適用を受けます。研究計画に変更がない場合は倫理審査委員会への申請は必要ありませんが、改正された指針に対応するための研究計画の変更等により、倫理審査委員会の審査を受ける必要が生じる場合があります。なお、研究計画の軽微な変更は、指針「第2 1 倫理審査委員会」(2)[4]に規定する迅速審査により対応できるものと考えます。 |

