II 健康障害の種類と定義 (表1)
はじめに、本マニュアルで使用する用語の定義について整理しておきたい。ワクチン接種後の健康障害は、(表1)に示すように分類することができる。すなわち、(1)ワクチンを正しく接種した場合でも起こり得る反応(予防接種後副反応)、(2)予防接種行為自体に対する反応、(3)予防接種が先行していたためにワクチン接種との因果関係が一見考えられる事例(紛れ込み事例)、(4)ワクチン自体に問題がある場合や接種の方法に問題がある場合(ワクチン関連物的・人的問題)に分類することができる。さらに、(4)ワクチン関連物的・人的問題は、ⅰ)ワクチンの品質に問題がある、ⅱ)ワクチンの取扱いに問題がある、ⅲ)接種上の間違い、の3つの場合に細分することができる。
なお、本マニュアルでは、ワクチンとの因果関係が証明された健康障害のみを「健康被害」と呼び、それ以外のものは、広く「健康障害」と呼んでいる。
また、予防接種法に基づく予防接種による健康被害の救済に関する措置においては、予防接種による疾病、障害又は死亡について、上記の健康障害の分類を用いて健康被害の認定を行っている訳ではない。
予防接種法に基づいて行われる予防接種は、感染症対策における最も基本的かつ重要な手法であり、「予防接種を見合わせる」には、十分な根拠が必須であり、そのためには、厚生省及び地方公共団体が協力して、ここに定める段階を踏み、意思決定を行う必要がある。それを怠った安易な意思決定は、国民を感染症から守るという観点から厳に慎むべきである。
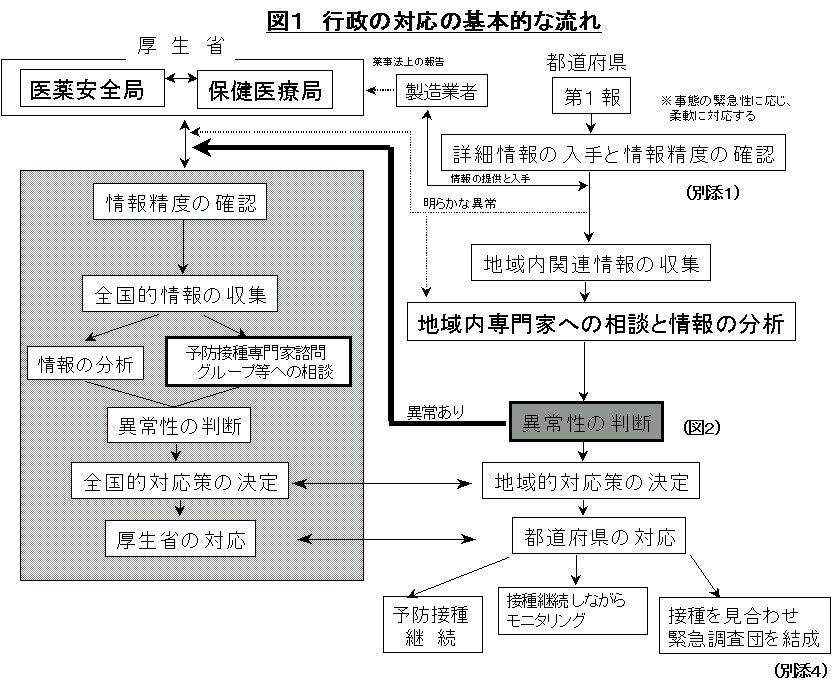
健康障害の第1報を受けた後、行政機関が適切な対応を行うために踏まなければならない段階については、その全体的な流れを(図1)に示す。
(都道府県レベル)
○ 第1報を受けた場合は、(別添1)に沿って、健康被害とされる症状について情報確認及び同様の発生状況の把握に直ちに着手する。
○ 同時にワクチン製造業者に、健康被害が疑われる症例に関する情報を提供するとともに、製品についての情報等関連情報の入手に努める。
○ 市町村(特別区を含む。以下同じ。)及び保健所は、相互に密接な連携を図り、(別添2)及びそれに付した「ポリオ様疾患患者調査票I」(及び必要に応じ、同調査票II)を用いて、地域における類似感染症の流行状況等の関連情報の収集を行う。
○ なお、情報収集においては、患者の検体(便からのウイルス分離等)の検査は、最も基本的かつ重要であり、検体の採取が早い時期に確実に行われていることを確認する必要があることは言うまでもない。
○ 都道府県は、地域内専門家への相談と収集された情報の分析とを行う。
(厚生省レベル)
○ 厚生省は、都道府県から相談を受けた場合、情報の精度と矛盾の有無をチェックし、助言を行う。
○ 厚生省も(別添1)を用いて、必要に応じたワクチンの品質の確認を含む全国的情報収集を行う。
○ 厚生省は、全国的観点から情報分析を行うとともに、厚生省の「予防接種専門家諮問グループ」その他の専門家の意見を聴取する。
○ これらの情報収集及び分析は、学術専門団体である日本医師会と十分な連携を図りながら行う。
(厚生省及び都道府県の共同作業)
○ 厚生省及び都道府県は、それぞれ総合的に情報を分析し、「異常の有無」に鑑みて発生事例の分類を行う。 この場合、紛れ込み事例や明確なワクチン関連物的・人的問題の把握に十分配慮しなければならない(図2)。
○ 対応策の決定に当たり、厚生省と当該都道府県は、必ず協議を行い、整合性の取れた対応を行う。
○ 都道府県の対応策としては、(1)予防接種継続、(2)予防接種継続しながらモニタリング(健康障害の発生の有無を継続的に監視)、(3)予防接種を見合わせ緊急調査実施、の3つの選択肢がある。
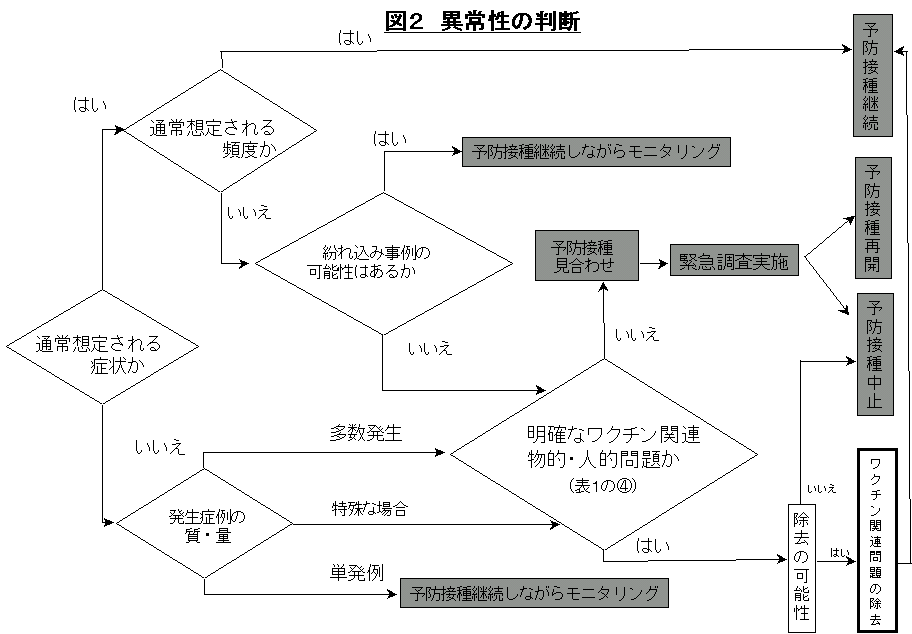
III―2 異常性の判断と適切な対応策の検討 (図2)
適切な対応策を決定するためには、当該事例が「異常な事例」であるか否か、判断を行う必要がある。そのためには、まず、(図2)に示す要領で、迅速に適切な情報収集を行い、合理的な判断を行わなければならない。情報収集の基本は、症状及び発生頻度の確認である。発生頻度の把握を行うためには、当該事例の発生した地域の近隣地域における状況(同一ロットでの副反応の発生状況を含む)についても情報収集を行う必要がある。
○ 収集した情報をもとに、(表1)の定義に沿って、(1)予防接種後副反応、(2)予防接種行為自体に対する反応、(3)紛れ込み事例、(4)ワクチン関連物的・人的問題(ⅰ)ワクチンの品質に問題がある、ⅱ)ワクチンの取扱いに問題がある、ⅲ)接種上の間違い)のいずれに該当するかの確認を行う。
○ このうち、(1)予防接種後副反応、(2)予防接種行為自体に対する反応、(3)紛れ込み事例、については、可能な限り、接種医、主治医及び市町村・保健所レベルで確認がなされ、その可能性が検討されるべきである。
○ その際に、接種医及び主治医は、少しでも因果関係のある可能性があれば、「因果関係を完全には否定できない」として回答する場合があるため、収集情報の精度を上げるためには、「因果関係がある可能性は相当高い」、「因果関係がある可能性は相当低い」、「因果関係がある可能性はない」、「判定できない」の選択肢を示すべきである。
○ また、(4)ワクチン関連物的・人的問題についても、丁寧な情報収集により、この問題のうちの比較的単純なもの(例えば、ワクチンの接種量や接種方法の誤り等の(4)ⅲ)接種上の間違い)についても早い段階で検討されるべきである。
○ こうした一連の情報収集及び分析の結果、予防接種見合わせを含む重大な意思決定が必要となるのは、(図2)に沿って考えれば明らかなように、(1)予防接種後副反応様の症状であっても、通常想定されるよりも多数発生しており、かつそれらが紛れ込み事例とは考えにくい場合、(2)典型的な副反応とは異なる重篤な症状の見られる事例が多数発生している場合、(3)典型的な副反応と異なる、極めて異常な症状が見られる場合、であり、その原因がワクチン関連物的・人的問題であるか判定する必要がある。
○ ワクチン関連物的・人的問題については、当該事例が広範かつ継続的に問題を引き起こす可能性が示唆される(例えば、品質に問題があるワクチンの使用範囲が大きく、広域的に使用されている等)場合には、速やかに厚生省に連絡され、国レベルの対応が検討されるべきである。
○ また、ワクチン関連物的・人的問題は、それが判明した段階で、直ちにその除去を行うことが原則である。
○ (4)ⅰ)ワクチンの品質に問題があることが考えられる場合であって、その確認に時間がかかることが想定される場合には、他の都道府県における予防接種に対する影響も考える必要があり、予防接種の見合わせを行うことを含め、重大な意思決定が必要となり得るので、厚生省と十分に協議すべきである。
III―3 予防接種再開の条件
一旦予防接種を見合わせた場合、予防接種を再開するか否かの決定は、原則的に厚生省が行うものとする。
再開のための条件は、疫学的に異常がなく、ワクチンの品質に問題が認められないことが確認されることであり、具体的には、次の条件が満たされる場合である。
(予防接種再開の条件)
(1) 情報収集システム
健康障害への対応において迅速に情報の収集を行うためには、通常時から正確な情報収集システムが確立していることが鍵となる。ワクチン接種との関連が疑われる何らかの報告があった場合には、速やかに詳細な情報の入手と精度の確認を行うことが重要である。
○ 通常時の情報収集システムとしては、予防接種制度及び薬事法に基づく副反応(副作用)の情報収集システムがある(別添3)。
○ 予防接種制度(予防接種後副反応報告)においては、その情報の流れは、「医師等」→→「市町村」→「都道府県」→「国」とされている。市町村長が報告書を作成することとされていることから、一次レベルの情報の収集は、市町村の役割であり、それを都道府県(必要に応じて国)が支援することとなる。
○ 薬事法においては、その情報の流れは、一般的に「医師等」→「製造業者」→「国」であり、製造業者が情報収集の主体となっている。
○ 予防接種法に基づく報告と薬事法に基づく報告は別のシステムであるが、医師の負担を軽減するとともに、より効果的な情報収集を行うため、都道府県は、症例について入手した情報を製造業者に提供し、製品についての情報提供を依頼する等、相互に情報を共有し、迅速な対応を可能にするシステムの構築を行う必要がある。
○ 新たなシステムを構築するよりも、これら現行システムの徹底を図り、報告の遅滞がないように努める必要がある。
(2) 情報の伝達
情報は、伝達はされても、発信側の意識と受信側の意識のずれがある場合等、内容が異なって伝わる場合がある。情報伝達の確実を期すため、伝達手段としては、詳細情報をファックスあるいは電子メールで送付した上で口頭で伝達確認する。また、その都度、情報伝達については時刻及びその内容について記録することが望ましい。
(3) 地域内専門家への相談と情報の分析
都道府県は、医師会等の協力を得て、平常時から相談できる予防接種の専門家との地域内連絡相談体制を確保することが重要である。収集された情報が十分なものであるか、更に収集すべき情報がないかを判断した上で、情報の分析を行う際には、原則として必ず、これらの地域内専門家に相談することとする。なお、地域内に相談できる専門家がいない場合には、厚生省が「予防接種専門家諮問グループ」に照会することが適当である。
IV―2 緊急調査実施について
(1) 調査の実施目的
都道府県における収集情報及び地域内専門家への相談と情報の分析のみでは、当該事例の症状等について(1)予防接種後副反応、(2)予防接種行為自体に対する反応、(3)紛れ込み事例、(4)ワクチン関連物的・人的問題、のいずれに該当するのか同定することが困難である場合、厚生省において「予防接種専門家諮問グループ」を編成して照会に答えるものとするが、より高度の専門的な情報収集及び分析が必要とされる場合には、緊急調査が実施される。
(2) 調査班の構成
二次的な情報収集を行うことから、基本的に、都道府県又は厚生省が主体となる調査が行われる。都道府県又は厚生省が事務局となり、日本医師会等の協力を得て、ウイルスの専門家、感染症の疫学専門家、当該地域の臨床専門家等で調査班を構成する。
(3) 調査の内容
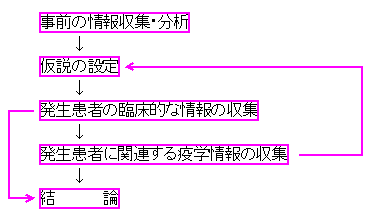
某県の事例においては、臨床的な情報と疫学的な情報の収集のために実地調査が行われた。疫学調査を基本として、更に、ワクチンの性状及び取扱い、予防接種の手法、提供されたサービスについても調査が行われた。その際の実地調査の流れを(別添4)として添付する。
世界保健機関(WHO)では、調査の手順について、「調査にあたっては、調査を行う前に可能な限り基礎的な情報について収集し、それに基づき、仮説を立てることが重要である。仮説は調査の過程で変わることもあるが、その後、調査の焦点は、仮説を検証することになる。また、調査中の定義による明確な症例の定義は不可欠である。調査では、地域の全ての症例を同定し、疑われるワクチンの接種を受けた全員について結果を明らかにする必要がある。疾患の危険性について、ワクチンを接種した人としていない人について比較しなければならない。」としている。
(4)情報の管理
都道府県においては、調査が実施されることについて厚生省と協議の上で公表するが、 現地における訪問先等の詳細情報については、調査結果と併せて後日提供することとする。なお、情報提供窓口については、一元化すべきである。
IV―3 関係機関の連携
健康障害への対応を行うに当たり、市町村、都道府県、厚生省、日本医師会等の関係機関がそれぞれの役割を十分に果たすと同時に、これらの機関が十分な連携を図ることが重要である。
IV―4 報告患者等への対応
患者やその関係者に対しては、ワクチンとの因果関係の有無に関わらず、十分な配慮が必要である。特に、死亡した例等の場合には、親族を亡くした心の痛みに配慮すべきである。
IV―5 対応の記録と評価
全ての症例の調査について、時系列的に明確に記録することが重要である。調査の結果を公表する際及び今後同様の事例が発生した場合にもよりよい対応が可能となる。
IV―6 情報の提供と公開
○ 都道府県及び調査団等において収集された情報については、原則として、全て公開する。当然のことながら、十分な確認作業が行われた上で、確認できたことのみならず、不明な点についても分かりやすい形で説明を行う必要がある。
○ また、関係者のプライバシー等については、十分に注意し、情報公開を行う場合には、事前に十分な理解と同意を得ておくことは大前提である。
表 1
ワクチン接種に関連すると思われる有害事象について、本マニュアルでは、下記の分類を用いる。
III 行政の対応
III―1 基本的な流れ (図1)
・ 国家検定の成績に問題がない
・ 症状から特定の原因が想定される場合には、それに対応する検査を行い、異常が認められない
IV その他の留意事項
IV―1 情報の収集と確認について
また、伝達する情報は、「発生事例についての収集情報」、「それに対する対応」に分けて聴取する。情報収集がどの段階まで進んでいるのか、収集されている情報については、(別添1)を共通様式として確認することが望ましい。
(参考)
さらに、「並行して、病原体及びワクチンの品質に着目した調査も行われるべきである。検査によって疑われる原因が確認されたり、判明することもある。」とされている。