
| 報道発表資料 | HOME |
平成12年11月24日
1.趣旨
○ 文部省、厚生省、通商産業省及び科学技術庁が共同して、「ヒトゲノム解析研究に関する共通指針(案)」検討委員会を設置し、ヒトゲノム・遺伝子解析研究一般を対象とする、倫理指針の原案策定の検討を行ってきた。
○ 去る11月16日、第6回検討委員会において、委員長一任で原案とりまとめが了承され、本日、原案が完成した。
2. 原案の概要
3. 今後の日程
各省庁関係審議会等において、原案を審議の上、来年始めにはパブリックコメントを行い、本年度内に指針を策定する予定。
4. 検討委員会の設置の目的、委員名
5. 検討委員会の開催状況
照会先 厚生省大臣官房厚生科学課 担当者 中垣、野口 電 話 内線:3803, 3804 直通:03-3595-2171
参考1
平成12年11月24日
(目的)
研究現場で遵守され、社会の理解と協力を得て、人間の尊厳及び人権が尊重され、ヒトゲノム・遺伝子解析研究が適正に推進されることを目的
(適用範囲)
すべてのヒトゲノム・遺伝子解析研究を対象
(主な内容)
○インフォームド・コンセントを基本とすること
○研究の適正性を確保すること
(事務局作成資料)
前文
I.基本的考え方
1. 基本方針
2. 本指針の適用範囲
II.研究者等の責務
3. すべての研究者等の基本的な責務
4. 研究実施機関の長の責務
5. 研究責任者の責務
6. 個人識別情報管理者の責務
7. 倫理審査委員会の責務及び構成
III.試料等提供者に対する基本姿勢
8. 試料等提供者等のインフォームド・コンセント
9. 遺伝情報の試料等提供者等への開示
10.遺伝カウンセリング
IV.試料等の取扱い
11.研究実施前提供試料等の利用
12.試料等の保存及び廃棄の方法
V.見直し
13.見直し
VI.用語の定義
14.用語の定義
参考2 平成12年11月16日現在
関係審議会等の開催日程について
| 8月 | 9月 | 10月 | 11月 | 12月 | |
| 本検討委員会 | 14 | 5 18 |
12 26 |
16 | |
| 科学技術会議 生命倫理委員会 ヒトゲノム研究小委員会 |
20 | 11 | |||
| 文部省 学術審議会バイオサイエンス部会 がん研究部会 |
(合同部会)24 | ||||
| 厚生省 厚生科学審議会先端医療技術評価部会 |
22 | 13 24 |
7(予) | ||
| 通商産業省 化学品審議会個人遺伝情報保護部会 |
2 | 16 | 13 | 4 |
| 雨 宮 浩 | 国立小児病院小児医療研究センター長 | |
| 位 田 隆 一 | 京都大学大学院法学研究科教授 | |
| 上 田 國 寛 | 京都大学化学研究所教授 | |
| 宇都木 伸 | 東海大学法学部法律学科教授 | |
| 小 幡 純 子 | 上智大学法学部教授 | |
| ◎ | 垣 添 忠 生 | 国立がんセンター中央病院長 |
| 金 澤 一 郎 | 東京大学大学院医学系研究科教授(神経内科学) | |
| 具 嶋 弘 | 山之内製薬株式会社研開経営部理事 | |
| 黒 木 登志夫 | 昭和大学腫瘍分子生物学研究所長 | |
| 櫻 井 秀 也 | 社団法人日本医師会常任理事 | |
| 笹 月 健 彦 | 九州大学生体防御医学研究所長 | |
| 清 野 進 | 千葉大学大学院医学研究科教授 | |
| 高 芝 利 仁 | 弁護士 | |
| 地 神 芳 文 | 工業技術院生命工学工業技術研究所次長 | |
| 福 嶋 義 光 | 信州大学医学部教授(衛生学) | |
| 町 野 朔 | 上智大学法学部教授 | |
| 丸 山 英 二 | 神戸大学法学部教授 | |
| 南 砂 | 讀賣新聞社編集局解説部次長 | |
| 山 口 建 | 国立がんセンター研究所副所長 |
平成12年11月現在。五十音順(敬称略)。◎は委員長
| 青 野 由 利 | 毎日新聞社科学環境部編集委員 | |
| 味 木 和喜子 | 大阪府立成人病センタ−調査部調査課調査・登録グループ登録総括主査 | |
| 油 谷 浩 幸 | 東京大学先端科学技術研究センター助教授 | |
| 池 田 恭 治 | 国立療養所中部病院長寿医療研究センター老年病研究部長 | |
| 稲 田 俊 也 | 国立精神・神経センター精神保健研究所老化研究室長 | |
| 内 野 眞 也 | 野口病院外科医師 | |
| 浦 川 道太郎 | 早稲田大学法学部教授 | |
| 大 山 真 未 | 科学技術政策研究所上席研究官 | |
| 岡 慎 一 | 国立国際医療センターエイズ治療・研究開発センター臨床研究開発部長 | |
| 掛 江 直 子 | 早稲田大学人間総合研究センター助手 | |
| 菊 池 裕 | 国立医薬品食品衛生研究所衛生微生物部 主任研究官 | |
| 蔵 田 伸 雄 | 三重大学人文学部助教授 | |
| 黒 崎 雅 之 | 東京医科歯科大学助手 | |
| 斎 藤 博 久 | 国立小児病院免疫アレルギー研究部長 | |
| 齋 藤 有紀子 | 北里大学医学部医学原論研究部門 | |
| 佐 藤 恵 子 | 国立がんセンター中央病院臨床試験管理室 | |
| 菅 野 純 夫 | 東京大学医科学研究所助教授 | |
| 菅 野 康 吉 | 栃木県立がんセンターがん遺伝子研究室・がん予防研究室 | |
| 玉 井 真理子 | 信州大学医療技術短期大学部 | |
| 塚 田 俊 彦 | 国立がんセンター研究所細胞増殖因子研究部室長 | |
| 津 金 昌一郎 | 国立がんセンター研究所臨床疫学研究部長 | |
| 辻 省 次 | 新潟大学脳研究所教授 | |
| 外 口 崇 | 医薬品副作用被害救済・研究振興調査機構研究振興部長 | |
| 戸 田 達 史 | 大阪大学大学院医学系研究科バイオメディカル教育研究センター教授 | |
| 中 川 徹 | 日立製作所日立健康管理センター | |
| ぬで 島 次 郎 | 三菱化学生命科学研究所社会生命科学研究室主任研究員 | |
| 橋 本 雄 之 | 国立感染症研究所遺伝子資源室(遺伝子バンク)室長 | |
| 長谷川 知 子 | 静岡こども病院染色体科医長 | |
| 二 見 仁 康 | 国立がんセンター研究所細胞増殖因子研究部室長 | |
| 松 浦 幸 男 | バイオ産業情報化コンソーシアム(JBIC)情報化推進部長 | |
| 松 本 恒 雄 | 一橋大学大学院法学研究科教授 | |
| 水 澤 博 | 国立医薬品食品衛生研究所変異遺伝部第三室(細胞バンク)室長 | |
| 宮 本 真 司 | 年金福祉事業団資金運用事業部運用管理課長 | |
| 森 川 功 | 早稲田大学人間総合研究センター客員研究員 | |
| 森 崎 隆 幸 | 国立循環器病センターバイオサイエンス部長 | |
| 山 内 正 剛 | 放射線医学総合研究所第2研究グループ主任研究官 | |
| 山 縣 然太郎 | 山梨医科大学医学部教授(保健学講座) | |
| ○ | 山 口 建 | 国立がんセンター研究所副所長 |
| 吉 田 輝 彦 | 国立がんセンター研究所分子腫瘍学部長 | |
| 吉 村 義 信 | 武田薬品工業(株)創薬研究本部薬物機能第一研究所所長 |
平成12年11月現在。五十音順(敬称略)。○は座長。 ぬで島(’ぬで’は偏が木・旁が勝)
参考4
検討委員会開催状況
| 第1回 | 平成12年 8月14日 |
|
|
| 第2回 | 平成12年 9月 5日 |
|
|
| 第3回 | 平成12年 9月18日 |
|
|
| 第4回 | 平成12年10月12日 |
|
|
| 第5回 | 平成12年10月26日 |
|
|
| 第6回 | 平成12年11月16日 |
|
|
1.基本方針
2.本指針の適用範囲
3. すべての研究者等の基本的な責務
4. 研究実施機関の長の責務
5. 研究責任者の責務
6. 個人識別情報管理者の責務
7. 倫理審査委員会の責務及び構成
8. 試料等提供者等のインフォームド・コンセント
9. 遺伝情報の試料等提供者等への開示
10.遺伝カウンセリング
11. 研究実施前提供試料等の利用
12. 試料等の保存及び廃棄の方法
13.見直し
14.用語の定義
参考資料
科学研究の推進は、人々が健やかで心豊かに生活できる社会を実現するための重要な課題である。その中で、20世紀後半に開始されたヒトゲノム・遺伝子解析研究は、我々の世代の遺伝情報や研究が次の世代への貴重な財産となる研究であって、生命科学及び保健医療科学の進歩に大きく貢献し、人類の健康や福祉の発展、新しい産業の育成などに重要な役割を果たそうとしている。
一方、ヒトゲノム・遺伝子解析研究は、個人を対象とした研究に大きく依存し、また、研究の過程で得られた遺伝情報は試料等提供者やその血縁者の遺伝的素因を明らかにし、その取扱いによっては様々な倫理的、法的、社会的問題を招く可能性があるという側面がある。そこで、人間の尊厳及び人権を尊重し、社会の理解と協力を得て、適正に研究を実施することが不可欠である。そのため、医学研究における倫理規範等に基づき、試料等提供者個人の人権の保障が、科学的、社会的な利益に優先されなければならないことに加えて、この側面について、社会に十分な説明を行い、その理解に基づいて研究を実施することが求められる。しかしながら、ヒトゲノム・遺伝子解析研究一般に関して、上記のような要請に応えることのできる規範は十分には確立されておらず、人間の尊厳が確保され、試料等提供者やその家族、血縁者の人権が保障され、研究が適正に実施されるための具体的な指針の策定が望まれてきた。
本指針は、「ヒトゲノム研究に関する基本原則」(平成12年6月14日科学技術会議生命倫理委員会取りまとめ)に示された原則に基づき、また、「遺伝子解析研究に付随する倫理問題等に対応するための指針」(平成12年4月28日厚生科学審議会先端医療技術評価部会取りまとめ)を参考としつつ、ヒトゲノム・遺伝子解析研究一般に適用されるべき倫理指針として、文部科学省、厚生労働省及び経済産業省において共同で作成し、社会に提示するものである。
I.基本的考え方
1.基本方針
本指針は、ヒトゲノム・遺伝子解析の特色を踏まえ、すべてのヒトゲノム・遺伝子解析研究に適用されるべき倫理指針として策定されたものであり、研究現場で遵守され、社会の理解と協力を得て、人間の尊厳及び人権が尊重され、その適正な研究の推進が図られることを目的とし、以下を基本方針としている。
(1) 人間の尊厳に対する十分な配慮
(2) 事前の十分な説明と自由意思による同意(インフォームド・コンセント)
(3) 個人に関する情報の保護の徹底
(4) 人類の知的基盤、健康、福祉へ貢献する社会的に有益な研究の実施
(5) 個人の人権の保障の科学的、社会的利益に対する優先
(6) 本指針に基づく研究計画の作成、遵守及び事前の倫理審査委員会の審査、承認による研究の適正性の確保
(7) 研究の実施状況の第三者による調査と研究結果の公表を通じた研究の透明性の確保
2.本指針の適用範囲
本指針は、ヒトゲノム・遺伝子解析研究を対象とし、研究者等に遵守を求めるものである。
<本指針施行前の研究に関する細則>
<海外との共同研究に関する細則>
1. 海外研究機関と共同研究を行う場合、海外研究の相手国においても試料等の提供の取扱い及びヒトゲノム・遺伝子解析研究の意義等に関して、本指針の定める考え方が遵守され、人間の尊厳及び人権が尊重されなければならない。
2. 海外研究の相手国で定める法、指針などを遵守しつつ、原則として本指針の基準を下回らない方法で研究を行わなければならない。
3. 海外研究の相手国における基準が、本指針よりも厳格な場合には、その厳格な基準に合わせて研究を行わなければならない。
なお、診療において実施され、解析結果が試料等提供者及びその家族の診療に直接生かされることが医学的に確立されている臨床検査及びそれに準ずるヒトゲノム・遺伝子解析などは、本指針の対象としない。ただし、これらのヒトゲノム・遺伝子解析についても、診療を行う医師の責任において、関係学会等において作成される指針等を参考に、本指針の趣旨を踏まえた適切な対応が望まれる。
II.研究者等の責務
3. すべての研究者等の基本的な責務
(1) すべての研究者等は、生命現象の解明、診断、治療、予防方法の改善、健康の増進などを目的として、ヒトゲノム・遺伝子解析研究を実施しなければならない。
(2) すべての研究者等は、ヒトゲノム・遺伝子解析研究の社会的有益性を確認するとともに、個人の人権の保障を科学的、社会的な利益に優先して配慮しなければならない。
(3) すべての研究者等は、試料等提供者等への事前の十分な説明とその自由意思による同意(インフォームド・コンセント)を受けて、ヒトゲノム・遺伝子解析研究を実施することを基本としなければならない。
(4) すべての研究者等は、職務上知り得た個人に関する情報を正当な理由なく漏らしてはならない。その職を辞した後も同様である。
(5) すべての研究者等は、個人に関する情報の保護を図るとともに、個人に関する情報の取扱いに関する苦情等に誠実に対応しなければならない。
(6) すべての研究者等は、個人に関する情報の予期せぬ漏洩等、試料等提供者等の人権の保障の観点から重大な懸念が生じた場合には、速やかに研究実施機関の長及び研究責任者に報告しなければならない。
(7) すべての研究者等は、倫理審査委員会の承認を得て、研究実施機関の長により許可された研究計画書に従って研究を実施するなど、本指針を遵守し、人間の尊厳及び人権の尊重に最大限配慮して、適正にヒトゲノム・遺伝子解析研究を実施しなければならない。
(8) すべての研究者等は、研究実施に当たっての適正な手続の確保、外部の有識者による調査、試料等提供者からの研究の進捗状況の問い合わせへの的確な対応、研究結果の公表など、研究の透明性の確保を図らなければならない。
(9) すべての研究者等は、試料等の提供が善意に基づくものであることに留意し、既に提供されている試料等を適切に活用することなどにより、人からの試料等の提供を必要最低限とするよう努めなければならない。
4.研究実施機関の長の責務
(1) 研究実施機関の長は、その機関におけるヒトゲノム・遺伝子解析研究の実施に関する最終的な責任を有し、研究責任者及び研究実施担当者が研究計画にしたがって適正に研究を実施するよう監督しなければならない。その際、研究実施機関の長は、試料等提供者等の人権を最大限保障すべきこと、この場合において、本指針や研究計画などに反した場合、懲戒処分など不利益処分等がなされ得ることをその機関の関係者に周知徹底しなければならない。
<研究実施機関の長の例示に関する細則>
(2) 研究実施機関の長は、個人に関する情報の漏洩防止のための十分な措置を講じなければならない。
<個人情報保護のための措置に関する細則>
(3) 試料等の提供が行われる機関等、匿名化されていない個人に関する情報を取り扱う研究実施機関の長は、ヒトゲノム・遺伝子解析研究において、個人に関する情報の保護を図るため、個人識別情報管理者を置かなければならない。また、必要に応じて、指揮命令系統を明確にした上で、分担管理者又は個人識別情報管理者の監督の下に実際の業務を行う補助者を置くことができる。
<個人識別情報管理者の要件に関する細則>
1. 個人識別情報管理者及び分担管理者は、刑法(明治40年法律第45号)、国家公務員法(昭和22年法律第120号)その他の法律により業務上知り得た秘密の漏洩を禁じられている医師、薬剤師等でなければならない。
2. 個人識別情報管理者及び分担管理者は、その提供する試料等を用いてヒトゲノム・遺伝子解析研究(試料等の提供を除く。)を行う研究責任者又は研究実施担当者を兼ねることはできない。
(4) 研究実施機関の長は、ヒトゲノム・遺伝子解析研究実施の可否などを審査するため、その諮問機関として、倫理審査委員会を設置しなければならない。ただし、試料等の提供が行われる機関が小規模であること等により、倫理審査委員会の設置が困難である場合には、共同研究機関、公益法人又は学会によって設置された倫理審査委員会をもってこれに代えることができる。
<倫理審査委員会の設置に関する細則>
<共同研究の取扱いに関する細則>
(5) 研究実施機関の長は、すべての研究計画又はその変更について、倫理審査委員会の意見を尊重し、許可するか否かを決定しなければならない。この場合において、倫理審査委員会が不承認の意見を提出した研究については、その実施を許可してはならない。
(6) 研究実施機関の長は、研究責任者から研究の実施状況について1年に1回以上定期的な報告を受けるほか、外部の有識者による定期的な実地調査を1年に1回以上実施するなど、ヒトゲノム・遺伝子解析研究の実施状況を把握し、必要な場合には、その変更、中止を命じなければならない。
<外部の有識者による実地調査に関する細則>
1. 研究実施機関の長は、インフォームド・コンセントの実施状況及び個人に関する情報の保護の状況について、研究計画書に従って適正に実施されているか実地調査させるものとする。
2. 研究実施機関の長は、研究責任者及び研究実施担当者を、実地調査へ協力させなければならない。
3. 外部の調査担当者は、実地調査の中で知り得た個人に関する情報を正当な理由なく漏らしてはならない。
(7) 研究実施機関の長は、許可した研究計画書の写し及び研究の実施状況に関する定期的な報告書の写しを個人識別情報管理者に送付しなければならない。
(8) 研究実施機関の長は、試料等提供者等からの苦情等の窓口を設置するなど、試料等提供者等からの苦情等や問い合わせに適切に対応しなければならない。
(9) 試料等の提供が行われる機関の長は、原則として試料等を匿名化した上で、外部の機関(試料等の提供が行われる機関において、同時にヒトゲノム・遺伝子解析研究も行う場合は、その研究部門は外部の機関とみなす。)に提供しなければならない。
<匿名化せずに行う外部の機関への提供に関する細則>
(10) 試料等の提供が行われる機関の長は、必要に応じ、適切な遺伝カウンセリング体制の整備や遺伝カウンセリングについての説明及びその適切な施設の紹介など、試料等提供者等が遺伝カウンセリングを受けられるよう配慮しなければならない。
5.研究責任者の責務
(1) 研究責任者は、ヒトゲノム・遺伝子解析研究の実施に当たって、あらかじめ研究計画書を作成し、研究実施機関の長に許可を求めなければならない。研究計画書を変更しようとする場合も同様である。
(2) 研究責任者は、研究計画書の作成に当たり、実施しようとしているヒトゲノム・遺伝子解析研究に伴う、試料等提供者等に予想される様々な影響等を踏まえ、研究の必要性、試料等提供者等の不利益を防止するための研究方法等を十分考慮しなければならない。
<試料等提供者が精神・知的障害を伴う疾患の場合に関する細則>
(3) 研究責任者は、ヒトゲノム・遺伝子解析研究の特殊性に十分配慮して研究計画書を作成しなければならない。特に、インフォームド・コンセントの手続及び方法、個人に関する情報の保護の方法、研究により予測される結果及びその開示の考え方、試料等の保存及び使用の方法並びに遺伝カウンセリングの考え方については、明確に記載しなければならない。
<研究計画書に記載すべき事項に関する細則>
(4) 研究責任者は、許可された研究計画書に盛りこまれた事項を、すべての研究実施担当者に遵守させるなど、研究実施担当者が適正にヒトゲノム・遺伝子解析研究を実施するよう監督しなければならない。
(5) 研究責任者は、ヒトゲノム・遺伝子解析研究の実施状況について、研究実施機関の長に1年に1回以上、定期的に文書で報告しなければならない。
<報告事項に関する細則>
(6) 研究責任者は、原則として、匿名化された試料等又は遺伝情報を用いて、ヒトゲノム・遺伝子解析研究を実施しなければならない。
<匿名化を行わない研究に関する細則>
(7) 研究責任者は、匿名化されていない試料等又は遺伝情報を原則として外部の機関に提供してはならない。
<匿名化せずに行う外部の機関への提供に関する細則>
(8) 研究責任者は、ヒトゲノム・遺伝子解析研究の業務の一部を委託する場合には、受託者に対しては、試料等又は遺伝情報を原則として匿名化しなければならない。
<匿名化せずに行う委託に関する細則>
(9) 研究責任者は、試料等提供者等の人権の保障や知的財産権の保護に配慮しながら、ヒトゲノム・遺伝子解析研究の進捗状況及びその結果を、定期的に及び試料等提供者等の求めに応じて、分かりやすく説明又は公表しなければならない。
6.個人識別情報管理者の責務
(1) 個人識別情報管理者は、原則として研究責任者からの依頼に基づき、ヒトゲノム・遺伝子解析研究の実施前に試料等又は遺伝情報を匿名化しなければならない。ただし、研究実施担当者等において匿名化作業が行われる場合にあっては、それが適正に行われるよう、監督しなければならない。
<試料等の匿名化の例外に関する細則>
(2) 個人識別情報管理者は、匿名化の際に取り除かれた個人識別情報を、原則として外部の機関に提供してはならない。
<個人識別情報の外部の機関への提供に関する細則>
(3) 個人識別情報管理者は、匿名化作業の実施のほか、匿名化されていない試料等を使用する研究実施担当者を適切に監督するなど、個人識別情報が含まれている情報が漏洩しないよう厳重に管理しなければならない。
7.倫理審査委員会の責務及び構成
(1) 倫理審査委員会は、本指針に基づき、研究計画の実施の適否等について、倫理的観点とともに科学的観点も含めて審査し、文書により意見を述べなければならない。
(2) 倫理審査委員会の委員は、職務上知り得た情報を正当な理由なく漏らしてはならない。
(3) 倫理審査委員会は、様々な立場からの委員によって公正かつ中立的な審査が行えるよう、適切に構成し運営されなければならない。
<倫理審査委員会の構成に関する細則>
<倫理審査委員会の運営に関する細則>
<運営規則に関する細則>
(4) 倫理審査委員会は、その決定により、委員長があらかじめ指名した委員又はその下部組織による迅速審査手続を設けることができる。その結果については、迅速審査を行った委員以外の委員又は上部組織である倫理審査委員会に報告されなければならない。
<迅速審査手続に関する細則>
1. 迅速審査手続による審査に委ねることができる事項は、一般的に以下のとおりとする。
2. 迅速審査の結果の報告を受けた委員は、委員長に対し、理由を付した上で、当該事項について、改めて倫理審査委員会における審査を求めることができる。この場合において、委員長は、相当の理由があると認めるときは、倫理審査委員会を速やかに開催し、当該事項について審査することとしなければならない。
(5) 倫理審査委員会については、その組織に関する事項や運営に関する規則が公開されるとともに、議事の内容についても原則として公開されなければならない。
<組織に関する事項の公開に関する細則>
<議事内容の公開に関する細則>
1. 議事の内容は、それが明らかとなるように具体的に公開されなければならない。
2. 試料等提供者等の人権、研究の独創性、知的財産権の保護に支障が生じる恐れのある部分は、倫理審査委員会の決定により非公開とすることができる。この場合、倫理審査委員会は、非公開とする理由を公開しなければならない。
III.試料等提供者に対する基本姿勢
8.試料等提供者等のインフォームド・コンセント
(1) 研究責任者(他の研究実施機関から試料等の提供を受けて研究を実施する者を除く。
<試料等提供者が疾患等を有する場合の告知に関する細則>
(2) 研究責任者は、試料等提供者に対して、事前に、その研究の目的、方法、予測される研究成果、試料等提供者が被る可能性のある不利益、試料等の保存及び使用方法等について十分な説明を行った上で、自由意思に基づく文書による同意(インフォームド・コンセント)を受けて、試料等の提供を受けなければならない。
(3) 研究責任者は、試料等提供者本人からインフォームド・コンセントを受けることが困難な場合であって、その人からの試料等の提供を受けないと実施しようとしている研究が成り立たないと倫理審査委員会が承認し、研究実施機関の長が許可した場合には、試料等提供者本人の代諾者等からインフォームド・コンセントを受けることができる。
<代諾者等からインフォームド・コンセントを受ける場合の取扱いに関する細則>
<代諾者の選定の基本的考え方に関する細則>
1. 任意後見人、親権者、後見人や保佐人が定まっているときはその人
2. 試料等提供者本人の配偶者、成人の子、父母、兄弟姉妹、孫、祖父母又は同居の親族、及びそれらの近親者に準ずると考えられる人
<遺族の選定の基本的な考え方に関する細則>
(4) 試料等提供者又はその代諾者等は、自らが与えたインフォームド・コンセントについて、いつでも不利益を受けることなく撤回することができる。
(5) 研究責任者は、試料等提供者又はその代諾者等からインフォームド・コンセントの撤回があった場合には、原則として、当該試料等提供者に係る試料等及び研究結果を匿名化して廃棄しなければならない。
<廃棄の例外に関する細則>
1. 試料等及び研究結果の廃棄をしなくても差し支えない場合は、以下のとおりとする。
2. 既に研究結果が公表されている場合は、研究結果については、廃棄しなくても差し支えない。
(6) 研究責任者は、試料等提供者等からのインフォームド・コンセントを受ける手続においては、試料等提供者又は代諾者等に対し、十分な理解が得られるよう、必要な事項を記載した文書を用いて説明を行わなければならない。試料等提供者が単一遺伝子疾患等の場合には、遺伝カウンセリングの利用に関する情報を含めて説明を行うとともに、必要に応じて遺伝カウンセリングを実施しなければならない。
<説明文書の記載に関する細則>
(7) 他の研究実施機関から試料等又は遺伝情報の提供を受ける研究責任者は、当該試料等又は遺伝情報に関するインフォームド・コンセントの内容を当該他の研究実施機関からの文書等によって確認しなければならない。
(8) 研究責任者は、ヒトゲノム・遺伝子解析研究の実施前に、ヒトゲノム・遺伝子解析研究又は関連する医学研究に使用することを想定して、試料等提供者等からインフォームド・コンセントを受ける場合には、その時点において予想される具体的研究目的を明らかにするとともに、個人に関する情報が、匿名化の可能性を含めて、どのように管理され、かつ、保護されるかを説明し、理解を得なければならない。
9.遺伝情報の試料等提供者等への開示
(1) 研究責任者は、個々の試料等提供者の遺伝情報が明らかとなるヒトゲノム・遺伝子解析研究に関して、試料等提供者が、自らの遺伝情報の開示を希望している場合には、原則として開示しなければならない。ただし、遺伝情報がそれを提供する十分な意義がなく、開示しないことについて試料等提供者のインフォームド・コンセントを受けている場合には、この限りでない。
<遺伝情報の開示に関する細則>
1. 研究責任者は、試料等提供のインフォームド・コンセントに際し、開示をしないことにつき同意が得られているにもかかわらず、当該試料等提供者が事後に開示を希望した場合は、以下の場合を除き、当該試料等提供者の遺伝情報を開示しなければならない。開示しない場合には、当該試料等提供者に遺伝情報を開示しない理由を分かりやすく説明しなければならない。
2. 研究責任者は、試料等提供者が未成年者の場合に、その未成年者が自らの遺伝情報の開示を希望している場合には、開示した場合の精神的な影響等を十分考慮した上でその未成年者に開示することができる。ただし、その未成年者が16歳未満の場合には、当該未成年者の代諾者の意向を確認し、これを尊重しなければならない。また、研究責任者は、未成年者の遺伝情報を開示することによって、差別、養育拒否、治療への悪影響が心配される場合には、研究実施機関の長に報告をしなければならない。研究実施機関の長は、開示の前に、必要に応じ、開示に係る倫理審査委員会の意見や未成年者とその未成年者の代諾者の話し合いを求めるようにしなければならない。
(2) 研究責任者は、個々の試料等提供者の遺伝情報が明らかとなるヒトゲノム・遺伝子解析研究に関して、試料等提供者が、自らの遺伝情報の開示を希望していない場合には、開示してはならない。
<遺伝情報の非開示に関する細則>
(3) 研究責任者は、試料等提供者の遺伝情報を、試料等提供者本人以外の人から求めがあっても、試料等提供者本人の同意がない場合は、原則として開示してはならない。
<試料等提供者以外の人に対する開示に関する細則>
1. 試料等提供者の代諾者等(未成年者に対して代諾した人を除く。)が試料等提供者本人の遺伝情報の開示を希望する場合には、その代諾者等が開示を求める理由又は必要性を倫理審査委員会に諮った上で、当該委員会の意見に基づき研究実施機関の長が対応を決定しなければならない。
2. 研究責任者は、試料等提供者が未成年者の場合に、その未成年者の代諾者から当該未成年者の遺伝情報の開示の求めがあった場合には、当該代諾者にこれを開示することができる。ただし、その未成年者が16歳以上の場合には、当該未成年者の意向を確認し、これを尊重しなければならない。また、研究責任者は、未成年者の遺伝情報を開示することによって、差別、養育拒否、治療への悪影響が心配される場合には、研究実施機関の長に報告しなければならない。研究実施機関の長は、開示の前に、必要に応じ、開示に係る倫理審査委員会の意見や未成年者とその未成年者の代諾者の話し合いを求めるようにしなければならない。
3. 研究責任者は、試料等提供者の血縁者から求めがあった場合、試料等提供者が自らの遺伝情報の血縁者への開示を希望していない場合であっても、その遺伝情報が試料等提供者の血縁者の生命に重大な影響を与える可能性が高いことが判明し、かつ、有効な対処方法があるときは、研究実施機関の長に報告しなければならない。研究実施機関の長は、特に下記事項について考慮した開示に関する倫理審査委員会の意見を求め、それに基づき、研究責任者と協議しなければならない。その結果を踏まえ、研究責任者は、改めて、試料等提供者の理解を求め、承諾を得られるよう努めなければならない。その上で、試料等提供者が血縁者への開示を希望しない場合であっても、試料等提供者の血縁者に対し、十分な説明を行った上で、当該試料等提供者の血縁者の意向を確認し、開示を希望する場合には、開示することができる。
(4) 研究責任者は、単一遺伝子疾患等に関する遺伝情報を開示しようとする場合には、医学的又は精神的な影響等を十分考慮し、診療を担当する医師を通じて開示を行うこととするほか、必要に応じ、遺伝カウンセリングを実施しなければならない。
10.遺伝カウンセリング
(1) 目的
ヒトゲノム・遺伝子解析研究における遺伝カウンセリングは、対話を通じて、試料等提供者及びその家族、血縁者に正確な情報を提供し、疑問に適切に応え、その人たちの遺伝性疾患等に関する理解を深め、ヒトゲノム・遺伝子解析研究や遺伝性疾患等をめぐる不安、さらに悩みに応えることによって、今後の生活に向けて自らの意思で選択し、行動できるように支援、援助することを目的とする。
(2) 実施方法
遺伝カウンセリングは、遺伝医学に関する十分な知識を有し、遺伝カウンセリングに習熟した医師、医療従事者等の協力により実施されなければならない。
<遺伝カウンセリングに代わる情報の提供に関する細則>
IV.試料等の取扱い
11.研究実施前提供試料等の利用
(1) 研究実施機関において、ヒトゲノム・遺伝子解析研究の実施前に提供され、保存されている試料等の利用の可否は、試料等の提供者等の同意の有無又は内容及び試料等が提供された時期を踏まえ、以下の(2)から(4)までに定めるところにより、倫理審査委員会の承認を得た上で、研究実施機関の長が決定する。
(2) 本指針施行後に提供された研究実施前提供試料等については、本指針の理念を踏まえて、研究実施機関の長及び研究責任者は、その利用について慎重に判断し、また、倫理審査委員会は、研究における利用の可否を慎重に審査しなければならない。
(3) 試料等の提供時に、ヒトゲノム・遺伝子解析研究における利用を含む同意が与えられているA群試料等については、その同意の範囲内でヒトゲノム・遺伝子解析研究に利用することができる。
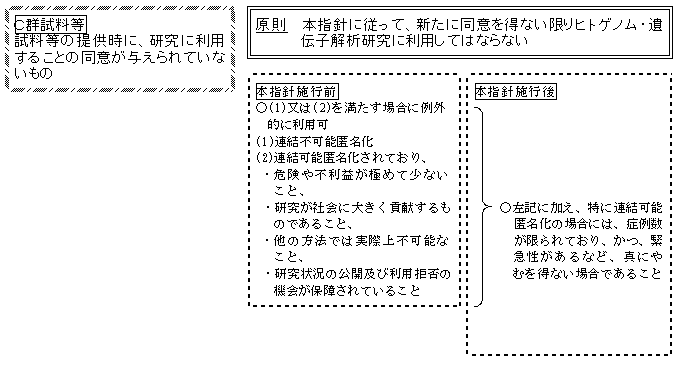
(4) 試料等の提供時に、ヒトゲノム・遺伝子解析研究における利用が明示されていない研究についての同意のみが与えられているB群試料等及び研究に利用することの同意が与えられていないC群試料等については、原則として、本指針において定める方法等に従って、新たに同意を得ない限りヒトゲノム・遺伝子解析研究に利用してはならない。
<本指針施行後に提供されたA群試料等の利用に関する細則>
<本指針施行前に提供されたB群試料等の利用に関する細則>
1) 連結不可能匿名化されていることにより、試料等の提供者等に危険や不利益が及ぶ可能性がない場合
2) 連結可能匿名化されている場合においては、ヒトゲノム・遺伝子解析研究により試料等の提供者等に危険や不利益が及ぶ可能性が極めて少なく、研究に高度の有用性が認められ、他の方法では実際上研究の実施が不可能又は極めて困難であること
<本指針施行後に提供されたB群試料等の利用に関する細則>
<本指針施行前に提供されたC群試料等の利用に関する細則>
1) 連結不可能匿名化されていることにより、試料等の提供者等に危険や不利益が及ぶ可能性がない場合
2) 連結可能匿名化されており、かつ、次のすべての要件を満たしている場合
<本指針施行後に提供されたC群試料等の利用に関する細則>
12.試料等の保存及び廃棄の方法
(1) 保存の一般原則
研究責任者は、研究実施機関内で試料等を保存する場合には、試料等提供者等の同意事項を遵守し、研究計画書に定められた方法に従わなければならない。
(2) ヒト細胞・遺伝子・組織バンクへの提供
研究責任者は、試料等をヒト細胞・遺伝子・組織バンクに提供する場合には、当該バンクが試料等を一般的な研究用試料等として分譲するに当たり、連結不可能匿名化がなされることを確認するとともに、バンクに提供することについて同意を得られているなどの、試料等提供者等との同意事項を遵守しなければならない。
(3) 試料等の廃棄
研究責任者は、研究計画書に従い自ら保存する場合及びヒト細胞・遺伝子・組織バンクに提供する場合を除き、試料等の保存期間が研究計画書に定めた期間を過ぎた場合には、試料等提供者等の同意事項を遵守し、匿名化して廃棄しなければならない。
V.見直し
13.見直し
前文
ヒトゲノム・遺伝子解析研究に関わるすべての関係者が、この指針を遵守することが求められる。
本指針施行前に既に着手され、現在実施中のヒトゲノム・遺伝子解析研究に対しては適用しないが、可能な限り、本指針に沿って適正に実施することが望まれる。
研究実施機関の長とは、例えば、以下のとおりである。
・ 保健所の場合は、保健所長
・ 大学医学部の場合は、医学部長
・ 企業等の研究所の場合は、研究所長
個人に関する情報を厳重に管理する手続、設備、体制を整備し、例えば、コンピューターを利用する場合には、個人に関する情報を処理するコンピュータは、他の一切のコンピュータと切り離すなどの措置を講じなければならない。
研究実施機関に既に設置されている類似の委員会を本指針に適合する倫理審査委員会に再編成すれば、名称の如何を問わない。
共同研究の場合には、研究計画についてそれぞれの研究実施機関において設置された倫理審査委員会の承認を得ることが原則であり、研究実施機関の長は、その審査に当たって、他の研究実施機関における研究計画の承認状況、インフォームド・コンセントの状況、匿名化の状況などの重要な情報を得て、当該倫理審査委員会にその情報を提供しなければならない。
その職を辞した後も同様である。
試料等提供者等が匿名化を行わずに外部の機関へ提供することに同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わずに、外部の機関に提供することが認められている場合には、試料等の匿名化を行わないことができる。
試料等提供者が、治療又は予防方法が確立していない単一遺伝子疾患であって、精神・知的障害を伴うものである場合には、研究の必要性、当該提供者に対する医学的・精神的影響及びそれらに配慮した研究方法の是非等について、研究責任者は特に慎重に検討し、また、倫理審査委員会は、特に慎重に審査しなければならない。
研究計画書に記載すべき事項は、一般的に以下のとおりとするが、研究内容に応じて変更できる。
研究責任者が研究実施機関の長に行う研究の実施状況の定期報告事項は、一般的に以下のとおりとするが、研究内容に応じて変更できる。
試料等提供者等が同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わないことが認められている場合には、試料等又は遺伝情報の匿名化を行わないことができる。
試料等提供者等が匿名化を行わずに外部の機関へ提供することに同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わないことが認められている場合には、匿名化されていない試料等又は遺伝情報の外部の機関への提供を行うことができる。
試料等提供者等が同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わないことが認められている場合には、試料等又は遺伝情報の匿名化を行わないことができる。
試料等提供者等が同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わないことが認められている場合には、試料等の匿名化を行わないことができる。
試料等提供者が同意し、かつ、倫理審査委員会の承認を受け、研究実施機関の長が許可した研究計画書において匿名化を行わないことが認められている場合には、個人識別情報の外部の機関への提供を行うことができる。
その職を辞した後も同様である。
以下の事項の運営規則が定められなければならない。
組織に関する公開すべき事項は、以下のとおりとする。
以下この8((4)及び(7)を除く。)において同じ。)は、試料等の提供の依頼を受ける人を、不合理、不当又は不公平な方法で選んではならない。
試料等の提供の依頼を受ける人が、疾病や薬剤反応性異常を有する場合及びそれらの可能性のある場合には、その人が病名又はそれに相当する状態像などの告知を受けていなければならない。
試料等提供者本人からインフォームド・コンセントを受けることが困難であり、代諾者等からのインフォームド・コンセントによることができる場合及びその取扱いは、以下のとおりとし、いずれの場合も、研究責任者は、研究の必要性及び代諾者等を選定する考え方を研究計画書に記載し、当該研究計画書は倫理審査委員会により承認され、研究実施機関の長に許可されなければならない。
研究責任者は、代諾者について、一般的には、以下に定める人の中から、試料等提供者の家族構成や置かれている状況等を勘案して、試料等提供者の推測される意思や利益を代弁できると考えられる人が選定されることを基本として、研究計画書に代諾者を選定する考え方を記載しなければならない。
研究責任者は、遺族について、一般的には、死亡した試料等提供者本人の配偶者、成人の子、父母、兄弟姉妹、孫、祖父母又は同居の親族、及びそれらの近親者に準ずると考えられる人の中から、死亡した試料等提供者の家族構成や置かれていた状況、慣習等を勘案して、試料等提供者の生前の推測される意思を代弁できると考えられる人が選定されることを基本として、研究計画書に遺族を選定する考え方を記載しなければならない。
試料等提供者又は代諾者等に対する説明文書に記載すべき事項は、一般的に以下のとおりとするが、研究内容に応じて変更できる。
研究責任者は、試料等提供者が自らの遺伝情報の開示を希望していない場合であっても、その遺伝情報が試料等提供者等の生命に重大な影響を与えることが判明し、かつ、有効な対処方法があるときは、研究実施機関の長に報告しなければならない。研究実施機関の長は、特に下記事項について考慮した開示に関する倫理審査委員会の意見を求め、それに基づき、研究責任者、試料等提供者の診療を担当する医師及びその医師が所属する医療機関の長と協議しなければならない。その結果を踏まえ、研究責任者は試料等提供者に対し、十分な説明を行った上で、当該試料等提供者の意向を確認し、なお開示を希望しない場合には、開示してはならない。
遺伝カウンセリング体制が整備されていない試料等の提供が行われる機関は、試料等提供者又はその家族、血縁者から遺伝カウンセリングの求めがあった場合には、適切な施設を紹介しなければならない。
研究実施機関の長及び研究責任者は、A群試料等が提供された時点における同意が、他のヒトゲノム・遺伝子解析研究への利用に関し、そのヒトゲノム・遺伝子解析研究の意義、研究目的又は匿名化等の方法などに、どの程度言及された同意であったか、また、同意が得られた時期などにも配慮して、その利用の取扱いを判断し、また、倫理審査委員会も、同様の観点から上記を配慮して、その利用の取扱いを審査しなければならない。
本指針施行前に提供されたB群試料等については、以下のいずれかの要件を満たす場合として、倫理審査委員会でその利用を承認し、研究実施機関の長により許可された場合に限り、ヒトゲノム・遺伝子解析研究に利用することができる。
本指針施行後に提供されたB群試料等については、「本指針施行前に提供されたB群試料等の利用に関する細則」に記載された要件に加えて、試料等の利用を拒否する機会が保障されており、特に連結可能匿名化の上で実施される研究については、B群試料等が提供された時点における同意が、他の研究への利用に関し、研究目的や匿名化等の方法などにどの程度言及された同意であったか、また、同意が得られた時期などにも配慮して、倫理審査委員会がヒトゲノム・遺伝子解析研究への利用を承認し、研究実施機関の長により許可された場合に限り、ヒトゲノム・遺伝子解析研究に利用することができる。
本指針施行前に提供されたC群試料等については、以下のいずれかの要件を満たす場合として、倫理審査委員会がその利用を承認し、研究実施機関の長により許可された場合に限り、ヒトゲノム・遺伝子解析研究に利用することができる。
本指針施行後に提供されたC群試料等については、「本指針施行前に提供されたC群試料等の利用に関する細則」に記載された要件に加えて、特に連結可能匿名化の上で実施される研究については、症例数が限られており、かつ、緊急に研究を実施する必要がある場合など、倫理審査委員会が真にやむを得ないとその利用を承認し、研究実施機関の長により許可された場合に限り、ヒトゲノム・遺伝子解析研究に利用することができる。
研究の有益性等の判断
|
研究計画書の作成
|
倫理審査委員会における審査
|
研究実施機関の長の決定
|
研究の実施
|
研究結果の公表
|
○研究実施前提供試料等の利用の可否は、以下を踏まえ、倫理審査委員会の承認を得た上で、研究実施機関の長が決定。本指針施行後に提供されたものについては、特に慎重に判断。
|


| 雨 宮 浩 | 国立小児病院小児医療研究センター長 | |
| 位 田 隆 一 | 京都大学大学院法学研究科教授 | |
| 上 田 國 寛 | 京都大学化学研究所教授 | |
| 宇都木 伸 | 東海大学法学部法律学科教授 | |
| 小 幡 純 子 | 上智大学法学部教授 | |
| ◎ | 垣 添 忠 生 | 国立がんセンター中央病院長 |
| 金 澤 一 郎 | 東京大学大学院医学系研究科教授(神経内科学) | |
| 具 嶋 弘 | 山之内製薬株式会社研開経営部理事 | |
| 黒 木 登志夫 | 昭和大学腫瘍分子生物学研究所長 | |
| 櫻 井 秀 也 | 社団法人日本医師会常任理事 | |
| 笹 月 健 彦 | 九州大学生体防御医学研究所長 | |
| 清 野 進 | 千葉大学大学院医学研究科教授 | |
| 高 芝 利 仁 | 弁護士 | |
| 地 神 芳 文 | 工業技術院生命工学工業技術研究所次長 | |
| 福 嶋 義 光 | 信州大学医学部教授(衛生学) | |
| 町 野 朔 | 上智大学法学部教授 | |
| 丸 山 英 二 | 神戸大学法学部教授 | |
| 南 砂 | 讀賣新聞社編集局解説部次長 | |
| 山 口 建 | 国立がんセンター研究所副所長 |
平成12年11月現在。五十音順(敬称略)。◎は委員長
| 青 野 由 利 | 毎日新聞社科学環境部編集委員 | |
| 味 木 和喜子 | 大阪府立成人病センタ−調査部調査課調査・登録グループ登録総括主査 | |
| 油 谷 浩 幸 | 東京大学先端科学技術研究センター助教授 | |
| 池 田 恭 治 | 国立療養所中部病院長寿医療研究センター老年病研究部長 | |
| 稲 田 俊 也 | 国立精神・神経センター精神保健研究所老化研究室長 | |
| 内 野 眞 也 | 野口病院外科医師 | |
| 浦 川 道太郎 | 早稲田大学法学部教授 | |
| 大 山 真 未 | 科学技術政策研究所上席研究官 | |
| 岡 慎 一 | 国立国際医療センターエイズ治療・研究開発センター臨床研究開発部長 | |
| 掛 江 直 子 | 早稲田大学人間総合研究センター助手 | |
| 菊 池 裕 | 国立医薬品食品衛生研究所衛生微生物部 主任研究官 | |
| 蔵 田 伸 雄 | 三重大学人文学部助教授 | |
| 黒 崎 雅 之 | 東京医科歯科大学助手 | |
| 斎 藤 博 久 | 国立小児病院免疫アレルギー研究部長 | |
| 齋 藤 有紀子 | 北里大学医学部医学原論研究部門 | |
| 佐 藤 恵 子 | 国立がんセンター中央病院臨床試験管理室 | |
| 菅 野 純 夫 | 東京大学医科学研究所助教授 | |
| 菅 野 康 吉 | 栃木県立がんセンターがん遺伝子研究室・がん予防研究室 | |
| 玉 井 真理子 | 信州大学医療技術短期大学部 | |
| 塚 田 俊 彦 | 国立がんセンター研究所細胞増殖因子研究部室長 | |
| 津 金 昌一郎 | 国立がんセンター研究所臨床疫学研究部長 | |
| 辻 省 次 | 新潟大学脳研究所教授 | |
| 外 口 崇 | 医薬品副作用被害救済・研究振興調査機構研究振興部長 | |
| 戸 田 達 史 | 大阪大学大学院医学系研究科バイオメディカル教育研究センター教授 | |
| 中 川 徹 | 日立製作所日立健康管理センター | |
| ぬで 島 次 郎 | 三菱化学生命科学研究所社会生命科学研究室主任研究員 | |
| 橋 本 雄 之 | 国立感染症研究所遺伝子資源室(遺伝子バンク)室長 | |
| 長谷川 知 子 | 静岡こども病院染色体科医長 | |
| 二 見 仁 康 | 国立がんセンター研究所細胞増殖因子研究部室長 | |
| 松 浦 幸 男 | バイオ産業情報化コンソーシアム(JBIC)情報化推進部長 | |
| 松 本 恒 雄 | 一橋大学大学院法学研究科教授 | |
| 水 澤 博 | 国立医薬品食品衛生研究所変異遺伝部第三室(細胞バンク)室長 | |
| 宮 本 真 司 | 年金福祉事業団資金運用事業部運用管理課長 | |
| 森 川 功 | 早稲田大学人間総合研究センター客員研究員 | |
| 森 崎 隆 幸 | 国立循環器病センターバイオサイエンス部長 | |
| 山 内 正 剛 | 放射線医学総合研究所第2研究グループ主任研究官 | |
| 山 縣 然太郎 | 山梨医科大学医学部教授(保健学講座) | |
| ○ | 山 口 建 | 国立がんセンター研究所副所長 |
| 吉 田 輝 彦 | 国立がんセンター研究所分子腫瘍学部長 | |
| 吉 村 義 信 | 武田薬品工業(株)創薬研究本部薬物機能第一研究所所長 |
平成12年11月現在。五十音順(敬称略)。○は座長。 ぬで島(’ぬで’は偏が木・旁が勝)
| 報道発表資料 | HOME |