| 報道発表資料 | HOME |
平成12年11月8日
1 平成12年10月24日、栄養補助食品等分科会において「保健機能食品の表示等について」の報告書が取りまとめられ、現在、食品衛生調査会合同部会において審議されているところです。
2 つきましては、当該報告書について、国民の皆様等からのご意見を募集します。
3 具体的な意見募集については、厚生省ホームページに掲載しますので、電子メールまたは郵送にて本日から11月15日(水)まで受け付けます。提出されたご意見の概要については、同分科会報告書を審議する食品衛生調査会合同部会においてご報告いたします。
【別添資料】
資料1
1 目 的
人生80年時代の今日、健やかな一生を送るため、国民一人一人が自ら健康に対する関心を高める中、食品求められる機能も複雑かつ多様化している。
保健機能食品制度は、こうした国民の要望と諸外国の制度との整合性を図る観点から創設するものである。
具体的には、
| (1)特定保健用食品: (個別許可型) |
身体の生理学的機能等に影響を与える保健機能成分を含んだ食品であって、健康の維持増進及び特定の保健の用途に資するもの |
| (2)栄養機能食品 : (規格基準型) |
高齢化、食生活の乱れ等により、通常の食生活を行うことが困難な場合等に不足しがちな栄養成分の補給・補完に資するもの |
2 検討経緯
本制度については、規制緩和推進計画、OTO決定及びMOSS協議でも取り上げられており、厚生省としては、「いわゆる栄養補助食品の取扱いに関する検討会」を開催し、本年3月に報告書が取りまとめられた。
今回、具体的な制度化に向けて、食品衛生調査会の食品規格、乳肉水産、表示特別、添加物及び毒性の5部会の合同分科会として栄養補助食品等分科会を設定して6月以降5回にわたって審議を行ってきたが、今回、分科会報告として取りまとめたものである。
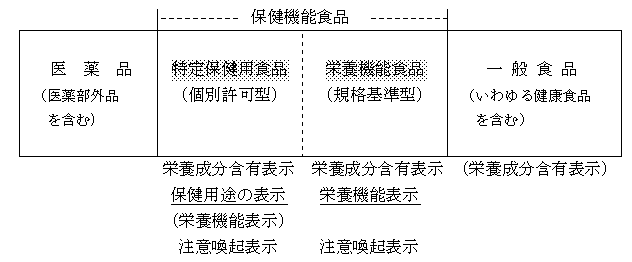
3 制度の概要図(分類と名称)
(概要図)

(表示事項)
| 対象食品 | 表 示 例 | |
| 特定保健用食品 | 全ての食品 | ・血圧を正常に保つことを助ける食品です。 ・便通を良好にする食品です。 |
| 栄養機能食品 | 下記に示す栄養成分を一定量含む食品 ビタミン(.A、D、E、B1、B2、B6、B12、C) ナイアシン、葉酸(ビオチン)、パントテン酸、カルシウム、鉄 |
・ビタミンDは、腸管でのカルシウムの吸収 を促進し、骨の形成を助ける栄養素です。 ・カルシウムは、骨や歯の形成に必要な栄養 素です (注意喚起表示等) ・本品は、多量に摂取しても疾病が治癒したり、より健康が増進するものではありません。 ・本品は、特定保健用食品と異なり、厚生労働省による個別審査を受けたものではありません。 |
| 注1: | 保健機能食品には疾病リスク低減表示(例:この食品はカルシウムを多く含み、将来の骨粗しょう症の危険度を減らします)は認められない。 |
| 注2: | 上記のビタミンやミネラル以外の栄養素を食品として使用できないわけでなく、栄養機能表示ができないものである。 また、ハーブ類については、比較的作用が緩和なものから強いものまで、さらに副作用の懸念のあるものまで広範囲に存在することから医薬品又は特定保健用食品で対応する。 |
4 今後の日程
| 12年11月8日(水): | 食品衛生調査会合同部会開催 各国大使館へ説明、ホームページ掲載による意見募集 |
| 20日(月): | 食品衛生調査会合同部会開催 |
| 11月下旬 : | パブリックコメント募集、WTO通報 |
| 13年 2月 : | 薬事・食品衛生審議会食品衛生分科会開催 |
| 3月 : | 関係省令等改正、通知発出 |
| 4月 : | 保健機能食品制度の施行 |
照会先 厚生省生活衛生局食品保健課 中垣新開発食品保健対策室長(内線2456) 担当:井上、森田(内線2458)
資料2
平成 12 年 10 月 24 日
食品衛生調査会栄養補助食品等分科会
1 はじめに
○ 当食品衛生調査会栄養補助食品等分科会は、食品衛生調査会の食品規格、乳肉水産、表示特別、添加物及び毒性の5部会の合同分科会として設置され、本年6月以降5回にわたって会議を開催し、検討を続けてきた。
○ 当分科会における検討すべき課題は、いわゆる健康食品のうち一定の要件を満たすものについて、規格基準、表示基準の設定、評価指針の策定、製造基準の策定、添加物の審査指針策定等のきわめて多岐にわたるものであり、各委員の間でも意見の分かれる課題も多く存在した。
○ 海外に目を転じて見れば、こうした一定の機能を持つ食品については、特に表示に関して種々議論され、動き始めていると言える。具体的には、CODEX(FAO/WHO合同食品規格計画)では、1996年5月の第24回食品表示部会で栄養強調表示が採択され、1997年4月の第25部会以降、健康強調表示を検討してきているが、現在までStep3にとどまっているところである。一方、米国においては1994年に成立した栄養補助食品・健康・教育法(DSHEA)が制定され、ビタミン、ミネラル、ハーブ等について科学的根拠があれば、FDAに通知するだけで、一定の効能効果が記載できることとなった。また、1998年4月には、FDAから身体の構造又は機能への効果に関する表示についての細則が提案された。他方EUにおいては、健康強調表示に関する指令はまだ存在しないが、ビタミン類及びミネラル類を中心とした栄養補助食品に対する考え方や表示について現在検討している。このように、健康強調表示の状況は各国により異なっているのが現状である。
○ 一方、我が国におけるいわゆる栄養補助食品の検討は、食薬区分の見直しと並行して行われてきており、具体的には平成7年3月の規制緩和推進計画、平成8年3月のOTO本部決定等でこの課題が取り上げられてきた。なお、平成12年3月31日に閣議決定された規制緩和推進計画においては、栄養補助食品について、検討会及び審議会の議論並びにCODEXの議論を踏まえる必要があるが平成12年度に所要の制度改正を行うこととされている。こうした状況の中、厚生省はいわゆる栄養補助食品の取扱いに関する検討会(以下「検討会」という。)を設置して検討を行い、本年3月には栄養補助食品の意義・目的、定義、範囲、名称、表示、いわゆる健康食品の類型化等について報告書がとりまとめられた。当分科会においては、この検討会報告書も検討の素材としたところである。
○ 既に述べたとおり、当分科会において与えられた課題すべてに委員共通の理解が得られたわけではないこと、国際機関あるいは諸外国においても取扱いが大きく異なっていることを踏まえれば、本制度については、容易に結論が出せる課題ではないことは言うまでもない。
○ しかしながら、一方既に多くの商品が生産され市場に流通しており、その中には品質、広告、宣伝等に問題があるものもあることから、いわゆる健康食品が無秩序に氾濫することにより、国民の栄養摂取状況を混乱させ、健康上の被害をもたらすことがないよう、一定の規則を定めることが必要であり、あわせて消費者に対して正しい情報提供を行うことが喫緊の課題となっている。
○ また、本問題については、政府の規制緩和推進計画にも検討すべき課題として盛り込まれており、早急な対応が求められている。
○ 本分科会報告は、こうした状況を踏まえ、栄養補助食品制度について当面実施すべき方向を示すものとして取りまとめられたものである。以下の各論で述べるとおり、今後引き続いて検討すべき課題も多く残っており、さらなる検討を行政に望むものである。
2 分類及び名称
○ 1で既述したとおり、今回の検討は食薬区分の見直しと並行して行われてきた。したがって、先の検討会においても錠剤・カプセル剤等の通常の食品形態でないもの(以下「錠剤等」という。)を中心として検討してきた。
○ 一方、我が国では既に平成3年から栄養改善法に基づく制度として、保健の目的を表示できる特定保健用食品制度が存在しており、本年10月10日現在で既に195品目が許可されており国民の間に定着しつつある。この特定保健用食品は、現在は通常の食品形態のものに限定されているが、既に医薬品が規制緩和の観点から形状のみにより判断することを廃止することを決定していることを踏まえれば、今後あえて錠剤等を対象から除外することは適当ではない。
○ 検討会では対象となる食品について、表示できる内容に応じて個別許可型と規格基準型の2種類を提案している。当分科会においてもこの考え方を踏襲することとする。
○ これまで使用されてきた栄養補助食品とは英語のdietary supplementを直訳したものである。一方、これまでいわゆる健康食品においては、既に健康補助食品あるいは栄養補助食品という名称が自発的に用いられ、それなりに定着してきている。こうした現状との混同を避け、紛らわしさを払拭し、国民に分かり易い制度とするため、今回、いわゆる健康食品の類型化として、当分科会は、個別許可型は「特定保健用食品」、規格基準型は「栄養機能食品」とし、両者を包含する名称として「保健機能食品」とすることを提唱する。以下においては、この名称により記述することとする(別紙1参照)。
3 栄養機能食品の規格基準
○ 当分科会では、上記の栄養機能食品の対象となりうる成分としてビタミン、ミネラル、ハーブ類、タンパク質、脂肪酸及び食物繊維を取り上げることとした。
○ 具体的な検討品目についてはさらに専門の委員の検討に委ね、それを踏まえてさらに討議した結果、当面検討すべきものとして、平成11年に第6次改定が行われた日本人の栄養所要量で取り上げられた25群のビタミン、ミネラルを優先して取り上げることとした。
○ なお、ハーブ類については、比較的作用の緩和のものから強いものまで、さらに副作用の強いものまで広範囲に存在することから、保健機能食品の体系中では栄養機能食品になじまず、個別許可型である特定保健用食品で対応することが適当である。
○ 25群のビタミン、ミネラルのうち規格基準を設定する対象、上限値の設定については、医薬部外品の基準を参考とすることが適当である。具体的な考え方、数値等については別紙2の通りとする。
○ 規制緩和という観点からは、栄養機能食品を広く認めることが必要であり、今回、規格基準を設定しなかったビタミン、ミネラルさらにはタンパク質、脂肪酸、食物繊維については、可能なものから順次規格基準を設定すべく、引き続き検討することが必要であるが、その際には、食品の安全性確保に支障をきたすことがないよう、科学的知見に基づき検討することが必要である。
4 表示基準
○ 保健機能食品の表示については、次の要件を満たすことが必要である。
○ 栄養機能食品の栄養機能表示については、CODEXの栄養素機能表示例等国際的に定着しているもの、広く学会等で認められているものであって、国民が容易に理解できるものとすることが適当である。
○ 特定保健用食品の保健機能表示については、既に現行制度で多数の例が存在しており、今後許可される表示にもこれが参考となる。しかし、後述するように、国民の保健に資するため、科学的根拠に基づくさらなる適正な審査を課すこと等から、薬事法に規定される疾病の診断・治療・予防に言及しない範囲において、科学的根拠に応じた国民の選択に資する適切な表示を認めることが必要である。
○ また、保健機能食品の表示については、すべての国民が安全に摂取できるよう、禁忌事項を含めた注意喚起表示を行わせることが必要不可欠である。
○ さらに国民が栄養機能食品と特定保健用食品を混同することのないよう、表示で十分に配慮することが必要である。
○ なお、保健機能食品における疾病リスク低減表示については、検討会報告でも指摘されているように、未だ国際的にも検討途上であること、医薬品の予防効果の表示と区別が付きにくいという意見もあることから、現時点において認めることは適当ではないと考えられるが、今後CODEXでの検討動向等を踏まえつつ、引き続き検討することが必要である。
○ こうした表示の考え方については、別紙3の「保健機能食品の表示の基本的考え方」としてとりまとめたが、今後、この考え方に基づいて、行政が具体例を示すこと等により、わかりやすい表示基準を策定・公表することが必要である。
5 製造基準
○ 検討会報告では、保健機能食品について食品衛生法に基づく製造基準(食品GMP)を設定することが提言されている。
○ 当分科会としても保健機能食品については、その品質を維持し、国民の信頼を得るためには、食品GMPを設定することが必要と考える。
○ 具体的な食品GMPの検討に際しては、医薬品GMPの内容、導入経緯が参考となる。
○ 内容については、医薬品GMPと全く同じであれば規制緩和を行い食薬区分を見直した意味がなくなる。ただし、これは食品GMPが一方的に医薬品GMPよりも簡便なものでなければならないということではなく、食品にふさわしい内容とすべきということである。
○ また、食品GMPの導入は、新たな規制という観点から論ずるのみではなく、指導・育成という観点からもとらえるべきものである。具体的には、既存の多くのいわゆる健康食品の製造業者が積極的に科学的知見の収集に努め、保健機能食品の適切な製造に取り組むことを奨励する方向で実施すべきである。
○ また、医薬品においては、昭和44年のWHO勧告を受け、昭和51年に当時の薬務局長通知で医薬品GMPを実施しているが、さらに許可要件としてのGMP実施までには相当の年数を経過している。
○ こうした状況を踏まえて、当分科会としては今回確定的な食品GMPの内容、導入時期等について、あえて結論をまとめることとしなかった。これは食品GMPが不要ということではなく、引き続き行政及び専門家による検討を望むものである。
○ なお、食品GMPの円滑な導入のためには、各事業者がその責任を自覚し、責任管理体制の確立等の自主的な取組みを行うことが望まれる。
○ さらに厚生省は、GMPの検討の一環として、食品衛生法第20条に基づく施設基準の設定をあわせて検討すべきである。
6 特定保健用食品の申請・評価・表示に関する指針
○ 従来の特定保健用食品は、生活衛生局長の下に設置された検討会で専門家が検討を行い、その結果に基づき厚生大臣が許可してきた。今後は、医薬行政と組織が一元化すること、特定保健用食品の役割の増大が期待されることも踏まえ、必要に応じて医薬品に準じた取扱いをすることが望まれる。この観点から、特定保健用食品の審査は、審議会において議論されることが適当である。
○ 審議会における議論の前提として、申請者の便宜を図るとともに、審査の透明性を確保するため、審査基準については、広く一般に公表することが必要である。
○ 当分科会では、当該申請食品の有効性、安全性等を科学的に評価するため、別添1の指針を提案する。なお、食品等としてヒトが摂取してきた経験が十分に存在しないものについては、食品添加物を評価する際と同等の安全性に関する資料を必要とすべきである。
○ なお、既存の許可を受けている特定保健用食品については、既に一定の科学的な評価を踏まえたものであり、引き続き従来通りの表示を認めることが適当である。ただし、今回認められる新たな表示を希望する場合は、新たな基準に沿った資料に基づく再度の許可申請を必要とすべきである。
○ また、行政が必要に応じて再評価を行う仕組みを講じることも必要である。
○ 直接今回の指針に係るものではないが、特定保健用食品として類似の商品が多く許可された場合には、規格基準を定めて栄養機能食品として製造が可能となるような措置を講じることも検討すべきである。
7 食品添加物指針
○ 通常形態の食品に使用できる食品添加物とは別に「保健機能食品であってカプセル、錠剤等通常の形態でない食品」に用いられる賦形剤、乳化剤等について、当該食品に使用できる食品添加物としての指定及び使用基準の改正に関する指針を別添2のとおり策定したところである。
○ 上記指針においては、医薬品の添加剤として既に使用実績がある等合理的な理由のある場合には、関連する資料により安全性等を評価することが可能と考えられ、必要な添付資料の一部を省略することができることとしたところである。
○ また、保健機能食品の原材料(主成分)として用いられるビタミン、ミネラルについても、上記指針により、当該食品に使用できる物質として指定することが適当である。
8 おわりに
○ 保健機能食品については、今後もCODEXをはじめとした国際機関、諸外国の動向を注視し、国際的整合化を念頭に置いて、我が国においても不断の検討が必要である。
○ いわゆる健康食品については、従来誇大広告、不当な高価格、不良品といった負の側面も指摘されてきた。新しい保健機能食品制度が正しく理解され、定着するためには、消費者保護の観点からも、保健機能食品及びその表示あるいは広告の監視指導が重要であり、食品衛生法第11条に基づく表示の基準の設定や同法第12条の規定の解釈の明確化を図ること等により、食品衛生部局における監視指導体制を充実するとともに、薬事担当部局とも一層の連携を図ることが必要である。
○ 国民に対して正しい情報を提供して、自らの選択に委ねるためには、相談機関の充実やアドバイザリースタッフの確保が必要と考えられ、そのための官民役割分担した施策の充実が望まれる。
○ 人生80年時代の今日、健やかな一生を送るため、国民一人一人が自らの健康に対する関心を高める中、食品に求められる機能も複雑かつ多様化している。今回の保健機能食品制度は、こうした国民の要望に応えるためのものであり、今後の成長が見込まれる分野である。この制度が国民の間に定着し、健全な発展を遂げることを心から期待するところである。
なお、上限値については、一般用医薬品の数値を準用すべきという指摘が複数の委員からなされた。今回は医薬部外品の最大分量を準用することとするが、この最大分量については、最新の科学的な知見を踏まえ、必要に応じた今後の検討を望むものである。
| 基準設定のための根拠資料 | 条 件 | 栄養機能食品 の 上 限 値 |
該当栄養成分 | ||||
| 医療用医薬品 の承認基準 |
NOAEL | UL | 栄養 摂取量 |
||||
| (1) | ○ | ○ | ○ | ○ | UL−栄養摂取量 〉医薬部外品最大分量の場合 UL−栄養摂取量〈 医薬部外品最大分量の場合 |
医薬部外品最大分量 UL−栄養摂取量 |
V.A, B6 Ca 鉄 ビオチン |
| (2) | ○ | ○ | × | ○ | NOAEL−栄養摂取量 〉医薬部外品最大分量の場合 NOAEL− 栄養摂取量〈 医薬部外品最大分量の場 |
医薬部外品最大分量 NOAEL−栄養摂取 |
V.B1,B12, C |
| (3) | ○ | ○ | ○ | × | UL−栄養所要量 〉医薬部外品最大分量の場合 UL−栄養所要量〈 医薬部外品最大分量の場合 |
医薬部外品最大分量 UL−栄養所要量 |
V.E, D 葉酸 ナイアシン |
| (4) | ○ | ○ | × | × | NOAEL−栄養所要量 〉医薬部外品最大分量の場合 NOAEL−栄養所要量〈 医薬部外品最大分量の場合 |
医薬部外品最大分量 NOAEL−栄養所要 |
パントテン酸 |
| (5) | ○ | × | × | ○ | 医薬部外品最大分量がある場合 | 医薬部外品最大分量 | V.B2 |
| (6) | × | − | − | − | V.K, リン、マグネシウム、カリウム、銅、ヨウ素、マンガン、セレン、亜鉛、クロム、モリブデン | ||
| 注) | 栄養機能食品の上限値: | 栄養機能食品に配合される栄養成分を1日当たりに摂取できる最大限度量 |
| 栄養機能食品の下限値: | 栄養機能食品に配合される栄養成分を1日当たりに摂取できる最小限度量 |
(ビタミン)
| ビタミンA (レチノール) |
ビタミンD | ビタミンE | ビタミンB1 | ビタミンB2 | ナイアシン | ||
| 基 本 的 考 え 方 に基づく 栄養素の 上 限 値 下 限 値 |
上 限 値 |
2,000IU | 200IU | 150mg | 25mg | 12mg | 15mg |
| 下 限 値 |
600IU | 35IU | 3mg | 0.3mg | 0.4mg | 5mg | |
| ビタミンB6 | 葉 酸 | ビタミンB12 | ビオチン | パントテン酸 | ビタミンC | ||
| 基 本 的 考 え 方 に基づく 栄養素の 上 限 値 下 限 値 |
上 限 値 |
10mg | 200μg | 60μg | 500μg | 30mg | 1,000mg |
| 下 限 値 |
0.5mg | 70μg | 0.8μg | 10 μg | 2mg | 35mg | |
(ミネラル)
| カルシウム | 鉄 | ||
| 基 本 的 考 え 方 に基づく 栄養素の 上 限 値 下 限 値 |
上 限 値 |
600mg | 10mg |
| 下 限 値 |
250mg | 4mg | |
| 栄 養 機 能 食 品 | 特 定 保 健 用 食 品 |
| 1 保健機能食品(栄養機能食品)である旨 | 1 保健機能食品(特定保健用食品)である旨 |
| 2 栄養成分の表示(機能表示する成分を含む) | 2 栄養成分の表示(保健機能に関与する成分を含む) |
| 3 栄養機能表示 | 3 特定の保健用途の表示(表示許可された表示) |
| 4 1日当たりの摂取目安量 | 4 1日当たりの摂取目安量 |
| 5 摂取方法 | 5 摂取方法 |
| 6 1日当たりの栄養所要量に対する充足率 | 6 1日当たりの栄養所要量に対する充足率 (栄養所要量が定められているものに限る) |
| 7 摂取をする上での注意事項 | 7 摂取をする上での注意事項 |
| 8 本品は、特定保健用食品と異なり、厚生労 働省による個別審査を受けたものではない旨 |
4 具体的な表示例
(1)ビタミン・ミネラルの栄養機能表示例と注意喚起表示例
当該表示は、栄養成分の補給・補完を目的とし、身体の健全な成長、発達、健康の維持に必要な栄養成分の栄養 生理的機能を表示するものである。
当該表示内容に該当する機能性等の裏付けともなる科学的根拠は、これまでにヒトにおいてその栄養生理的機能が実証され、過去の食経験からも確立されたものでなければならない。
(ビタミン)
| 名 称 | 栄 養 機 能 表 示 | 注 意 喚 起 表 示 |
| ビタミンD | ビタミンDは、腸管でのカルシウムの吸収を促進し、骨の形成を助ける栄養素です。 | ・本品は多量に摂取しても疾病が治癒したり、より健康が増進するものではありません。 ・本品の多量摂取により、悪心、嘔吐の症状が現れる場合がありますので、1日の摂取目安量を必ず守って下さい。 |
(ミネラル)
| 名 称 | 栄 養 機 能 表 示 | 注 意 喚 起 表 示 |
| カルシウム | カルシウムは、骨や歯の形成に必要な栄養素です。 | ・本品は多量に摂取しても疾病が治癒したり、より健康が増進するものではありません。 ・本品の多量摂取により、頭痛、めまい、嘔吐、筋肉痛の症状が現れる場合がありますので、1日の摂取目安量を必ず守って下さい。 |
(2)特定保健用食品の保健用途の表示例(高度機能強調表示例)
当該表示は、食生活において特定の保健の目的で摂取する者に対し、特定の保健の機能を有する成分を含む食品の摂取により、健康の維持増進に役立ち、特定の保健の用途に適する旨の表示である。従って、当該表示は、食品そのものに疾病の診断、治療又は予防の効能効果があることを言及したり、あるいは身体の組織機能を増強、増進させることにより、疾病の診断、治療又は予防の効能効果がある旨の表示をするものではなく、食品そのものに科学的根拠の裏付けのある特定の保健の機能を有する成分を含み、それを摂取することにより、健康の維持増進のための身体の生理的機能や組織機能の維持、手助け(補助)または特定の保健に役立つ、適する旨の表示である。
なお、当該表示内容は、厚生労働省において個別に生理的機能や特定の保健機能を示す有効性や安全性等に関する科学的根拠に関する審査を受け、その根拠を厚生労働大臣が認知し、表示の許可を受けたものでなければならない。
当該食品は○○成分を含んでいる(○○成分を主成分とする)ことから、
| 資 料 の 種 類 | A欄 (ビタミン類、 ミネラル類) |
B欄 (賦形剤や 乳化剤等の 添加物) | ||
| 指定 要請 |
使用 基準 改正 |
指定 要請 |
使用 基準 改正 |
|
|
(1) 本要請の目的及び理由
(2) 資料概要
(3) 起源又は発見の経緯及び使用状況に関する資料
(1) 起源又は発見の経緯
(2) 外国における許可状況
(3) 諸外国での使用状況や医薬品等としての使用実績
(4) 物理化学的性質及び成分規格に関する資料
(1) 名称
(2) 構造式又は示性式
(3) 分子式及び分子量
(4) 含量規格
(5) 製造方法
(6) 性状
(7) 確認試験
(8) 示性値
(9) 純度試験
(10) 乾燥減量、強熱減量、水分
(11) 強熱残分(強熱残留物)又は灰分
(12) 定量法
(13) 物質の安定性
(14) 保健機能食品であって、カプセル、錠剤等通常の食品形態
(15) 成分規格案の設定根拠
(5) 有効性/必要性に関する資料
(1)ビタミン類、ミネラル類について
ア ヒトにおける有効性
イ 同様の効果をもつ成分との比較検討
ウ 保健機能食品であってカプセル、錠剤等通常の食品形態で
エ 他の成分との相互作用等
(2)賦形剤や乳化剤等の添加物について
ア 賦形剤や乳化剤等の添加物としての必要性
イ 同種の添加物との比較検討
ウ 保健機能食品であってカプセル、錠剤等通常の食品形態で
エ 要請する品目の食品中の主要な栄養成分に及ぼす影響
(6) 安全性に関する資料
(1) 毒性に関する資料
ア 単回投与毒性試験
イ 28日間反復投与毒性試験
ウ 90日間反復投与毒性試験
エ 1年間反復投与毒性試験
オ 繁殖試験
カ 催奇形性試験
キ 発がん性試験
ク 1年間反復投与毒性/発がん性併合試験
ケ 抗原性試験
コ 変異原性試験
タ 一般薬理試験
チ その他参考となる試験(医薬品として実施された試験等)
(2) 体内動態に関する資料
(3) ヒトにおける安全性に関する資料
(4) 1日摂取量に関する資料
(7) 使用基準案に関する資料 |
◎ ◎
◎ ◎ ◎
◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎
◎ ◎ ◎
− − −
◎ ◎ ◎ ○ ○ ○ ○ ○ ○ ◎ ○ ○ ◎ ◎ ◎ ◎ |
◎ ◎
− △ △
△ △ △ △ △ △ △ △ △ △ △ △ △ △
◎ ◎ ◎
− − −
△ △ △ △ △ △ △ △ △ △ △ △ △ ◎ ◎ ◎ |
◎ ◎
◎ ◎ ◎
◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎ ◎
− − −
◎ ◎ ◎
◎ ◎ ◎ ○ ○ ○ ○ ○ ○ ◎ ○ ○ ◎ △ ◎ ◎ |
◎ ◎
− △ △
△ △ △ △ △ △ △ △ △ △ △ △ △ △
− − −
◎ ◎ ◎
△ △ △ △ △ △ △ △ △ △ △ △ △ △ ◎ ◎ |
表2 保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品の成分となる物質が食品内又は消化管内で分解して食品常在成分となることを確認する場合の検討事項
|
1.通常の使用条件下で、当該物質が容易に食品内又は消化管内で分解して食品常在成分と同一物質になること。
2.食品内又は消化管内での分解に関わる主要な因子(pH、酵素等)が明らかであること。
3.通常の使用条件下で適正な量を使用した場合、当該物質の体内への吸収が食品成分と同程度であり、他の栄養成分の吸収を阻害しないこと。
4.摂取された物質の未加水分解物又は部分加水分解物が大量に糞便中に排泄されないこと。
5.当該物質を含む保健機能食品であって、カプセル、錠剤等通常の食品形態でない食品を摂取したとき、過剰摂取の問題が起きないこと。 |
年 月 日
厚 生 労 働 大 臣 殿| 住所(法人にあっては、主たる事務所の所在地) 氏名(法人にあっては、名称及び代表者の氏名) 印 |
食品衛生法第6条及び第7条第1項の規定に基づき、食品衛生法施行規則別表2の2に下記品目を指定されるよう要請します。
(注意)
| 1. | 用紙の大きさは、日本工業規格A4とすること。 |
| 2. | 字は、墨、インク等を用い、邦文にあっては楷書ではっきり書くこと。 |
| 3. | 要請者が外国に在住する場合には、国内連絡先を記載すること。なお、印を署名に代えることができる。 |
年 月 日
厚 生 労 働 大 臣 殿| 住所(法人にあっては、主たる事務所の所在地) 氏名(法人にあっては、名称及び代表者の氏名) 印 |
食品衛生法第7条第1項の規定に基づき、食品衛生法施行規則別表2の2において指定されている下記品目の使用基準を下記のとおり改正されるよう要請します。
(注意)
| 1. | 用紙の大きさは、日本工業規格A4とすること。 |
| 2. | 字は、墨、インク等を用い、邦文にあっては楷書ではっきり書くこと。 |
| 3. | 要請者が外国に在住する場合には、国内連絡先を記載すること。なお、印を署名に代えることができる。 |
| 報道発表資料 | HOME |