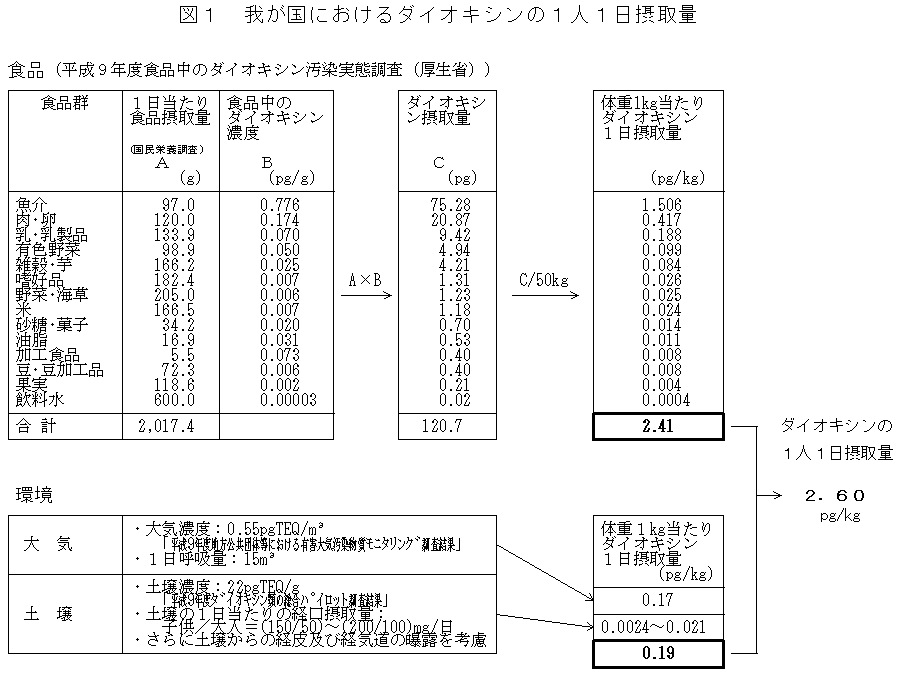
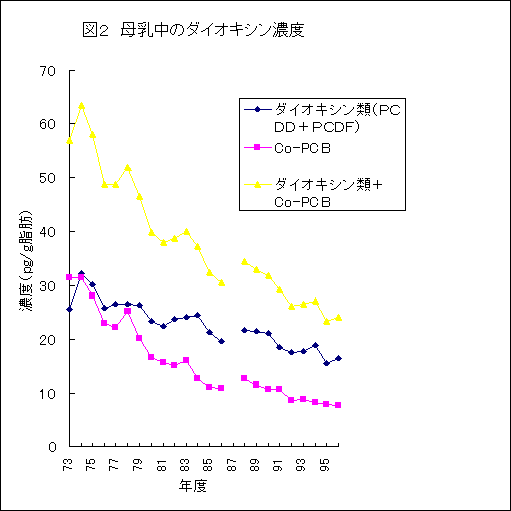
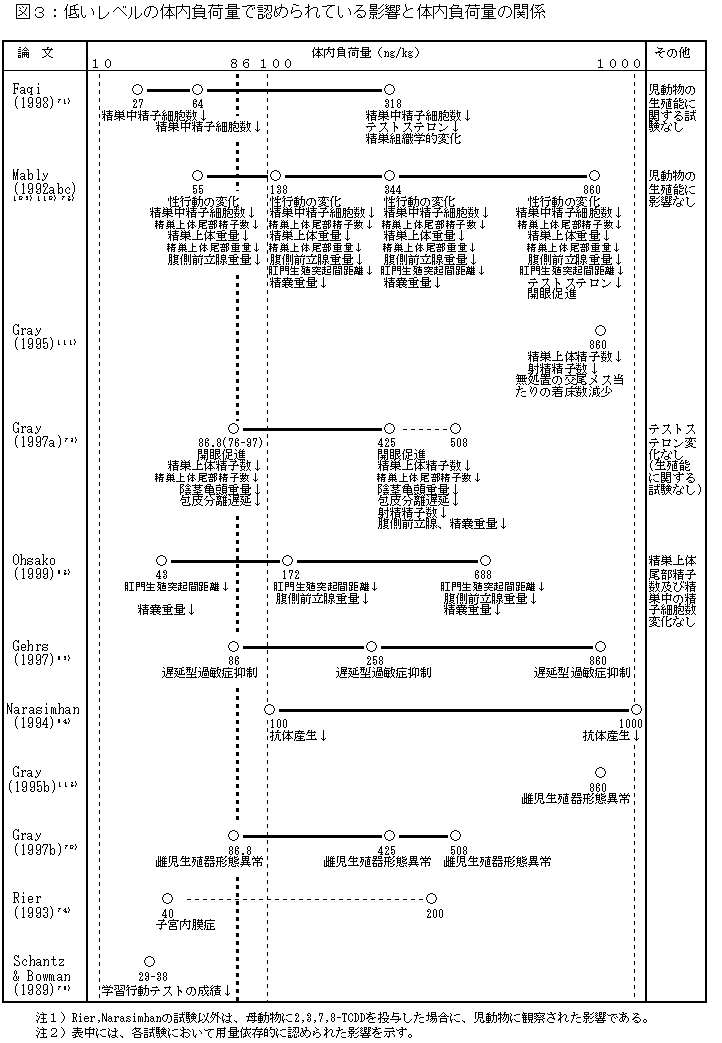
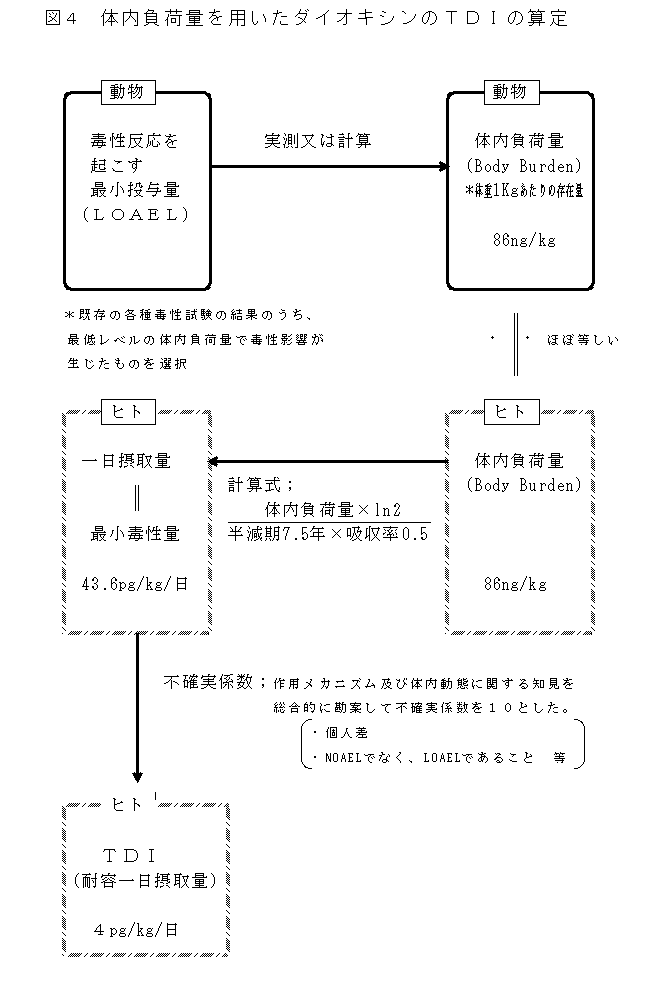
| 1) |
WHO Summary Report of "Consultation on Tolerable Daily Intake from Food of PCDDs and PCDFs" (1991) EUR/ICP/PCS 030(S) 0369n |
|
2)
|
US.EPA.:Health assessment document for 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds. (1994) EPA/600/bp-92/001a,b,c |
| 3) |
厚生省:ダイオキシンのリスクアセスメントに関する研究・中間報告書 (平成8年6月) |
| 4) |
環境庁:ダイオキシンリスク評価検討会報告書 (平成9年5月) |
|
5)
|
Executive Summary Report of "Assessment of the health risks of dioxins: re-evaluation of the Tolerable Daily Intake (TDI)
(1999) |
| 6) |
厚生省:平成9年度食品中のダイオキシン類等汚染実態調査報告(平成10年10月28日) |
| 7) |
環境庁:平成9年度地方公共団体等における有害大気汚染モニタリング調査について(平成10年12月22日) |
| 8) |
環境庁:平成9年度有害大気汚染物質モニタリング調査結果について(平成10年7月16日) |
| 9) |
環境庁:平成9年度ダイオキシン類の総合パイロット調査結果について(平成10年10月23日記者発表資料) |
| 10) |
厚生省:平成9年度厚生科学研究事業 母乳中のダイオキシン類に関する研究 |
| 11) |
De Vito, M. J., Birnbaum, L. S., Farland, W. H., Gasiewicz, T. A. (1995) Comparisons of estimated human body burdens of dioxinlike chemicals and TCDD body burdens in experimentally exposed animals. Environ. Health Perspect., 103, 820-831 |
| 12) |
Mocarelli, P., Patterson, D. G., Jr., Marocchi, A and Needham, L. L. (1990) Chemosphere, 20, 967-974 |
| 13) |
Nagayama J., Kuratsune, M., Masuda, Y. (1976) Determination of chlorinated dibenzofurans in Kanechlors and "Yusho Oil". Bull.Environ.Contami Toxicol., 15, 9-13 |
| 14) |
Hsu, S-T., Yu, M-L. M., Y.-C.J. Guo, Y.LL & Rogan, W.J. (1994) The Yu-cheng rice oil poisoning incident. In: Schecter, A., ed, Dioxins and Health, New York, Plenum Press, pp.661-684 |
| 15) |
WHO/IARC (1997) Polychlorinated Dibenzo-para-dioxins and Dibenzofurans. IARC Monographs on the Evaluation of Carcinogenic Risk to Humans; Volume 69, Geneva |
| 16) |
労働省:豊能郡美化センターダイオキシン問題に係る調査研究報告書(平成11年3月26日) |
| 17) |
May,G. (1973) Chloracne from the accidental production of tetrachlorodibenzodioxin. Br. J. Industr. Med., 30, 276-283 |
| 18) |
May, G. (1982) Tetrachlorodibenzodioxin : A survey of subjects ten years after exposure. Br. J. Industr. Med., 39, 128-135 |
| 19) |
Moses, M., Lilis, R., Crow, K.D., Thornton, J., Fischbein, A., Anderson, H.A., Selikoff, I.J. (1984) Health status of workers
with past exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxinin in the manufacture
of 2,4,5- trichlorophenoxyacetic acid : Comparison of findings with and without chloracne. Am. J. Industr. Med., 5, 161-182 |
| 20) |
Moses, M., Prioleau, P.G. (1985) Cutaneous histologic findings in chemical workers with and without chloracne with past exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin. J. Am. Acad. Dermatol., 12, 497-506 |
| 21) |
Bond, G.G., McLaren, E.A., Brenner, F.E., Cook, R.R. (1989) Incidence of chloracne among chemical workers potentially exposed to chlorinated dioxins. J. Occup. Med., 31, 771-774 |
| 22) |
Ott, M.G., Messerer, P., Zober, A. (1993) Assessment of past occupational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin using blood lipid analyses. Int. Arch. Occup. Environ. Health, 65, 1-8 |
| 23) |
Poland, A.P., Smith, D., Metter, G., Possick, P. (1971) A
health survey of workers in a 2,4-D and 2,4,5-T Plant. With special attention to chloracne, porphyria cutanea tarda, and psychologic parameters. Arch. Environ. Health, 22, 316-327 |
| 24) |
Oliver, R.M. (1975) Toxic effects of 2,3,7,8 tetrachlorodibenzo 1,4 dioxin in laboratory workers. Br. J. Industr. Med., 32, 49-53 |
| 25) |
Pazderova-Vejlupkova, J., Nemcova, M., Pickova, J., Jirasek, L., Lukas, E. (1981) The development and prognosis of chronic intoxication by tetrachlordibenzo-p-dioxin in men. Arch. Environ. Health, 36, 5-11 |
| 26) |
Bond, G.G., Ott, M.G., Brenner, F.E., Cook, R.R. (1983) Medical and morbidity surveillance findings among employees potentially exposed to TCDD. Br. J. Industr. Med., 40, 318-324 |
| 27) |
Martin, J.V. (1984) Lipid abnormalities in workers exposed to dioxin. Br. J. Industr. Med., 41, 254-256 |
| 28) |
Jennings, A.M., Wild, G., Ward, J.D., Ward, A.M. (1988) Immunological abnormalities 17 years after accidental exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Br. J. Industr. Med., 45, 701-704 |
| 29) |
Calvert, G.M., Sweeney, M.H., Morris, J.A., Fingerhut, M.A., Hornung, R.W., Halperin, W.E. (1991) Evaluation of chronic bronchitis, chronic obstructive pulmonary disease, and ventilatory function among workers exposed
to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Am. Rev. Respir. Dis., 144, 1302-1306 |
| 30) |
Calvert, G.M., Hornung, R.W., Sweeney, M.H., Fingerhut, M.A., Halperin, W.E. (1992) Hepatic and gastrointestinal effects in an occupational cohort exposed to 2,3,7,8-tetrachlorodibenzo-para-dioxin. J. Am. Med. Assoc.,
267, 2209-2214 |
| 31) |
Calvert, G.M., Sweeney, M.H., Fingerhut, M.A., Hornung, R.W., Halperin, W.E. (1994) Evaluation of porphyria cutanea Tarda in U.S. workers
exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Am. J. Industr. Med., 25, 559-571 |
| 32) |
Calvert, G.M., Wille, K.K., Sweeney, M.H., Fingerhut, M.A., Halperin, W.E. (1996) Evaluation of serum lipid concentrations among U.S. workers exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Arch. Environ. Health, 51, 100-107 |
| 33) |
Collins, J.J., Strauss, M.E., Levinskas, G.J.,
Conner, P.R. (1993) The mortality experience of workers exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin
in a trichlorophenol process accident. Epidemiology, 4, 7-13 |
| 34) |
Ott, M.G., Zober, A., Germann, C. (1994) Laboratory results for selected target organs in 138 individuals occupationally exposed to TCDD. Chemosphere, 29, 2423-2437 |
| 35) |
Egeland, G.M., Sweeney, M.H., Fingerhut, M.A., Wille, K.K., Schnorr, T.M., Halperin, W.E. (1994) Total serum testosterone and gonadotropins in workers exposed to dioxin. Am. J. Epidemiol., 139, 272-281 |
| 36) |
Zober, A., Messerer, P., Ott, M.G. (1997/98) BASF studies
: Epidemiological and clinical investigations on dioxin-exposed chemical workers. Teratog. Carcinog. Mutag., 17, 249-256 |
| 37) |
Manz, A., Berger, J., Dwyer, J.H., Flesch-Janys, D., Nagel, S., Waltsgott, H. (1991) Cancer mortality among workers in chemical plant contaminated with dioxin. Lancet, 338, 959-964 |
| 38) |
Flesch-Janys, D., Berger, J., Gurn, P., Manz, A., Nagel, S., Waltsgott, H., Dwyer, J.H. (1995) Exposure to polychlorinated dioxins and furans (PCDD/F) and mortality in a cohort of workers from a herbicide-producing plant in Hamburg, Federal Republic of Germany. Am. J. Epidemiol., 142, 1165-1175 |
| 39) |
Kogevinas, M., Kauppinen, T., Winkelmann, R., Becher, H., Bertazzi, P.A., de Mesquita, H.B.B., Coggon, D., Green, L., Johnson, E., Littorin, M., Lynge, E., Marlow, D.A., Mathews, J.D., Neuberger, M., Benn, T., Pannett, B., Pearce, N., Saracci, R. (1995) Soft tissue sarcoma and non-hodgkin's lymphoma in workers exposed to phenoxy herbicides, chlorophenols, and dioxins : Two nested case-control studies. Epidemiology, 6, 396-402 |
| 40) |
Kogevinas, M., Becher, H., Benn, T., Bertazzi, P.A., Boffetta, P., de Mesquita, H.B.B., Coggon, D., Colin, D., Flesch-Janys, D., Fingerhut, M., Green, L., Kauppinen, T., Littorin, M., Lynge, E., Mathews, J.D., Neuberger, M., Pearce, N., Saracci, R. (1997) Cancer mortality in workers exposed to phenoxy herbicides, chlorophenols, and dioxin. An expanded and updated international cohort study. Am. J. Epidemiol., 145, 1061-1075 |
| 41) |
Becher, H., Flesch-Janys, D., Kauppinen, T., Kogevinas, M., Steindorf, K., Manz, A., Wahrendorf, J. (1996) Cancer mortality in German male workers exposed to phenoxy herbicides and dioxins. Cancer Causes. Control, 7, 312-321 |
| 42) |
Hooiveld, M., Heederik, D.J.J., Kogevinas, M., Boffetta, P., Needham, L.L., Patterson, D.G.Jr., de Mesquita, H.B.B. (1998) Second follow-up of a Dutch cohort occupationally exposed to phenoxy herbicides, chlorophenols, and contaminants. Am. J. Epidemiol., 147, 891-901 |
| 43) |
Fingerhut, M.A., Halperin, W.E., Marlow, D.A., Piacitelli,
L.A., Honchar, P.A., Sweeney, M.H., Greife, A.L., Dill, P.A., Steenland, K., Suruda, A.J. (1991) Cancer mortality in workers exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin. New. Engl. J. Med., 324, 212-21 |
| 44) |
Saracci, R., Kogevinas, M., Bertazzi, P.-A., de Mesquita, B.H.B., Coggon, D., Green, L.M., Kauppinen, T., L'Abbe, K.A., Littorin, M., Lynge, E., Mathews, J.D., Neuberger, M., Osman, J., Pearce, N., Winkelmann, R. (1991) Cancer mortality in workers exposed to chlorophenoxy herbicides and chlorophenols. Lancet, 338, 1027-1032 |
| 45) |
Reggiani, G. (1978) Medical problems raised by the TCDD contamination in Seveso, Italy. Arch. Toxicol., 40, 161-188 |
| 46) |
Reggiani, G. (1980) Acute human exposure to TCDD in Seveso, Itary. J. Toxicol. Environ. Health, 6, 27-43 |
| 47) |
Caramaschi, F., Corno, G.D., Favaretti, C., Giambelluca, S.E., Montesarchio, E., Fara, G.M. (1981) Chloracne following environmental contamination by TCDD in Seveso, Italy. Int. J. Epidemiol., 10, 135-143 |
| 48) |
Mocarelli, P., Pocchiari, F., Nelson, N. (1988) Preliminary report : 2,3,7,8-tetrachlorodibenzo-p-dioxin exposure to humans - Seveso, Italy. Morbid. Mortal. Week. Rep., 37, 733-736 |
| 49) |
Mocarelli, P., Needham, L.L., Marocchi, A., Patterson, D.G.Jr., Brambilla, P., Gerthoux, P.M., Meazza, L., Carreri, V. (1991) Serum concentrations of 2,3,7,8-tetrachlorodibenzo-p-dioxin and test results from selected residents of Seveso, Italy. J. Toxicol. Environ. Health, 32, 357-366 |
| 50) |
Assennato, G., Cervino, D., Emmett, E.A., Longo, G., Merlo, F. (1989) Follow-up of subjects who developed chloracne following TCDD exposure at Seveso. Am. J. Industr. Med., 16, 119-125 |
| 51) |
Bertazzi, P.A., Zocchetti, C., Pesatori, A.C., Guercilena, S., Sanarico, M., Radice, L. (1989) Ten-year mortality study of the population involved in the Seveso incident in 1976. Am. J. Epidemiol., 129, 1187-1200 |
| 52) |
Bertazzi, P.A., Bernucci, I., Brambilla, G., Consonni, D., Pesatori, A.C. (1998) The Seveso studies on early and long-term effects of dioxin exposure : A review. Environ. Health Perspect., 106, 625-633 |
| 53) |
Mocarelli, P., Brambilla, P., Gerthoux, P.M., Patterson, D.G.Jr, Needham, L.L. (1996) Change in sex ratio with exposure to dioxin. Lancet, 348, 409 |
| 54) |
Henriksen, G.L., Ketchum, N.S., Michalek, J.E., Swaby, J.A. (1997) Serum dioxin and diabetes mellitus in veterans of Operation Ranch Hand. Epidemiology, 8, 252-258 |
| 55) |
Centers for Disease Control. (1987) Postservice mortality among Vietnam veterans. J. Am. Med. Assoc., 257, 790-795 |
| 56) |
Centers for Disease Control. (1988a) Health status of Vietnam veterans. I. Psychosocial characteristics. J. Am. Med. Assoc., 259, 2701-2707 |
| 57) |
Centers for Disease Control. (1988b) Health status of Vietnam veterans. II. Physical health. J. Am. Med. Assoc., 259, 2708-2714 |
| 58) |
Masuda, Y. (1996) Causal agents of yusho. In: Kuratsune,
M., Yoshimura, H., Hori, Y., Okumura, M., & Masuda, Y., eds, Yusho : A Human Disaster Caused by PCBs and Related Compounds, Fukuoka, Kyusyu University Press, pp.49-80 |
| 59) |
Ikeda, M., Yoshimura, T. (1996) Survival of patients. In: Kuratsune, M., Yoshimura, H., Hori, Y., Okumura, M., & Masuda, Y., eds, Yusho : A Human Disaster Caused by PCBs and Related Compounds, Fukuoka, Kyusyu University Press, pp.317-323 |
| 60) |
Kociba, R. J., Keyes, D. G., Beyer, J. E., Carreon, R. M., Wade, C. E., Dittenber D. A., Kalnins, R. P., Frauson, L. E., Park, C. N., Barnard, S. D., Hummel, R. A. and Humiston C. G. (1978) Results of two-year chronic toxicity and oncogenicity study of 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats. Toxicol. Appl. Pharmacol., 46, 279-303 |
| 61) |
NTP (National Toxicology Program) (1982) Carcinogenicity bioassay of 2,3,7,8-tetrachlorodibenzo-p-dioxin in Osborne-Mendel rats and B6C3F1 mice (gavage study).NTP Tech.Rept.Ser.No.209. Reserch Triangle Park, NC. |
| 62) |
Ohsako, S., Miyabara, Y., Sakaue, M., Kurokawa, S., Nishimura, N. Aoki, Y., Tohyama, C., Sone, H., Ishizuka, M., Jana, N. R., Sarkar, S., Yonemoto, J. (1999) Effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) on the development of male reproductive organs in the rats. Organohalogen Compounds (in press) |
| 63) |
Burleson, G.R., Lebrec, H., Yang, Y.G., Ibanes, J.D., Pennington, K.N., Birnbaum, L.S. (1996) Effect of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD) on influenza virus host resistance in mice. Fundam. Appl. Toxicol., 29, 40-47 |
| 64) |
Narasimhan, T., Craig, A., Arellano, L., Harper, N., Howie, L., Menache, M., Birnbaum, L., Safe, S. (1994) Relative sensitivities of 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced Cyp1a-1 and Cyp1a-2 gene expression and immunotoxicity in female B6C3F1 mice. Fundam. Appl. Toxicol., 23, 598-607 |
| 65) |
Gehrs, B.C., Riddle, M.M., Williams, W.C., Smialowicz, R.J. (1997) Alterations in the developing immune system of the F344 rat after perinatal exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin.II.Effects on the pup and adult. Toxicology, 122, 229-240 |
| 66) |
Badesha, J.S., Maliji, G., Flaks, B. (1995) Immunotoxic effects of exposure of rats to xenobiotics via maternal lactation. Part I 2,3,7,8-tetrachlorodibenzo-p-dioxin. Int. J. Path., 76, 425-439 |
| 67) |
Courtney, K. D., Moore, J. A. (1971) Teratology studies with 2, 4, 5-trichlorophenoxyacetic acid and 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin. Toxicol. Appl. Pharmacol., 20, 396-403 |
| 68) |
Couture, L. A., Harris, M. W., Birnbaum, L. S. (1990) Characterization of the peak period of sensitivity for the induction of hydronephrosis in C57BL/6N mice following exposure to 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin. Fundam. Appl. Toxicol., 15, 142-150 |
| 69) |
Murray, F. J., Smith, F. A., Nitschke, K. D., Humiston, C. G., Kociba, R. J., Schwetz, B. A. (1979) Three-generation reproduction study of rats given 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD) in the diet. Toxicol. Appl. Pharmacol., 50, 241-252 |
| 70) |
Gray, L. E., Jr., Wolf, C., Mann, P., Ostby, J. S. (1997b) In utero exposure to low doses of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin alters reproductive development of female Long Evans hooded rat offspring. Toxicol. Appl. Pharmacol., 146, 237-244 |
| 71) |
Faqi, A. S., Dalsenter, P. R., Merker, H. J., Chahoud, I. (1998). Reproductive toxicity and tissue concentrations of low doses of 2, 3, 7, 8-tetrachlorodibenzeno-p-dioxin in male offspring rats exposed throughout pregnancy and lactation. Toxicol. Appl. Pharmacol., 150, 383-392 |
| 72) |
Mably, T. A., Bjerke, D.L., Moore R.W., Gendron-Fitzpatrick, A., Peterson, R. E., (1992c) In utero and lactational exposure of male rats to 2,3,7,8-tetrachlorodibenzo-p-dioxin. 3. Effects on spermatogenesis and reproductive Capability. Toxicol. Appl. Pharmacol., 114, 118-126 |
| 73) |
Gray, L. E., Jr., Ostby, J. S., Kelce, W. R. (1997a) A dose-response analysis of the reproductive effects of a single gestational dose of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin in male Long Evans hooded rat offspring. Toxicol. Appl. Pharmacol., 146, 11-20 |
| 74) |
Rier, S. E., Martin, D. C., Bowman, R. E., Dmowski, W. P., Becker, J. L. (1993) Endometriosis in rhesus monkeys (Macaca mulatta) following chronic exposure to 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin. Fundam. Appl. Toxicol., 21, 433-441 |
| 75) |
厚生省:平成9年度厚生科学研究事業 子宮内膜症等に及ぼすダイオキシンの評価に関する研究 |
| 76) |
Schantz, S. L., Bowman, R. E. (1989) Learning in monkeys exposed perinatally to 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD). Neurotoxicol. Teratol., 11, 13-19 |
| 77) |
Van den Heuvel, J.P., Clark, G.C., Kohn, M.C.,
Tritscher, A.M., Greenlee, W.F., Lucier, G.W., Bell, D.A. (1994) Dioxin-responsivegenes: examination of dose-response relationships using quantitative reverse transcriptase-polymerase chain reaction. Cancer Res., 54, 62-68 |
| 78) |
DeVito, M.J., Ma, X., Babish, J.G., Menache, M., Birnbaum, L.S. (1994) Dose-response relationships in mice following subchronic exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin: CYP1A1, CYP1A2, estrogen receptor, and protein tyrosine phosphorylation. Toxicol. Appl. Pharmacol., 124, 82-90 |
| 79) |
Neubert, R., Jacob-Muller, U., Stahlmann, R., Helge, H., Neubert, D. (1990) Polyhalogenated dibenzo-p-dioxins and dibenzofurans and the immune system. 1. Effects on peripheral lymphocyte subpopulations of a non-human primate (Callithrix jacchus) after treatment with 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Arch. Toxicol., 64, 345-359 |
| 80) |
Neubert, R., Golor, G., Stahlmann, R., Helge, H., Neubert, D. (1992) Polyhalogenated dibenzo-p-dioxins and dibenzofurans and the immune system. 4. Effects of multiple-dose treatment with 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) on peripheral lymphocyte subpopulations of a non-human primate (Callithrix jacchus). Arch. Toxicol., 66, 250-259 |
| 81) |
Schwetz, B.A., Norris, J. M., Sparschu, G. L., Rowe, U. K., Gehring, P. J., Emerson, J. L., Gerbig, C.G. (1973) Toxicology of chlorinated
dibenzo-p-dioxins. Environ. Health Perspect., 5, 87-99 |
| 82) |
Environmental Protection Agency (EPA) (1985) Health Assessment Document for Polychlorinated Dibenzo p-dioxin. (U.S.) EPA, Cincinnati, OH. PB86-122546 |
| 83) |
Hebert,C.D., Birnbaum L.S.(1987) The influence of aging on intestinal absorption of TCDD in rats. Toxicol. Lett, 37, 47-55 |
| 84) |
Lucier,G.W., Rumbaugh,R.C., McCoy,Z., Hass,R., Harvan,D., Albro,P. (1986) Ingestion of soil contaminated with 2,3,7,8-tetrachlorodibenzo-p-dioxin salters hepatic enzyme activities in rats. Fundam. Appl. Toxicol, 6,364-371 |
| 85) |
Shu,H., Paustenbach,D., Murray,F.J., Marple,L., Brunck,B., Dei Rossi,D.,Teitelbaum,P.(1988) Bioavailability of soil-bound TCDD: Oral bioavailability in the rat. Fund. Appl. Toxicol, 10, 648-654 |
| 86) |
Umbreit,T.H., Hesse,E.J., Gallo,M.A. (1986) Bioavailability of dioxin in soil from a 2,4,5-T manufactureing site. Science, 232, 497-499 |
| 87) |
Geyer,H., Scheunert,I., Korte,F. (1986) Bioconcentration potential of organic environmental chemicals in humans. Regul. Toxicol. Pharmaco、6, 313-347 |
| 88) |
Birnbaum L.S. , Couture,L.A. (1988) Disposition of octachlorodibenzo-p- dioxin (OCDD) in male rats. Toxicol. Appl. Pharmacol, 93, 22-30 |
| 89) |
Patterson, D. G. Jr, Needham, L. L., Pirkle,J.L., Roberts,D.W., Bagby,J., Garrett,W.A., Andrews,J.S.Jr., Falk,H., Bernert,J.T., Sampson,E.J. et al (1988) Correlation between serum and adipose tissue levels of 2,3,7,8-tetrachlorodibenzo-p-dioxin in 50 persons from Missouri.Arch.Environ. Contam. Toxicol, 17, 139-143 |
| 90) |
Vinopal,J.H., Casida,J.E. (1973) Metabolic stability of 2,3,7,8- tetrachlorodibenzo-p-dioxin in mammalian liver microsomal systems and living mice. Arch. Environ. Contam. Toxicol, 1, 122-132 |
| 91) |
Nelson,J.O., Menzer,R.E., Kearney,P.C., Pimmer,J.R. (1977) 2,3,7,8- tetrachlorodibenzo-p-dioxin: in vitro binding to rat liver microsomes. Bull. Environ. Contam. Toxicol, 18, 9-13 |
| 92) |
Olson,J.R., Gasiewicz,T.A., Neal,R.A. (1980) Tissue distribution, excretion, and metabolism of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in the golden Syrian hamster. Toxicol. Appl. Pharmacol, 56, 78-85 |
| 93) |
Poiger,H., Buser,H.R., Weber,H., Zweifel,U., Schlatter,C. (1982) Structure elucidation of mammalian TCDD-metabolites. Experientia, 38, 484-486 |
| 94) |
Olson J.R. (1983) Metabolism and disposition of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in guinea-pigs. Toxicol. Appl. Pharmacol, 85, 263-273 |
| 95) |
Van den Berg,M., De Jongh,J., Poiger,H., Olson,J.R. (1994) The toxicokinetics and metabolism of polychlorinated dibenzo-p-dioxins (PCDDs) and dibenzofurans (PCDFs) and their relevance for toxicity. Crit. Reviews Toxicol., 24, 1-74 |
| 96) |
Poland,A., Glover,E.(1979) An estimate of the maximum in vivo covalent binding of 2,3,7,8-tetrachlorodibenzo-p-dioxin to rat liver protein, ribosomal RNA, and DNA. Cancer Res., 39, 3341-3344 |
| 97) |
Piper,W.N., Rose,J.Q., Gehring,P.J.(1973) Excretion and tissue distrubution of 2,3,7,8-tetrachlorodibenzo-p-dioxin in the rat. Environ. Health Perspect, 5, 241-244 |
| 98) |
Schecter,A., Startin,J., Wright,C., Papke,O., Ball,M., Lis, A. (1996) Concentrations of polychlorinated dibenzo-p-dioxins and dibenzofurans in human placental and fetal tissues from the U.S.and in placentas from Yu-cheng exposed mothers. Chemoshere, 32, 551-557 |
| 99) |
Furst P., Kruger,C., Meemken,H.A., Groebel,W. (1989) PCDD and PCDF levels in human milk-dependence on the period of lactation. Chemoshere、18, 439-444 |
| 100) |
Okey, A. B., Riddick, D. S., Harper, P. A. (1994) The Ah receptor: mediator of the toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds. Toxicol. Lett., 70, 1-22 |
| 101) |
Fernandez-Salguero, P. M., Hilbert, D.M., Rudikoff, S., Ward, J. M. , Gonzales, F. J. (1996) Aryl-hydrocarbon receptor deficient mice are resistant to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) - induced toxicity. Toxicol. Appl. Pharmacol., 140, 173-179 |