植物由来の遺伝子組換え食品の安全性について
世界保健機関本部
スイス、ジュネーブ
2000年 5月29日〜6月2日
| 世界保健機関 このドキュメントは、世界保健機関(WHO)の正式な出版物ではありません。 すべての権利はWHOによって保護されています。販売や商業上の目的以外であれば、このドキュメントの内容の全部又は一部を論評、要約、複写及び翻訳することは自由です。このドキュメントで示されている意見は、それらの執筆者の責任において示されているものです。 |
仮訳
1. はじめに
2. 背景
3. 検討範囲
4. 遺伝子組換え食品の栄養学的評価と食品安全性評価へのアプローチ
- 4.1 はじめに
- 4.2 安全性評価
- 4.3 非意図的な影響
- 5.1 はじめに
- 5.3 栄養及び安全性評価の方法
- 6.1 はじめに
- 6.3 アレルギー誘発性
8. 提言
9. 参考資料
1.はじめに
バイオテクノロジー応用食品に関するFAO/WHO合同専門家会議が、2000年5月29日から6月2日までジュネーブの世界保健機関(WHO)本部で開催された。ディスカッションペーパーの筆者を含め、総勢27名の専門家がこの専門家会議に参加した。参加者全員の名簿は付属資料Iのとおりである。
WHOの栄養、発育及び健康環境クラスター長であるシン・プーナム・ケトラパル女史が、WHOとFAOを代表して専門家会議を開会した。シン女史は、挨拶の中で、バイオテクノロジーは農業と食品産業の発展、維持において大変有用な手法となるであろうと述べた。バイオテクノロジーは、それが食品生産の他の技術と適切に統合されたとき、21世紀における人口の増加と都市化の要求に応えうる重要な力になると述べた。 また、シン女史は、バイオテクノロジーにより得られた食品の安全性及び栄養的側面について、一般社会が抱いている不安に注目した。シン女史は、リスクアセスメントの方法論について継続的な検討が必要であることを強調し、この専門家会議が、この件に関する有用な指針をFAOとWHOの加盟国に対して提供することを期待した。
専門家会議は、ハリー・カイパー博士を議長に、マリリア・レジーニ・ヌッティ博士を副議長に選出した。また、ジェイムス・マリアンスキー博士がラポーターに、ジェニファー・トムソン博士が副ラポーターに選出された。専門家会議は、プログラムのそれぞれのセクション毎にこの専門家会議の報告書のドラフティングを助ける共同ラポーターを任命することを決めた。ロナルド・ウォーカー博士はセクションA(遺伝子組換え食品の栄養学的評価と食品安全性評価へのアプローチ)、ケイス・デゥニィ博士はセクションB(栄養に関連する事項)、そしてイアン・ムンロ博士はセクションC(食品の安全性に関する個別の問題)の共同ラポーターに任命された。
2.背景
かつてFAO/WHOやOECDにより行われた専門家会議では、実質的同等性はヒトの消費に使用される遺伝子組換え植物から得られる食品及び食品成分の安全性評価における重要な要素であると提言された(OECD, 1993; FAO, 1996)。この概念は、科学に基づいたアプローチであり、遺伝子組換え食品は既存の適切な対照物と比較される。このアプローチは、食品の絶対的な安全性をめざすというものではない。どんな食品にとってもそれはとうてい到達できないゴールである。むしろ、このアプローチのゴールは、遺伝子組換え食品及び遺伝子を組換えた結果食品に導入されたあらゆる物質が、比較対照である伝統的な食品と同程度に安全であることを保証することである。
いくつかの国において、実質的同等性の概念が、遺伝子組換え植物から得られる食品及び食品成分の安全性評価の重要な要素として使用されている。それらの国々は、このアプローチが科学的に健全かつ実用的であることを知っている。しかしながら、この概念の適用について世界的に統一したコンセンサスは得られていない。その結果、このアプローチが安全性のための十分な基礎を提供しないとの批判が生じ、各国政府及び各国際機関は、それに代わる方法を検討するよう求められている。
FAO及びWHOは、1996年のFAO/WHO合同専門家会議(FAO,1996)以降これまでに得られた実績を検討し、新たな科学的知見が、遺伝子組換え植物から得られた食品及び食品成分の安全性を評価するために用いられている現在のアプローチを代える必要性を示唆しているかどうかを検討するために、この専門家会議を開催した。また、この専門家会議は、最近の科学的な報告に照らし、実質的同等性の概念の科学的基礎、その概念の適用及び限界について検討する機会を提供した。
3.検討範囲
この会議は、組換えDNA技術を用いて遺伝子を組換えた植物から得られた食品及び食品成分の安全性及び栄養上の問題を検討するために召集された。そうはいうものの、この報告書に記載された実質的同等性(SE)の概念と原則は、他の技術によって遺伝子を組換えた植物又はその植物からつくられた食品及び食品成分にも適用できる。
この報告書では、“遺伝子組換え食品/植物”という用語は組換えDNA技術を用いて改変(改良)された植物又は当該植物から得られた食品及び食品成分という意味で用いられている。
特に、この専門家会議は次の事項について検討を要請された。
- ・ 各国政府、FAO、WHO、他の国際的機関や関連する国際的フォーラムによってなされた成果を考慮し、利用可能な科学的データを基盤としたバイオテクノロジー応用食品の安全性と栄養上の特徴に関する科学的助言を、FAO, WHO及びその加盟国に対して与えること。
- ・ より一層高まる社会の関心と当該食品の試験で得られた実績を考慮しながら、バイオテクノロジー応用食品の安全性と栄養面の評価に関する現在の方法を見直すこと。
- ・ バイオテクノロジー応用食品の安全性及び栄養学的評価のために、今後必要となる研究やその優先順位について提言すること。
1999年6-7月の第23回総会により創設されたコーデックスバイオテクノロジー応用食品特別部会の第一回会議が、2000年3月に日本の千葉にて開催された。特別部会は、FAOとWHOがこの専門家会議を召集することを歓迎し、あわせてこの専門家会議に対して、次の質問事項について科学的知見をまとめるよう求めた。
- ・ どのような包括的な科学的原則が、安全性と栄養性の評価において適用されるべきか。
- ・ 安全性及び栄養評価における実質的同等性の概念の役割と限界は何か。また、安全性及び栄養評価に利用できる他の方法があるか。
- ・ 長期的健康影響の可能性や意図しない/予期しない悪影響をモニターし評価するには、どのような科学的方法を用いることができるか。
- ・ アレルギー誘発性の評価には、どのような科学的方法を用いることができるか。
- ・ 植物や微生物に使用される抗生物質耐性マーカー遺伝子によって生ずるリスクの可能性を評価するためには、どのような科学的方法を用いることができるか。
遺伝子組換え食品/植物の環境放出に関する環境安全性の問題は、定められた検討事項の範囲外であるため、この専門家会議では検討しなかった。同様の理由により、社会経済的事項やリスクマネージメント、社会的受容といった科学以外の側面についても検討しなかった。
4.遺伝子組換え食品の栄養学的評価と食品安全性評価へのアプローチ
4.1 はじめに
伝統的な毒性試験を実施することにより食品全体(丸ごとの食品)の安全性に関する重要な情報を得ることは難しいということが長年認識されている(OECD 1996年)。従来の毒性試験に限界があるということが特に明らかにされたのは、動物を用いた投与試験を放射性食品の安全性を評価するのに用いた時である。
動物試験は、殺虫剤、薬品、工業用化学物質及び食品添加物などの多くの化合物の安全性評価における主要な要素である。多くの場合、動物試験に供される物質は、その特性が良く知られており、純度が明確で、特定の栄養上の価値がなく、ヒトへの曝露も一般的に低い。したがって、こうした物質の場合には、ヒトの健康に重大な悪影響を与える可能性を明らかにするために、ヒトへの曝露量をはるかに超えた量の化合物を動物に投与することが比較的簡単である。
このように、化学物質では、たいていの場合、悪影響が観察されない曝露量を定め、それに適切な安全係数を乗じて安全の上限値を定めることが可能である。
一方、食品は、その組成及び栄養価が広範多岐にわたる様々な化合物の複合体である。食品は容積が大きくすぐに満腹になってしまうことから、動物に食品を給餌する場合には、たいていヒトの食事中に存在すると思われる量のほんの数倍程度の量しか投与することができない。さらに、ある食品について動物試験を実施する際、その食品自体に直接関係のない悪影響が生ずることを避けるために、食事全体の栄養価とバランスを考慮することが重要となる。それゆえ、あらゆる潜在的な悪影響を検知し、それと食品の個々の特徴とをきちんと関連付けることはきわめて難しいものとなる。また、これとは別に、動物試験
の必要性を判断するにあたり検討すべきことは、重要な情報を得られそうにない研究のために実験動物を用いるのが妥当であるかどうかという点である。
実際に、今日消費される食品のほとんどは、毒性試験の対象とはなっていない。それらは一般に、食べて安全なものとして受け入れられているものである。
新しい食品の安全性を評価する方法を作成するにあたり、安全な食品とはどういうものかという基準を設けることが重要であった。1991年にOECDは、予測した使用条件の下でその食品を消費したときにどんな害ももたらさない合理的な確証がある場合には、その食品は安全であると考えられるとした。
(丸ごとの)食品に対して伝統的な毒性試験とリスクアセスメントの手続きを適用することが難しいということは、遺伝子組換え食品の安全性評価にはそれに代わる別のアプローチが必要であるということを意味した。こうしたことが、実質的同等性の概念をつくるきっかけとなった。
このアプローチは、安全性評価の最終目的が食品の絶対的な安全を求めることではなく、比較対照となる伝統的な食品が存在する場合に、遺伝子組換え食品がその比較対照である食品と同程度に安全であるかどうかを検討することである。
専門家会議は、丸ごとの食品に対して伝統的な毒性試験を適用することに関して、すでに実用上難しい点があることが明らかであり、遺伝子組み換え食品の安全性評価のテクニックとして、そうした毒性試験を標準的に用いることができないということに同意した。また、専門家会議は、動物福祉の観点から、意味のある情報を得ることができない場合に毒性試験を用いることは正当化され得ないであろうと認めた。さらに、専門家会議は、実質的同等性の概念は、安全性評価のテクニックを見直し、かつ動物モデルを別のモデルへと置き換えることによって毒性試験における動物の利用を軽減するアプローチのひとつのよい例であるとした。
実質的同等性の概念は、遺伝子組換え食品の安全性を評価するための実用的なアプローチとしてつくられた。専門家会議は、実質的同等性(Substantial Equivalence)は安全性評価プロセスにおける重要な1ステップとしてみなされるべきであることに同意した。この概念を適用すること自体は安全性評価ではない。つまり、危害の特性を示すのではなく、むしろ既存の食品と比較する遺伝子組換え食品の安全性評価の枠組みを作るのに用いられるものである。安全性評価の焦点となる意図的及び非意図的な差異を明らかにするための出発点として、遺伝子組換え生物(植物、微生物あるいは動物)、そして/または遺伝子組換え生物から得られた食品は、最も類似した既存の対照物と比較される。比較に用いられるデータは、適切な方法を用いて得られるべきであり、妥当な統計学的技法を利用して分析されるべきである。こうした比較のアプローチにおいては、農学、遺伝学及び化学的性質を考慮すべきであり、それらすべてが検討される場合にのみ、客観的な安全性評価が実施可能となる。さらにどのような、またどの程度の追加試験が必要なのかは、その差異の性質及びその差異が十分に分析されているかどうかに左右される。試験は優良試験所規範(Good Laboratory Practice)に従って実施されるべきである。
4.2 安全性評価
4.2.1 基本的原則
いくつかの国際的機関がすでに新規食品の安全性評価に関連した事項について検討しており、これまで遺伝子組換え植物・微生物について取り組んできた(WHO, 1991; OECD, 1993; WHO, 1995; FAO, 1996; ILSI, 1996; EC委員会,1997)。一般的に、そうした食品の安全性評価は、包括的、段階的に、かつケースバイケースのアプローチが必要である。また、いくつかの政府機関では、それぞれのケースに応じて必要とされる試験の範囲を決定するのを助ける判断樹を作っている(SCF, 1997; UK ACNFP, 1995)。このアプローチは、適切な安全性評価を行うに当たり役に立つものである。
遺伝子組換え食品の安全性評価は、遺伝子組換え食品と対照となる伝統的な食品とを比較することにより行われる。それは、一連の質問事項で構成される段階的なプロセスに従う。安全性評価において考慮される要因は次の事項を含む。
・ 同定(特性を明らかにすること);
・ 起源;
・ 成分組成;
・ 加工/調理処理が及ぼす影響;
・ 遺伝子の組換え方法;
・ 組換えDNA(例えば、挿入遺伝子の安定性、遺伝子の伝播の可能性);
・ 新たに導入されたDNAが発現させる蛋白質;
- ・ 機能に関する影響;
・ 毒性影響;
・ アレルギー誘発性;
・ 遺伝子が発現することによる二次的な影響、宿主DNAの分離、代謝経路、(主要栄養素、微量栄養素、抗栄養素、内因性毒素、アレルゲン及び生理活性物質など);
・ 遺伝子組換え食品の導入に伴う摂取量及び食事への影響の可能性
上述の要素は、特に遺伝子組換え植物から得られた食品の評価に直接関係のあるものである。遺伝子組換え動物や微生物から得られた食品の安全性評価の際には、他の要素についてもケースバイケースで考慮する必要があるだろう。
4.2.2 動物試験の必要性
遺伝子組換え食品の特性から判断して、入手可能なデータではその食品の安全性を評価するのに不十分であることが判明した場合には、動物試験が必要となるであろう。これは特にその遺伝子組換え食品が食事内容に重要な影響を与える可能性がある場合、新たな遺伝子産物の食経験がない場合、又は遺伝子組換えによりいくつかの代謝経路に影響を及ぼす場合に必要となる。
ひとつあるいは複数の新たな遺伝子およびその遺伝子産物の存在により、遺伝子組換え食品が既存のものと異なる場合には、その遺伝子産物を単離して、食品添加物の毒性試験と同様に試験することが可能である。しかし、この場合、試験に供される遺伝子産物は、遺伝子組換え食品中に産生されたものと生化学的、機能的に同じであることを確認することが必須となる。これにより、遺伝子組換え植物から得られた食品を直接給餌したときと比較して毒性試験の感受性を増大させることが可能となり、また、丸ごとの食品の毒性試験を行ったときに生じ得る人工的な影響(artefact)が避けられる。ただしこの方法は、その詳細な分析において、予想外の顕著な変化が見られない場合にのみ適用できるものである。そうでない場合には、丸ごとの食品の試験が必要となるかもしれない。丸ごとの食品について動物試験を実施する場合には、その食品は一般的にヒトが消費する形態で行われるべきである。動物試験の種類は、ケースバイケースで検討される必要がある。遺伝子の改変により、栄養素の量や生物学的利用能が直接的または間接的に影響を受けている場合には、毒性影響の可能性を調査することに加え、動物試験が要求されるであろう。
食品を長期間消費した場合の安全性を評価するために毒性試験が必要となった場合には、少なくとも90日間の亜急性毒性試験を実施し、食品を反復摂取した場合の安全性を実証することが最低限必要となる。この場合、まず先に短期間の予備試験を行い、投与する食品が試験に用いる動物種の嗜好にあっており、かつ、試験体(供試食品)の混入量が適切であることを確認することが必要である。例えば、対照食品を含むコントロール群の食餌中に含まれている自然毒(一般的な食品中に存在しているが、その含有量が一般に安全とみなされている毒素)の量が、何らかの健康影響を生じさせるような量ではないことを確認する必要がある。動物試験に用いる最高投与量は、栄養バランスを崩さないように定めるとともに、最低用量は、ヒトにおける当該食品の消費量と比較できるように設定しなければならない。
追加の毒性試験が必要かどうかは、90日間毒性試験や他の試験の結果を考慮して、ケースバイケースで検討されるべきである。例えば、90日間毒性試験中に、細胞の増殖能力に変化が見られる場合には、長期毒性試験が必要となるかもしれない。
伝統的な毒性学的試験は、遺伝子組換え食品を含め、丸ごとの食品を評価するには限界がある。前述した全食餌中に混合できる(丸ごとの)食品の最大量をもとに、悪影響の有無及びその性質、さらにヒトへの推定曝露量を考慮して、安全性のある限界域が推測されるであろう。不適切な試験を避けるためには、栄養上適切な動物用の食餌が必要である点を考慮して実験デザインを組まなければならない。
早期影響のバイオマーカーを用いれば、食品の毒性試験の診断上の意義や感度が増すであろうといわれているが(Schilter ら。1996)、このアプローチを使用する際には、順応影響と毒性影響を混同しないことが必要である。
4.3 非意図的な影響
塩基配列が同定されたDNAを挿入し、宿主となる生物に特定の標的とする形質(意図的な影響)を与える課程において、理論的には、別の形質が付加されるかまたは既存の形質が消失する(非意図的な影響)可能性がある。遺伝子組換え食品の評価には、そのような非意図的な影響を検出する方法、及びその生物学的重要性と食品の安全性に関する影響を評価する手続きを含んでいる。
非意図的な影響が起こるのは、ランダムに遺伝子を挿入することにより、既存の遺伝子が破壊されたり、蛋白質の発現が変化したり、新たな代謝物が生成されるといった理由によるものであろう。酵素が高レベルで発現することにより、例えば、ある一連の代謝経路が改変され、代謝パターンが変化するなどの二次的生化学的影響を生ずるであろう。
非意図的な影響が生ずる可能性は、組換えDNA技術の利用に特異的なものではない。むしろ、従来の育種でも生じうる遺伝的かつ一般的な現象である。この問題に対処するために採用されたアプローチのひとつに、植物の品種改良の初期段階で、異常で望ましくない表現型及び農学的特徴を持った個体を選抜/排除するというアプローチがある。連続的な戻し交配を行うことも、非意図的な影響を排除するために通常用いられる手法である。
遺伝子改変によっておこる非意図的な影響は、2つのグループに分けられる:一つは意図的な影響と代謝との関連あるいは遺伝子の挿入位置に関する情報に基づく"予測可能な(predictable)"影響であり、もう一つは"予期しない(unexpected)"影響である。遺伝子改変の精度が従来の育種と比べて高まることにより、非意図的な影響が代謝経路に及ぼす影響を予見することがより容易になるであろう。
非意図的な影響を検知するのに用いられる比較対照物となるものは、理想的には、同一条件下において生育された同一遺伝子型の親系統に近いものであるべきである。しかし実際には、これは常時実行可能ではないので、その場合には、できるだけ近似している系統が選択されるべきである。自然界での変動の域についても、非意図的影響の統計学上の有意差を評価する際に考慮されるべきである。
非意図的な影響について統計的な有意性がみられた場合、その生物学的な意義について評価されるべきである。これには、その変化を誘導する機序に関する知見が助けとなるだろう。非意図的影響の生物学的及び安全上の重要性を評価する際には、遺伝子組換え植物に関するデータは、既存品種に関するデータ及び文献データと比較されるべきである。もしその差異が従来の食品作物中の天然種の変動の域を越えるようならば、さらなる評価が必要である。
非意図的な影響を評価するための現在のアプローチは、特定成分の分析(標的を定めたアプローチ)に基づいている。非意図的影響を検知する確率を増すには、プロファイリング技術が代替方法として考えられる(標的を定めないアプローチ)。プロファイリング技術は、たとえば遺伝子、蛋白質及び代謝等の各レベルで用いられており、標的を定めた化学分析よりも広範に非意図的影響を検知するのに役立つだろう。だが、まだ十分に開発や評価がなされておらず限界がある。
将来、植物の遺伝子改変は種間組換えを複数起こすなど、より複雑になるだろう。このような場合、プロファイリング技術により、既存種との差異が認められた場合、その差異が健康に及ぼしうる影響について検討されなければならない。
4.4 実質的同等性(SE)という概念の評価
専門家会議は、実質的同等性(SE)の概念が批判を引き起こしてきたことを認めた。この批判は、実質的に同等であると判断することが、安全性評価のスタート地点であるよりもむしろ最終地点であるといった、誤った認識に一部よっている。さらに、かつて議論されたSEについての3つの結論(すなわち、(1)実質的に同等である、(2)明らかな差異以外は実質的に同等である、及び(3)実質的に同等ではない。FAO、1996)も、SEに対する不支持を生じさせたのかもしれない。
SEという概念の現在における使用のされ方、及びSEに代わる手法を用いる可能性について検討した結果、この専門家会議は、SEの概念の適用は安全性評価の堅固な枠組み作りに貢献するという結論に至った。また、専門家会議は、すでに承認され市場に出された遺伝子組換え食品の安全性評価に用いられた手法に満足した。
安全性評価に係るこのSEの原則については、より正確に理解されるよう改善の余地があることが合意された。専門家会議は、SEについて伝達されるべき重要なメッセージとは、SEは安全な食品としての利用の歴史のある比較対照(既存の食品)と遺伝子組換え食品との類似性及び差異を明らかにし、その後の安全性評価の方法を方向付けるために用いられる概念であると結論づけた。
この専門家会議は、組成上の変化を検討するのみでは安全性を決定することはできないということを繰り返した。安全性は、あらゆる側面における比較の結果が整理された後にのみ判断される。
食品添加物や化学物質に用いられる標準的な安全性評価の原則(WHO, 1987)は丸ごとの食品には向いていないこと、また食品の由来が何であれ、(丸ごとの)食品のリスクを量的に評価できないことが再確認された。専門家会議は、既存の食品と比較して安全性を評価することが、遺伝子組換え食品の安全性を評価するための最適な手段であるということに同意した。
専門家会議は、遺伝子組換え食品の摂取による長期的な影響に関する事項について検討し、どんな食品であってもその長期的な影響はほとんど知られていないことに注目した。また多くの場合、一部の人々は食品由来の特定の健康影響に対して感受性が高いなど、個人による遺伝要因の差異が、食品の長期的健康影響の特定を困難にしている。
こうした状況を考慮し、専門家会議は、遺伝子組換え食品の市場流通前の安全性評価により、すでにそれら遺伝子組換え食品がその対照物(既存の食品)と同程度に安全であるということが保証されていることを踏まえ、遺伝子組換え食品に特異的な長期的影響の可能性はほとんどありえないであろうことを確認した。さらに、観察的疫学調査という手段では、既存の食品が持っている健康影響に対比して、遺伝子組換え食品に特有な健康影響を明らかにすることは困難であろうと考えられた。RCTs (randomised controlled trials)のような実験的調査は、もし適切に計画・実施されるのであれば、遺伝子組換え食品を含むあらゆる食品の中長期的影響を調査するのに利用できるであろう。そのような試験により、ヒトへの安全性に対する追加的証拠を得られるだろうが、実施するのは難しいだろう。この点に関して、人々が毎日摂取する食品及び食品成分の多様性を認識することもまた重要である。
以上の議論を踏まえ、専門家会議は、SEの概念を適切に適用する以外に、遺伝子組換え食品の安全性を確保するよい方法はまだ実存しないという見解に達した。しかし、安全性評価プロセスの一部については、遺伝子組換え技術の開発にあわせ改善され得るであろうと認めた。プロファイリング技術などの新しい手法によって、より詳細な比較分析が可能となるだろう。しかし、そうした手法が認められるには、それら手段についてさらに開発が進められる必要がある。
5.栄養に関連する事項
5.1 はじめに
ヒトに消費される食品の種類は何世紀も経て大きく変化し、食事中の栄養素のバランスも変わっている。伝統的な品種改良技術、突然変異または組換えDNA技術による植物育種が、栄養の質や機能を変えるために用いられている。30年前、伝統的な品種改良により脂肪酸の一種であるエルシン酸のないなたねを特定・選抜した結果、好ましい脂肪酸組成をもった油を産生するなたね「カノーラ」が開発された。今では、カノーラ油は世界中のほとんどの先進国において、ヒトの脂質の摂取に重要な位置を占めるようになった。さらに最近では、突然変異育種法を用いて伝統的な工業用高リノレイン油にかえて食用油をつくる組換え亜麻が作られた。新しい食品を作り出したり、機能を高めた食品が作られることにより、供給される食品の内容を変える可能性もある。組換えDNA技術の存在は、健康維持に役立つ食品に開発の機会を与える。組換えDNA技術の主な効果は、より早く確実に栄養組成を変えることができることである。
これまで栽培されている遺伝子改変植物は、農耕上の機能強化のために開発されたものであるが、栄養改変は国民の健康にさらに大きな影響を与える。現在市場には栄養を強化するために遺伝子を組換えた植物から得られた食品は出ていないが、組換えDNA技術を用いて栄養成分の量が変化した植物がいくつかある。後者の例として、スターチの含有量を増加したじゃがいもがあるが、これは、スターチの安定供給、効率的な加工、脂肪吸収の低下、舌触りの向上などの効果がある。
遺伝子改変植物から、健康の向上と食品機能の強化を目的とした食品が製造される例がいくつかある。そのひとつは、遺伝子改変によりベータカロテンを強化した米であり、もうひとつは、酒の醸造には好ましくない蛋白質であるグルテリンを減少させた米である。また別の例として、伝統的な突然変異技術や組換えDNA技術により脂肪酸の量を改変したなたね油がある。近年、飽和脂肪酸の量を減らし、オレイン酸の量を増やしたカノーラや大豆油が作られているが、これらは動脈硬化の原因のひとつである総コレステロールやLDLコレステロールを減らし、また同時に、油の機能を高める目的がある。この専門家会議では、特に開発途上国で生活する人々の間でビタミンA欠乏により起こっている夜盲症にターゲットをあてて開発された「ゴールデンライス」に関する最近の報告の詳細についてヒアリングを行った(Yeら。2000年)。これらの例は、栄養に関係のある状態や病気の発生を減らすために栄養成分を改変した食品の可能性を強調している。
5.2 予期していない効果:ある一つの栄養素に焦点をあてることにより他の変化が起こりうるケース
もっとも望ましい遺伝子タイプが選抜され、予測どおり発現する遺伝的な多様性を作るために、同種間または異種間の交配や突然変異に用いられる伝統的な植物の育種技術が計画されている。どんな植物育種の方法も、予期しない効果を生み出し得る。アンチセンス技術によりつくられた低グルテリンの遺伝子改変米では、酒の醸造に関係する米の保存蛋白に関して改善がみられているが、グルテリンの量を減らすことによりプロラミンの量が非意図的に増加した。プロラミンの量の変化は、酒の生産には影響を与えないが、その米がもし食品として用いられた場合には栄養上の質やアレルギーを起こす可能性に影響を与えるかもしれない。大豆や米に関する別の例として、リジンを増加した遺伝子組換え大豆では、予期しない効果として油の含有量が減少したものがあったり、遺伝子組換え米「ゴールデンライス」ではベータカロテンを増加させたことによりキサントフィルが蓄積するという予期しない効果がみられている。こうした予期しない効果が現れるのを防ぐ手段としては、特定の細胞においてしか働かないプロモーターを用いるという方法がある。
低グルテリン米の事例では、総蛋白質量やアミノ酸組成を分析するといった標準的な栄養分析によって、そのプロラミン量の変化を検知することはできない。それを検知する唯一の方法は、ドデシル硫酸ナトリウム(SDS)ゲル電気泳動法である。ベータカロテンを強化した遺伝子組換え米中に予期しない効果としてキサントフィルが蓄積しているという現象も、標準的な栄養分析では明らかにすることはできない。キサントフィルが変化していることは、高速液体クロマトグラフィー(HPLC)法により調べられた。このように、予期しない変化があるかどうかを調べるには栄養素に応じて適切な分析方法を用いなければならない。
組換えDNA技術を含めた植物育種による植物中の栄養素の改変は、少なくともつぎの二つの方法によって、他の栄養成分を大きく変化させる可能性がある。
その一つは、植物の構成成分を意図的に改変することにより植物の栄養素組成全体を変え、公衆の栄養状態を変えてしまうもの。続いて二つめは、予期しない栄養上の変化によって栄養組成が変わり、公衆の栄養状態を変えてしまうものである。遺伝子組換え植物の成分組成は、それぞれ個別には安全なものとして評価されるかもしれないが、栄養組成全体が変わってしまった場合には、その影響について明らかにされなければならない。個々の栄養素の変化は、植物の加工やヒトの栄養状態に影響を与えうることから、遺伝子組換え植物の評価に必要とされる栄養又は毒性に関する専門知識の統合を早急に押し進めることを提言する。すべてのタイプの植物育種法によりひきおこされる栄養素の変化が、健康に影響を与える可能性について、評価される必要がある。
植物の栄養成分を変えるために突然変異育種技術を用いた例には、亜麻油の成分を、業務用の高リノレイン酸油から脂肪酸組成をとうもろこし油の組成に近づけた高リノレイン酸油に変えたもの、また、オレイン酸を高め(80-90%)飽和脂肪酸及び不飽和多価脂肪酸を減らした遺伝子組換え大豆やカノーラなどがある。
遺伝子組換え植物の栄養組成全体が変わっているかどうか、遺伝子組換え植物から作られた食品が栄養摂取パターンを変えているかどうかを確かめることが重要となるであろう。重要栄養成分を変えた食品の場合には、公衆の栄養状態に与える影響を評価する前に、栄養摂取全体が変わっていないかどうか、どの程度変わっているかどうかを確かめるために、市場流通後のアセスメントが必要となる。
成分の変化が生物学的利用能にどの程度影響を与えているか、また、時間の経過や、加工保存によってどの程度安定して維持されているかを確かめることが重要である。例として、開発途上国における保存条件の下で、遺伝子組換え米中のカロテノイドがどの程度安定して残るかという疑問が挙げられた。
5.3 栄養及び安全性評価の方法
さらに追加的な安全性評価が求められる場合には、総蛋白質量、脂肪、灰分、素繊維質、微量栄養素といった食品成分を評価する際に用いられる伝統的な分析方法の他に、予期しない影響や栄養成分の変化、また、食餌や健康へ影響を与えるかもしれない生物学的利用能を明らかにするために別の分析も行う必要が出てくるであろう。
栄養素の量が大きく変化したり、他の栄養素や予期しない影響との相互作用といった可能性があることから、ある例では、動物を用いた投与試験を行い栄養組成や栄養素の生物学的利用能の変化により起こる現象を確かめる必要があるだろう。栄養素の変化が通常の幅(レンジ)に収まっているような栄養上の改変がおきている場合には、通常の幅(レンジ)に収まっていない変化がおきている場合よりもそれを確かめる必要性は少ないであろう。
遺伝子組換え食品は公衆の栄養状態を高める可能性をもっており、また、開発途上国及び先進国の人々に特定の機能を高めた食品を提供する可能性を持っている。大きな問題は、栄養バランスを失う可能性や、栄養素や他の成分の予期しない変化を起こす可能性があることにある。ある植物で生じた栄養素のレベルの変化は、食餌全体に影響を与えるかもしれない。そうしたケースでは、栄養素や生物学的利用能の変化をモニターし、消費者の栄養・健康状態に与えうる影響を評価することが重要となるであろう。しかし、消費者の栄養状態に与える影響を評価することは、遺伝子組換え植物の出現に特有なものではなく、食餌上の重要な変化一般にとって大切なことである。
6.食品の安全性に関する個別の問題
6.1 はじめに
この章では、遺伝子組換え食品の安全性に関して、しばしば持ち上がる個別の問題を扱う。これらには、遺伝子組換え植物から腸内細菌叢や哺乳類の細胞への遺伝子移行の可能性や、遺伝子組換え植物の選抜時の標識となる抗生物質耐性遺伝子の安全性、遺伝子組換え食品中に存在する新規遺伝子産物によって引き起こされるかもしれないアレルギー誘発性の評価などの問題も含まれる。以下の議論では、これらのトピックスについての既存の知見を評価し、健康へのリスクの可能性を評価できるような科学的アプローチを構築する。
6.2 遺伝子組換え植物からの遺伝子移行:メカニズムと食品の安全性への影響
以下の議論の背景として、全ての食品はDNAを含んでおり、しかも大量に摂取されていることをまず認識しなければならない。ヒトにおけるRNAとDNAの摂取量はまちまちだが、一般的には一日につき0.1〜1.0 gの範囲にある(Doerfler and Schubbert, 1997)。ヒトの食事で摂取される遺伝子組換え食品中に存在する新規DNAに対して懸念があるが、このDNA量は摂取されるDNA全量の25万分の1以下でしかないことを考慮しなければならない。このことと、DNAの消化性に鑑みれば、遺伝子組換え植物から哺乳類細胞への遺伝子伝播が起こる確率は極めて低い。しかしながら、遺伝子伝播の可能性と、それが起こった場合の影響を検討しておく必要がある。
通常の食餌環境下において、植物中のDNAが微生物や哺乳類細胞へ移行するには、以下の全ての事象が起こる必要がある:
- ・植物DNA中の関連した遺伝子は、おそらく線形フラグメントとして、放出されなければならない;
- ・ 遺伝子は、植物中や腸管内のヌクレアーゼ下でも生き残らなければならない;
- ・ 遺伝子は、食事中の他のDNAに打ち勝って(微生物や哺乳類細胞中へ)取り込まれなければならない;
- ・ 遺伝子を受け入れる細菌や哺乳類細胞は、形質転換能力を有し、また遺伝子は制限酵素下でも生き残らなければならない;及び
- ・ 遺伝子はほとんど修正されずまたは改変されずに宿主DNAに挿入されなければならない
微生物や哺乳類細胞への植物DNAの遺伝子伝播の可能性を評価することを目的とした実験は数多くある。今日まで、植物DNA中の標識遺伝子がこれらの細胞に移行したという報告はない。マウスに細菌由来のDNAを大量に経口投与したモデル実験の結果では、テストDNA断片は明らかに細菌とマウス細胞に移行していた(Scubbert et al., 1998)。この報告は、伝播は全くないか又は極めて低い頻度でしか起こらないとする他の報告とは対照的である。
Scubbertらの報告の重要性は、大いに議論されてきた(Beever and Kemp,2000)。その結果、これらのデータは、植物DNAが哺乳類細胞に移行して、かつそこに安定して存在し続けられることを示していないと結論付けられた。また、植物由来の完全な遺伝子が哺乳類細胞に移行して発現するという証拠もない。
存在が知られている細菌の大部分は、自然環境下では、本来形質転換する能力がなく、植物DNAが細菌に移行して、発現するという証拠は今のところ全くないことに注目すべきである。遺伝子の移行は実験室において観察されてきたが、それは相同組換えが可能なときのみである(Nielsen et al., 1998)。遺伝子組換え植物中の挿入遺伝子配列は、多くの場合、原核生物の遺伝子と相同性を示すことにも留意する必要がある。この専門家会議でも、遺伝子組換えトウモロコシを飼料として与えられた鶏や羊について調査が行われ、腸管の正常な細菌叢中の細菌へのDNA移行について試験が行われていることは承知している。
遺伝子組換え植物から細菌への遺伝子の水平伝播が起こっているとすると、遺伝子(例えば、抗生物質耐性遺伝子)は受容細胞の健全性を変化させているかもしれない。健全性の減少により、遺伝子や遺伝子断片を遺伝子プールから排除する淘汰圧を十分に生み出すことができなくなるかもしれない。細胞集団におけるこの遺伝子の存在は、受容種の進化のための予備遺伝子として働くこともあり得る。
細菌について得られている知見は、培養し、直ちに分析することができる細菌についてのものである。培養することも同定することもできない細菌は、現存する微生物叢の大きな割合をしめている。それゆえ、これらの細菌についての知見無しに、遺伝子または遺伝子断片の獲得の可能性や確率、重要性を評価することは不可能である。
哺乳類細胞による植物DNA摂取の重要性は細菌のそれとは異なる。なぜならば、既存のデータが、そのようなDNAは生殖細胞経由では伝達されないことを示しているからである。外来DNAを含む細胞がどの程度まで補食されるのかは、まだ明確になっていない。また、組み込まれたDNAが安定して体細胞の中で複製を行っているのかどうかも分かっていない。哺乳類細胞は、外来性のDNAの摂取によっても同様に影響を受け得る。
遺伝子の水平伝播に関して最も考慮すべき事柄は、遺伝子組換え植物から移行されて受容細胞で発現している遺伝子の影響についてである。それゆえ、仮に伝播が起こっているとして、移行された遺伝子の形質による健康への影響が懸念される場合は、そのような移行についてのデータが、安全性評価の一部として必要になるだろう。
専門家会議では、現在遺伝子組換え植物において用いられている抗生物質耐性マーカーは、既にその安全性が評価されていると認識している(WHO,1993)。
現在使用されているマーカーについては、ヒトや家畜の健康にリスクを及ぼすという証拠は存在しない。そうは言うものの、近年の文献に記載されている遺伝子伝播の頻度が様々であるので、機能を保持した抗生物質耐性遺伝子の受容細胞への移行と発現は、確率は低いが、無視することはできない。もし、受容細胞が治療目的で用いられる抗生物質でも耐え生き残るとすると、薬剤耐性細胞の増殖は、薬剤の効果を損なうことになる。このことから、さらに次のようなことに注意する必要がある:その抗生物質に耐性のある培養可能な細菌がすでに広範囲に存在するかどうか、その抗生物質は臨床的に重要か(重要となり得るか)、及び代替となる効果的な治療法があるかどうかなど。
遺伝子組換え植物に現在用いられているいくつかの抗生物質耐性遺伝子についてのデータは、遺伝子の水平伝播がそれぞれの抗生物質の治療的使用に重要な影響を及ぼさないであろうことを示唆している。特定の治療に重要な薬剤や、代替治療法が限られている薬剤に抗生物質耐性を付与する遺伝子の場合、その移行と発現の可能性により、それらは広く利用される遺伝子組換え作物・食品・食品成分のゲノムとして利用されるべきではない。
商業用作物においては、抗生物質耐性遺伝子を組み込む方法以外の、他の多くの方法を用いることができる。これらの方法は、遺伝子組換えの後にその遺伝子を取り除くことや、他のマーカー遺伝子を用いることも含む。もし、他のマーカー遺伝子を用いた場合は、それらについても安全性評価が必要となる。加えて、いくつかの植物品種の実用的な形質転換のためには、これらの方法のさらなる技術的進歩や追加的な方法が必要となるだろう。科学技術が進歩し、もしそれらが利用可能であり安全であることが示されれば、抗生物質耐性遺伝子を利用する以外の他の組換え技術を使用することを、専門家会議は推奨する。
これらの代替技術のさらなる進歩が必要ならば、追加的な研究が強力に奨励されるべきである。
6.3 アレルギー誘発性
6.3.1 はじめに
食物アレルギーとは、通常無害な食品及び食品成分に対して起こる有害な反応であり、食品中の特定の蛋白に対する体内の免疫システムの異常反応を伴う。
真性食物アレルギーには、いくつかの免疫学的反応タイプがある(Sampson and Burks, 1996)。最も一般的な食物アレルギーのタイプは、抗原特異的IgE抗体を介したものである。IgEを介した反応は、その症状が原因となる食物の摂取後数分から2〜3時間以内におこることから、即時型過敏症反応として知られる。
IgE反応は、食品だけでなく、花粉、カビの胞子、動物の毛、昆虫の毒及び他の環境中の刺激物に対して起こる。食品アレルギーはすべてのアレルギー疾患のほんの一部しか占めていないが、IgEを介したアレルギー反応は、先進国においておそらく人口の約10〜25%の人に影響をあたえている(Mekori,1996)。IgEを介した食物アレルギーは大人よりも乳幼児や幼い子どもにより一般的であり、3歳未満の乳幼児の罹患率は5〜8%程度である(Bock,1987;Smpson, 1990)。食物アレルギーには、抗体を介するものだけではなく、細胞を介する反応もあり、そこでは組織結合性感作リンパ球が働いている(Sampson, 1990)。リンパ球が媒介する反応では、原因食物を摂取してから8時間以上経過した後に症状があらわれる。リンパ球が媒介する反応によるアレルギー反応では、食品の役割は依然として不明確であるが(Burks and Sampson,1993)、グルテン過敏性腸疾患としても知られている小児脂肪便症は、特定の地理的地域に応じて300人から3000人に1人の割合で発生しているといわれている。
コーデックス食品規格委員会(CAC)は、世界規模で、IgE反応と関連する最も一般的なアレルギー食品のリストを採択した。そのリストには、ピーナッツ、大豆、牛乳、卵、魚、甲殻類、麦及び木の実が含まれている。広範な文献検索によれば、160以上にのぼる食品が散発的なアレルギー反応に関係していることが分かっているが(Hefle,1996)、コーデックスの食品リストに載っているアレルギー食品は、中程度から重篤なアレルギー反応を起こす人全体の90%以上において原因食品となっている。生鮮果物や野菜に対するアレルギー反応、いわゆる口腔周囲アレルギー症候群も一般的ではあるが(Parker, 1990)、症状は比較的穏やかで口腔領域に限られており、また、そのアレルゲンは加熱と消化に対して不安定であることから、これらの食品はコーデックス委員会が採択したリストには含まれていない。また、コーデックス委員会が採択したリストには、グルテン過敏性腸疾患の病理に影響するとされるグルテン含有穀物(麦、ライ麦、大麦、オート麦、小麦)が含まれている。
IgEを介する食物アレルギーの症状は、穏やかなものから重篤で生命を脅かすようなものまで幅広い。人によって原因食品に対する閾値が異なっているが、最も過敏な食物アレルギー患者の場合、原因食品の量がごくわずかでもアレルギー反応を起こすが、生命を脅かす反応はたいていの場合、より多くの量の原因食品に曝露されることによって起こる。
グルテン過敏性腸疾患は腸の吸収不良症候群であり、体力消耗、貧血、下痢、骨の痛み、その他により特徴づけられる。グルテン過敏性腸疾患の症状を引き起こす閾値量は知られていないが、かなり低量であると考えられている。
IgEを介する食物アレルギーとグルテン過敏性腸疾患はともに、特定の食事の除去により治療される。両疾患とも閾値量が極めて低いので、安全で効果的な除去食を作るのに大変な注意を払わなければならない。
いくつかの食品成分がハプテンとして働く可能性はあるものの、ほとんど全ての食物アレルゲンは蛋白質である。同様に、麦、ライ麦、大麦等のプロラミン蛋白は、グルテン過敏性腸疾患を引き起こす。主食となる穀物は、幾千もの異なった蛋白質を含んでいるが、それらのうち、ごく少数がアレルゲンとなる。これらの蛋白質の分布は、植物のそれぞれの部位において多様であり、また気候や植物の病気といった環境要因の影響も受ける。伝統的な育種は、我々の食事における蛋白質の構成に多様性をもたらす。しかしながら、伝統的な品種改良の結果もたらされた食事中蛋白の多様性は、我々の主要食品のアレルギー誘発性にほとんど影響を与えていない。対照的に、食事の嗜好の変化が、食物アレルギーの発症に重要な関係がある。例えば、ピーナッツ(グラウンドナッツ)のアレルギーは、北米や西欧では特異的にきわめて頻繁に起こるが、一般的にピーナッツをほとんど食べない他の国ではあまり起こらない。また、キウイフルーツのような最近食品として消費されているものは食物アレルギーの原因であることが新たに分かった。こうした報告により、食品供給においてアレルゲンとなる可能性のある食品は多くはないが、新しいアレルギー誘発性食品が時々市場に出てくることが分かる。
上記のことから、遺伝子改変によって作られた食品の安全性を評価する際、アレルギー誘発性について特に注意を払う必要があることが明らかである。
6.3.2 遺伝子組換え食品中の新規蛋白のアレルギー誘発性に関する評価
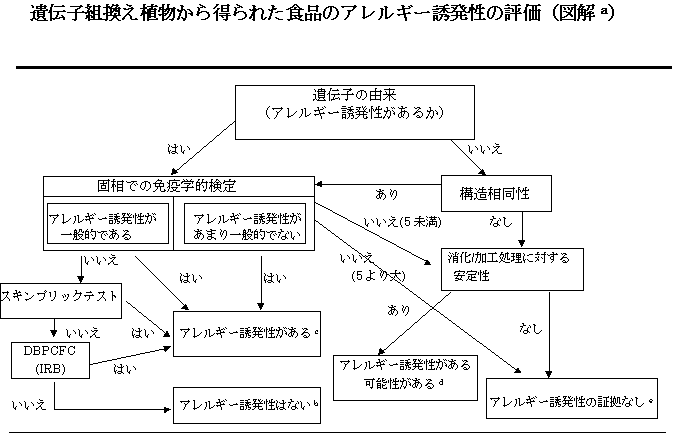
1996年に、国際食品バイオテクノロジー諮問委員会と国際生命科学協会アレルギー免疫研究所(the International Food Biotechnology Council and the Allergy and Immunology Institute of the International Life Sciences Institute )は、判断樹によるアプローチ(decision-tree approach)を開発した(Metcalfe et al.,1996)。このアレルギー評価の手法は、農業バイオテクノロジー産業に広く採用された。この手法は、遺伝子の由来、新たに発現した蛋白質と既知のアレルゲンとの構造相同性、挿入遺伝子の由来に対してアレルギーを起こすことが知られている人の血清からとったIgEと新たに発現した蛋白質との免疫結合性、及び新たに導入された蛋白質の物理学的性状に焦点をあてている(Metcalfe ら、 1996; Taylor, 1997)。この研究は遺伝子組換え食品のアレルギー誘発性の評価を行った当該専門家会議によって妥当なものとみなされた(図解)。
通常、遺伝子組換え食品は新たに導入された蛋白質を含んでいることから、遺伝子組換え食品の安全性には、こうした新たな蛋白質のアレルギー誘発性に関する評価を含むべきである。現在の判断樹(decision-tree)によるアプローチでは、多くの食物アレルゲンに共通の多くのパラメーターについて試験を実施する必要がある。これらの試験の結果得られた特性により、アレルギーを起こす可能性のある遺伝子産物をすみやかに同定する。ただし、アレルギー誘発性があるかまたはアレルギー誘発性が欠損しているかを確認するためにはひとつの基準では十分ではない。現在の判断樹(decision-tree)において用いられている基準には次の事項が含まれている。
- ・ 挿入遺伝子の由来:挿入遺伝子の由来が既知のアレルゲンを含む場合には、特に注意を払わなければならない。
- ・ 構造相同性:多くのアレルゲンのアミノ酸配列は容易に入手可能である。
- ・ 新たに導入された蛋白質の免疫学的反応性:新たな蛋白質が、アレルギーを起こす既知のものに由来する場合か、あるいは既知アレルゲンと構造相同性がある場合には、それらに対してアレルギーを起こす人の血清から得たIgEとのその新たな蛋白質との免疫学的反応性を調べる。
- ・ pH 及び/または消化による影響:ほとんどのアレルゲンは、胃酸及び消化性プロテアーゼに対して耐性を有する。
- ・ 熱処理または加工処理に対する安定性:食品中のアレルゲンが、調理または他の加工法を経て不安定な場合には、ほとんど心配ない。
判断樹(decision-tree)によるアプローチのアレルギー評価における信頼性を高めるために、他の適当な判断基準を含めることが望ましいかどうかについて議論された。遺伝子組換え食品が既知のアレルギー影響をもつことが既に知られているものから得られた遺伝子を含む場合には、新たな遺伝子産物がアレルギーを起こさないことが証明されない限り、その新たな遺伝子産物はアレルギー誘発性を有すると想定しなければならない。現在の判断樹によるアプローチは、挿入遺伝子の由来に対してアレルギーを起こす人の血清から得られたIgEと新規蛋白質との結合能を評価することを推奨しており、必要であればスキンテストやブラインド摂食テストを行うものであるが、専門家会議はこのアプローチは妥当かつ必要であるとした。遺伝子改変により宿主の蛋白質組成を著しく変化させることが予測できる状況を除き、遺伝子(その遺伝子の由来がアレルギー誘発性であってもなくても)挿入による既存の宿主内蛋白のアレルギー誘発性確保という非意図的な影響を評価する必要はないと考えられた。
遺伝子組換え食品がアレルギー歴をもたないものから得られた遺伝子を含む場合、現在の判断樹によるアプローチでは、既知のアレルゲンとの構造相同性の比較や、新たに作られた蛋白質の消化性及び加工処理に対する安定性に依存していたが、この2つの基準のみでは、アレルギー誘発歴を持たないものから得た遺伝子を含んだ遺伝子組換え食品の潜在的なアレルギー誘発性を評価するのに十分ではないであろうということが広く認められている。
配列の相同性、すなわち少なくとも8つの連続するアミノ酸配列が同じであることという現在の基準は、批判にさらされている(Metcalfe et al., 1996)。アミノ酸配列がより少数、おそらく4つのアミノ酸配列があるが、同一であることをもって判断すべきであるという意見もある。アミノ酸の配列の相同性は8つをもってその判断基準とするという考えは、 T細胞結合エピトープに必要な最低限のペプチドの長さを考慮すると、それなりの理由があるようにみえる (Metcalfe et al., 1996)。また、エピトープは3次構造に大きくその機能を依存するが、この基準では非連続した、あるいは立体構造的なエピトープを同定することはできない(Metcalfe et al., 1996)。しかしながら、熱処理に対する食物アレルゲンの安定性は、これらアレルゲンにおける連続したエピトープの存在がより重要であることを示唆している。遺伝子組換え食品のアレルギー誘発性の評価において、(アミノ酸)配列の相同性という基準をどのように使用するか、国際的な科学的コンセンサスが必要である。
消化に対する安定性試験は、遺伝子組換え食品のアレルギー誘発性に関する評価において、より有効な基準であると考えられる。ほ乳動物の消化を模擬した胃腸消化モデルが、遺伝子改変により食品に導入された既知の食物アレルゲンや蛋白質の消化安定性を評価するのに用いられている(Astwood et al., 1996)。
この基準の有用性は明らかであるが、消化安定性の評価における適切なプロトコールについて合意が必要である。また消化に対して安定であるがアレルゲンにならない新たな蛋白質が存在するだろうことも認識されている。そのような蛋白質のアレルギー誘発性を評価するには追加的な試験が必要である。
アレルギーを引き起こした履歴のないものから採取された遺伝子を含む食品のアレルギー誘発性を評価するため、追加の試験方法を開発することの必要性が広く指摘されている。以下の2つの追加的な試験方法が、判断樹によるアプローチに加えられる価値があると考えられる。
新たな蛋白質の発現量及び発現部位は、アレルギー誘発性の評価において重要な要素となる。食品中に比較的低量で発現した新たな蛋白質は、限られたアレルギー感作の可能性を持つにすぎないだろう。主な食物アレルゲンは、たいてい、通常消費される食品中の主要蛋白質であることが多い。したがって、有意なレベルの新たな蛋白質を含む遺伝子組換え食品については、詳しい評価が必要である。植物の非食用部分に発現する新たな蛋白質は、食品アレルギーという観点からは問題ではない。
新たな蛋白質の機能に関する考察もまた、判断樹によるアレルギー誘発性評価に加えられるべきである。ある種の蛋白質はアレルゲンとしてよく知られている。例えば、ブラジルナッツ、クルミ、ヒマワリの種及びマスタードに存在する2S高メチオニンアルブミンは、それらの主要なアレルゲンである。従って他の2S高メチオニンアルブミンついてもアレルギーを起こす可能性についてかなり注意深く精査されるべきである。植物の病気に関係する蛋白質の多くは、アレルギー活性を示しており、そうした蛋白質については全種類について精査する必要がある。アレルギーを起こす可能性をもった機能性蛋白質のリストについて、国際的な合意が求められるべきである。もちろん、このリストにない他の蛋白質についても検討しなければならないが、このリストは、アレルギー評価の方法全体の中で、重要な部分となりうるであろう。
遺伝子組換え食品のアレルギー誘発性を評価するために動物モデルを使用するかどうかについても議論された。残念ながら遺伝子組換え食品のアレルギー誘発性に関する評価において、信頼性のある十分評価された動物モデルは今のところ存在せず、動物モデルの改良に関して、さらに研究を推し進めることが奨励された。
分子量やグリコシル化の程度といった他の特性についても議論されたが、これらの特性はアレルギー誘発性の判断に大変役立つものとは考えられなかった。
遺伝子組換え食品に存在する新たな蛋白質が、グルテン過敏性腸疾患の誘因となる可能性についても評価するべきである。特に、もし必要となる遺伝子が、明らかに小麦、ライ麦、大麦、オート麦又は関連する穀物から得られたものである場合には、グルテン過敏性腸疾患の誘発にその遺伝子産物が何らかの役割をもっている可能性について慎重に検討しなければならない。さらに、遺伝子改変がこうした穀粒において行われた場合、グルテン蛋白質に非意図的な影響を与える可能性についても検討しなければならない。遺伝子組換え食品及びその新たな蛋白質がグルテン過敏性腸疾患においてもつ役割について評価するための適切な判断樹によるアプローチについて、国際的な合意が必要である。
6.3.3.遺伝子改変により得られたアレルゲンの低減あるいは除去
遺伝子改変により、特定の食品に自然に生じる蛋白質アレルゲンを低減あるいは除去することができる。一つには、遺伝子組換え米の開発がアンチセンス技術により開発された例が挙げられ、その技術は主要な米アレルゲンの量を劇的に減少させた(Matsuda et al., 1995)。この類のさらなる努力が推奨される。
※図解は別紙を参照
図解についての脚注
(a) この図は、国際食品バイオテクノロジー諮問委員会と国際生命科学協会アレルギー免疫研究所(the International Food Biotechnology Council and the Allergy and Immunology Institute of the International Life Sciences Institute )によって作成された判断樹によるアプローチから採用したものである (Metcalfe et al., 1996) 。
(b) アレルギーをもつ人における検査、及びその人から得た血清による検査の組み合わせは、主要なアレルゲンが食品中に移行していないことをかなりの確率で示す。残る不確かな部分は、起源物質に対してアレルギー反応を示す母集団のうちの少数の人々にアレルギーを起こすようなマイナーなアレルゲンの存在である。
(c) アレルギーをもつ人における検査、及びそれらの人から得た血清による検査において得られた陽性結果は、新しい蛋白質が潜在的なアレルゲンであるという高い信憑性を与える。
(d) 新しい蛋白質が、既知のアレルゲンと構造相同性をもたない場合、あるいはアレルギーを起こすことが一般的でないものに由来し、かつ少数(5未満)のアレルギー患者の血清から得られたIgEに関してそれと結合したという証拠がない場合であっても、消化や加工処理に対して安定であるものはおそらくアレルゲンとなると考え、この不確かさについてさらなる評価が必要であろう。その検査の種類は、ケースバイケースで決定されるだろう。
(e) 既知のアレルゲンと構造相同性をもたず、消化や加工処理に対して安定でない新しい蛋白質が、アレルギー誘発性を生じるという証拠はない。同様に、一般にアレルギーを起こさないものから得た遺伝子が発現してできた蛋白質で、かつ少数のアレルギー患者(5より多く14未満)の血清から得たIgEと結合しないことが証明された蛋白質も、アレルギー誘発性を生じるという証拠はない。安定性試験はこうしたケースにおいても必要となるだろう。しかしながら、この2つの判断基準に基づく判断の信頼性は妥当といえる。この専門家会議は、新しい蛋白質の発現量のように、他の基準についても考慮されるべきであることを提唱した。
7.結論
1. 専門家会議は、遺伝子組換え食品の安全性評価は、包括的、段階的に、かつケースバイケースのアプローチが必要であり、そこでは一連の体系的な質問に順次答えていく方法が有用であるということで同意した。遺伝子組換え食品と、比較対照である既存の食品との間の、類似性や相違を調べることに焦点をあてるという比較のアプローチは、潜在的な安全性と栄養に関する問題を明らかにするのを助ける。また、このアプローチは遺伝子組換え食品の安全性及び栄養的評価のための、最も適切な方法であると考えられる。
2. 専門家会議は、実質的同等性の考え方を適切に用いる以外に、遺伝子組換え食品の安全性をより確保するようなよい方法は存在しないという見解に至った。しかしながら、安全性評価の過程のいくつかの点については、遺伝子組換え技術の発展に立ち後れないよう、適宜修正しなけれならないとの合意を得た。実質的同等性の考え方は、遺伝子組換え食品の安全性評価の実用的なアプローチとして作られた。その考え方自体は安全性評価そのものではないが、安全性評価の過程におけるキーステップであると考えるべきである。
つまり、危害を分析することではなく、むしろ比較対照である既存の食品を比較して、遺伝子組換え食品の安全性評価を構築するのに用いられたものである。専門家会議は、実質的同等性の考え方を適用することは、強固な安全性評価の枠組み作りに貢献すると結論づけた。専門家会議は、市場流通を認められた遺伝子組換え食品の安全性の評価に用いられたこのアプローチに満足した。
3. 専門家会議はさらに、遺伝子組換え食品の安全性評価には、新しい形質を獲得したり、すでに存在する形質を失うなど、非意図的影響のインパクトを検知し評価する方法が必要であると認めた。非意図的影響が起こる可能性は、遺伝子組換え技術に特異的なものでなく、伝統的な育種においても一般的にみられる現象である。非意図的影響を評価するための現在のアプローチは、特定成分の分析(標的を定めたアプローチ)に基づいている。非意図的影響を検知する確率を増すには、プロファイリング技術が代替方法として考えられる(標的を定めないアプローチ)。非意図的影響に関連する生物学的重要性及び安全性の評価のために、遺伝子組換え食品はまず他の従来からの品種と比較し、またそのデータは文献データと比較されるべきである。もし、組換え食品についてのデータが自然界での変動の域を越えるようなものであれば、栄養的、毒性的評価が必要となる。そこでは、遺伝子組換え食品の特定の成分あるいは丸ごとの食品としての評価が要求されるであろう。
4. 専門家会議は、遺伝子組換え食品の摂取による長期的な影響に関する事項について検討し、どんな食品であってもその長期的な影響はほとんど知られていないことに注目した。また、多くの場合、一部の人々は食品由来の特定の健康影響に対して感受性が高いなど、個人による遺伝要因の差異が、食品の長期的健康影響の特定を困難にしている。こうした状況を考慮し、専門家会議は、遺伝子組換え食品の市場流通前の安全性評価により、すでにそれら遺伝子組換え食品がその対照物(既存の食品)と同程度に安全であるということが保証されていることを踏まえ、遺伝子組換え食品に特異的な長期的影響の可能性はほとんどありえないことを確認した。さらに、観察的疫学調査という手段では、既存の食品が持っている健康影響に対比して、遺伝子組換え食品に特有な健康影響を明らかにすることは困難であろうと考えられた。
RCTs (randomised controlled trials)のような実験的調査は、もし適切に計画・実施されるのであれば、遺伝子組換え食品を含むあらゆる食品の中長期的影響を調査するのに利用できるであろう。そのような試験により、ヒトへの安全性に対する追加的証拠を得られるだろうが、実施するのは難しいだろう。この点に関して、人々が毎日摂取する食品及び食品成分の多様性を認識することもまた重要である。
5. 専門家会議では、栄養的効果をもつ遺伝子組換え食品は、先進及び発展途上国に、より良質な食品をもたらすだろうことを認めた。ある植物で生じた栄養素のレベルの変化は、食餌全体に影響を与えるかもしれない。そうしたケースでは、栄養素や生物学的利用能の変化をモニターし、消費者の栄養・健康状態に与えうる影響を評価することが重要となるであろう。しかし、消費者の栄養状態に与える影響を評価することは、遺伝子組換え植物の出現に特有なものではなく、食餌上の重要な変化一般にとって大切なことである。
6. 専門家会議では、もし遺伝子組換え食品が、アレルギー影響の知られている生物由来の遺伝子産物を含む場合には、そうではないと証明されない限り、その遺伝子産物はアレルギー誘発性を有すると見なすべきであることで意見が一致した。一般的にアレルギー誘発性食品からの遺伝子導入は、導入遺伝子がアレルゲンをコードしないことを述べない限りは、中止を促すべきである。新しい蛋白質を遺伝子組換え食品に導入したとき、図解に示す判断樹を基にアレルギー誘発性の評価を行うべきである。追加される内容は遺伝子がアレルギー誘発性として知られてない生物由来のとき、判断樹によるアプローチに加えられるように考慮すべきである。新しい蛋白質の発現量や発現部位と新しい蛋白の機能特性は二つの追加基準となるだろう。
7. 専門家会議は、食品として摂取される植物及びその製品から、腸内微生物やヒトの細胞へ遺伝子が水平伝播する可能性は、ほとんどないと考えられるが、完全に無視することはできないとした。遺伝子の水平伝播について検討すべき最も重要なことは、移行した遺伝子が、移行先の細胞の中で発現しているかどうかということである。重要な例としては、もし仮に遺伝子の移行が起こるとすれば、遺伝子組換え食品から腸管内微生物への抗生物質耐性遺伝子の移行である。この遺伝子が移行した細胞内で発現するかどうかの検討においては、医療や獣医領域で重要な抗生物質であるかどうか、自然界における耐性のレベルはどうか、効果的なこれに代替しうる治療法があるかどうかを検討することが重要である。一般に、臨床的に重要な抗生物質に対する耐性をエンコードしている抗生物質耐性遺伝子は、遺伝子組換え生物や食品及び食品成分に広く使用されるべきではない。さらに専門家会議は、現在遺伝子組換え植物に使用されている抗生物質耐性マーカーは、前もって安全性の評価がされているという認識のもと、現在使用されているマーカーが、ヒト及び家畜の健康に影響を及ぼす危険性があるという根拠はないと結論した。
8.提言
1. 丸ごとの食品を用いる際、動物試験の技術的限界のあることが指摘されながらも、専門家会議は、特定のケースでは動物実験は有用であるとの考えを示した。今後、この分野についてはさらに調査と標準化が率先して行われるべきであると提言した。
2. ある特定の成分の分析に基づいて、意図しない影響を検出する方法は、プロファイリング技術といった代替法により補完されることが可能であろう。こうした技術は開発中であり、こうした方法が更に開発され、検証されるよう提言された。これは、おそらく多くの種の間で行う多様な遺伝子改変といったような、より複雑な遺伝子改変において特に重要となるであろう。
3. 従来の育種や遺伝子改変により得られた植物から作られた食品中の栄養の変化をモニターし、公衆の栄養状態を評価することは重要となるであろう。
将来、出現するであろう特定の栄養素を変えた食品は、特に発展途上国にとって重要なものとなるであろう。そして、発展途上国における適切な技術の普及と能力開発についての努力がはかられるべきである。
4. 遺伝子組換え食品の評価に必要な、栄養・毒性の専門知識の統合が早急に押し進められるよう提言された。これは、植物の遺伝子改変の分野において研究開発を促進し、また、重要な安全性及び栄養的問題についての早期の同定(検出)を可能にするであろう。
5. 専門家会議は、もし可能でありかつ安全に行えるのであれば、遺伝子組換え食品に抗生物質耐性遺伝子を残さない(用いない)別の組換え技術を用いるよう奨励する。また、さらに技術開発が必要な場合には、より研究が進められるよう強く奨励する。
6. 実質的同等性の概念の統一的な適用を促すために、合意文書をつくるように提言された。その文書には、野外試験の適切な設計のためのガイドライン及び、遺伝子組換え植物とそれらの比較対照となる既存の食品との比較データを入手し、分析するための適切な統計学的方法の利用に関するガイドラインが含まれるべきである。
7. 遺伝子組換え食品の安全性評価に関する原則についてのコミュニケーションは、改善されなければならない。専門家会議では、伝えるべきキーメッセージとして、実質的同等性とは、遺伝子組換え食品と安全な食品としての利用の歴史をもつ対照物との間の類似性と相違性を明らかにするために用いられる概念であると結論づけた。
8. FAO/WHOは、遺伝子組換え食品及びそれに含まれる新しい蛋白質のアレルギー誘発性の評価に関する専門家会議を招集すべきである。専門家会議は遺伝子組換え食品のアレルギー誘発性の評価のための判断樹を改良し、又、例えば消化に対する安定性の評価に適用できる最適な方法等の特定の基準を標準化し、十分なものにすることに焦点をあてるべきとした。
9. 専門家会議はFAO/WHO専門家会議が将来、検討する事項として以下の事項を挙げた。
- ・ 遺伝子組換え微生物に特異的な安全性評価
・ 遺伝子組換え動物(魚を含む)に特異的な安全性評価
・ 遺伝子組換え食品の栄養的側面を含めた、機能性食品の安全性評価
・ 丸ごとの食品の安全性試験の方法の改良
・ 食品を生産するための植物や微生物における抗生物質耐性遺伝子の使用と、その医療上起こりうる問題
付属資料 I
出席者リスト
(省略)
付属資料 II
資料一覧
(省略)
付属資料 III
コーデックスバイオテクノロジー応用食品特別部会からの
質問事項への回答
1) どのような包括的な科学的原則が、安全性と栄養性の評価において適用されるべきか。
世界中におけるこれまでの経験により、共通する科学的原則が明らかになり、現在その原則が安全性及び栄養性の評価に用いられている。
ある人に対しては安全ではない食品もあるし、多くの食品には、許容量以上に存在しているのであれば健康上の問題をおこすであろう物質を含むものもあるが、現在食品として供給されているものは、安全な使用の長い歴史がある。
遺伝子組換え技術を利用して得られた食品は、大抵、伝統的な作物から得られ、遺伝子改変により1つ又は2−3の良く知られた形質を示す。伝統的作物の使用により得られた知識と経験は、そうした植物から得られる食品の安全性評価における重要な要素となる。
(丸ごとの)食品及び多くの複雑な成分の安全性評価は、食品添加物や農薬や汚染物質等、単一物質であり、かつ、良く精製された化学物質の安全性評価に用いられる方法とは違ったアプローチが必要である。丸ごとの食品の安全性評価のアプローチは、ケースバイケースで、多くの専門分野にまたがったデータや情報を検討して行われる。そして適宜、農業的、遺伝的、分子生物的、栄養的、毒性的及び化学的な特性について行われるものであるが、これに限られるものではない。動物による毒性試験は常に行われるものではないが、安全性評価の結果必要となった場合には、その試験は特定の問題に対処できるよう適切にデザインされたものでなければならない。
下記の事項は、評価の際に検討されるべきいくつかの主要な点である。即ち、新しい遺伝子、新しい蛋白質及び他の食品成分であり、これらは意図的変化及び非意図的変化、また、悪影響や予測できない影響が起こる可能性を減らすための措置について考慮の上検討される必要がある。また、特別なケースでは(抗生物質耐性といった)付加的影響も検討されるであろう。
遺伝子組換え食品と伝統的な食品は多くの特性が共通であり、多くの場合新しい食品あるいは食品成分は比較対照となる既存の食品と栄養的に同等である場合が多い。
従来から行われている、総蛋白質量、脂肪、灰分、素繊維質及び微量栄養素といった食品成分を評価する際に用いられる分析法について議論が必要であり、予測しない影響や、栄養面の食餌及び健康に影響を与えるかもしれない栄養組成の変化を同定するためのプロファイリング法を用いることについて議論の必要があるであろう。
栄養素の量が大きく変化したり、他の栄養素や予期しない影響との相互作用といった可能性があることから、動物を用いた投与試験を行い、栄養組成や栄養素の生物学的利用能の変化により起こる現象を確かめる必要があるだろう。
通常の栄養素の変化が通常の幅(レンジ)に収まっているような栄養上の改変が起きている場合には、通常の幅(レンジ)に収まっていない変化が起きている場合よりも、それを確かめる必要性は少ないであろう。
データと情報は、他の科学者による十分な科学的検討に耐え得るだけの質と量がなければならない。安全性評価は、存在するであろう危害発生要因の性質と危害の重大性に関する情報を明らかにし、適切なマネジメント法がとれるように計画される。
結論として、遺伝子組換え技術を用いて得られた食品及び食品成分の安全性評価において、新しい科学的原則や方法は必要ではない。伝統的な食品の安全性評価に用いられているのと同様の原則が、遺伝子組換え食品の安全性及び健全性の評価に用いられるべきである。また、遺伝的組換えの性質に応じ、特定の安全及び栄養面についての評価も必要となる。
2) 安全性及び栄養評価における実質的同等性の概念の役割と限界は何か。また、安全性及び栄養評価に利用できる他の方法があるか。
実質的同等性の概念は、安全性評価における重要な要素として確立されている。そしてこの概念は、いくつかの国際的な報告書において検討されてきた。
この概念は、改変された又は新しい食品・食品成分のヒトの消費における安全性を評価する際に、食品としてあるいは食品の原料として用いられる既存の生物(植物)を比較の対照とすることができるという考えに基づいている。実質的同等性は、安全性評価において価値があるものだと広く同意されている。
実質的同等性の概念を適用することにより、食品及び食品成分の類似性や明らかな違いが特定される。そしてさらなる安全性評価は、新しい産物における相違点に焦点をあて、既存の食品との比較において実施される。この方法で行われる安全性評価は、新しい食品に対する絶対的な保証を与えるものではない。
この実質的同等性の概念の別の側面とは、この概念が適切な対照物がある場合にのみ用いることができるということである。したがって、対照物についての十分なデータの存在あるいは作成が必要となる。比較対照物が無いとき、実質的同等性は安全性の評価に用いることができない。このような場合、安全性試験は食品に付与された形質に応じて行う必要がある。
遺伝子組み換え植物から得られた食品の安全性評価のために現在用いられている方法は、適切であると考えられる。実質的同等性の概念を適切に用いる以外に、遺伝子組換え食品の安全性を十分確保できるような、よりよい代替方法は現在存在しない。しかし、安全性評価プロセスにおけるある側面については、遺伝子組換え技術の開発の時勢に遅れないように改善されえるであろうと認めた。プロファイリング技術などのような新しい方法論によって、より詳細な分析的比較が可能となるであろう。しかし、こうした方法を評価する前に、その方法についてさらに技術改良が進められる必要があることを認めた。
3) 長期的健康影響の可能性や意図しない/予期しない悪影響をモニターし評価するには、どのような科学的方法を用いることができるか。
この専門家会議は、この報告書にまとめられた安全性評価の方法論は、遺伝子組換え食品の長期影響の可能性を検知し評価するのに十分であると確認した。
専門家会議は、遺伝子組換え食品の摂取による長期的な影響に関する事項について検討し、どんな食品であってもその長期的な影響はほとんど知られていないことを確認した。多くの場合、一部の人々は食品由来の特定の健康影響に対して感受性が高いなど、個人による遺伝要因の差異が食品の長期的影響の特定を困難にしている。
こうした状況を考慮し、専門家会議は、遺伝子組換え食品の市場流通前の安全性評価により、すでにそれら遺伝子組換え食品にはその対照物(既存の食品)と同程度に安全であるということが保証されていることを踏まえ、遺伝子組換え食品に特異的な長期的影響の可能性はほとんどありえないであろうことを確認した。
安全性評価の重要な側面は、導入される遺伝子産物の形質を検討することである。導入された遺伝子産物やその食品が、ヒトの食品としての消費の歴史を持たない場合、おそらく90日の投与試験が要求されるだろう。もしこの試験が、長期影響の可能性を示唆する場合(例えば細胞増殖に関することなど)、さらに長期試験を実施し、その遺伝子産物の開発が継続されるべきであるかどうかを検討することが必要となるだろう。
専門家会議は、食事と疾病の関連を確立するモニタリングが望まれるとの考えを示した。しかしながら、多くの慢性健康影響は多くの要因によるものであり、観察的疫学調査という手段では、既存の食品が持っている健康影響に対比して、遺伝子組換え食品に特有な健康影響を明らかにすることは困難であろうと考えられた。RCTs (randomised controlled trials)のような実験的調査は、もし適切に計画・実施されるのであれば、遺伝子組換え食品を含むあらゆる食品の中長期的影響を調査するのに利用できるであろう。そのような試験により、ヒトへの安全性に対する追加的証拠を得られるだろうが、実施するのは難しいだろう。この点に関して、人々が毎日摂取する食品及び食品成分の多様性を認識することもまた重要である。
同じような問題は、長期的な健康への良い影響の可能性を検出することにもあてはまる。しかし、栄養的効果を生みだす遺伝子組換え食品は、いまだ先進国・開発途上両国において、実用化にむけて開発途中である。このような場合、ある特定の作物中の栄養素の量の変化は、食餌全体に影響を与えるであろうし、このような食品の栄養価の変化を調査し、栄養及び健康への影響の可能性を評価することが重要となるであろう。
非意図的な影響が生じる可能性は、組換えDNA技術の利用に特異的なものではない。むしろ、従来の育種でも生じうる遺伝的かつ一般的な現象である。この問題に対処するために採用されたアプローチのひとつに、植物改良の初期的段階で異常で望ましくない表現型及び農学的特徴を持った個体を選抜/排除するというアプローチがある。連続的な戻し交配を行うこともまた、非意図的な影響を排除するために通常用いられる手法である。まれなケースではあるが、こうしたアプローチとともに、特定の構成成分の分析的スクリーニングを同時に行うこともある。
遺伝子改変によっておこる非意図的な影響は、2つのグループに分けられる:一つは意図的な影響と代謝との関連あるいは遺伝子の挿入位置に関する情報に基づく“予測可能な (predictable)”影響であり、もう一つは“予期しない (unexpected)”影響である。遺伝子改変の精度が従来の育種と比べて高まることにより、非意図的な影響が代謝経路及ぼす影響を予見することがより容易になるであろう。
非意図的な影響を検知するのに用いられる比較対照となるものは、理想的には同一条件下において生育された同遺伝子型の親系統に近いものであるべきである。しかし実際には、これは常時実行可能ではないので、その場合には、できるだけ近似している系統が選択されるべきである。自然界での変動の域についても、非意図的影響の統計学上の有意差を評価する際に考慮されるべきである。
非意図的な影響について統計的な有意性がみられた場合、その生物学的な意義について評価されるべきである。これには、その変化を誘導する機序に関する知見が助けとなるだろう。非意図的影響の生物学的及び安全上の重要性を評価する際には、遺伝子組換え植物に関するデータは、既存品種に関するデータ及び文献データと比較されるべきである。もしその差異が従来の食品作物中の天然種の変動の域を越えるようならば、さらなる評価が必要である。
非意図的な影響の可能性を評価するための現在のアプローチは、特定の成分の分析(標的を定めたアプローチ)に基づいている。非意図的影響を検知する確率を増すには、プロファイリング技術が代替方法として考えられる(標的を定めないアプローチ)。プロファイリング技術は、たとえば遺伝子、蛋白質及び代謝等の各レベルで用いられている。
将来、植物の遺伝子改変は種間組換えを複数おこすなど、より複雑になるだろう。これにより非意図的な影響が生ずる機会が増大するかもしれない。このような場合、プロファイリング技術により、従来のターゲットを絞った化学分析よりも幅広く違いを検出することが可能となるだろうが、この技術はまだ十分発達しておらず、いくつかの限界がある。プロファイリング技術によって、その影響がもたらす違いが認められた場合には、そうした違いが安全性上意味があるかどうかを検討する必要が生じるだろう。
4) アレルギー誘発性の評価には、どのような科学的方法を用いることができるか。
アレルギー誘発性の評価は全ての遺伝子組換え食品に行われるべきである。
その評価においては、ほとんどの場合挿入遺伝子による新しい蛋白質が調査の焦点となるべきである。
遺伝子組換え食品のアレルギー誘発性の評価は全てのケースにおいて行われるべきである。遺伝子改変による意図した影響が、宿主植物中の蛋白質の量を著しく変えた場合には、宿主植物に本来備わっているアレルギー誘発性が増す可能性についても評価すべきである。
判断樹による方法は、新しい蛋白質のアレルギー誘発性を評価する際に用いられるべきである。挿入遺伝子が、アレルギーを起こすことが歴史的に知られた生物を起源とする場合には、新たに導入された蛋白質が、挿入遺伝子の起源である生物に対してアレルギーをもつ人の血清中のIgEに反応するかについて、まず焦点を当てるべきである。(免疫化学的反応が得られない場合には)必要に応じ新しい蛋白質の抽出物のスキンテストを行ったり、挿入遺伝子の起源である生物にアレルギーを起こすことがわかっている人を用いて、遺伝子組換え食品のブラインド摂食テストを行うことにより、新しい蛋白質がアレルギー誘発性でないことを確認する。これらの一連の試験により、アレルギーを起こすことがわかっている生物から得られた遺伝子により発現する新しい蛋白質のアレルギー誘発性(又はアレルギー誘発性の欠損)に関する適切な根拠が得られる。
判断樹によるアプローチは、ひとつの基準では十分に予測できないので、いろいろな基準の組み合わせにより行うべきである。現在の基準には、新しく導入された蛋白類が既存のアレルゲンと構造相同性を有しているか、また構造相同性がある場合には、アレルギーを起こす患者の適切な血清から取り出したIgEと新しく導入した蛋白質との免疫化学的反応はどうか、胃や腸のモデルシステムにおいて消化液に対する新しい蛋白質の安定性があるかどうかということが含まれる。この専門家会議は、遺伝子産物がアレルギーを起こすことが知られていない場合、使用できるように二つの追加基準を判断樹のアプローチに組み込むことは有用であろうと提案した。新しい蛋白質の発現量と発現部位、及び新しい蛋白質の機能的性質をそのリストに加えるよう検討すべきである。これらの基準をともに用いることにより、新しい蛋白質がアレルギーを起こすものではなく、又、アレルゲンと知られているものと交差反応せず、食物アレルゲンとなりうる可能性が限られていることを示す合理的な根拠となる。なお、さらに基準を追加することにより、判断樹のアプローチに信頼性が増すであろう。
特に、この専門家会議では、遺伝子組換え食品の新しい蛋白質のアレルギー誘発性の評価のために、十分に信頼性のある動物モデルを開発する研究を続けることを支持した。また、専門家会議は、食品中のアレルギーを起こす蛋白質を明らかにし、それらの蛋白質のアミノ酸配列を同定するためのさらなる研究を行うことを支持した。
5) 植物や微生物に使用される抗生物質耐性マーカー遺伝子によって生ずるリスクの可能性を評価するためには、どのような科学的方法を用いることができるか。
遺伝子組換え植物において、抗生物質耐性遺伝子の遺伝子産物は、他の導入された遺伝子産物において行われるのと同様の、標準的な安全性評価の対象となるべきである。それにより、抗生物質耐性遺伝子の遺伝子産物は、毒性およびアレルギー誘発性について評価されるべきである。
植物や微生物に抗生物質耐性遺伝子が存在する場合、病原性微生物にその遺伝子が移行する可能性や、臨床上の影響の可能性を検討すべきである。食品として摂取される植物及びその製品から、腸内微生物やヒトの細胞へ遺伝子が水平伝播する可能性は、ほとんどないと考えられるが、完全に無視することはできない。遺伝子の水平伝播について検討すべき最も重要なことは、移行した遺伝子が、移行先の細胞の中で発現しているかどうかということである。重要な例としては、もし仮に遺伝子の移行が起こるとすれば、遺伝子組換え食品から腸管内微生物への抗生物質耐性遺伝子の移行である。この遺伝子が移行した細胞内で発現するかどうかの検討においては、医療や獣医領域で重要な抗生物質であるかどうか、自然界における耐性のレベルはどうか、効果的なこれに代替しうる治療法があるかどうかを検討することが重要である。一般に、臨床的に重要な抗生物質に対する耐性をエンコードしている抗生物質耐性遺伝子は、遺伝子組換え生物や食品及び食品成分に広く使用されるべきではない
|
・ バイオテクノロジー応用食品に関するFAO/WHO合同専門家会議報告書の英語版をもとに、この日本語訳を作成しました。オリジナルは(http://www.who.int/fsf/Gmfood/FAO-WHO_Consultation_report_2000.pdf)で入手可能です。
・ なお、この翻訳に関するお問い合わせは厚生省生活衛生局食品保健課までお願いします。 |