厚生労働科学研究費補助金(食品の安全性高度化推進研究事業)
分担研究報告書
ダイオキシン類による食品汚染実態の把握に関する研究
分担研究課題 食品中臭素化ダイオキシン及びその関連化合物質汚染調査
分担研究者 中川礼子 福岡県保健環境研究所
分担研究報告書
ダイオキシン類による食品汚染実態の把握に関する研究
分担研究課題 食品中臭素化ダイオキシン及びその関連化合物質汚染調査
分担研究者 中川礼子 福岡県保健環境研究所
研究要旨
プラスチックの難燃剤として添加される臭素系化合物は,その製造過程やそれらを含むプラスチックの焼却で臭素化ダイオキシン(PBDD/DF)を生成することが明らかにされている。臭素系難燃剤特に臭素化ジフェニルエーテル(PBDE)はその残留性・蓄積性が大きく、発ガン性や神経発達に関する毒性データも最近散見されるようになった。しかし、これらPBDD/DF及びPBDEによる食品汚染に関して現在までに得られているデータは少なく,ヒトへの曝露量を正確に推定することは困難である。そこで,食品の汚染の実態を明らかにし,ヒトへの曝露量について評価することが食品の安全確保の上で急務となっている。本研究では(1)個別試料として、三地域から採取した生鮮魚介類44試料、魚介加工食品として1試料について調査を実施した。その結果、中国・四国地域の7種の生鮮魚類に1,2,3,4,6,7,8-HpBDFを、タイに2,3,7,8-TeBDDを、アナゴに2,3,7,8-TeBDF及び3-Br-2,7,8-CDFを検出したが、その他の二地域の魚介類からは検出されなかった。PBDEについては、すべての魚介類から検出されたが、中部地域の魚介類が他の二地域のものよりも総濃度が高い傾向が認められた。異性体別構成では、主として、4臭素化体の寄与が大きく、底質に棲息する魚類については、十臭素化体DBDEの寄与も大きかった。また、PBDE濃度は脂肪含量との相関傾向が認められた。(2)関連化合物質(難燃剤)の一つである四臭素化ビスフェノールA(TBBPA)の微量分析法を検討し、個別食品試料及びマーケットバスケット試料の第1群から13群について汚染調査を実施した。これらを基に、1日摂取量を推定した。
研究協力者
| 芦塚由紀 (福岡県保健環境研究所) 堀 就英 (福岡県保健環境研究所) 飛石和大 (福岡県保健環境研究所) 佐々木久美子 (国立医薬品食品衛生研究所) |
| A. | 研究目的 難燃剤はテレビなど家電製品やコンピュータに使用されるプラスチックへ結合させるか、または、単に添加され使用される。他には、織物製品のコーティング剤などに拡大使用されている。近年、工場排水が流入する河川や湾内に棲息する魚介類や職場や家庭内ダストで曝露されたヒトの血液・母乳において、難燃剤による汚染が問題となった。特に、臭素化ジフェニルエーテル(PBDE)は、それ自身残留性・蓄積性が著しいことから、最近、本物質に関した報告が散見されるようになっている1)。一例として、母乳中のPBDE濃度が北欧の研究で、1972年から1997年まで指数関数的に増加していることが明らかになり注目された2)。本物質の様々な毒性が報告されていることに加え、製品そのものに不純物として高毒性臭素化ダイオキシン(PBDD/DF)が存在する可能性が高いこと、また、焼却炉での不完全燃焼により、PBDD/DFが非意図的に生成することから、本物質の使用が問題となっている。2001年、日本人脂肪中にPBDD/DF及びPBDEを検出した報告がある3)。現在、ヨーロッパ国内では使用規制を設けるなどの対策がとられているが、電化製品の輸入に伴う汚染問題が依然として残されている。日本では、ヒトや動物など生態系に入りにくいと言われてきた十臭素化ジフェニルエーテル(DBDE)を初期から採用している。本物質の国内需用量は1990年の1万トンをピークとして2003年には2200トンと業界の自主規制により減少している4)が、一方で、PBDE以外の物質テトラブロモビスフェノールA(TBBPA)の使用量が増加した。以上の産業的背景の中、ヒトの健康を守るため、主たる汚染経路である食品について有害臭素化合物の汚染実態を明らかにすることが急務である。 初年度である平成16年度は、計画に掲げたように、食品を介したヒトへの曝露量を推定し、食品による健康被害を回避する資料を提供するために、我々が確立した微量分析法によって、三地域から採取した生鮮魚介類45試料について調査を実施した。 また、関連化合物質(難燃剤)の一つであるTBBPAの微量分析法を検討し、個別食品試料及びマーケットバスケット試料の第1群から13群について汚染調査を実施した。 |
| B. | 研究方法 |
| 1. | 個別食品における臭素化ダイオキシン及び臭素化ジフェニルエーテル汚染実態調査 |
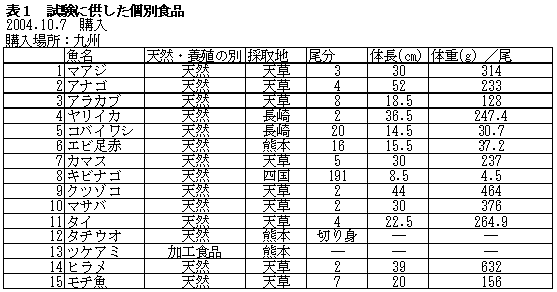
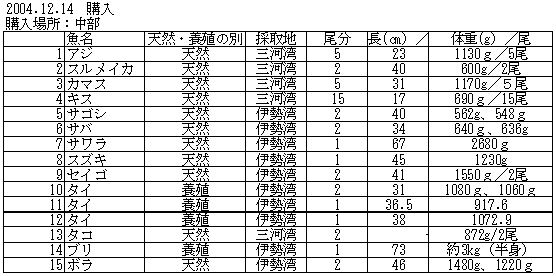
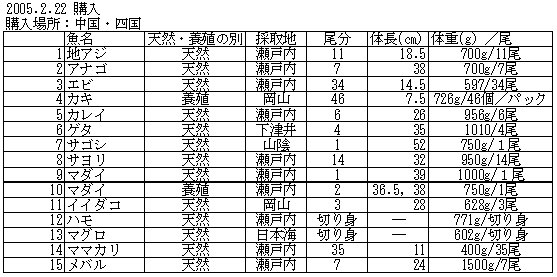
| 1-1 | 実験材料 個別食品試料の調製 生鮮魚介類として、九州地方(天草)、中部地方(三河湾、伊勢湾)、中国・四国地方(瀬戸内海)の鮮魚店から、各々15件計45試料を購入した。内訳は表1に示ように、生鮮魚介は44試料、加工食品は1試料であった。試料は可食部をそれぞれフードプロセッサーで均一化し、分析に供するまで、-20℃で保存した。 |
| 1-2 | カラムクロマトグラフィー
|
| 1-3 | 臭素化ダイオキシン及び臭素化ジフェニルエーテル標準品及び標準溶の調製 ポリブロモダイオキシン類(TeBDD/DF〜HxBDD/DF)の11標準品及びその13Cラベル体6標準品、モノブロモポリクロロダイオキシン類の8標準品(MoBTriCDD/DF, MoBTeC DD/DF, MoBPeCDD, MoBHxCDD, MoBTeCDD- 13C)をCambridge Iosotope Laboratories 社から購入し、それぞれの標準原液100ng/mL溶液(6臭素化は200ng/mL)を調製した。クリーンアップスパイク溶液として、13Cラベル化臭素化ダイオキシン類5ng/mLノナン溶液を作成した(表2)。 臭素化ジフェニルエーテル標準品は関東化学(株)よりシリンジスパイクとして13C12-22'344'5'-HexaBDE(MBDE-138-IS(Wellington Laboratories社製)を、また、クリーンアップスパイクとして11種混合の標準液(MBDE-MXC)を購入し、各々5ng/mLノナン溶液を作成した。なお、検量線用標準液はBDE-CVS-Eを使用した。(表3-1〜3-2)。表4-1〜4-3にPBDD/DF、MoBPCDD/DF及びPBDEのモニターイオンを示す。 |
| 1-4 | 機器及び装置 |
| 1-4-1 | 臭素化ダイオキシン及び臭素化ジフェニルエーテルの測定 測定機器 高分解質量分析計(HRMS):Micromass社製 Autospec ULTIMA、分解能:10000 イオン源温度270℃ 高分解ガスクロマトグラフ(HRGC):Hewlett Packard社製 HP6890 カラム1:J&W社製 DB-5 0.25mmi.d.x 30m、膜厚 0.1μm カラム2:Quadrex社製 MP65HT 0.25mmi.d.x25m、膜厚 0.1μm 注入方法:スプリットレス 注入口温度:260℃ 昇温条件:130℃〜20℃/min〜240℃〜5℃/min〜320℃(7.5min) |
| 1-4-2 | 試料の凍結乾燥 VIRTIS社製 凍結乾燥機 AD 2.0 ES-BC |
| 1-4-3 | 高速溶媒抽出 機器:DIONEX社製 ASE-300 抽出セル:99mL 抽出物捕集バイアル:200mL容量 抽出条件:オーブン温度100℃ 抽出圧力:1500psi オーブン昇温時間:7分 設定温圧保持時間:10分 フラッシュ容積:セル容量の40% ガスパージ時間:120秒 靜置サイクル数:3回 ハイドロマトリックス:使用する前にアセトン/ヘキサン(2:1)で予め洗浄。 |
| 1-5 | 実験操作 試料の調製 均一試料約100gを特注ビーカー(径9cm x高さ7cm)に精確に秤量し、-20℃で凍結した後、凍結乾燥機で約35時間かけて、乾燥させた。乾燥した検体はスパーテルで細かく砕き、ハイドロマトリックスを混ぜながら、各一検体につき、高速溶媒抽出装置の抽出セル(99mL)2本に充填した。クリーンアップスパイク13C-PBDDs/DFs(250〜1000pg)、1-Bromo-2,3,7,8-TeCDD-13Cを100pg及び13C-PBDEs(500〜2500)を添加後、1-4-3の条件(100℃、1500psi、抽出溶媒はヘキサン)で、高速溶媒抽出した。抽出液は40℃以下で約100mLになるまで減圧濃縮(以下減圧濃縮はすべて40℃以下で実施)した。硫酸20mLで3回処理を行い、ヘキサン洗浄水20mLで洗浄した。無水硫酸ナトリウムで乾燥させた後、各ヘキサン検液を5mLまで濃縮し、シリカゲルクロマトグラフィーに供し、10%ジクロロメタン/ヘキサン150mLで溶出させた。本画分はポリ臭素化ジフェニルエーテル(PBDEs)及びポリ臭素化ダイオキシン(PBDDs/DFs)の溶出画分である。これを減圧濃縮し、フロリジルカラムクロマトグラフィーに供した。負荷後、ヘキサン150mLで溶出させ第一画分(PBDEs溶出画分)、ついでジクロロメタン/ヘキサン(60:40,v/v)200mLで溶出させ第二画分(PBDDs/DFs溶出画分)を得た。第一画分(PBDEs溶出画分)は減圧濃縮し、約1mLとしたのち、DMSO分配により精製した。最後にシリンジスパイクの13C12-2,2',3,4,4',6-HxBDE(#138)(1ng)を加え、濃縮後、ノナン25μLに転溶し、HRGC/HRMSによるPBDEs測定に供した。一方、第二画分(PBDDs/DFs溶出画分)は5mLまで減圧濃縮後、活性炭カラムクロマトグラフィーに供し、10%ジクロロメタン/ヘキサン50mL及びトルエン200mLで溶出し、トルエン画分をPBDDs/DFs画分とし、減圧濃縮した。残渣を少量のヘキサンに溶解し、シリンジスパイクの13C12-OCDD(125pg)、13C12-2,3,4,7,8-PeBDF(250pg)を加え、濃縮後、ノナン25μLに転溶し、HRGC/HRMSによるPBDDs/DFs及びMonoBPCDDs/DFs(モノブロモポリクロロダイオキシン類)測定に供した。 |
|
||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 表4-1 | PBDDs/DFs測定に用いたモニターイオン |
| 定量イオン | 確認イオン | |
| TeBDD | 499.6904 | 497.6924 |
| PeBDD | 577.6009 | 579.5989 |
| HxBDD | 655.5114 | 657.5094 |
| TeBDF | 483.6955 | 481.6975 |
| PeBDF | 561.6060 | 563.6039 |
| HxBDF | 641.5145 | 641.5144 |
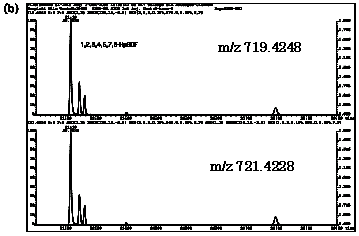
| HpBDF | 719.4248 | 721.4228 |
| OBDD | 815.3282 | 813.3302 |
| 13C12-TeBDD | 511.7307 | |
| 13C12-PeBDD | 589.6412 | |
| 13C12-HxBDD | 663.5295 | |
| 13C12-OBDD | 827.3685 | |
| 13C12-TeBDF | 495.7357 | |
| 13C12-PeBDF | 573.6462 |
| 表4-2 | MonoBromoPolyChloroDDs/DFs測定に用いたモニターイオン |
| 定量イオン | 確認イオン | |
| Mono-Bromo-TriCDD | 365.8436 | 367.8410 |
| Mono-Bromo-TeCDD | 399.8045 | 401.8019 |
| Mono-Bromo-PentaCDD | 435.7628 | 433.7655 |
| Mono-Bromo-HexaCDD | 469.7237 | 467.7265 |
| Mono-Bromo-HeptaCDD | 503.6847 | 505.6819 |
| Mono-Bromo-TriCDF | 349.8487 | 351.8460 |
| Mono-Bromo-TeCDF | 383.8096 | 385.8070 |
| 13C-Mono-Bromo-TeCDD | 411.8448 | ─ |
| 表4-3 | PBDEs測定に用いたモニターイオン |
| 定量イオン | 確認イオン | |
| TriBDE | 405.8027 | 407.8006 |
| TeBDE | 485.7111 | 483.7132 |
| PeBDE | 565.6196 | 563.6216 |
| HxBDE | 643.5301 | 641.5321 |
| HpBDE | 721.4406 | 723.4386 |
| OBDE | 641.5145 | 639.5160 |
| NoBDE | 719.4250 | 721.4230 |
| DBDE | 799.3335 | 797.3355 |
| 13C12-TriBDE | 417.8429 | ─ |
| 13C12-TeBDE | 497.7516 | ─ |
| 13C12-PeBDE | 575.6622 | ─ |
| 13C12-HxBDE | 655.5708 | ─ |
| 13C12-HpBDE | 733.4809 | ─ |
| 13C12-OBDE | 653.5547 | ─ |
| 13C12-NoBDE | 731.4652 | ─ |
| 13C12-DBDE | 811.3737 | ─ |
| 2. | テトラブロモビスフェノールA(TBBPA)の分析 |
| 2-1 | 実験材料 |
| 2-1-1 | トータルダイエット試料 2002年に国民栄養調査および県民栄養調査をもとに調整した福岡県のトータルダイエット試料(第1群から第13群まで)を分析した。第10群、第11群、第12群はn=2で行った。 |
| 2-1-2 | 個別食品 2001年9月から2004年2月までの間に購入した生鮮魚介類、加工食品、海藻類の個別食品を分析試料として用いた。(表5) 生鮮魚介類として、サンマ、アジ、イサキ、ヤズ、サバ、カワハギ、イワシ、タイ(2件)、ブリ、キハダマグロ、マス、イシダイ、スズキ、ヤリイカ、アゲマキ、カキ(2件)の18検体、加工食品として、ウナギ(蒲焼き)、開きアジ、鯛すぼまき、魚肉ソーセージ、煮干しの5検体、海藻類として、ノリ、ワカメ、ヒジキ、昆布の4検体を用いた。試料は皮を除く可食部をそれぞれフードプロセッサーで均一化し、分析に供するまで-20℃で保存した。 |
| 表5 | 個別試料の調製 (平成13年9月-平成16年2月に購入) |
| 検体名 | 産地 | 検体名 | 産地 | ||
| 生鮮魚 | サンマ | 横須賀 | 生鮮魚 | ヤリイカ | 長崎 |
| アジ | 長崎 | アゲマキ | 韓国 | ||
| イサキ | 佐賀関 | カキ1 | 福岡 | ||
| ヤズ | 長崎 | カキ2 | 福岡 | ||
| サバ | 五島 | 加工食品 | うなぎの蒲焼き | 鹿児島 | |
| カワハギ | 鐘崎 | 開きアジ | 八代 | ||
| イワシ | 北海道 | 鯛のすぼまき | 長崎 | ||
| タイ1 | 長崎 | 魚肉ソーセージ | 五島 | ||
| タイ2 | 北九州 | 煮干し | 愛媛 | ||
| ブリ | 長崎 | 海藻類 | ひじき | 不明 | |
| キハダマグロ | 台湾 | 昆布 | 三陸 | ||
| マス | ノルウェー | ワカメ | 鳴門 | ||
| イシダイ | 北九州 | ノリ | 不明 | ||
| スズキ | 北九州 |
| 2-2 | 標準溶液及び試薬 標準品はCambridge Isotope Laboratories社のテトラブロモビスフェノールA 標準溶液(50μg/mLメタノール溶液)及びテトラブロモビスフェノールA-ring-13C12(50μg/mLメタノール溶液)を使用した。テトラブロモビスフェノールA-ring-13C12はクリーンアップスパイクに使用した。シリンジスパイクには関東化学社製のInternal standard Mix 25(クリセン-d12,アセナフテン-d10, ピレン-d10, フェナントレン-d12,の500-μg/mL混合液)を用いた。 メタノール、ジクロロメタン、ヘキサンは関東化学社製のダイオキシン類分析用を用いた。 |
| 2-3 | 機器及び測定条件 ガスクロマトグラフィー質量分析計:Agilent 社製 HP6890/5973MSD カラム:DB-5(J&W) 0.25mmi.d.×30m,0.25μm 注入法:スプリットレス 注入量:2μl 注入口温度:280℃ 昇温条件:120℃(1min)→(20℃/min)→300℃(8℃) モニターイオン:
クリセン-d12;240 |
| 2-4 | 分析操作 均一化した魚介類試料10gをビーカーに精秤し、ケイ藻土と混合した後、33mLの高速溶媒抽出用セルに充填した。クリーンアップスパイク(13C12-TBBPA)を25ng添加し、高速溶媒抽出装置(DIONEX ASE-300)を用いて抽出(溶媒:メタノール)した後(表6)、抽出液を80mLにし、分液ロートに移した。ヘキサン20mLで分配した後、メタノール層を1Lの分液ロートに移し、5%食塩水400mLを加えてジクロロメタン50mLで2回抽出した。抽出液をエバポレーターで濃縮した後、窒素ガスで乾固し、ジエチル硫酸による誘導体化(エチル化)を行った。1NのKOH/エタノールを0.5mL加えてよく溶解した後、ジエチル硫酸を0.2mL加えて、エチル化した。30分放置した後、1N KOH/エタノールを加えて5mLにし、70℃で1時間アルカリ分解を行った。ヘキサン洗浄水を加えて8mLとし、ヘキサン1mLで2回抽出した後、ヘキサン層を無水硫酸ナトリウムで乾燥した。標準溶液も同様の操作で誘導体化、ヘキサン抽出を行った。次にフロリジルカラムで精製を行った。パスツールにフロリジル0.5gを充填し、2%ジエチルエーテル/ヘキサン7mLで溶出した。窒素ガスで濃縮乾固し、1mLヘキサンに溶解した後、硫酸シリカゲルカラムで精製した。44%硫酸シリカゲルをパスツールピペットに0.5g充填し、サンプルを負荷させた。ジクロロメタン15mLで溶出した。溶出液を濃縮し、シリンジスパイクを加えて最終検液50µLとし、四重極GC/MSで測定した。定量は同位体希釈法によって行い、回収率はシリンジスパイクのクリセン-d12とクリーンアップスパイクのピーク比より計算した。
(倫理面への配慮) 臭素化ダイオキシンは、塩素化ダイオキシンのような毒性評価が定まってはいないが、少なくとも2,3,7,8-テトラブロモダイオキシンは2,3,7,8-TCDDと同様の毒性を有するとされている。本研究を実施する実験室及び測定室は、ISO14001の認証を受けており、研究者自身の安全は勿論、研究所周辺への汚染防止などに十分な配慮をしているため、倫理上の問題はないと考えられる。 |
||||||||||||||||||||||
| C. | 結果と考察 |
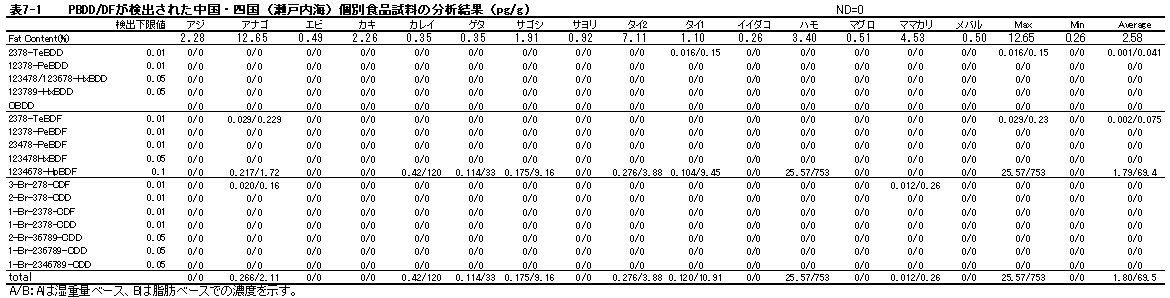
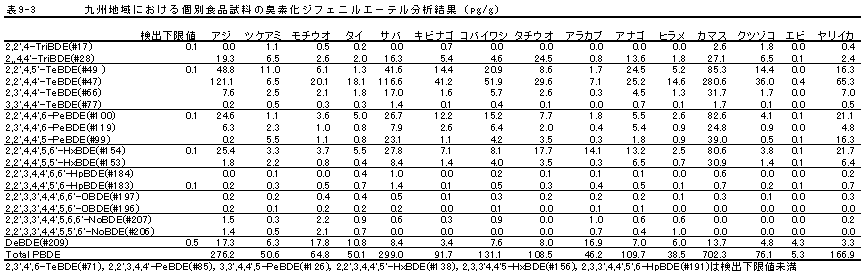
| 1. | 個別食品における臭素化ダイオキシン及び臭素化ジフェニルエーテル汚染実態調査 今回、測定した臭素化ダイオキシンの検出下限値は、TeBDD/DF, PeBDD/DFが0.01 pg/g、HxBDD/DFが0.05pg/g、HpBDFが0.1pg/gであった。なお、OBDDの検出下限値は、測定毎の変動が大きく、一律には決められなかった。また、MonoBTriCDD/DF及びMonoBTeCDD/DFが0.01pg/g、MonoBPeCDD〜Mono BHpCDDが0.05pg/gであった。図1はNative体PBDD/DFのHRGC/HRMSクロマトグラムである。 分析対象となった魚介類食品は、表1に示すように三地域から集めた生鮮魚介44試料及び加工食品1試料計45試料であった。九州(天草)、中部(伊勢湾・三河湾)のいずれの魚介類試料からも、PBDD/DFは検出されなかった。しかし、表7に示すように中国・四国(瀬戸内海)の試料の数例から、PBDD/PBDFを検出した。検出した試料は抽出からの再前処理を行い、DB-5及びMP65HTの2種類のカラムを用いたHRGC/HRMS測定によって確認した(図2-1-1〜2-4)。具体的には、1,2,3,4,6,7,8-HpBDFをハモ、カレイ、タイNo.2、アナゴ、サゴシ、ゲタ、タイNo.1の7試料から、25.6pg/g(ハモ)〜0.104pg/g(タイNo.1)検出した。さらに、2,3,7,8-TeBDDを0.016pg/g(タイNo.1)、2,3,7,8-TeBDFを0.029pg/g(アナゴ)、また、3-Br-2,7,8-CDFを0.020pg/g(アナゴ)検出した。平成15年度の調査では、キハダマグロとマスに1,2,3,4,6,7,8-HpBDFを各0.05pg/g、また、3-Br-2,7,8-CDFをそれぞれ0.02pg/g(イシダイ)、0.03pg/g(アラカブ)検出していることから、1,2,3,4,6,7,8-HpBDF及び3-Br-2,7,8-CDFは高頻度に検出される臭素系ダイオキシンと考えられる。脂肪ベース濃度は、ハモ(753pg/g fat)、カレイ(120pg/g fat)、ゲタ(33pg/g fat)など底質に棲息する魚介類に特に高く、底質汚染がその原因であることが示唆される。個別食品毎の総TEQ濃度では、表7-2及び8に示すように、ND=0とした場合、0(アジ、エビ、カキ、サヨリ、イイダコ、マグロ、メバル等)〜0.256 pgTEQ/g(ハモ)、平均では0.02pgTEQ/g(中国・四国(瀬戸内海))、0.006pgTEQ/g(三地域全体)となった。ND=1/2xLODとした場合では、0.035pgTEQ/g(アジ、エビ、カキ、サヨリ、イイダコ、マグロ、メバル等)〜0.29pg TEQ/g(ハモ)、平均では0.054pgTEQ/g(中国・四国(瀬戸内海))、0.041pgTEQ/g(三地域全体)の汚染濃度となった。脂肪ベースTEQでは、ハモが7.52pgTEQ/gfatと最大値を示したが、これは、検出した1,2,3,4,6,7,8-HpBDFの寄与が大きい。今回の定量値の評価について、構成する魚類等も異なり、単純比較は困難である。あえて、平成15年度調査5)(厚生労働省科学研究費補助金食品安全確保事業佐々木主任研究者)の鮮魚(55種類)の塩素化ダイオキシン類平均値1.287pgTEQ/gを参考値として用いると、今回のモノブロムポリクロロダイオキシンを含む臭素系ダイオキシンの平均値は、その値に比べ、0.5%(ND=0)〜3.2%(ND=1/2xLOD)であり、非常に小さいと言える。平成15年度の環境省での排出等実態調査4)では、難燃剤製造工場や難燃繊維加工工場からの排ガス、排出水、降下煤じん、付近の公共用水域水質及び底質、難燃剤及び加工品を調査しており、特に一部の工場底質から、1,2,3,4,6,7,8-HpBDF及び3-Br-2,7,8-CDFの他にも、2,3,7,8-TeBDF、1,2,3,7,8-PeBDF、 2,3,4,7,8-PeBDF、OBDD、OBDFが検出されたと報告している。中国・四国の試料購入場所が内海に面した町であり、周辺に存在する工業地帯の影響が強いと考えられる。したがって、今回検出されなかった上記の残りの化合物についても、微量かもしれないが、今後別の食品から検出されることが予想される。 一方、関連化合物としてのPBDEについては、測定した生鮮魚介試料すべてから数種の異性体が検出され、その定量値を同じく表9-1〜9-3に示している。また、その異性体分布を図3に示した。PBDE異性体構成は4臭素化体である#47が主成分であり、エビやタコ、及び中国・四国ではカレイ、ゲタ、ハモなどの底質に棲息する魚種にDBDEの寄与が大きい傾向が見られる。また、マグロ、アラカブについてもDBDEが大きかったが、原因についてはまだ明らかでない。表10に示すように、個体別総濃度平均値で見ると、中部地域が他の二地域よりも高い傾向が認められた。中部ではサワラ、サバ、ブリに1ng/gを超えるPBDEが検出された。これは、海域の汚染に加え、養殖餌のPBDE汚染が影響していることも考えられる。また、三地域とも、PBDE総濃度は脂肪含量と相関傾向があることが確認され(図4)、PBDEの高い生物濃縮性が示唆された。 |

| 図1 | Native-PBDD/DF標準溶液のマスクロマトグラム |

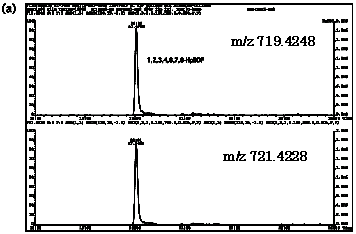
| 図2-1 | ハモにおける1,2,3,4,6,7,8-HpBDFのマスクロマトグラム |
| (a)DB-5 | (b)MP65HT |
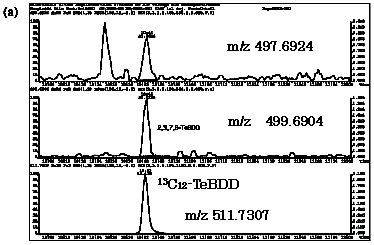
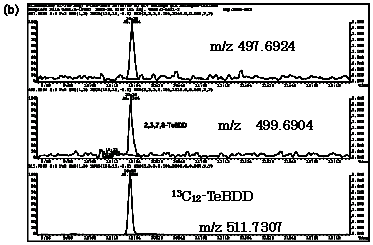
| 図2-2 | タイ(1)における2,3,7,8-TeBDDのマスクロマトグラム |
| (a)DB-5 | (b)MP65HT |
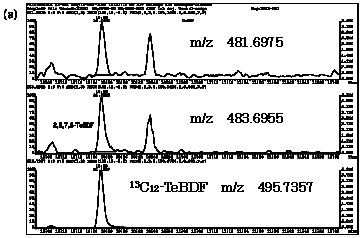
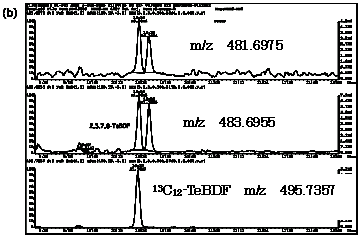
| 図2-3 | アナゴにおける2,3,7,8-TeBDFのマスクロマトグラム |
| (a)DB-5 | (b)MP65HT |
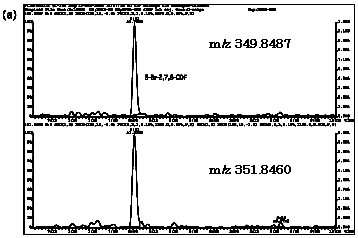
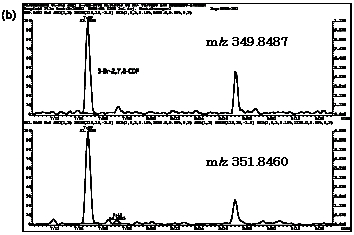
| 図2-4 | アナゴにおける3-Br-2,7,8-CDFのマスクロマトグラム |
| (a)DB-5 | (b)MP65HT |
| 表8 | 魚介類中臭素系ダイオキシン総括表 |
| 購入場所 | No. | 魚名 | 天然・養殖の別 | PBDD/DF | ||
| ND=0 | ND=1/2LOD | |||||
| pgTEQ/g、W.B. | pgTEQ/g、F.B. | pgTEQ/g、W.B. | ||||
| 九州 | 1 | マアジ | 天然 | 0.000 | 0.000 | 0.035 |
| 2 | アナゴ | 天然 | 0.000 | 0.000 | 0.035 | |
| 3 | アラカブ | 天然 | 0.000 | 0.000 | 0.035 | |
| 4 | ヤリイカ | 天然 | 0.000 | 0.000 | 0.035 | |
| 5 | コバイワシ | 天然 | 0.000 | 0.000 | 0.035 | |
| 6 | エビ足赤 | 天然 | 0.000 | 0.000 | 0.035 | |
| 7 | カマス | 天然 | 0.000 | 0.000 | 0.035 | |
| 8 | キビナゴ | 天然 | 0.000 | 0.000 | 0.035 | |
| 9 | クツゾコ | 天然 | 0.000 | 0.000 | 0.035 | |
| 10 | マサバ | 天然 | 0.000 | 0.000 | 0.035 | |
| 11 | タイ | 天然 | 0.000 | 0.000 | 0.035 | |
| 12 | タチウオ | 天然 | 0.000 | 0.000 | 0.035 | |
| 13 | ツケアミ | 加工食品 | 0.000 | 0.000 | 0.035 | |
| 14 | ヒラメ | 天然 | 0.000 | 0.000 | 0.035 | |
| 15 | モチ魚 | 天然 | 0.000 | 0.000 | 0.035 | |
| 平均値 | 0.000 | 0.000 | 0.035 | |||
| 中国・ 四国 |
1 | 地アジ | 天然 | 0.000 | 0.000 | 0.035 |
| 2 | アナゴ | 天然 | 0.007 | 0.055 | 0.040 | |
| 3 | エビ | 天然 | 0.000 | 0.000 | 0.035 | |
| 4 | カキ | 養殖 | 0.000 | 0.000 | 0.035 | |
| 5 | カレイ | 天然 | 0.004 | 1.209 | 0.038 | |
| 6 | ゲタ | 天然 | 0.001 | 0.326 | 0.035 | |
| 7 | サゴシ | 天然 | 0.002 | 0.092 | 0.036 | |
| 8 | サヨリ | 天然 | 0.000 | 0.000 | 0.035 | |
| 9 | マダイ | 天然 | 0.017 | 1.545 | 0.046 | |
| 10 | マダイ | 養殖 | 0.003 | 0.039 | 0.037 | |
| 11 | イイダコ | 天然 | 0.000 | 0.000 | 0.035 | |
| 12 | ハモ | 天然 | 0.256 | 7.520 | 0.290 | |
| 13 | マグロ | 天然 | 0.000 | 0.000 | 0.035 | |
| 14 | ママカリ | 天然 | 0.001 | 0.026 | 0.036 | |
| 15 | メバル | 天然 | 0.000 | 0.000 | 0.035 | |
| 平均値 | 0.019 | 0.721 | 0.054 | |||
| 中部 | 1 | アジ | 天然 | 0.000 | 0.000 | 0.035 |
| 2 | スルメイカ | 天然 | 0.000 | 0.000 | 0.035 | |
| 3 | カマス | 天然 | 0.000 | 0.000 | 0.035 | |
| 4 | キス | 天然 | 0.000 | 0.000 | 0.035 | |
| 5 | サゴシ | 天然 | 0.000 | 0.000 | 0.035 | |
| 6 | サバ | 天然 | 0.000 | 0.000 | 0.035 | |
| 7 | サワラ | 天然 | 0.000 | 0.000 | 0.035 | |
| 8 | スズキ | 天然 | 0.000 | 0.000 | 0.035 | |
| 9 | セイゴ | 天然 | 0.000 | 0.000 | 0.035 | |
| 10 | タイ | 養殖 | 0.000 | 0.000 | 0.035 | |
| 11 | タイ | 養殖 | 0.000 | 0.000 | 0.035 | |
| 12 | タイ | 養殖 | 0.000 | 0.000 | 0.035 | |
| 13 | タコ | 天然 | 0.000 | 0.000 | 0.035 | |
| 14 | ブリ | 養殖 | 0.000 | 0.000 | 0.035 | |
| 15 | ボラ | 天然 | 0.000 | 0.000 | 0.035 | |
| 平均値 | 0.000 | 0.000 | 0.035 | |||
| 最大値 | 0.256 | 7.520 | 0.290 | |||
| 最小値 | 0.000 | 0.000 | 0.035 | |||
| 平均値 | 0.006 | 0.240 | 0.041 | |||
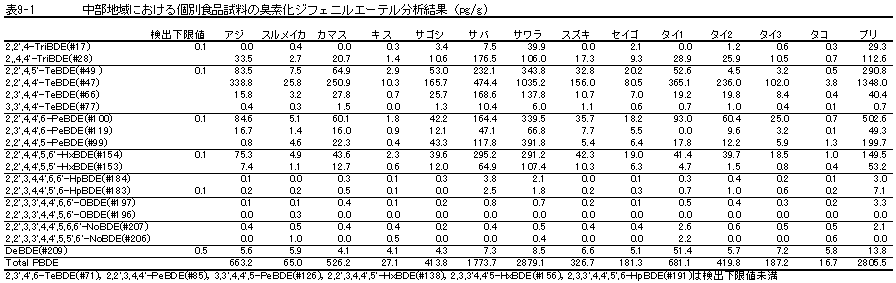
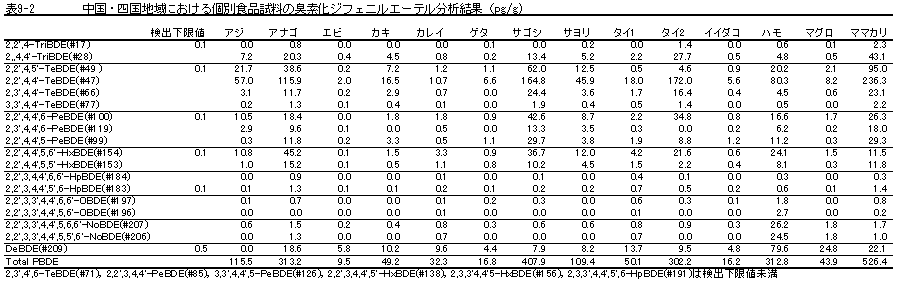
中部地域 |
中国・四国地域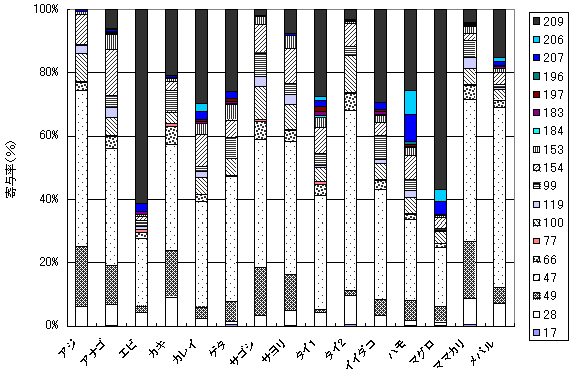 |
| 図3-1 | 個別食品におけるPBDE異性体構成 上段:中部 下段:中国・四国 |
九州地域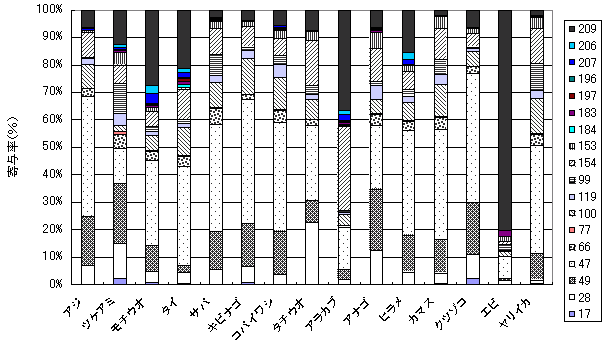 |
| 図3-2 | 個別食品におけるPBDE異性体構成 九州 |
| 表10 | 魚介類中臭素化ジフェニルエーテル総括表 |
| 購入場所 | No. | 魚名 | 天然・養殖の別 | 脂肪含量 (%) |
ΣPBDE | |
| ng/g、W.B. | ng/g、F.B. | |||||
| 九州 | 1 | マアジ | 天然 | 5.67 | 0.28 | 4.87 |
| 2 | アナゴ | 天然 | 7.52 | 0.11 | 1.46 | |
| 3 | アラカブ | 天然 | 0.37 | 0.05 | 12.45 | |
| 4 | ヤリイカ | 天然 | 0.38 | 0.17 | 44.46 | |
| 5 | コバイワシ | 天然 | 0.74 | 0.13 | 17.60 | |
| 6 | エビ足赤 | 天然 | 0.19 | 0.01 | 2.82 | |
| 7 | カマス | 天然 | 9.88 | 0.70 | 7.11 | |
| 8 | キビナゴ | 天然 | 1.82 | 0.09 | 5.04 | |
| 9 | クツゾコ | 天然 | 1.42 | 0.08 | 5.34 | |
| 10 | マサバ | 天然 | 20.45 | 0.30 | 1.46 | |
| 11 | タイ | 天然 | 1.01 | 0.05 | 4.95 | |
| 12 | タチウオ | 天然 | 0.33 | 0.11 | 32.56 | |
| 13 | ツケアミ | 加工食品 | 1.02 | 0.05 | 4.95 | |
| 14 | ヒラメ | 天然 | 0.30 | 0.04 | 12.88 | |
| 15 | モチ魚 | 天然 | 3.93 | 0.06 | 1.65 | |
| 平均値 | 3.67 | 0.15 | 10.64 | |||
| 中国・ 四国 |
1 | 地アジ | 天然 | 2.28 | 0.12 | 5.07 |
| 2 | アナゴ | 天然 | 12.65 | 0.31 | 2.48 | |
| 3 | エビ | 天然 | 0.49 | 0.01 | 1.94 | |
| 4 | カキ | 養殖 | 2.26 | 0.05 | 2.18 | |
| 5 | カレイ | 天然 | 0.35 | 0.03 | 9.29 | |
| 6 | ゲタ | 天然 | 0.35 | 0.02 | 4.81 | |
| 7 | サゴシ | 天然 | 1.91 | 0.41 | 21.34 | |
| 8 | サヨリ | 天然 | 0.92 | 0.11 | 11.83 | |
| 9 | マダイ | 天然 | 1.10 | 0.05 | 4.54 | |
| 10 | マダイ | 養殖 | 7.11 | 0.30 | 4.25 | |
| 11 | イイダコ | 天然 | 0.26 | 0.02 | 6.15 | |
| 12 | ハモ | 天然 | 3.40 | 0.31 | 9.20 | |
| 13 | マグロ | 天然 | 0.51 | 0.04 | 8.55 | |
| 14 | ママカリ | 天然 | 4.53 | 0.53 | 11.61 | |
| 15 | メバル | 天然 | 0.50 | 0.12 | 23.52 | |
| 平均値 | 2.58 | 0.16 | 8.45 | |||
| 中部 | 1 | アジ | 天然 | 4.72 | 0.66 | 14.04 |
| 2 | スルメイカ | 天然 | 1.19 | 0.06 | 5.45 | |
| 3 | カマス | 天然 | 4.50 | 0.53 | 11.70 | |
| 4 | キス | 天然 | 0.46 | 0.03 | 5.82 | |
| 5 | サゴシ | 天然 | 1.30 | 0.41 | 31.78 | |
| 6 | サバ | 天然 | 13.65 | 1.77 | 12.99 | |
| 7 | サワラ | 天然 | 11.27 | 2.88 | 25.56 | |
| 8 | スズキ | 天然 | 0.72 | 0.33 | 45.68 | |
| 9 | セイゴ | 天然 | 0.98 | 0.18 | 18.50 | |
| 10 | タイ | 養殖 | 8.12 | 0.68 | 8.39 | |
| 11 | タイ | 養殖 | 9.36 | 0.42 | 4.49 | |
| 12 | タイ | 養殖 | 4.10 | 0.19 | 4.57 | |
| 13 | タコ | 天然 | 0.35 | 0.02 | 4.81 | |
| 14 | ブリ | 養殖 | 17.28 | 2.81 | 16.24 | |
| 15 | ボラ | 天然 | 1.69 | 0.25 | 14.94 | |
| 平均値 | 5.31 | 0.75 | 15.00 | |||
| 最大値 | 20.45 | 2.88 | 45.68 | |||
| 最小値 | 0.19 | 0.01 | 1.46 | |||
| 平均値 | 3.85 | 0.35 | 11.36 | |||
中部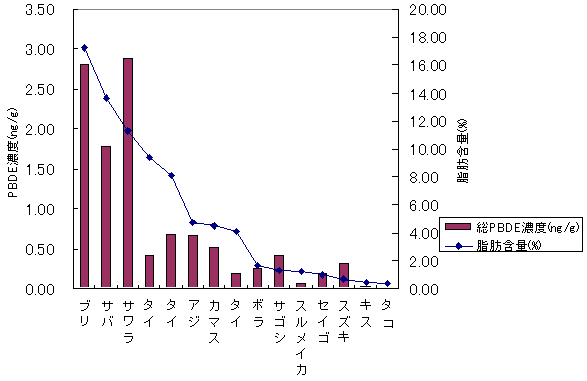
|
中国・四国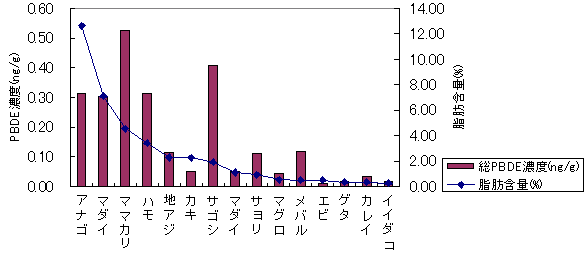
|
| 図4-1 | 個別食品の脂肪含量とPBDE濃度の関係 上段:中部 下段:中国・四国 |
九州
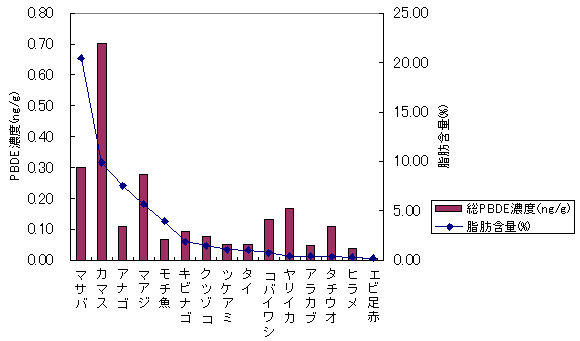 |
| 図4-2 | 個別食品の脂肪含量とPBDE濃度の関係 九州 |
| 2 | テトラブロモビスフェノールA(TBBPA)の分析 |
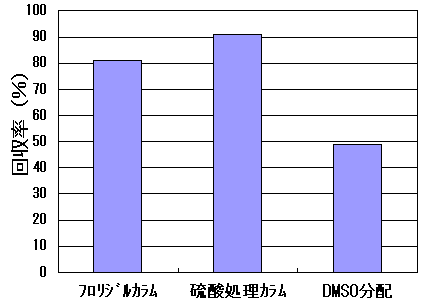
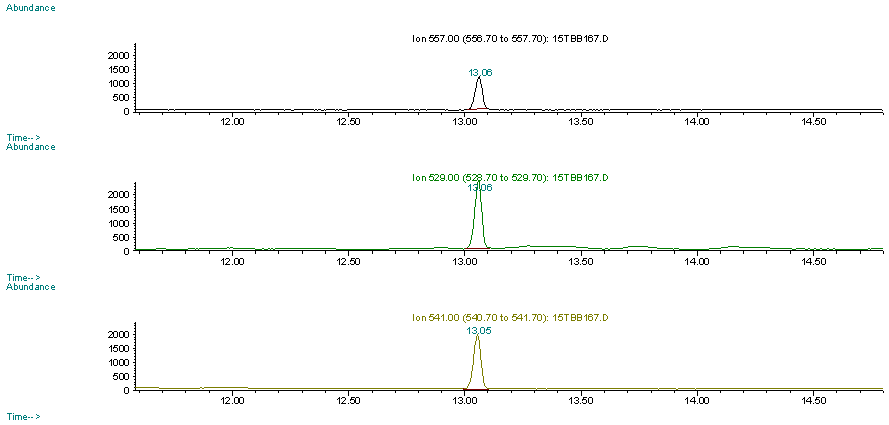
| 2-1 | 分析方法の検討 TBBPAの分析方法については、環境庁の平成11年度化学物質分析法開発調査報告書(その1)に示されている分析法(新潟県保健環境科学研究所)に準拠した。そして、多種類の魚介類試料を分析するために、試料の抽出と誘導体化後の精製方法について予め検討を行った。試料の抽出過程は、自動化するために高速溶媒抽出(ASE)を用いた抽出法を検討した。メタノールを抽出溶媒として用いて,振とう抽出(回収率80.3%)と同等の回収率(89.5%)が得られた。高速溶媒抽出における条件を表6に示す。 TBBPA誘導体化後の精製法として,フロリジルカラム,硫酸シリカゲルカラム,ヘキサン/DMSO分配の3種類の方法を検討した。表11に各精製法の条件を示す。ヘキサン/DMSO分配による精製は回収率が低かった(図5)。また,フロリジルカラム,硫酸シリカゲルカラムのみの精製では,マトリックスの多い魚介類で妨害成分の除去が不十分であったため,両方のカラム精製を行うことにした。図6に分析操作(検体採取、抽出、精製過程)のフローを示す。アジを用いて添加回収試験(n=3)を行った結果、回収率は74.6±2.9%であり、良好であった。図7に誘導体化後のTBBPA標準溶液のクロマトグラム、図8に実試料のクロマトグラムを示す。 |
|
|
均一化した試料10g
|
| 図6 | 魚介類試料におけるTBBPAの分析方法 |
 |
Native-TBBPA(557) |
| Native-TBBPA(529) | |
| 13C12-TBBPA(541) |
| 図7 | TBBPA標準溶液(0.5ppm)におけるSIMクロマトグラム |
 |
Native-TBBPA(557) |
| Native-TBBPA(529) | |
| 13C12-TBBPA (541) |
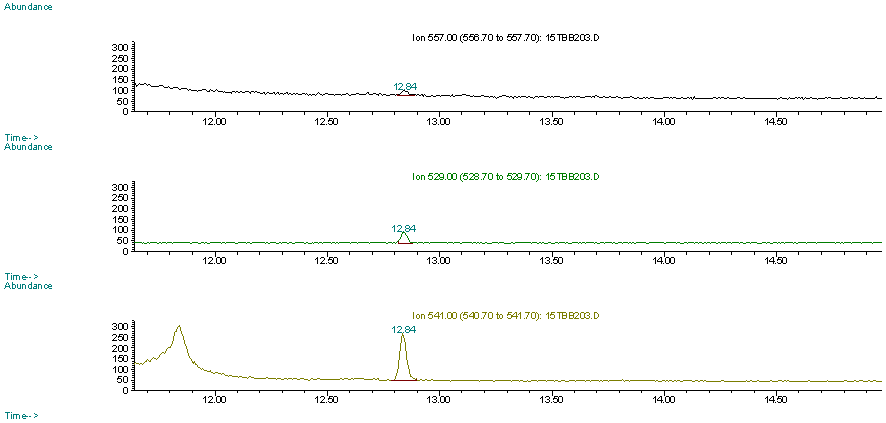
| 図8 | 試料(サンマ)におけるTBBPAのSIMクロマトグラム |
| 2-2 | トータルダイエット試料の分析 トータルダイエット試料第1群から13群までの分析結果を表12に示す。13C12-ラベル体の回収率は50.5-95.8%の範囲で、第7群(有色野菜)以外は70%以上の良好な回収率であった。第10群(魚介類)の試料BからTBBPAが検出された(濃度0.46ng/g)。その他の食品群はすべてND(<0.1ng/g)であった。TBBPAの摂取量はダイオキシン類やPCBと同様に魚介類からの寄与が高いことが示唆された。また、分析結果より、TBBPAの一日当摂取量はND=0で計算した場合は18.8ng/day、ND=LOD/2で計算した場合は110.2ng/dayと算出された。今回の分析では第10群以外のすべての食品群でNDという結果であったため、ND=0とした場合と、ND=LOD/2とした場合での一日当摂取量に5倍以上の差が見られた。より正確に一日当摂取量と推定するためには、より高感度な分析を行う必要があると考えられた。 |
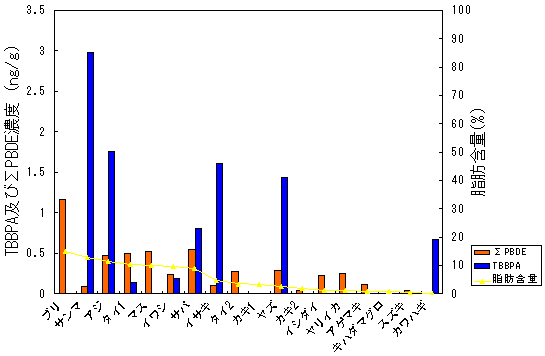
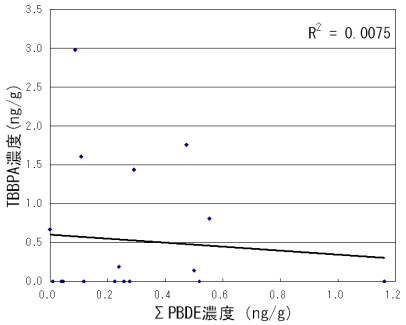
| 2-3 | 魚介類試料の分析 魚介類の個別試料(計27件)を分析した結果を表13(生鮮魚)、表14(加工食品)、表15(海藻類)に示す。13C12-ラベル体の回収率は53.7-97.8%の範囲で、ブリ、開きアジ、煮干し、わかめ、のり以外は70%以上の良好な回収率であった。生鮮魚介類のサンマ、アジ、イサキ、ヤズ、サバ、カワハギ、イワシ、タイの8検体からTBBPAが検出された。最も濃度が高かったのはサンマの2.98ng/gであった。今回分析を行った加工食品と海藻類からは検出されなかった。試料の分析における検出下限値は0.1ng/g(SN=10)であった。 図9は生鮮魚介類におけるTBBPAおよびΣPBDE濃度、魚可食部中の脂肪含量を示している。昨年度測定したΣPBDE濃度が高かったブリ、マスからはTBBPAは検出されなかった。逆に、カワハギのようにPBDEはNDであったがTBBPAが検出された試料もあった。図10はTBBPA濃度とΣPBDE濃度の相関を示している。今回の結果からはTBBPA濃度とΣPBDE濃度の相関は見られなかった。今後さらに、様々な食品における臭素系難燃剤の汚染状況を明らかにするために、サンプルの種類や検体数を増やして調査を継続していきたいと考えている。 |
| E. | 健康危険情報 特になし |
| F. | 研究発表 |
| 1. | 論文発表
|
| 2. | 学会・協議会発表
|
文献
| 1. | Darnerud P.P., Eriksen G.S., Jóhan-nesson T., Larsen P.B., and Viluksela M.:Polybrominated Diphenyl Ethers:Occurrence,Dietary Exposure,and Toxi-cology. Environ.Health Perspec., 109, supplement1 49-66, 2001. |
| 2. | Meironyté D, Noren K., Bergman Å.:Analysis of Polybrominated Diphenyl Ethers in Swedish Human Milk. A Time-related Trend Study,1972-1997.J. Toxicol. Environ. Health Part A, 58:329-341,1999. |
| 3. | Choi JW, Fujimaki TS, Kitamura K, Hashimoto S, Ito H, Suzuki n, Sakai S, Morita M.: Polybrominated dibenzo-p-dioxins, dibenzofurans, and polybromi-nated diphenyl ethers in Japanese human tissue. Environ Sci Technol.Mar. 1;37(5):817-21, 2003. |
| 4. | http://www.env.go.jp/chemi/dioxin/chosa(2005)環境省 平成15年度臭素系ダイオキシン等排出実態調査結果報告書 平成17年3月 |
| 5. | 平成15年度厚生労働科学研究費補助金研究報告書 「ダイオキシンの汚染実態把握及び低減化に関する研究」 |
| 表12 | トータルダイエット試料の分析結果(試料中濃度) |
| TBBPA濃度 (ng/g) |
回収率 (%) |
|
| 第1群(米類) | ND | 72.2 |
| 第2群(米以外の穀類) | ND | 92.2 |
| 第3群(砂糖・菓子類) | ND | 70.8 |
| 第4群(油脂類) | ND | 80.8 |
| 第5群(豆類) | ND | 86.5 |
| 第6群(果実類) | ND | 89.7 |
| 第7群(緑黄色野菜) | ND | 50.5 |
| 第8群(その他の野菜) | ND | 80.1 |
| 第9群(調味嗜好飲料) | ND | 92.7 |
| 第10群(魚介類)A | ND | 79.3 |
| 第10群(魚介類)B | 0.46 | 86.4 |
| 第11群(肉・卵類)A | ND | 79.9 |
| 第11群(肉・卵類)B | ND | 85.5 |
| 第12群(乳類)A | ND | 87.0 |
| 第12群(乳類)B | ND | 91.2 |
| 第13群(その他の食品) | ND | 95.8 |
| 表13 | 生鮮魚介類の分析結果 |
| TBBPA濃度 (ng/g) |
回収率 (%) |
|
| サンマ | 2.98 | 81.4 |
| アジ | 1.76 | 74.6 |
| イサキ | 1.61 | 81.7 |
| ヤズ | 1.44 | 96.0 |
| サバ | 0.81 | 74.8 |
| カワハギ | 0.67 | 98.5 |
| イワシ | 0.19 | 97.8 |
| タイ1 | 0.14 | 70.7 |
| タイ2 | ND | 86.4 |
| ブリ | ND | 61.5 |
| キハダマグロ | ND | 89.5 |
| マス | ND | 90.7 |
| スズキ | ND | 78.0 |
| ヤリイカ | ND | 97.6 |
| アゲマキ | ND | 83.5 |
| カキ1 | ND | 72.2 |
| カキ2 | ND | 91.8 |
| 表14 | 魚介類加工食品の分析結果 |
| TBBPA濃度 (ng/g) |
回収率 (%) |
|
| うなぎの蒲焼 | ND | 85.9 |
| 開きアジ | ND | 61.9 |
| 鯛のすぼまき | ND | 85.2 |
| 魚肉ソーセージ | ND | 91.5 |
| 煮干し | ND | 62.4 |
| 表15 | 海藻類の分析結果 |
| TBBPA濃度 (ng/g) |
回収率 (%) |
|
| ひじき | ND | 70.7 |
| 昆布 | ND | 98.8 |
| わかめ | ND | 61.5 |
| のり | ND | 53.8 |
|
|