| ┌ │ └ |
平成16年12月15日 厚生労働省 |
┐ │ ┘ |
| 1 基本的考え方 |
| ○ | 「なぜ、いわゆる「混合診療」の解禁が主張されるのか」という原点に立ち返って考えてみれば、患者の立場から個別に見たときに保険外の負担が過大な事例があり、現行制度では患者の切実な要望に的確に対応し切れていない実態に辿り着く。 |
| ○ | この際、保険外の負担の在り方を根本的に見直し、患者の切実な要望に迅速かつ的確に対応できるよう、改革を行うこととする。 |
| 2 国内未承認薬等の使用について |
| ○ | 国内未承認薬の使用については、「国内で承認されるまでに時間がかかり、欧米で承認されているのに、全額自己負担でないと使えない。」といった患者からの要望がある。 |
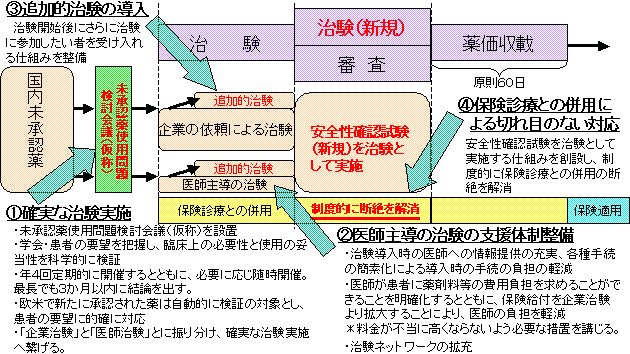
| ○ | 治験とは、国内未承認薬の使用機会の提供と、使用者の安全性の確保を両立させるための仕組みである。さらに、治験には、治験に参加した患者のデータが評価され、その後の医療の進歩に活かされるという側面がある。 国内未承認薬については、確実な治験の実施に繋げ、制度的に切れ目なく保険診療との併用が可能な体制を確立することとする。具体的には、(1)確実な治験の実施、(2)医師主導の治験の支援体制の整備、(3)追加的治験の導入及び(4)制度的な保険診療との断絶の解消の措置を講じるとともに、薬事承認の優先審査等により迅速な保険導入を図る。 |
| ○ | 医薬品の臨床使用に当たっては、使用者への未承認薬の使用機会の提供と安全確保との両立が重要であり、未承認薬の有効性、安全性等について、一定の科学的根拠に基づく評価を行うことが必要である。 このため、厚生労働大臣の設置に係る専門家からなる「未承認薬使用問題検討会議(仮称)」を設け、学会・患者要望の定期的な把握と科学的な評価を行うとともに、これを踏まえ、企業の依頼による治験と医師主導の治験とに振り分け、確実な治験実施に繋げる。 会議は、年4回定期的に開催するとともに、必要に応じ随時開催することで、学会・患者要望のある未承認薬の取扱いについては、最長でも3か月以内に結論を出すものとする。 また、米、英、独及び仏で新たに承認された薬については、自動的に検証の対象とすることで患者の要望に的確に対応し、おおむねすべての事例について、確実な治験の実施に繋げる。 |
| ○ | 医師主導の治験を適切かつ円滑に実施するため、医師主導の治験に係る相談に積極的に応じるとともに、医薬品を提供する製薬企業に対し、当該治験を行おうとする医師への適切な情報提供を指導するなど実務上の支援を行う。さらに、医師主導の治験に係る必須文書の作成、保存等については、製薬企業の依頼による治験に係るものと併せて、本年10月に既に合理化を図ったところであるが、今後とも、医療現場からの要望を踏まえ、治験医師の負担が過大なものとならないよう、必要に応じ、手続の簡素化等を行っていく。 |
| ○ | 医師主導の治験においては、治験医師が患者に薬剤料等の費用負担を求めることは特に禁止されていないが、現在、これが必ずしも明らかになっていないことから、これを明確化する。 また、現在、治験に係る診療の保険給付の範囲からは、すべての検査及び画像診断並びに当該治験の対象とされる薬物の予定される効能又は効果と同様の効能又は効果を有する医薬品に係る診療が除かれているが、医師主導の治験について保険給付の範囲を拡大することにより、治験医師の負担を軽減する。 なお、治験において患者に薬剤料等の費用負担を求めるに当たっては、料金が不当に高くならないよう、必要な措置を講じる。 |
| ○ | 治験を促進するために平成15年8月に開始された大規模治験ネットワークについて、治験に協力する医療機関の大幅な拡充を図る。また、普及状況が十分でない医師主導の治験については、大規模治験ネットワークをはじめとした各種治験ネットワークを通じて学会や関係団体との連携を強化し、制度の一層の普及啓発や医師主導の治験に係る患者要望の収集に努めるとともに、患者が主治医を通じて必要な治験に係る情報を入手できるような体制の構築に努める。
|
| ○ | 治験開始後に、新たに治験参加を希望する患者に対応するため、追加的治験を導入し、当該患者を受け入れる仕組みを整備する。 |
| ○ | 関連学会及び患者団体等から要望があり、医療上必要性が高いと認められる医薬品については、薬事法上の承認申請のための治験が終了した後も、主治医と製薬企業との適切な連携の下、承認後の使用実態を想定した新たな安全性確認試験を治験として実施する仕組みを創設することにより、制度的に保険診療との併用の断絶を解消する。 |
| ○ | なお、『乳がん治療により摘出された乳房の再建術』については、現在、自家組織を使用した皮弁術については保険適用となっているが、シリコンパッド等の人工乳房を使用した形成術については、使用材料が薬事法上未承認であることもあり、保険適用外となっている。 これについては、使用材料に係る治験の実施により保険診療との併用が可能となる途が開かれることとなる。乳がん治療の一環である場合には、保険診療との併用が可能となることから、その旨を明確化することとする。 |
| 3 医療技術について |
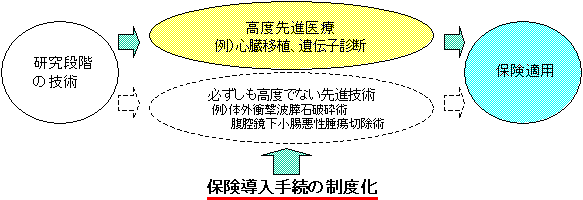
| ○ | 医療技術については、「高度先進医療として認められるまでに時間がかかる。高度先進医療以外の技術については、保険導入のための手続がよく分からない」といった医療現場からの指摘がある。 |
| ○ | ついては、必ずしも高度でない先進技術(体外衝撃波膵石破砕術、腹腔鏡下小腸悪性腫瘍切除術等)について、保険導入の前段階として、保険診療との併用を認めるとともに、高度先進医療も含め、保険導入手続の透明化及び迅速化を図ることとする。 |
| ○ | 保険診療と保険外診療との併用を認めるべきであるとの指摘がなされている、『保険未収載の確立された治療法』、『患者の価値観により左右される診療行為』等について、適切なルールの下に併用を認めるため、必ずしも高度でない先進的な医療技術についても、保険診療と保険外診療との併用を認める。 |
| ○ | 併用が認められるためには、医療技術の有効性及び安全性が確保されていることのほか、保険医療費の膨張を抑える観点から、必ずしも高度である必要はないが、一定程度の先進性があり、効率的であることなどが求められる。このような条件を満たす医療技術については、医療技術ごとに医療機関に求められる一定水準の要件を設定し、該当する医療機関は届出により実施可能な仕組みを新たに設けることとする。 |
| ○ | 医療技術ごとに実施可能な医療機関の基準を設定するためには、医療技術の科学的評価が必要であり、厚生労働大臣の設置に係る専門家会議を設けることとする。当該会議における検討に当たっては、検討過程の透明性の確保や検討の迅速性に配慮することとする。 |
| ○ | また、不当な患者負担の増大を防止するために、その実施に当たっては、保険医療機関に対し、関係する事項の掲示、十分な情報提供の下での患者の自由な選択と同意、自費負担に係る徴収額と明確に区分した領収書の交付、実施状況の地方社会保険事務局長への定期的な報告等を求めることとする。 |
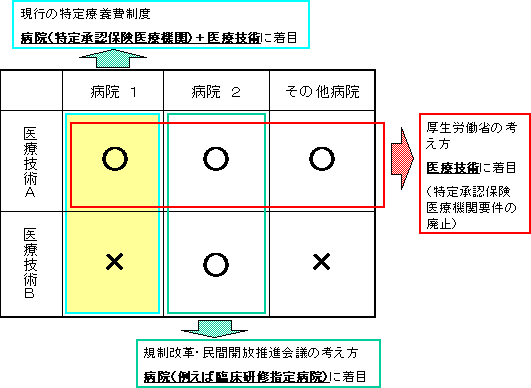
| ○ | 「一定水準以上の医療機関に包括的に混合診療を解禁すべき」という考え方は、医療機関に着目して、「混合診療」を認める範囲を画定するものである。しかし、医療技術ごとに必要な専門性、設備等は異なるため、すべての医療技術に通ずる医療機関の水準を一律に設定することは困難である。 |
| ○ | したがって、保険診療と保険外診療との併用を認める範囲については、医療技術ごとに医療機関に求められる一定水準の要件を設定し、該当する医療機関は届出により実施可能な仕組みを新たに設けることが適当である。 このような手法により、約100技術、約2,000医療機関が新たに対象となることが見込まれる。これにより、実質的に「一定水準以上」の医療機関への拡大に対応できる上に、医療技術によっては、むしろ広い範囲の医療機関で実施可能となる。 |
| ○ | 医療機関に着目して範囲を画定した場合には、保険診療との併用サービスの範囲は医療機関の判断で画定されるので、有効性及び安全性は事後的にしか検証されない。事前確認を経ない場合には、安全性に関し、重大な問題を引き起こすおそれがある。一方、医療技術ごとに医療機関の水準を設定した場合には、技術ごとに有効性及び安全性を事前確認できるので、いわば「無理のない」形で対応することを可能となる。 |
| ○ | 現在の高度先進医療の審査は、医療技術の有効性及び安全性を確認し、かつ、当該技術ごとに医療機関を審査し、承認する仕組みとなっている。この審査に要する期間は、通常1年程度であり、「審査の更なる迅速化や速やかな保険収載が必要ではないか」との指摘がなされている。 |
| ○ | 今後は、医療技術ごとに一定水準の要件を設定し、該当すれば届出により直ちに実施可能な仕組みとすることにより、相当程度透明化及び迅速化が図られることとなるが、さらに、以下のような措置を講ずることとする。
|
| ○ | 現行の高度先進医療については、以下のような指摘がなされている。
|
| ○ | このような指摘についても、医療技術ごとに医療機関に求められる一定水準の要件を設定し、該当する医療機関は届出により実施可能な仕組みを新たに設けることにより、対応が可能である。 |
| ○ | なお、当面は、以下のような見直しを行うこととする。
|
| 4 制限回数を超える医療行為について |
| ○ | 制限回数を超える医療行為については、「もう1回検査をしてほしいが、全額自己負担でないと、制限回数以上の検査を受けられない」といった患者からの要望がある。 |
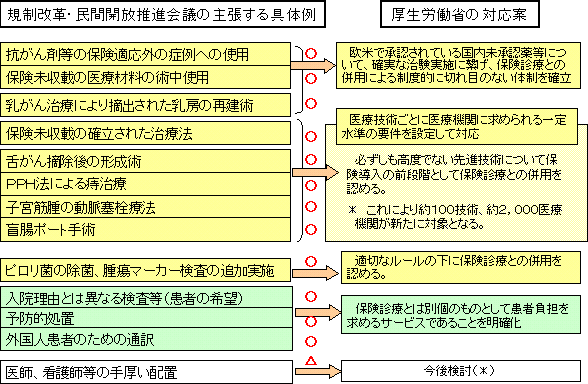
| ○ | ついては、『保険適用回数が制限されている医療行為を制限回数以上に行うこと』についても、適切なルールの下に保険診療との併用を認めることとする。 ただし、医学的な根拠が明確なものについては、保険導入を検討する。 |
| ○ | 現在、『ピロリ菌の除菌』、『腫瘍マーカー検査』等については、保険適用回数が制限されており、基礎的部分について保険給付を受けながら、制限回数以上にこれを行って患者に負担を求めることは認められていない。これについては、基本的に、保険診療との併用を認めることとするが、制限回数以上の検査を行うことのみを理由として、基礎的部分について保険給付を行うことは認めない。 また、『追加的リハビリテーション』についても、あくまで患者の要望に応じたものであるとの要件を確保しつつ、保険診療と保険外診療との併用を認めることとする。 なお、『医師、看護師等の手厚い配置』の取扱いについては、患者が保険外負担として多額の差額を求められていた付添看護の廃止(平成6年実施、平成9年完全実施)前の状況に戻ることが危惧されることから、慎重な検討が必要である。 |
| ○ | これらについても、不当な患者負担の増大を防止するために、その実施に当たっては、保険医療機関に対し、関係する事項の掲示、十分な情報提供の下での患者の自由な選択と同意、自費負担に係る徴収額と明確に区分した領収書の交付、実施状況の地方社会保険事務局長への定期的な報告等を求めることとする。 |
| 5 療養の給付と直接関係のないサービス等について |
| ○ | 現在、療養の給付とは直接関係のないサービス等について患者から実費を徴収することは、特に禁止されていないものの、『外国人患者のための通訳』など、療養の給付と直接関係のないサービス等に該当するか否かが必ずしも明らかでないものについて、その取扱いについて混乱が生じているのではないか、との指摘がある。 |
| ○ | これを踏まえ、『入院患者に対する検査及び検診』や『予防的処置』についても、療養の給付から独立して行われるものについては、原則として、患者からその費用の支払いを受けることができる旨を明確化することとする。 診療行為に付帯するサービスについても、例えば、『外国人患者のための通訳』については、患者が通訳を用意することを病院が支援するために通訳をあっせんすることは、患者と通訳サービス提供者との間の契約の問題であり、療養の給付とは無関係であることを明確化することとする。 |
| 6 改革の手順 |
| ○ | 提起されている具体的事例については、まずは現行制度の枠組みの中で対応することとし、できるものから順次実施して平成17年夏までを目途に実現する。ただし、国内未承認薬に係る施策については、平成16年度中に必要な措置を講じる。 |
| ○ | さらに、現行制度について、将来的な保険導入を前提としているものであるかどうかといった観点から、名称も含め、法制度上の整備を行うこととし、平成18年の通常国会に提出を予定している医療保険制度全般にわたる改革法案の中で対応することとする。 |
| 7 改革の考え方 |
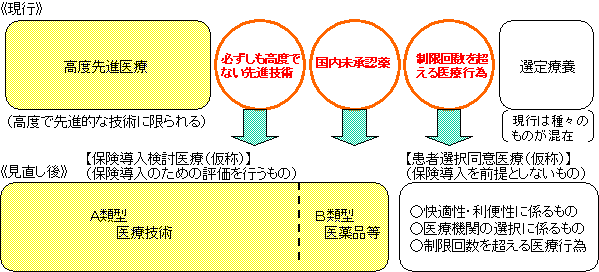
| ○ | 現在、保険診療と保険外診療との併用が認められている2つの類型については、
|
| ○ | ついては、「将来的な保険導入のための評価を行うものであるかどうか」の観点から現行制度を抜本的に見直し、「特定療養費制度」を廃止し、「保険導入検討医療(仮称)」(保険導入のための評価を行うもの)と「患者選択同意医療(仮称)」(保険導入を前提としないもの)とに新たな枠組みとして再構成する。 |
| ○ | 具体的には、以下のように位置付けることとする。
|
| ○ | このような改革により、より分かりやすい制度となるとともに、保険診療と保険外診療との併用に関する具体的要望については、今後新たに生じるものについても、おおむねすべてに対応することができる。 |
| いわゆる「混合診療」問題について |
| いわゆる「混合診療」問題についての基本的考え方 |
|
| 「なぜ、いわゆる『混合診療』の解禁が主張されるのか。」 | |
| 現行制度では、患者の切実な要望に的確に対応し切れていない。 | |
患者の立場から個別に見れば、保険外の負担が過大な事例あり。
|
|
| 「国内で承認されるまでに時間がかかり、 欧米で承認されているのに、全額自己負担 でないと使えない。」 |
確実な治験実施に繋げ、制度的に切れ目なく 保険診療との併用が可能な体制を確立 |
|
| 必ずしも高度でない先進技術について、保険導入の前段階として、保険診療との併用を認めるとともに、高度先進医療も含め、保険導入手続を透明化・迅速化 |
| * | 各技術の有効性・安全性、効率性等を確認の上、併用を認める。 |
| * | 厚生労働大臣の設置に係る専門家会議による検討を踏まえ、厚生労働大臣が医療技術ごとに医療機関に求められる一定の水準の要件を設定し、該当する医療機関は届出により実施可能な仕組みを新たに設ける。 |
| 「一定水準以上の医療機関に包括的に混合診療を解禁すべき」との意見について |
|
|
||||||||||
|
|
||||||||||
|
医療技術ごとに医療機関の水準を設定して、約100技術、約2,000医療機関に拡大可能 実質的に「一定水準以上」の医療機関への拡大に対応できる上に、技術によってはむしろより広い範囲の医療機関で実施可能 |
||||||||||
|
|
||||||||||
| 事前確認を経ない場合には、安全性に関し、重大な問題を引き起こすおそれあり。事後検証方式は無理 また、例えば大学病院であれば、本来、研究費で行うべき先端的・学術的診療も、大学病院自らの判断により、保険料財源からの支出を受けながら行うことが可能となってしまう。 |
例えば大学病院であれば、大半の医療技術について、一定水準の要件を満たす。 (いわば、有効性・安全性を確保した上での無理のない解禁」) |
| 「医療技術を個別承認する仕組みは、医療技術の進歩に遅れ、かつ不透明」との意見について |
| 規制改革・民間開放推進会議の主張 |
|
|
| 現行の高度先進医療の取扱い |
|
|
|
|
| 適切なルールの下に、保険診療との併用を認める。ただし、医学的な根拠が明確なものについては、保険導入を検討する。 |
| 例) | 腫瘍マーカー検査は、月1回に限り算定できる。 |
| 《現行》 | 《見直し後》 | |||||||||||||||||
|
|
|
|
| * | 患者が保険外負担として多額の差額を求められていた付添看護の廃止(平成6年実施、平成9年完全実施)前の状況に戻ることが危惧されることから、慎重な検討が必要 |
|
| ○ | 提起されている具体的事例については、まず現行制度の枠組みの中で対応 |
| できるものから順次実施し、平成17年夏までを目途に実現。ただし、国内未承認薬の使用に係る施策については、平成16年度中に必要な措置を講じる。 | |
| ○ | さらに、現行制度について、将来的な保険導入を前提としているものであるかどうかといった観点から、名称も含め、法制度上の整備を行う。 |
| 平成18年の通常国会に提出を予定している医療保険制度全般にわたる改革法案の中で対応 | |
| 改革の考え方 |
| ○ | 「将来的な保険導入のための評価を行うものであるかどうか」の観点から現行制度を抜本的に見直し、「特定療養費制度」を廃止し、「保険導入検討医療(仮称)」と「患者選択同意医療(仮称)」とに新たな枠組みとして再構成する。 |
| ○ | このような改革により、より分かりやすい制度となるとともに、保険診療と保険外診療との併用に関する具体的要望については、今後新たに生じるものについても、おおむねすべてに対応することができる。 |
|
| 1 | 国内未承認薬の使用について 確実な治験の実施に繋げ、制度的に切れ目なく保険診療との併用が可能な体制を確立する。 具体的には、(1)確実な治験の実施、(2)医師主導の治験の支援体制の整備、(3)追加的治験の導入及び(4)制度的な保険診療との併用の断絶の解消の措置を講じる。 その際、特に、患者の切実な要望に迅速かつ的確に対応する観点から、以下のような措置を講ずる。
|
| 2 | 先進技術への対応について 必ずしも高度でない先進技術を含め、以下のとおり、医療技術の保険導入のための手続を制度化するとともに、その迅速化及び透明化を図る。
|
| 3 | 制限回数を超える医療行為等
|
| 4 | 保険診療と保険外診療との併用の在り方について
|
| 5 | 改革の手順
|
| 内閣府特命担当大臣(規制改革、産業再生機構)、 行政改革担当、構造改革特区・地域再生担当 |