実験方法
1. 試料
| 固形試料については粉砕し均一化したのち,粉末試料についてはそのまま,分析まで-20°Cで保存した. |
2. 試薬・試液
| 標準品:アクリルアミド(純度99.9%)は関東化学(株)製の電気泳動用を使用した.アクリルアミド-1-13C(99 atom % 13C,以下AA-1-13Cと略)はCDN ISOTOPES社製を使用した. |
| 標準原液:各標準品10 mgを正確に10 mLの褐色メスフラスコに採り,精製水を加えて全量を10 mLとし1000 mg/Lの標準原液とした.本溶液は褐色の共栓付ガラス容器に入れ,冷蔵庫(4°C)に保存した. |
| 標準溶液:各標準原液を精製水で適宜希釈して標準溶液とした. |
| 臭化カリウム:和光純薬工業(株)製の特級試薬 |
| 0.1 mol/L 臭素酸カリウム溶液:臭素酸カリウム(和光純薬工業(株)製特級試薬)1.67 gを精製水に溶解して100 mLとした. |
| 1 mol/L チオ硫酸ナトリウム溶液:チオ硫酸ナトリウム五水和物(和光純薬工業(株)製特級試薬)24.82 gを精製水に溶解して100 mLとした. |
| トリエチルアミン:和光純薬工業(株)製の特級試薬 |
| フロリジルカートリッジカラム:Waters社製Sep-Pak |
| n-ヘキサン(ヘキサン),酢酸エチル及びアセトン:和光純薬工業(株)又は関東化学(株)製の残留農薬試験用試薬を使用した. |
| 無水硫酸ナトリウム:和光純薬工業(株)又は関東化学(株)製の残留農薬試験用試薬を使用した. |
| 硫酸:和光純薬工業(株)製の特級試薬 |
| 精製水:イオン交換水をガラス製の蒸留装置を用いて2回蒸留したものを使用した. |
3. 装置
| ガスクロマトグラフ/質量分析計:Hewlett |
| ホモジナイザー:ポリトロン(KINEMATICA AG社製) |
| 遠心濃縮機:スピードバックESC-2000(サーバント社製) |
4. GC/MS測定条件
| カラム:DB-WAX(内径0.25 mm,長さ30 m,膜厚0.25 μm,J & W Scientific 社製)にガードカラムとして不活性化キャピラリーカラム(内径0.25 mm,長さ2 m,J & W Scientific 社製)を接続した. |
| オーブン温度:50°C (1 min)→15°C/min→240°C (11.3 min) |
| 注入口温度:250°C |
| トランスファーライン温度:240°C |
| イオン化電圧:70 eV(EIモード) |
| 測定モード:選択イオン検出(SIM)及びSCAN |
| SIM条件:モニターイオン(下線が定量用,他は定性用) |
| 2-BPA:m/z 149, 151, 108, 106, 70 |
| 2-BPA-13C(AA-1-13Cの臭素化体):m/z 150, 152, 108, 106, 71 |
| SCAN条件:スキャン範囲50〜550 amu,スキャンスピード1.5 scans/sec |
| EM電圧:SIM測定では2800 V,SCAN測定ではオートチューニングでの設定値を用いた. |
| キャリアーガス:ヘリウム(1 mL/minで定流量モード) |
| 注入量:2 μL(スプリットレス) |
5. 試験溶液調製法
| 試料2.0 gを250 mLの遠沈管にとり,内標準として100 μg/mL AA-1-13C溶液20 μLを添加した.精製水40 mLを加え,2分間ホモジナイズ抽出し,2600 rpmで10分間遠心分離した.上澄み液を50 mLの共栓付メスシリンダーに移し,精製水で40 mLとし,このうち20 mL(試料1.0 g相当)を50 mLの共栓付遠沈管にとり,ヘキサン10 mLを加え5分間振とう洗浄を2回行った(エマルジョンが生じた場合には3000 rpmで5分間遠心分離した).5 mol/L硫酸を用いてpH 1以下とし,臭化カリウム10 gを加えて完全に溶解したのち,0.1 mol/L臭素酸カリウム溶液6 mlを加えよく混合してから冷蔵庫(庫内温度4〜10°C)中で90分間静置した.臭素化後の溶液に1 mol/Lチオ硫酸ナトリウム溶液を臭素の黄褐色が消失するまで加え,過剰の臭素を分解したのち,酢酸エチル10 m1ずつで2回5分間振とう抽出した(エマルジョンが生じた場合には3000 rpmで5分間遠心分離した).抽出液を合わせ無水硫酸ナトリウムで脱水し,ロータリーエバポレーターを用いて酢酸エチルを留去した.残留物を10%アセトン含有ヘキサン(10% A/H)約2 mLで溶解し,予めヘキサン10 mLで洗浄したフロリジルカートリッジカラムに負荷した.濃縮容器は10 % A/H 1 mLずつで2回洗い,洗液をカラムに負荷した.カラムを10 % A/H 6 mLで洗浄したのち,20 % A/H 15 mLで被検物質を溶出し,溶出液を試験管で集めた.溶出液を遠心濃縮機を用いて濃縮後,窒素を吹きつけて溶媒を留去し,残留物にアセトン0.5 mLを加えたのち,トリエチルアミン20 μLを添加して脱臭化水素し,試験溶液とした. |
6. 検量線の作成
| アクリルアミド標準溶液をアクリルアミド無添加及び5〜2000 ngになるように段階的に50 mLの共栓付遠沈管にとり,次に内標準として100 mg/mL AA-1-13C溶液10 μLを添加し,精製水で20 mL定容とした.調製した検量線用標準溶液について,ヘキサンによる洗浄を除き5. 試験溶液調製法の項と同様に操作して,検量線用試験溶液を調製した. |
7. 定量及び確認
| 定量はGC/MS(SIM)測定により,内標準の2-BPA-13Cに対する2-BPAのピーク面積比を求めて内標準法により行った.確認はSCAN測定ではマススペクトルを,SIM測定では定性用イオンの相対強度比を,標準品と比較することにより行った. |
結果及び考察
1. 臭素化条件の検討
| 臭化カリウム-臭素酸カリウムを用いたアクリルアミドの臭素化条件については,中村 9) の詳細な報告があり,この臭素化法を行っている従来の報告 1),4), 9),10)や上水試験方法12)などでは,すべてその条件を準用している.しかし,これらは試料として主に水が対象であったのに対して,今回対象とするポテトチップスなどの試料は,脂肪やでんぷんなどのマトリックスを多く含み,臭素と反応する不飽和脂肪酸などのアルケン類も多く含むことが予想されたため,改めて臭素化条件について検討した.その際,臭素化への影響をできるだけ少なくするため,抽出液は臭素化前にヘキサン洗浄による脱脂を行った.また,従来法では検液(抽出液)100 mLを用いて分液ろうとなど大型のガラス器具を多数使用するため,多検体を処理するにはやや効率が悪かった.そのため,小スケール化を図り,抽出液20 mLを用いて,50 mLの共栓付遠沈管のみで臭素化操作を行えるようにした.検討はヘキサン洗浄後のポテトチップス抽出液を用いて,中村 9) の報告を参考にして,(1)臭化カリウム量,(2)0.1 mol/L臭素酸カリウム量,(3)反応時間の3項目について行った.その結果,抽出液20 mLに対して(1)臭化カリウム量は10 g(従来法の約1.7倍量),(2)0.1 mol/L臭素酸カリウム量は6 mL(従来法の約3倍量)を用いることとした.(3)反応時間については,冷蔵庫内60分でほぼ一定の収率となったが,できるだけ反応条件を一定にするため90分間静置することとした. |
2. クリーンアップ法の検討
| 臭素化後のクリーンアップ法としては,これまでにフロリジル 1),8)〜10),12) を用いる方法,シリカゲル 2)〜4) を用いる方法,GPC 6) を用いる方法などが報告されている.この中で報告例が多く上水試験方法でも採用されているフロリジルを用いて検討を行った.しかし,従来の方法では溶出溶媒に有害なベンゼンを使用したり,濃縮に時間のかかるエタノールを使用していたため,溶出溶媒について見直しを行った.また,検討に当たっては,省力化のために既製のカートリッジカラムを使用した.アクリルアミドを臭素化しその1μg相当量をフロリジルカートリッジカラムに負荷し,溶出パターンを検討したところ,2,3-DBPAは10 % A/H 10 mLでは溶出せず,20 % A/H 10 mLで定量的に回収された.そのため,カートリッジカラムのロットによる変動を考慮し10 % A/H 8 mLで洗浄後,20 % A/H 15 mLで溶出することとした. |
3. 抽出
| アクリルアミドは,水に非常に溶けやすい(2,155g/L, 30 ℃)ので,既報 1),2),5)〜7) に準じて試料は水で抽出した. |
4. 検量線及び検出限界
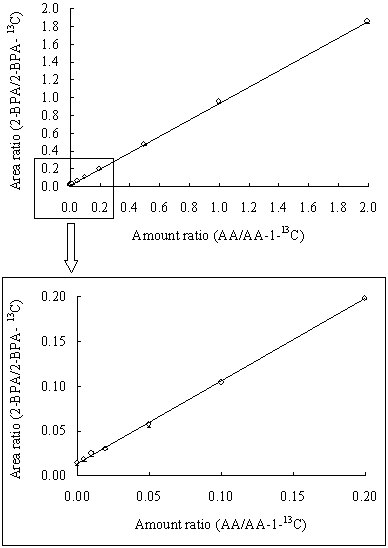
| 検量線は,実験方法の6. 検量線の作成の項に従い,検量線用試験溶液を調製し,GC/MS(SIM)測定で得られたクロマトグラムのピーク面積を用いてAA-1-13Cを内標準として作成した.Fig. 1に示したように,GCへの注入量として0〜8 ng(アクリルアミド相当量)の範囲で,相関係数r = 1.000の良好な直線性が得られた. 検出限界(LOD)は,アクリルアミド無添加の検量線用試験溶液(ブランク,n=8)の測定結果から,得られたピーク面積比の平均値にその標準偏差の3倍を加えた面積比を与える試料中濃度として求めた.同様に定量限界(LOQ)は,ピーク面積比の平均値にその標準偏差の10倍を加えた面積比を与える試料中濃度として求めた.その結果,LODは9 ng/g,LOQ は30 ng/gであった.実態調査では,LOD以上でLOQ未満の値は痕跡量(Tr)とした. また,AA-1-13Cの13C純度は99 atom % 13Cであるため,2-BPA-13Cの定量用イオンのm/z 150より1 amu小さいm/z 149に,相対強度が1 %相当の同位体ピークが存在する.そのため,ブランクの測定でも2-BPAの定量用イオンであるm/z 149に,内標準の同位体ピーク由来のピークが観察される.従って,LODはこの内標準による干渉により制約される.LODをより低くするためには,内標準の添加量を少なくするか,更に効果的には,この干渉を避けるために炭素を3つ13Cで標識したアクリルアミドの安定同位体(AA-13C3)を使用する必要がある.しかし,今回得られたLODはスウェーデン国立食品局の報告(10 ng/g) 7) とほぼ同じであり,実態調査を行うには十分な感度が得られた.なお,今回の検討では,AA-13C3は受注生産のため入手に長期間かかることから,入手が可能であったAA-1-13Cを内標準に用いた.また,重水素標識体については臭素化によりH-D交換がおこる可能性があったため使用しなかった. |
 |
|
|
5. 添加回収実験及び分析精度
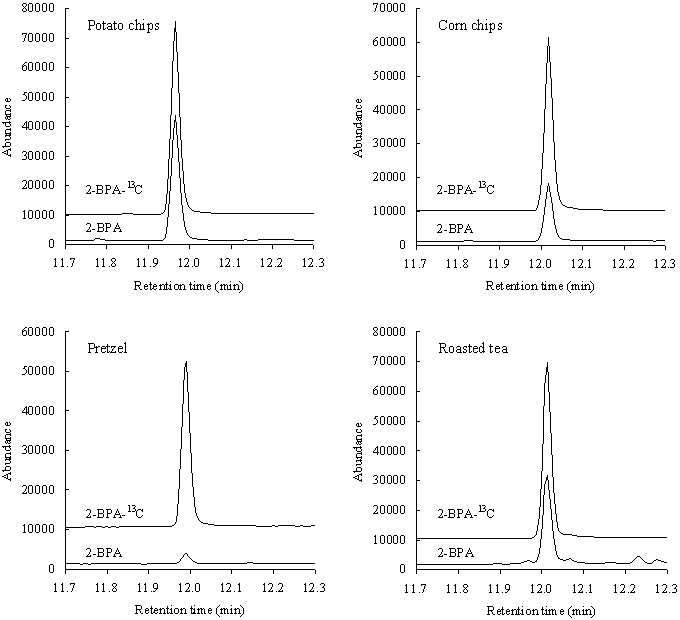
| スウェーデン等での報告を参考にして,アクリルアミドが検出される可能性があり,主原料がそれぞれ異なるポテトチップス,コーンチップス,プレッツェル及びほうじ茶を用いて添加回収実験を行った結果をTable 1に示した.また,その時の無添加試料のSIMクロマトグラムをFig. 2に示した.ポテトチップスでは100 ng/gと1000 ng/gの2濃度について,他の3食品については500 ng/gの添加濃度で実施したが,97〜105 %の良好な回収率が得られた.回収率の相対標準偏差はいずれも4 %未満であり,精度の良い結果が得られた.また,各試料からはいずれもアクリルアミドが検出されたが,検出値の相対標準偏差は検出値が低かったプレッツェルで8 %であった以外は5 %未満であり,実試料の測定でも精度の良い結果が得られた. |
| Table 1. Recovery of Acrylamide from Spiked Foods | ||||||||||||||||||||||||||||||
|
 |
|
|
6. 実態調査結果
| 市販食品31検体の実態調査を行った.Table 2にはその結果を食品の主原料毎に大まかに分類して示した.スウェーデン等の報告と同様に,ポテトチップスで1000 ng/gを越える高濃度が検出された検体があった.しかし,ポテトチップス全体では,検出値は36〜3340 ng/gと広範囲に亘っており,アクリルアミド含量が少ないものもあった.ポテトチップス以外の食品については,例数が少なく食品毎の傾向を考察できないが,不検出〜520 ng/gのアクリルアミドが検出され,スウェーデン等の報告と同程度のアクリルアミドが検出された.ただし,今回調査した食品数は非常に限られているため,示した検出値がそれぞれの食品を代表するものではない.日本国内の各種食品に含まれているアクリルアミドの全体像を把握するために,より多数の食品について今後実態調査を行う予定である. |
| Table 2. Analytical Results of Acrylamide in Foods | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
まとめ
| 1)試料に内標準として13C標識したAA-1-13Cを添加して水抽出し,酸性条件下臭化カリウム-臭素酸カリウムで臭素化し,生じた2,3-DBPAをトリエチルアミンで脱臭化水素して2-BPAとしたのち,GC/MS(SIM)で定量する食品中のアクリルアミドの分析法を確立した. |
| 2)ポテトチップス,コーンチップス,プレッツェル及びほうじ茶を用いて,100 〜1000 ng/gの添加濃度で添加回収実験を行った結果,回収率97〜105 %及び相対標準偏差0.8〜3.9 %の良好な結果が得られた.また,本分析法の検出限界は9 ng/gであった. |
| 3)市販食品31検体の実態調査を行った結果,アクリルアミドは,ポテトチップスから36〜3340 ng/g検出され,その他の食品からは不検出〜520 ng/g検出された. |
文献
| 1) Arikawa, A., Shiga, M., Determination of trace acrylamide in the crops by gas chromatorgaphy. Bunseki Kagaku, 29, T33-T38(1980). |
| 2) Castle, L., Campos, M.-J., Gilbert, J., Determination of acrylamide monomer in hydroponically grown tomato fruits by capillary gas chromatography - mass spectrometry. J. Sci. Food Agric., 54, 549-555(1991) |
| 3) Castle, L, Determination of acrylamide monomer in mushrooms grown on polyacrylamide gel. J. Agric. Food Chem., 41, 1261-1263(1993) |
| 4) Ozawa, H., Ibe, A., Tabata, S., Miyakawa, H., Sadamasu, Y., Yasuda, K., Determination of acrylamide monomer in unhulled rice by high performance liquid chromatography. Tokyo Eiken Nenpo(Ann. Rep. Tokyo Metr. Res. Lab. P.H.), 49, 84-87(1998). |
| 5) Bologna, L. S., Andrawes, F. F., Barvenik, F. W., Lentz, R. D., Sojka, R. E., Analysis of residual acrylamide in field crops. J. Chromatogr. Sci., 37 , 240-244(1999). |
| 6) Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S., Tornqvist, M., Acrylamide: a cooking carcinogen? Chem. Res. Toxicol. 13, 517-522(2000). |
| 7) Rosen, J., Hellenas, K.-E., Analysis of acrylamide in cooked foods by liquid chromatography tandem mass spectrometry. Analyst, 127, 880-882(2002). |
| 8) Hashimoto, A., Improved method for the determination of acrylamide monomer in water by means of gas-liquid chromatography with an electroncapture detector, Analyst, 101, 932-938(1976). |
| 9) Nakamura, H., Determination of trace acrylamide in water and sludge. Suido Kyokai Zasshi(Journal of Japan water works association), 514, 37-41(1977). |
| 10) Takata, K., Okamoto, T., A method for determination of acrylamide in environmental samples by gas chromatography using bromination-dehydrobromonation. Kankyo Kagaku(Journal of Environmental Chemistry), 1, 559-565(1991). |
| 11) Andrawes, F., Greenhouse, S., Draney, D. Chemistry of acrylamide bromination for trace analysis by gas chromatography and gas chromatography - mass spectrometry. J. Chromatogr., 399 , 269-275(1987) |
| 12) 日本水道協会“上水試験方法2001年版”2001, p. 533-537. |