| 資料3 |
相対的リスクの評価方法について
| 1 相対的リスク評価を行うための基礎情報の抽出 |
【1】ワークシートの作成
| (1) | 基礎情報の抽出作業は、原則、85製品群ごとに、各製品群に属する製品に配合される主たる成分に着目して行った。 | ||||||||||||||||||
| (2) | その結果、次のものを除き、47のワークシートとして整理した。 [ワークシートとして整理していないもの]
| ||||||||||||||||||
| (3) | 基礎情報の抽出は、幅広く情報を集めるという考え方にたって、相対的に情報量が多い医療用医薬品の添付文書に基づき行った。 | ||||||||||||||||||
| (4) | 基礎情報の抽出に用いる医療用医薬品の添付文書は、できるかぎり同一成分・同一剤型のものを用いたが、医療用医薬品として使用されていない成分については、やむを得ず異なる剤型のものを用いた。 | ||||||||||||||||||
| (5) | ワークシートの作成にあたっては、医療用添付文書の記載内容を、「リスクの程度の評価」に係るAからHまでのリスクファクターごとに抽出した。
《参考》リスクファクターについて
|
【2】作成上の留意点
| (1) | 医療用医薬品としての効能効果や用法用量(1日あたりの上限量等)に関する情報が参照できるよう、ワークシートに付記した。 |
| (2) | 一般用医薬品の添付文書については、「提供する情報」の検討を行う際に、その記載内容を踏まえた作業を行う。 |
| (3) | 添付文書で確認できる「頻度」に関する情報をワークシートに記入した。 |
| 2 相対的リスクの評価方法の整理 |
【1】評価の対象
| (1) | ワークシート上の「A」から「H」までの全てのリスクファクターを評価の対象とした。 ただし、「A」及び「D」については、他のリスクファクターの中で考慮されているものとして取り扱い、個別の評価は行わない。 |
| (2) | 評価は2段階に分けて行うこととし、「B」、「C」及び「E」をもとに各成分の特性(物性)に着目した作業を行ったうえで、「F」及び「G」をもとに、誤使用や過量使用等のおそれを前提とした評価を行う。 |
| (3) | 一般用医薬品の添付文書に記載され、医療用では反映しきれていない情報については、情報提供に関する検討にあわせて考慮する。 |
【2】評価の方法
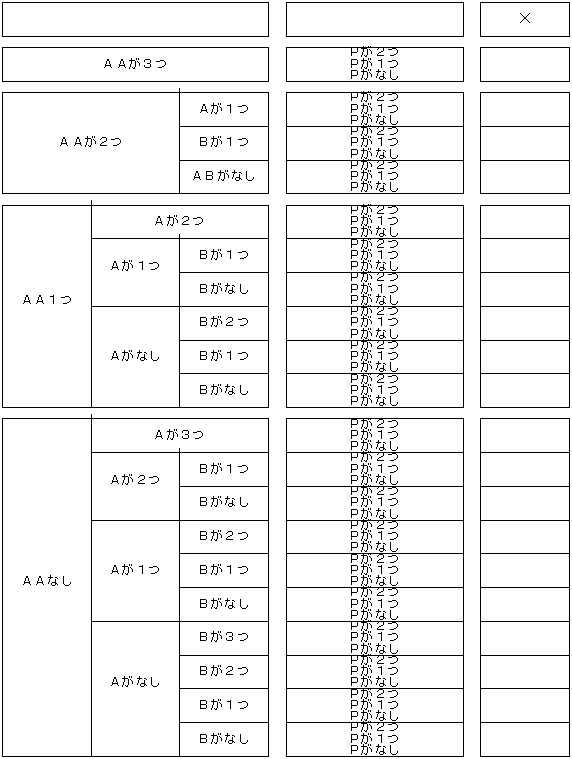
| (1) | ワークシートの「B」、「C」及び「E」それぞれを4区分に分類し、「F」及び「G」それぞれを3区分に分類する。また、「H」を2区分に分類する。 | ||
| (2) | 「B」については、「併用禁忌」をA、「併用注意」をBとし、Cは記載がない場合とする。 「併用禁忌」及び「併用注意」の両者に記載がある場合は、「B」におけるAが優先される。記載がない場合はCとなる。 また、併用禁忌のうち、特に注意を要するものをAAとする。
| ||
| (3) | 「C」については、薬理・毒性に基づく副作用及び特異体質・アレルギー等に基づく副作用等の記載がある場合をAとし、「C’」に記載がある場合をBとする。 「C」及び「C’」の両者に記載がある場合は、「C」におけるAが優先される。記載がない場合はCとなる。 また、「C」のうち、特に注意を要するものをAAとする。
| ||
| (4) | 「E」については、「適応禁忌」をA、「慎重投与」をBとし、Cは記載はない場合とする。 「適応禁忌」及び「慎重投与」の両者に記載がある場合は、「E」におけるAが優先される。記載がない場合はCとなる。 また、適応禁忌のうち、特に注意を要する適応対象についてはAAとする。
| ||
| (5) | 「F」及び「G」については、該当する情報がある場合をPとし、ない場合をQとする。 また、これらのうち、特に注意を要する過量使用等についてはPPとする。
| ||
| (6) | 一般用医薬品の添付文書に記載されている情報が、特に注意を要するものと考えられた場合は、各リスクファクターにおける評価に反映する。 |
【3】相対的リスク評価における留意点
| (1) | ワークシート上、剤型が異なる同一成分の添付文書を基礎情報としている場合、薬理作用や化学構造式に基づき、薬学的にみて明らかに同等に評価できる他の成分の基礎情報をもとに相対的リスク評価を行う。 |
| (2) | 使用量の違い等に起因する成分間の情報量に格差があるもののうち、薬理作用及び化学構造式等に基づき、薬学的にみて明らかに同等に評価できるものは、同程度とみなす。 |
| (3) | ワークシート上、情報が得られなかった成分については、薬理作用、効能効果及び用法用量等からみて同等として取扱えるものと同等に取扱う。 |
| (4) | ワークシートに掲げた成分のうち、製品としての相対的リスク評価に影響を及ぼさないと考えられる成分については、当該成分の評価は行わない。 |
| (5) | 製品としての相対的リスク評価については、成分ごとの評価結果のうち最も上位の評価結果とする。 |
リスク評価(分類)のイメージ
 | ||||
|