�u���t���܂̎g�p�w�j�v�i����āj
����17�N����
�����J���Ȉ��H�i�nj��t���
�ڎ�
�i�Q�l�j
| �m�v��n |
�Ԍ����Z���t�̓K���g�p |
| 1�j |
���ȓI�K���F�����n���ɑ���K�� |
�m�o�����n
| �� |
�@�����ǂ��A���B�킩��́C���ʒ����I�ȏo���ɂ�鍂�x�̕n���͌����Ƃ��ėA���͍s��Ȃ��B���퐶���Ɏx��𗈂��z��n�̗Տ��Ǐ�i�J�쎞�̓����E����C����Ȃǁj������ꍇ�ɂ́C2�P�ʂ̗A�����s���C�Տ������̉��P�̒��x���ώ@����B�S�g��Ԃ��ǍD�ȏꍇ�́C�w���O���r���iHb�j�l6g/dL�ȉ�����̖ڈ��ƂȂ�B |
�m���t�����ɔ����n���n
| �� |
�@���x�̕n���̏ꍇ�ɂ́C��ʂ�1�`2�P�ʁ^���̗A���ʂƂ���B |
| �� |
�@�����n���̏ꍇ�ɂ�Hb�l7g/dL���A�����s����̖ڈ��Ƃ���Ă��邪�C�n���̐i�s�x�C�늳���ԓ��ɂ��K�v�ʂ��قȂ�C�ꗥ�Ɍ��߂邱�Ƃ͍���ł���B
| �� |
�@Hb�l��10g/dL�ȏ�ɂ���K�v�͂Ȃ��B |
| �� |
�@�r�^�~��B12���R�C�t�_���R�C���ȖƉu���n�����n���ȂǁC�A���ȊO�̕��@�Ŏ��É\�ł��鎾���ɂ́C�����Ƃ��ėA�����s��Ȃ��B |
|
| 2�j |
�O�ȓI�K���F�}���n���ɑ���K�� |
�m�}���o���n
| �� |
�@Hb�l��10g/dL����ꍇ�͗A����K�v�Ƃ��邱�Ƃ͂Ȃ����C6g/dL�ȉ��ł͗A���͂قڕK�{�Ƃ���Ă���B
| �� |
�@Hb�l�݂̂ŗA���̊J�n�����肷�邱�Ƃ͓K�ł͂Ȃ��B |
|
| �� |
�@���҂̐S�x�@�\�C�������̎�ށi�ǐ��܂��͈����j�C���҂̔N���̏d���邢�͓���ȕa�ԓ��̑S�g��Ԃ�c�����ē��^�̕K�v���̗L�������肷��B
| �� |
�@���K�I�ɍs���Ă����p�O���^�̂�����10/30���[���iHb�l10g/dL�C�w�}�g�N���b�g�iHt�j�l30���ȏ�ɂ��邱�Ɓj�͋ߔN�ł͍����̂Ȃ����̂Ƃ���Ă���B
|
|
| �� |
�@�z���t�ʂ�20���ȏ�̏o���ʂɑ��ẮC�K�X�l�H�P���t����ɂ͓����A���u�~�����܂𓊗^����B�Ԍ����s���ɂ��g�D�ւ̎_�f�����s�������O�����ꍇ�ɂ́C�Ԍ����Z���t�𓊗^����B
�@�z���t�ʂ�20�`50���̏o���ʂɑ��ẮC�P���Z�������ێ����邽�߂ɁC�l�H�P���t�i�q�h���L�V�G�`���f���v���iHES�j�C�f�L�X�g�����Ȃǁj�𓊗^����B�Ԍ����s���ɂ��g�D�ւ̎_�f�����s�������O�����ꍇ�ɂ́C�Ԍ����Z���t�𓊗^����B���̒��x�܂ł̏o���ł́C�����A���u�~�����܁i5���l�����A���u�~�����͉��M�l�����`�����j�̕��p���K�v�ƂȂ邱�Ƃ͏��Ȃ��B
�@�z���t�ʂ�50�`100���̏o���ł́C�זE�O�t�n�A�t��C�l�H�P���t����ѐԌ����Z���t�̓��^�����ł͌����A���u�~���Z�x�̒ቺ�ɂ��x�����R�A���o������댯��������̂ŁC�K�X�����A���u�~�����܂𓊗^����B�Ȃ��C�l�H�P���t��1,000ml�ȏ�K�v�Ƃ���ꍇ�ɂ������A���u�~�����܂̎g�p���l������B |
| �� |
�@�z���t�ʈȏ�̏o���ʁi24���Ԉȓ���100���ȏ�j���́C100ml/���ȏ�A��������悤�Ȏ��Ԃɂ́C�V�N���������⌌���Z���t�̓��^���l������B |
| �� |
�@�ʏ��Hb�l��7�`8g/dL���x����Ώ\���Ȏ_�f�̋������\�ł��邪�C�������������邢�͔x�@�\��Q��]�z��Q�̂��銳�҂ł́CHb�l��10g/dL���x�Ɉێ����邱�Ƃ����������B |
| �� |
�@�p���1�`2���Ԃ͍זE�O�t�ʂƌ����A���u�~���Z�x�̌����������邱�Ƃ����邪�C�o�C�^���T�C�������肵�Ă���ꍇ�́C�זE�O�t�n�A�t��̓��^�ȊO�ɐԌ����Z���t�C�����A���u�~�����܂�V�N���������Ȃǂ̓��^���K�v�ƂȂ�ꍇ�͏��Ȃ��B |
| �� |
�@�Ԍ����Z���t1�P�ʁi200mL�R���j�̓��^�ɂ���ĉ��P�����Hb�l�́C�ȉ��̌v�Z�����狁�߂邱�Ƃ��ł���B
| �@ |
�\���㏸Hb�l�ig/dL�j�����^Hb�ʁig�j/�z���t�ʁidL�j
�z���t�ʁF70mL/kg�o�z���t�ʁidL�j���̏d�ikg�j�~70mL/kg/100�p |
�@�Ⴆ�C�̏d50kg�̐��l�i�z���t��35dL�j��Hb�l14�`15g/dL�̌��t��2�P�ʁi400mL�R��MAP��RCC1�o�b�O���̊ܗLHb�ʂ�14�`15g/dL�~4dL=56�`60g�j�A�����邱�Ƃɂ��CHb�l�͖�1.6�`1.7g/dL�㏸���邱�ƂɂȂ�B |
| �� |
�@�Ìň��q�̕�[��ړI�Ƃ��Ȃ��V�N���������Ƃ̕��p |
| 1�j |
�����ǂ̓`�d |
| 2�j |
�S�̉ߏ蕉�� |
| 3�j |
�A����ڐA�БΏh��a�iGVHD�j�̗\�h�� |
| 4�j |
�����������t�B���^�[�̎g�p |
| 5�j |
�n��������p |
| �m�v��n |
�����Z���t���g�p��K���g�p |
�@�ȉ��Ɏ����������͂����܂ł��ڈ��ł����āC���ׂĂ̏Ǘ�ɍ��v������̂ł͂Ȃ��B
| �� |
�@��������2�`5���^��L�ł́C�~������ȏꍇ�ɂ͌����A�����K�v�ƂȂ�B |
| �� |
�@��������2���^��L�����ł͂����Ώd�Ăȏo�����݂邽�߁C�����A�����K�v�ƂȂ�ꍇ������B
| �� |
�@��ʂɁC��������5���^��L�ȏ�ł́C�����A�����K�v�ƂȂ邱�Ƃ͂Ȃ��B |
| �� |
�@�����Ɍo�߂��Ă��錌�������ǁi�Đ��s�Ǖn���Ȃǁj�ŁC���ɏo���X���𗈂������ǂ��Ȃ��C�����������肵�Ă���ꍇ�ɂ́C��������5��`1���^��L�ł����Ă��C�����A���͋ɗ͔�����ׂ��ł���B
|
|
| �� |
�@���������ɂ��d�ĂȊ������o����F�߂�ꍇ�i���ɖԖ��C�����_�o�n�C�x�C�����ǂȂǂ̏o���j�ɂ́C��������5���^��L�ȏ�Ɉێ�����悤�Ɍ����A�����s���B |
| �� |
�@��������5���^��L�����ł́C��p�̓��e�ɂ��C�����Z���t�̏������́C�p���O�̌����A���̉ۂf����B
| �� |
�@�ҋ@�I��p���҂��邢�͍��Ő��h�C�d���O�����C�o�C�ǎx�����C�̐����Ȃǂ̐N�P�����u�ł́C�p�O���邢�͎{�s�O�̌�������5���^��L�ȏ゠��C�ʏ�͌����A����K�v�Ƃ��邱�Ƃ͂Ȃ��B |
|
| 3�j |
�l�H�S�x�g�p��p���̎��p���Ǘ� |
| �� |
�@�p���E�p���ʂ��Č�������3���^��L�����ɒቺ���Ă���ꍇ�ɂ́C�����A���̓K���ł���B�l�H�S�x���E��̗��_�v���^�~�����^��Ɍ��Z�y�ыÌŔ\��K�X�����C���f���Ȃ���C�K�v�ɉ�����5���^��L���x��ڏ��Ɍ����A���J�n���l������B |
| �� |
�@���G�ȐS�匌�ǎ�p�Œ����ԁi3���Ԉȏ�j�̐l�H�S�x�g�p��C�Ď�p�ȂǂōL�͂Ȗ���������v�����C�y�і����̐t����̑��̎����ŏo���X�����݂��̒��ɂ́C�����������邢�͎~������ȏo���ioozing�Ȃǁj���݂邱�Ƃ�����C�Ìň��q�̌��R�킸�C���̂悤���a�Ԃ�悷���ꍇ�ɂ́C��������5���^��L�`10��/��L�ȏ��ɂȂ�悤�Ɍ����A�����s���B |
| �� |
�@�}�������ɂ��24���Ԉȓ��ɏz���t�ʑ����ʂȂ���2�{�ʈȏ�̑�ʗA�����s���C�~������ȏo���Ǐ�ƂƂ��Ɍ���������F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�B |
| �� |
�@�o���X���̋��������\���̂���DIC�i��b�����������a�C���C�Y�ȓI�����C�d�NJ����ǂȂǁj�ŁC���������}����5���^��L�����ւƒቺ���C�o���Ǐ��F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�B
| �� |
�@����DIC�ɂ��ẮC�����A���̓K���͂Ȃ��B |
|
| �� |
�@�}�������a�E���������p��Ȃǂ̊����Ö@�ɂ����ẮC�����̏ꍇ1�`2���^��L�ȏ�Ɉێ�����悤�ɁC�v��I�Ɍ����A�����s���B |
| �@�i2�j |
�Đ��s�ǐ��n���E�����ٌ`���nj�Q |
| �� |
�@��������5��^��L�O��Ȃ�������ȉ��ɒቺ����ꍇ�ɂ́C�����A���̓K���ƂȂ�B |
| �� |
�@�v��I�Ɍ�������1���^��L�ȏ�ɕۂ悤�ɓw�߂�B
| �� |
�@���������͖����Ɍo�߂��邱�Ƃ������C��������5��^��L�ȏ゠���ďo���Ǐ牺�o�������x�̌y���ȏꍇ�ɂ́C�����A���̓K���Ƃ͂Ȃ�Ȃ��B |
|
| �� |
�@���������������������a�iITP�j�ŊO�ȓI���u���s���ꍇ�ɂ́C�܂��X�e���C�h�ܓ��̎��O���^���s���C�����̌��ʂ��s�\���ő�ʏo���̗\�������ꍇ�ɂ́C�K���ƂȂ�B
| �� |
�@���������������������a�iITP�j�́C�ʏ�͌����A���̑ΏۂƂ͂Ȃ�Ȃ��B |
|
| �� |
�@ITP�̕�e���琶�܂ꂽ�V�����ŏd�ĂȌ��������ǂ��݂�ꍇ�ɂ́C�����A���̂ق��ɕ��t�玿�X�e���C�h���邢�͖Ɖu�O���u�������܂̓��^�ƂƂ��Ɍ����A����K�v�Ƃ��邱�Ƃ�����B |
| �� |
�@�������ٍR���̕ꎙ�ԕs�K���ɂ��V��������Ɖu�����������ǁiNAIT�j�ŁC�d�ĂȌ����������݂�ꍇ�ɂ́C�������ٍR�����^�̌����A�����s���B
| �� |
�@�A���㎇���a�iPTP�j�ł́C�����A���̓K���͂Ȃ��B |
|
| �@�i4�j |
���𐫌��������������a�iTTP�j�y�їn�����A�ŏǏnj�Q�iHUS�j
| �� |
�@�����Ƃ��Č����A���̓K���Ƃ͂Ȃ�Ȃ��B |
|
| �@�i5�j |
�����@�\�ُ�� |
| �@�i6�j |
���̑��F�w�p�����N�������������ǁiHeparin induced thrombocytopenia:HIT�j |
| �� |
�@�����A���͋֊��ł��� |
| �� |
�@�d�Ăȏo���Ȃ����~������ȏꍇ�ɂ̂����A���̓K���ƂȂ�B |
| �� |
�@�Ō`��ᇂɑ��ċ��͂ȉ��w�Ö@���s���ꍇ�ɂ́C�p����K�v�ɉ������������𑪒肷��B |
| �� |
�@��������2���^��L�����Ɍ������C�o���X����F�߂�ꍇ�ɂ́C��������1�`2���^��L�ȏ�ɂȂ�悤�Ɍ����A�����s���B |
| 8�j |
�������זE�ڐA�i�����ڐA���j |
| �� |
�@���퍜���ڐA���邢�͎��ȑ������זE�ڐA���������זE�ڐA���ɍ����@�\������܂ł̊��Ԃ́C�v��I�Ɍ����A�����s���āC��������1�`2���^��L�ȏ�ɕۂB |
| �� |
�@�ʏ�C�o���\�h�̂��߂ɂ͌�������1�`2��/��L�����̏ꍇ�������Z���t�̓K���������A���̓K�����Ȃ�B |
| �����A������̗\�������������i�^��L�j |
�� |
�A����������
|
�~ |
2
|
| �z���t��(mL)�~103 |
3 |
�i�z���t�ʂ�70mL/kg�Ƃ���j
|
�@
�Ⴆ�C�����Z���t5�P�ʁi1�D0�~1011�ȏ�̌������ܗL�j���z���t��5,000mL�i�̏d65kg�j�̊��҂ɗA������ƁC����ɂ͗A���O�̌��������13,500/��L�ȏ㑝�����邱�Ƃ������܂��B�Ȃ��C�̏d25kg�ȉ��̏����ł�10�P�ʂ�3�`4���Ԃ����ėA������B
| 1�j |
�������҂ւ̌����A���̍l���� |
�@
�P�Ȃ鎞�ԓI�����̂��߂̓��^�͍T����ׂ��ł���B
| �m�v��n |
�V�N���������̓K���g�p |
| �� |
�@�Ìň��q�̕�[�ɂ�鎡�ÓI���^����ړI�Ƃ���B���R�o�����C�O�����̏o�����̎��ÂƊό��I���u���s���ۂɓK���ł���C�ό��I���u����������FFP�̗\�h�I���^�̈Ӗ��͂Ȃ��C�����܂ł����̎g�p�͎��ÓI���^�Ɍ��肳���B
�@FFP�̓��^�́C���Ɉ��S�Ō��ʓI�Ȍ������搻�܂��邢�͑�ֈ��i�i���R���r�i���g���܂Ȃǁj���Ȃ��ꍇ�ɂ̂݁C�K���ƂȂ�B���^�ɓ������ẮC���^�O�Ƀv���g�����r�����ԁiPT�j�C�����������g�����{�v���X�`�����ԁiAPTT�j�𑪒肵�C��ʏo���ł̓t�B�u���m�Q���l�����肷��B |
| �@�i1�j |
PT����с^�܂���APTT���������Ă���ꍇ�i(1)PT�́i�@�j�e��Ë@�ւɂ������̏����1.5�{�ȏ�INR 2.0�ȏ��C�i�A�j4530���ȉ��C�i�B�jINR 1.6�ȏ��^(2)APTT�́i�@�j�e��Ë@�ւɂ������������2�{�ȏ�C�i�A�j25���ȉ��Ƃ���j |
| �� |
�@�̏�Q�F�̏�Q�ɂ�蕡���̋Ìň��q�������ቺ���C�o���X���̂���ꍇ�ɓK���ƂȂ�B
| �� |
�@PT��1.5�{INR 2.0�ȏ�i4530���ȉ�����INR 1.6�ȏ��j�ŁC���ό��I���u���s���ꍇ��������FFP�̗\�h�I���^�̓K���͂Ȃ��B |
|
| �� |
�@L-�A�X�p���M�i�[�[���^�֘A�F�̑��ł̎Y���ቺ�ɂ��Ìň��q�̌����ɉ����C�R�Ìň��q����n���q�̎Y���ቺ���݂���ꍇ�C�����̏����q���ɕ⋋���邽�߂ɂ�FFP��p����B |
| �� |
�@�d�퐫���Ǔ��ÌŁiDIC�j�F�ʏ�C(1)PT�́i�@�j�e��Ë@�ւɂ������̏����1.5�{�ȏ�INR 2.0�ȏ��C�i�A�j4530���ȏ��ȉ��C�i�B�jINR 1.6�ȏ��^(2)APTT�́i�@�j�e��Ë@�ւɂ������������2�{�ȏ�C�i�A�j25���ȉ��C���邢�͖ڈ��Ƃ��āC�t�B�u���m�Q���l��100mg/dL�ȉ��̏ꍇ��FFP�̓K���ƂȂ�i�Q�l����1 DIC�f�f��Q�Ɓj�B |
| �� |
�@��ʗA�����FFFP�̓K���ƂȂ�B
�@�O���Ȃǂ̋~�}���҂ł́C����Ìŏ�Q���������Ă��邩���������C�Ìň��q���R�ɂ��o���X��������Ɣ��f���ꂽ�ꍇ�Ɍ���CFFP�̓K��������B |
| �� |
�@�Z�k���܂̂Ȃ��Ìň��q���R�ǁF���t�Ìő�V�C��XI���q�̂����ꂩ�̌��R�ǂ܂��͂������܂ޕ����̌��R�ǂł́C�o���Ǐ�������Ă��邩�C�ό��I���u���s���ۂ�FFP���K���ƂȂ�B |
| �� |
�@�N�}�����n��܁i�����t�@�����Ȃǁj�̌��ʂً̋}��iPT��1.5�{INR 2.0�ȏ�i30���ȉ�����INR 1.6�ȏ��j�j�FFFP�̓��^�́C�N�}�����n��܂ɂ��R�ÌŗÖ@���̏o���ŋً}�ɑΉ����ׂ��ꍇ�ƁC�ً}��p���Ɍ����ēK���ƂȂ�B |
| �@�i2�j |
��t�B�u���m�Q�����ǁi100mg/dL�ȉ��j�̏ꍇ |
| �� |
�@�d�퐫���Ǔ��ÌŁiDIC�j |
| �� |
�@L-�A�X�p���M�i�[�[���^�� |
| 2�j |
�Ìőj�Q���q����n���q�̕�[ |
| �� |
�@�v���e�C��C��v���e�C��S�̌��R�ǂɂ����錌���ǂ̔��ǎ��ɂ͕K�v�ɉ�����FFP�ɂ�茇�R���q���[����B�v���X�~���C���q�r�^�[�̌��R�ɂ��o���Ǐ�ɑ��Ă͍R���n��p���C���ʂ��s�\���ȏꍇ�ɂ�FFP�𓊗^����B |
| 3�j |
�������q�̕�[�iPT�y��APTT������ȏꍇ�j |
| �� |
�@���𐫌��������������a�iTTP�j�F��V��TTP�ɑ��Ă�FFP��u���t�Ƃ������������Ö@���s���B��V��TTP�ł́CFFP�̒P�Ɠ��^�ŏ[���Ȍ��ʂ�����B
| �� |
�@��V���n�����A�ŏǏnj�Q�iHUS�j�ł́CFFP��p�������������Ö@�͕K�������L���ł͂Ȃ��B |
|
| �� |
�@�����I�Ȏ~�����ʂ����҂��邽�߂̋Ìň��q�̍ŏ��̌��������l�́C����l��20�`30�����x�ł���B
�@�z�����ʂ�40mL/kg�i70mL/kg�i1-Ht/100�j�j�Ƃ��C��[���ꂽ�Ìň��q�̌���������͖ړI�Ƃ���Ìň��q�ɂ��قȂ邪�C100���Ƃ���C�Ìň��q�̌������x�����20�`30���㏸������̂ɕK�v��FFP�ʂ́C���_�I�ɂ�8�`12mL/kg�i40mL/kg��20�`30���j�ł���B |
| 1�j |
�z�����ʌ����̉��P�ƕ�[ |
| 2�j |
�`�������Ƃ��Ẳh�{�⋋ |
| 3�j |
�n�������̑��i |
| 4�j |
�������҂ւ̓��^ |
| 5�j |
���̑� |
�@
�d�NJ����ǂ̎��ÁCDIC��Ȃ��M���̎��ÁC�l�H�S�x�g�p���̏o���\�h�C��㏞���̍d�ςł̏o���\�h�Ȃǂ�FFP���^�̓K���Ƃ͂Ȃ�Ȃ��B
| 1�j |
�Z��@ |
| 2�j |
�����ǂ̓`�d |
| 3�j |
�N�G���_���Łi��J���V�E�����ǁj |
| 4�j |
�i�g���E���̕��� |
| 5�j |
�A�����M�[���� |
| 6�j |
�A���Z�b�g�̎g�p |
| �m�v��n |
�A���u�~�����܂̓K���g�p |
| �� |
�@�}���̒�`�����ǂɊ�Â��a�ԁC�܂����̎��Ö@�ł͊Ǘ�������Ȗ�����`�����ǂɂ��a�Ԃɑ��āC�A���u�~�����[���邱�Ƃɂ��ꎞ�I�ȕa�Ԃ̉��P��}�邽�߂Ɏg�p����B |
| �� |
�@�z���t�ʂ�50���ȏ�̑��ʂ̏o�����^����ꍇ�⌌���A���u�~���Z�x��3.0g/dL�����̏ꍇ�ɂ́C�����A���u�~�����܂̕��p���l������B |
| �� |
�@�t�@�\��Q�ȂǂŐl�H�P���t�̎g�p���s�K�ƍl������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B�܂��C�l�H�P���t��1,000mL�ȏ�K�v�Ƃ���ꍇ�ɂ��C�����A���u�~�����܂̎g�p���l������B |
| 2�j |
�l�H�S�x���g�p����S����p |
�@
�ʏ�C�S����p���̐l�H�S�x�̏[�U�ɂ́C��Ƃ��čזE�O�t�n�A�t�g�p�����B�l�H�S�x���{���̌��t��߂ŋN�������ꎞ�I�Ȓ�A���u�~�����ǂ́C�A���u�~�����܂𓊗^���ĕ����K�v�͂Ȃ��B�������C�p�O��茌���A���u�~���Z�x�܂����P���Z�����̍��x�Ȓቺ�̂���ꍇ�C���邢�͑̏d10kg�����̏����̏ꍇ�Ȃǂɂ͓����A���u�~�����܂��p�����邱�Ƃ�����B
�@
�l�H�S�x���{���̌��t��߂ŋN�������ꎞ�I�Ȓ�A���u�~�����ǂ́C�A���u�~�����܂𓊗^���ĕ����K�v�͂Ȃ��B
| 3�j |
�̍d�ςɔ�����������ɑ��鎡�� |
| �� |
�@��ʁi4L�ȏ�j�̕������h���ɏz�����ʂ��ێ����邽�߁C�����A���u�~�����܂̓��^���l�������B�܂��C���Ò�R���̕����̎��ÂɁC�Z���I�i1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂p���邱�Ƃ�����B
| �� |
�@�̍d�ςȂǂ̖����̕a�Ԃɂ���A���u�~�����ǂ́C���ꎩ�̂ł̓A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ��B |
|
| 4�j |
����̕���C�x������l�t���[�[�nj�Q
| �� |
�@�l�t���[�[�nj�Q�Ȃǂ̖����̕a�Ԃ́C�ʏ�A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ����C�}�����d�ǂ̖���������邢�͔x����ɑ��ẮC���A��ɉ����ĒZ���I(1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂̓��^��K�v�Ƃ���ꍇ������B
|
|
| 5�j |
�z���Ԃ��s����Ȍ��t���͓��̑̊O�z�{�s�� |
| �� |
�@�����̈��肪�����ꍇ�Ɍ��t���͎��ɂ����āC���ɓ��A�a���������Ă���ꍇ��p��ȂǂŒ�A���u�~�����ǂ̂���ꍇ�ɂ́C�z�����ʂ�������ړI�ŗ\�h�I���^���s�����Ƃ�����B |
| 6�j |
�Ìň��q�̕�[��K�v�Ƃ��Ȃ����ÓI���������@
| �� |
�@�M�����o���[�nj�Q�C�}���d�Njؖ��͏ǂȂNjÌň��q�̕�[��K�v�Ƃ��Ȃ��Ǘ�ł́C�����A���u�~�����܂��g�p����B |
| �� |
�@PPF���M�l���������́C�܂�Ɍ����ቺ���������̂ŁC�����Ƃ��Ďg�p���Ȃ��B |
|
| �� |
�@�M�����ʂ��̕\�ʐς�50���ȏ゠��C�זE�O�t��[�t�ł͏z�����ʂ̕s�������邱�Ƃ�����ȏꍇ�ɂ́C�l�H�P���t���邢�͓����A���u�~�����܂őΏ�����B
| �� |
�@�M����C�ʏ�18���Ԉȓ��͌����Ƃ��čזE�O�t��[�t�őΉ����邪�C18���Ԉȓ��ł����Ă��C�����A���u�~���Z�x��1.5g/dL�����̎��͓K�����l������B |
|
| 8�j |
��`�����ǂɋN������x����邢�͒����ȕ���F�߂���ꍇ |
| �� |
�@�p�O�C�p�゠�邢�͌o���ێ�s�\�ȏd�ǂ̉����Ȃǂɂ���`�����ǂ����݂��C���Ò�R���̔x����邢�͒����ȕ���F�߂���ꍇ�ɂ́C�����A���u�~�����܂̓��^���l������B |
| 9�j |
�z�����ʂ̒����Ȍ������}���X���Ȃ� |
| �� |
�@�}���X���C���ǂȂǂŏz�����ʂ̒����Ȍ������V���b�N���N�������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B |
| �� |
�@���^�ʂ̎Z��ɂ͉��L�̌v�Z����p����B���̂悤�ɂ��ē���ꂽ�A���u�~���ʂ����҂̕a��ɉ����āC�ʏ�2�`3���ŕ������^����B
| �@ |
�@�K�v���^�ʁig�j=���ҏ㏸�Z�x�ig/dL�j�~�z�����ʁidL�j�~2.5
�@�������C���ҏ㏸�Z�x�͊��Ғl�Ǝ����l�̍��C�z�����ʂ�0.4dL/kg�C���^�A���u�~���̌��Ǔ��������4/10�i40���j�Ƃ���B |
|
| 1�j |
�`�������Ƃ��Ẳh�{�⋋ |
�@2�j |
�]���� |
| 3�j |
�P�Ȃ錌���A���u�~���Z�x�̈ێ� |
�@4�j |
�������҂ւ̃A���u�~�����^ |
| 1�j |
�i�g���E���ܗL�� |
�@2�j |
�x����C�S�s�S |
�@3�j |
�����ቺ |
| 4�j |
���A |
�@5�j |
�A���u�~�������\�̒ቺ |
�͂��߂�
�@�ߔN�C���t���܂̈��S���͊i�i�Ɍ��サ�Ă������C�Ɖu���C�������Ȃǂ̕���p�⍇���ǂ�������댯�������܂��ɂ���C�y�ǂ̂��̂��܂߂���̕p�x�͌����ĒႢ�Ƃ͌������C�v���I�ȓ]�A���Ƃ邱�Ƃ��H�ɂ��邱�Ƃ���C���t���܂��{���I�ɗL����댯�������߂ĔF�����C���K���Ȏg�p�𐄐i����K�v������B
�@�܂��C���t���܂͐l�̂̈ꕔ�ł���C�L���ŋM�d�Ȏ����ł��錌�t�������Ă��邱�Ƃ���C���̎戵���ɂ͗ϗ��I�ϓ_����̔z�����K�v�ł���C���ׂĂ̌��t���܂ɂ��Ď������ł̎�����ڎw�����Ƃ����ۓI�Ȍ����ƂȂ��Ă���B
�]���āC���t�̍������S�����̒B���̂��߂ɂ͌��t���܂̎g�p�K�����̐��i���s���ł���B
�@���̂��߁C�����Ȃł́C1986�N�ɁC�̌�����������Č��t�̗ʓI�m�ۑ���u����ƂƂ��ɁC�u���t���܂̎g�p�K������v��݂��C���t���܂̍��������̒B����ڎw�����ƂƂ����B����C1989�N�ɂ͈�Ë@�֓��ł̗A���������S���K���ɍs����悤�u�A���Ö@�̓K�����Ɋւ���K�C�h���C���v�����肵���B
�܂��C1994�N�ɂ́u�������܂̎g�p��v�C1999�N�ɂ́u���t���܂̎g�p�w�j�v�y�сu�A���Ö@�̎��{�Ɋւ���w�j�v�����肳�ꂽ�B�����ɂ��C1992�N�ɂ͔Z�k�Ìň��q���܂̍����������B������C�A���u�~�����܁i�l�����A���u�~���C���M�l����
�`�������j�̎�������5���i1985�N�j����
50���i
2004�N�j�ցC�Ɖu�O���u�������܂̎�������40���i1995�N�j����
87���i
2004�N�j�ւƏ㏸
�����B����C���t���܂̎g�p�ʂ͕���11�N����N�X�������Ă���C����15�N�ɂ͌������܂Ŗ�2/3�C�A���u�~�����܂Ŗ�3/4�ɂȂ��Ă���B
�@
�������C�Ԍ����Z���t�y�ь����Z���t�̎g�p��
�͉����C�Ɖu�O���u�����͕���15�N�x�ɂ͂��߂Č����Ɍ������ȂǁC�\���Ȍ��ʂ��݂��Ă���Ƃ͌�����Ȃ��ƂȂ��Ă���B�܂��C���O���Ɣ�ׂ�ƁC�V�N�����������̌��t���܂̎g�p�ʂ���3�{�̏ɂƂǂ܂��Ă���C����Ȃ�k�����\�Ƒz�肳���B
�@����C����������������Ɍ��コ��
��ƂƂ��ɁC�����̉\�����팸���邽�߂ɁC�����̐��܂��܂ތ��t�̍������S�����C���S���̊m�ۋy�ѓK���g�p��ړI�Ƃ���C�u���S�Ȍ��t���܂̈��苟���̊m�ۓ��Ɋւ���@���v������15�N7���Ɏ{�s���ꂽ�B�ȏ�̊ϓ_�����Ì���ɂ����錌�t���܂̓K���g�p����w���i����K�v������B
�@���t���܂��g�p����ړI�́C���t�����̌��R���邢�͋@�\�s�S�ɂ��Տ�����ƂȂ�Ǐ��F�߂�Ƃ��ɁC���̐������[���ďǏ�̌y����}�邱�Ɓi��[�Ö@�j�ɂ���B
�@���̂悤�ȕ�[�Ö@���s���ۂɂ́C����̓��^���Ɋe�����̓��B���ׂ��ڕW�l��Տ��Ǐ�ƗՏ������l����\�ߐݒ肵�C�����ŕ�[���ׂ����t�����ʂ��v�Z���C����ɐ��̓��ɂ����錌�Ǔ��O�̕��z���ӑ��x���l�����ĕ�[�ʂ����C�ɉ����ĕ�[�Ԋu�����߂�K�v������B�܂��C����̓��^��ɂ́C�����̖ړI�C�ڕW���ǂ̒��x�B�����ꂽ���ɂ��Ă̗L�����̕]�����C�Տ��Ǐ�ƗՏ������l�̉��P�̒��x�Ɋ�Â��čs���C�����ɕ���p�ƍ����ǂ̔����̗L�����ώ@���C�f�Ø^�ɋL�^���邱�Ƃ��K�v�ł���B
| 2�D |
���t���g�p��̖��_�Ǝg�p�w�j�݂̍�� |
�@���t���܂̎g�p�ɂ��ẮC�P�Ȃ�g�p�҂̌o���Ɋ�Â��āC���̓K���y�ь��t���܂̑I�����邢�͓��^���@�Ȃǂ����肳��C�����Εs�K�Ȏg�p���s���Ă������Ƃ����Ƃ��Ă�������B���̂悤�Ȋϓ_����C�{�w�j�ɂ����ẮC���O�̌������ʂɊ�Â��C�����I�Ȍ������s�������̂ł���C����Ƃ��V���Ȉ�w�I�m��������ꂽ�ꍇ�ɂ́C�K�v�ɉ����Č��������ƂƂ���B
�@�܂��C�{�w�j�͕K��������t�̍ٗʂ𐧖���̂ł͂Ȃ����C�{�w�j�ƈقȂ����K���C�g�p���@�Ȃǂɂ��C�d�Ăȕ���p�⍇���ǂ��F�߂��邱�Ƃ�����C���̗Ö@�̑Ó��������Ƃ����\��������B���������āC���҂ւ̌��t���܂̎g�p�ɂ��Ă̐����Ɠ��Ӂi�C���t�H�[���h�E�R���Z���g�j���̎擾�ɍۂ��ẮC�����Ƃ��Ė{�w�j�܂������������邱�Ƃ��]�܂��B
�@����ɁC�{�w�j�͕ی��f�Ï�̐R����ƂȂ邱�Ƃ��Ӑ}������̂ł͂Ȃ����C���t���܂�p�����K���ȗÖ@�̐��i��ړI�Ƃ���ϓ_����C�ی��R���݂̍�����Č�������肪����ƂȂ邱�Ƃ����҂�����̂ł���B
| �@�� |
�@��68����7���K�肳��Ă���B |
| 3�D |
���܂��Ƃ̎g�p�w�j�̍l���� |
| 1�j |
�Ԍ����Z���t�ƑS���̓��^�ɂ��� |
�K���̌���Ɩ��_
�@�ꕔ�̊O�ȗ̈�ł́C���݂ł��S���̎g�p���邢�͑S���̑�ւƂ��Ă̐Ԍ����Z���t�ƐV�N���������̓��ʂ̕��p�������s���Ă���B�������Ȃ���C�����A������������āC����20�N�ȏオ�o�߂��C���̊ԁC�]���͐��S�����g���Ă����Ǘ�ɂ��Ă��C�Ԍ����Z���t���P�Ƃŗp������悤�ɂȂ�C�D�ꂽ�Տ����ʂ������邱�Ƃ��m�F����Ă������Ƃ���C���t�̊e�����̓��������������A���Ö@����w���i���邽�߁C�����ʂ̎�X�̕a�Ԃւ̎g�p�w�j�����肷�邱�ƂƂ����B
�Ȃ��C�S���̓K���ɂ��Ă̓G�r�f���X�������Ă��Ȃ��C�S���̋������p�����邱�Ƃ́C���t�̗L�����p��W���邱�Ƃ��猌�t���ܑS�̂̋����̐��ɂ�������
����B
���Ȍ��A���̐��i
�@���파�A���̈��S���͔���I�Ɍ��サ�����C���܂��Ɋ������E�C���X�Ȃǂ̓`�d�E������Ɖu�w�I�ȍ����ǂ�������댯��������C�����̊댯�����\�Ȍ��������邱�Ƃ����߂���B���݁C�ҋ@�I��p�ɂ�����A���Ǘ��80�`90���́C2,000mL�ȓ��̏o���ʂŎ�p���I���Ă���B���������āC�����̎�p�Ǘ�̑����́C�p�O�������C���t��ߎ��C�p���E�p�������Ȃǂ̎��Ȍ��A�����\���Ɋ��p���邱�Ƃɂ��C���파�A�����s�����ƂȂ����S�Ɏ�p���s�����Ƃ��\�ƂȂ��Ă���B
�A�����K�v�ƍl������ҋ@�I��p�̍ۂɁC�ߌ�A����ۊ������@�������̔����ɏ\���z������K�v��������̂́C���Ȍ��A���ɂ�铯�파�A������̉\�����������C���Ȍ��A����ϋɓI�ɐ��i���邱�Ƃ��K���g�p�����H���邽�߂ɂ����������B
| 2�j |
�����Z���t�̓��^�ɂ��� |
�K���̌���Ɩ��_
�@�����Z���t�͌������ɂ������Ȃ��C�������̌����C���͌����@�\�̒ቺ�Ȃ����ُ�ɂ��C�d�ĂȁC���Ƃ��Ēv���I�ȏo���Ǐ�i�������o���j��F�߂�Ƃ��ɁC�����̐��Ƌ@�\���[���Ď~�����邱�Ɓi���ÓI���^�j��ړI�Ƃ���ꍇ�ƁC���������ɂ��N���邱�Ƃ��\�������d�Ăȏo���𖢑R�ɖh�����Ɓi�\�h�I���^�j��ړI�Ƃ���ꍇ�ɍs���Ă��邪�C����70�`80���͗\�h�I���^�Ƃ��čs���Ă���B
�@�����Z���t�̎g�p�ʂ͔N�X�����X���ɂ��������A���̐��N�ԉ�����ԂƂȂ��Ă��邪�A�ēx��������\���������B���̔w�i�Ƃ��Ă͍���Љ�̓����ɂ�鈫����ᇂ̑������݂��邱�ƂƂƂ��ɁC�ߔN�C��ɑ������ᇂɑ��čs���Ă������͂ȉ��w�Ö@���Ō`��ᇂ̎��Âɂ��g�傳��C�܂��C�O�ȓI���u�Ȃǂɔ����g�p�������Ȃ������Ƃ���������B
�@�������Ȃ���A�����Z���t�̋����̐��͎��Y�ł��邱�Ƃ���펞�K�v�ʂ��m�ۂ��ėA�����邱�Ƃ�����Ȃ��Ƃł���B
�@���������āA�A���{���݂̍���ł��錌�������`�F�b�N���Ă���A�����邱�Ƃ����ۏ�͕s�\�ł���A���ɗ\�h�I���^�ł͌���������\�ߌ�����ŗA�����̌������ɊW�Ȃ�����I�ɍs�킴��Ȃ����Ƃ��������Ă���̂�����ł���B
| 3�j |
�V�N���������̓��^�ɂ��� |
�K���̌���Ɩ��_
�@�V�N���������́C�������̕a���̂ɑ���s�����������Ȃ���Ă��Ȃ����߁C�A�������ǂ�`�d����댯����L���Ă��邱�Ƌy�ь����`���Z�x��
�R�Ìŕۑ������t�ۑ��t�ɂ���߂���Ă��邱�Ƃɗ��ӂ���K�v������B
�������C�V�N���������̒����ۊǂ����{�ԏ\���Ђ̌��t�Z���^�[�Ō��ݍs���Ă���C����17�N10���ɂ�6�J���̒����ۊǂ����{�����\��ł���B
�@���݁C�V�N���������𓊗^����Ă��鑽���̏Ǘ�ɂ����ẮC���^���O�̋ÌŌn�������ُ�ł���Ƃ����{���̓K���a�Ԃł��邱�Ƃ͏��Ȃ��C�܂��K���Ǘ�ɂ����Ă����^��ɂ����̌����l�ُ�̉��P���m�F����Ă��邱�Ƃ͂���ɏ��Ȃ��B�V�N���������̓K���Ɠ��^�ʂ̌��肪�C�K���ɍs���Ă���Ƃ͌�������Ƃ�
�[�I�Ɏ��������ł���B�܂��C�]�����V�N���������͒P�ƂŁC���邢�͐Ԍ����Z���t�Ƃ̕��p�ɂ��C�z�����ʂ̕�[�ɗp�����Ă����B�������Ȃ���C���̂悤�ȖړI�̂��߂ɂ́C�����S�ȍזE�O�t�n�A�t��i���_�����Q���t�C�|�_�����Q���t�Ȃǁj��l�H�P���t�iHES�C�f�L�X�g�����Ȃǁj���邢�͓����̃A���u�~�����܂�p���邱�Ƃ����������B���̂悤�Ȃ��Ƃ���C����̎w�j�ɂ����ẮC�V�N���������̓K���͂����ꕔ�̗�O�iTTP/HUS�j�������āC�����I�ȋÌň��q�̕�[�Ɍ����邱�ƂL�����B
�������搻�܂̍����������i
�@���ď����Ɣ�r���āC�䂪���ɂ�����V�N���������y�уA���u�~�����܂̎g�p�ʂ́C���܂��ɍۂ����đ����B�Ìň��q�ȊO�̌��������̍������������S�ɒB�����邽�߂ɂ́C���肠�鎑���ł��錌�������̗L�����p�C���ɐV�N���������̓K���g�p��ϋɓI�ɐ��i���邱�Ƃ��ɂ߂ďd�v�ł���B
| 4�j |
�A���u�~�����܂̓��^�ɂ��� |
�K���̌���Ɩ��_
�@�A���u�~�����܁i�l�����A���u�~���y�щ��M�l����
�`�������j���C��h�{��Ԃւ̉h�{�f�Ƃ��Ă̒`�������̕⋋�ɂ��܂��ɂ����Ηp�����Ă���B�������Ȃ��瓊�^���ꂽ�A���u�~���͑̓��ő�ӂ���C�����͔M���ƂȂ�C�`�������ɂ͂قƂ�ǖ��ɗ����Ȃ��̂ŁC�`�������̕⋋�Ƃ����ړI�͒B�������Ȃ��B�`�������̕⋋�̂��߂ɂ́C���S�Ö��h�{�@��o���h�{�@�ɂ��h�{��Ԃ̉��P���ʏ�D�悳���ׂ��ł���B�܂��C��A���u�~�����ǂ͔F�߂�����̂́C����Ɋ�Â��Տ��Ǐ��Ȃ����C�y���ȏꍇ�ɂ������l�̕�݂̖̂ړI�ŁC�A���u�~�����܂������Ηp�����Ă��邪�C���̈�w�I�ȍ����͖�������Ă��Ȃ��B���̂悤�ɍ������ɖR���������̖��m�łȂ�
�K���ɂ��ẮC����̎g�p�w�j���珜�O���邱�Ƃɂ����g�p�͓K���ɂȂ�Ȃ����ƂY�g�p�w�j�ɖ��������B
�A���u�~�����܂̎������i
�@�킪���̃A���u�~�����܂̎g�p�ʂ́C�����������Z�ŁC
�ߋ����ő�g�p�ʂ�384��L�i1985�N�j����
174��L
�i2003�N�j�ւƖ�
55���}���������̂́C
�Ԍ����Z���t�ɑ���g�p�䗦�����܂����ď����������Ȃ葽���ƂȂ��Ă���B���������āC�A���u�~�����܂̍���������B�����邽�߂ɂ́C�������t�ɂ�錴�������̊m�ۂƕ����āC�A���u�~���̓K�������K�ɍs������
���d�v�ł����B
| 5�j |
�����ɑ���A���Ö@�ɂ��� |
�@�����ȗ̈�ɂ����ẮC�g�p���錌�t���܂̐�Ηʂ����Ȃ����߁C���̓K���g�p�ɂ��Ă̌������s���Ȃ��X���ɂ��������C���q����Љ���}�����錻��܂���ƁC���̓K���g�p��ϋɓI�ɐ��i���邱�Ƃ��K�{
�ł����B�������Ȃ���C����
����ɑ��錌�t���܂̓��^��ɂ��ẮC���܂��\���ȃR���Z���T�X�������Ă���Ƃ͌�����ɂ��邱�Ƃ���C���n��
�ɂ��Ă������n���ւ̐Ԍ����Z���t�̓��^���@
�C�V�����ւ̌����Z���t�̓��^���@�y�ѐV�����ւ̐V�N���������̓��^���@��
���肵���w�j�����肷�邱�ƂƂ�
���B
|
II |
�@�Ԍ����Z���t�̓K���g�p |
�@�Ԍ����Z���t�ired cell concentrate�FRCC�j�́C�}�����邢�͖����̏o���ɑ��鎡�Ëy�ѕn���̋}���ȕ��K�v�Ƃ���a�ԂɎg�p���ꂽ�ꍇ�C�ł��m���ȗՏ��I���ʂ邱�Ƃ��ł���B���̂悤�ȐԌ�����[�̑��`�I�ȖړI�́C�����z�n�֏\���Ȏ_�f���������邱�Ƃɂ��邪�C�z���t�ʂ��ێ�����Ƃ����ړI������B
�@
�Ȃ��C�Ԍ����Z���t�̐��@�Ɛ���ɂ��Ă͎Q�l����1415���Q�ƁB
| 1�j |
���ȓI�K���F�����n���ɑ���K�� |
�@���ȓI�ȕn���̑����́C�����I�ȑ����펾���ɋN��������̂ł���C���̑��C�����I�ȏ����Ǐo����q�{�o���Ȃǂ�����B�����ɂ����āC�Ԍ����A����v�����\�I�Ȏ����́C�Đ��s�ǐ��n���C�����ٌ`���nj�Q�C�����툫����ᇂȂǂł���B
�@
�����ǂ��A���B�킩��́C���ʒ����I�ȏo���ɂ�莞�ɍ��x�̕n���𗈂��B���̕n���͓S���R���n���ł���C�S�ܓ��^�ʼn��P���邱�Ƃ���C���퐶���Ɏx��𗈂��z��n�̗Տ��Ǐ�i�J�쎞�̓����E����C����Ȃǁj���Ȃ��ꍇ�ɂ́C�����Ƃ��ėA�����s��Ȃ��B�����I�n���ł���C�̓��̑㏞�@�\���������߂ɁC�����̏Ǐo�����邱�Ƃ͂܂�ł��邪�C�O�L�Ǐ���ꍇ�ɂ�2�P�ʂ̗A�����s���C�Տ������̉��P�̒��x���ώ@����B�S�g��Ԃ��ǍD�ȏꍇ�́C�w���O���r���iHb�j�l6g/dL�ȉ�����̖ڈ��ƂȂ�B���̌�͌������̎��ÂƓS�܂̓��^�Ōo�߂��ώ@����B
�@
�n���̌����𖾂炩�ɂ��C�r�^�~��B12���R�C�t�_���R�C���ȖƉu���n�����n���ȂǁC�A���ȊO�̕��@�Ŏ��É\�ł��鎾���ɂ́C�����Ƃ��ėA�����s��Ȃ��B
�@
�A�����s���ړI�́C�n���ɂ��Ǐo�Ȃ����x��Hb�l���ێ����邱�Ƃł��邪�C���̒l���ꗥ�Ɍ��߂邱�Ƃ͍���ł���B�������Ȃ���CHb7g/dL���A�����s����̖ڈ��Ƃ���Ă��邪�C���̒l�́C�n���̐i�s�x�C�늳���ԁC���퐶����Љ���̊����C�����ǁi���ɏz��n��ċz��n�̍����ǁj�̗L���Ȃǂɂ��قȂ�CHb7g/dL�ȏ�ł��A�����K�v�ȏꍇ������C���ꖢ���ł��s�K�v�ȏꍇ������C�ꗥ�Ɍ��߂邱�Ƃ͍���ł���B�]���ėA���̓K�������肷��ꍇ�ɂ́C�����l�݂̂Ȃ炸�z��n�̗Տ��Ǐ�𒍈Ӑ[���ώ@���C�������̊��������Ă���K�v������B���̏�ŁC�Տ��Ǐ�̉��P��������Hb�l���X�ɐݒ肵�C�A���{�s�̖ڈ��Ƃ���B
�@
���x�̕n���̏ꍇ�ɂ́C�z�����ʂ��������Ă��邱�ƁC�S���ɕ��S���������Ă��邱�Ƃ���C��x�ɑ�ʂ̗A�����s���ƐS�s�S�C�x��������������Ƃ�����B��ʂ�1�`2�P�ʁ^���̗A���ʂƂ���B�t��Q���������Ă���ꍇ�ɂ́C���ɒ��ӂ��K�v�ł���B
�@
������̏ꍇ�ł��CHb�l��10g/dL�ȏ�ɂ���K�v�͂Ȃ��B�J��Ԃ��A�����s���ꍇ�ɂ́C���^�O��̗Տ��Ǐ�̉��P�̒��x��Hb�l�̕ω����r�����ʂ�]������ƂƂ��ɁC����p�̗L�����ώ@������ŁC�K���ʂ̗A�����s���B�Ȃ��C�p��̓��^�ɂ��S�ߏ��ԁiiron
overload�j�𗈂��̂ŁC�s�K�v�ȗA���͍s�킸�C�o���邾�����^�Ԋu������B
�@
�Ȃ��C�������זE�ڐA�ɂ����闯�ӓ_�������i�Q�l1�j�Ɏ����B
| 2�j |
�O�ȓI�K���F�}���n���ɑ���K�� |
�}���o��
�@
�O�����̏o���������Ƌ}���o���𗈂��������́C��Ƃ��ď����Ǐo���ƕ��o���o���ɕ��ނł���B�����Ǐo���̌����͈ݏ\��w���������C�H���Ö�᎔j��C�}�����[���C�X�nj�Q�C������ᇂ���̏o���Ȃǂ�����C���o���o���̌��������ɂ͌��������邢�͓]�ڐ��̎�ᇁC�̑����B���Ȃǂ̎�������j��C�q�{�O�D�P�C�o�����X���C�����哮���⒰�������������j��Ȃǂ�����B
�@
�}���o���ł́CHb�l�ቺ�i�n���j�ƁC�z���t�ʂ̒ቺ���������Ă���B�z���Ԃ��猩��ƁC�z���t�ʂ�15���̏o���iclassI�j�ł́C�y���������ǎ��k���邢�͕p���������Əz���Ԃɂ͂قƂ�Ǖω��͐����Ȃ��B�܂��C15�`30���̏o���iclassII�j�ł́C�p���▬���̋������������C���҂͗����������Ȃ��Ȃ�s������悷��悤�ɂȂ�B����ɁC30�`40���̏o���iclassIII�j�ł́C���̏Ǐ�͍X�Ɍ����ƂȂ�C�������ቺ���C���_��Ԃ���������ꍇ������B�z���t�ʂ�40������o���iclassIV�j�ł́C�n���X���ƂȂ�C�����I�ɂ��댯�ȏ�ԂƂ���Ă�����1�B
�@
�n���̖ʂ���,�z���t������ȏꍇ�̋}���n���ɑ���ϐ��ɂ��Ă̖��m�ȃG�r�f���X�͂Ȃ��BHb�l��10g/dL����ꍇ�͗A����K�v�Ƃ��邱�Ƃ͂Ȃ���,6g/dL�ȉ��ł͗A���͂قڕK�{�Ƃ���Ă�����2�B���ɁC�}���ɕn�����i�s�����ꍇ�͂��̌X���͋����BHb�l��6�`10g/dL�̎��̗A���̕K�v���͊��҂̏�Ԃ⍇���ǂɂ���ĈقȂ�̂ŁCHb�l�݂̂ŗA���̊J�n�����肷�邱�Ƃ͓K�ł͂Ȃ��B
�@
��ʓI�Ȏ��p���̗A���̓K���̌������ȉ��Ɏ����B�Ȃ��C�e�Ȃ̎�p�ɂ�����A���Ö@�̒��ӓ_�������ɕt����i�Q�l2�`10�j�B
�@�p�O�̕n���͕K���������^�̑ΏۂƂ͂Ȃ�Ȃ��B���K�I�ɍs���Ă����p�O���^�̂�����10/30���[���iHb
�l10g/dL�C
�w�}�g�N���b�g�iHt
�j�l30���ȏ�
�ɂ��邱�Ɓj�͋ߔN�ł͍����̂Ȃ����̂Ƃ���Ă���B���������āC���҂̐S�x�@�\�C�������̎�ށi�ǐ��܂��͈����j�C���҂̔N���̏d���邢�͓���ȕa�ԓ��̑S�g��Ԃ�c�����ē��^�̕K�v���̗L�������肷��B
�@�Ȃ��C�����n���̏ꍇ�ɂ͓��ȓI�K���Ɠ��l�ɑΏ�����B
�@��ʂɕn���̂���ꍇ�ɂ́C�z�����ʂ͑������Ă��邽�߁C���^�ɂ��}���ɕn���̐������s���ƁC�S�����̔x����������N�����댯��������B�p�O���^�́C��������o�����R���g���[���ł��Ȃ��ꍇ���͂��̋��ꂪ����ꍇ�̂ݕK�v�Ƃ����B
�@
�����n�����҂ɑ���A���̓K���f����ۂ́C�����n�����҂ɂ�����㏞�����i�Q�l11�j���l���ɓ����ׂ��ł���B�����āC��p�����S�Ɏ{�s���邽�߂ɕK�v�ƍl������Ht�l�̍Œ�l�i�Q�l12�j���C���҂̑S�g��Ԃɂ��قȂ邱�Ƃ𗯈ӂ��ׂ��ł���B
�@�܂��C������n���̈�����ᇂ̑����䂪���ł́C�p�O�̊��҂͕n���ƂƂ��ɂ����Ήh�{��Q�ɂ���`�����ǂ��Ă��邪�C���̏ꍇ�ɂ͏p�O�ɉh�{�Ǘ��i���S�Ö��h�{�@�C�o���h�{�@�Ȃǁj��ϋɓI�ɍs���C���̐�����}��B
�@
��p���̏o���ɑ��ĕK�v�ƂȂ�A���ɂ��āC�\�ߏp�O�ɔ��f���ď�������i�Q�l13 15�j�B����ɁC�����t�@�����Ȃǂ̍R�ÌŖ��^����Ă���ꍇ�Ȃǂł́C�p�O�̍R�ÌŁE�R�����Ö@�ɂ��āC���̎��_�Œ��f���邩�Ȃǂf���邱�Ƃ��d�v�ł���i�Q�l14 16�j�B
�@�p���̏o���ɑ���
�o���ʂ̍팸�i�Q�l13 15�j�ɓw�߂�ƂƂ��ɁC�z���t�ʂɑ���o���ʂ̊����ƗՏ������ɉ����āC�����Ƃ��Ĉȉ��̂悤�Ȑ����A���ɂ��Ώ�����i�}1�j�B�S�g��Ԃ̗ǍD�Ȋ��҂ŁC�z���t�ʂ�15�`20���̏o�����N�������ꍇ�ɂ́C�זE�O�t�ʂ̕�[�̂��߂ɍזE�O�t�n�A�t��i���_�����Q���t�C�|�_�����Q���t�Ȃǁj���o���ʂ�2�`3�{���^����B
�@
�z���t�ʂ�20���ȏ��̏o���ʂɑ��ẮC�P���Z�������ێ����邽�����C�l�H�P���t�i�q�h���L�V�G�`���f���v���iHES�j�C�f�L�X�g�����Ȃǁj����ɂ͓����A���u�~�����܁i5���l�����A���u�~���܂��͉��M�l�����`���j�𓊗^����B�Ԍ����s���ɂ��g�D�ւ̎_�f�����s�������O�����ꍇ�ɂ́C�Ԍ����Z���t�𓊗^�������B
�@
�z���t�ʂ�20�`50���̏o���ʂɑ��ẮC�P���Z�������ێ����邽�߂ɁC�l�H�P���t�i�q�h���L�V�G�`���f���v���iHES�j�C�f�L�X�g�����Ȃǁj�𓊗^����B�Ԍ����s���ɂ��g�D�ւ̎_�f�����s�������O�����ꍇ�ɂ́C�Ԍ����Z���t�𓊗^�������B���̒��x�܂ł̏o���ł́C�����A���u�~�����܁i5���l�����A���u�~�����͉��M�l�����`�����j�̕��p���K�v�ƂȂ邱�Ƃ͏��Ȃ��B
�@
�z���t�ʂ�50�`100���̏o���ł́C�זE�O�t�n�A�t��C�l�H�P���t����ѐԌ����Z���t�̓��^�����ł͌����A���u�~���Z�x�̒ቺ�ɂ��x�����R�A���o������댯��������̂ŁC�K�X�����A���u�~�����܂𓊗^����B�Ȃ��C�l�H�P���t��1,000ml�ȏ�K�v�Ƃ���ꍇ�ɂ������A���u�~�����܂̎g�p���l������B
�@
���ʏ��20ml/kg�ƂȂ��Ă��邪�C�}���E���ʏo���͋~���̂��߂ɂ���ɒ����ʂ����邱�Ƃ��K�v�ȏꍇ������B���̏ꍇ�C�������ꂽ�l�H�P���t�̈ꕔ�͑̊O�ɗ��o���Ă��邱�Ƃ����Ă���ƁC20ml/kg���������ʂ��\�ł���B
�@����ɁC�z���t�ʈȏ�̏o���ʁi24���Ԉȓ���100���ȏ�j
����100ml/���ȏ�A��������悤�Ȏ����ɂ́C�Ìň��q�⌌�����̒ቺ�ɂ��o���X���i��ߐ��̋Ìŏ�Q�ƌ��������j���N����\��������̂ŁC�ÌŌn�⌌�����̌����l�y�їՏ��I�ȏo���X�����Q�l�ɂ��āC�V�N���������⌌���Z���t�̓��^���l������i�V�N������������ь����̎g�p�w�j�̍����Q�Ɓj�B���̊ԁC�����E�������Ȃǂ̃o�C�^���T�C����A�ʁE�S�d�}�E���Z�C����Ɍ��t�K�X�Ȃǂ̏������Q�l�ɂ��ĕK�v�Ȍ��t������lj�����B���k��������90mmHg�ȏ�C���ό�����60�`70mmHg�ȏ�Ɉێ����C���̔A�ʁi0.5�`1mL/kg/���j���m�ۂł���悤�ɗA�t�E�A���̊Ǘ����s���B
�@�ʏ��Hb�l��7�`8g/dL���x����Ώ\���Ȏ_�f�̋������\�ł��邪�C����������
�Ȃǂ̐S�������邢�͔x�@�\��Q��]�z��Q�̂��銳�҂ł́CHb�l��10g/dL���x�Ɉێ����邱�Ƃ����������B
�@�Ȃ��C�z���t�ʂɑ�������ȏ�̏o���ʂ�����ꍇ�ɂ́C�\�ł���Ή�������Ȍ��A�������݂�悤�ɓw�߂�B
| �}1 |
�@�o�����҂ɂ�����A�t�E�����A���Ö@�̓K�� |
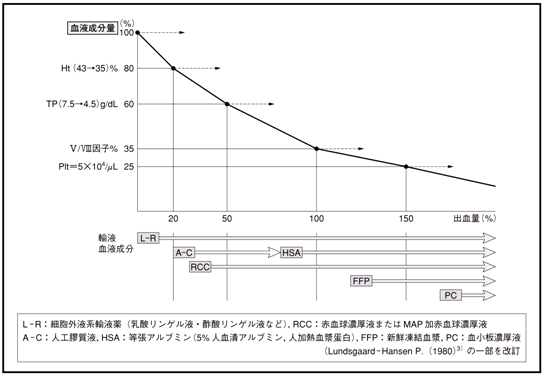
�@�p���1�`2���Ԃ͑n������̊Ԏ��t�̘R�o��`�����ى��̘��i�ɂ��C�זE�O�t�ʂƌ����A���u�~���Z�x�̌����������邱�Ƃ�����B�������C�o�C�^���T�C�������肵�Ă���ꍇ�́C�זE�O�t�n�A�t��̓��^�ȊO�ɐԌ����Z���t�C�����A���u�~�����܂�V�N���������Ȃǂ̓��^���K�v�ƂȂ�ꍇ�͏��Ȃ����C�����𓊗^����ꍇ�ɂ͊e�������܂̎g�p�w�j�ɂ����̂Ƃ���B
�@�}���ɕn�����i�s����p��o���̏ꍇ�̓��^�́C�A�����O�ȓI�~�����u�ƂƂ��ɑ��}�ɍs���B
�@�Ԍ����Z���t
1�P�ʁi200mL�R���j�̓��^�ɂ���ĉ��P�����Hb�l�́C�ȉ��̌v�Z�����狁�߂邱�Ƃ��ł���B
�@�\���㏸Hb�l�ig/dL�j
�@�@�����^Hb�ʁig�j/�z���t�ʁidL�j
�@�z���t�ʁF70mL/kg�o�z���t�ʁidL�j
�@�@���̏d�ikg�j�~70mL/kg/100�p
�@�Ⴆ�C�̏d50kg�̐��l�i�z���t��35dL�j��
Hb�l14�`15g/dL�̌��t��2�P�ʁi400mL�R��MAP��RCC1�o�b�O���̊ܗLHb��
��14�`15g/dL�~4dL=56�`60g�j�A�����邱�Ƃɂ��CHb�l�͖�1.6�`1.7g/dL�㏸���邱�ƂɂȂ�i�}2�j�B
�@���^�̑Ó����C�I���������^�ʂ̓I�m�����邢�͕���p�̗\�h��Ȃǂ̕]���Ɏ����邽�߁C�Ԍ����Z���t�̓��^�O�ɂ́C���^���K�v�ȗ��R�ƕK�v�ȓ��^�ʂm�ɔc�����C���^��ɂ͓��^�O��̌����f�[�^�ƗՏ������̉��P�̒��x���r���ĕ]������ƂƂ��ɁC����p�̗L�����ώ@���āC�f�Ø^�ɋL�ڂ���
�B
�Ìň��q�̕�[��ړI�Ƃ��Ȃ��V�N���������Ƃ̕��p
�@�Ԍ����Z���t�ƐV�N���������p���āC�S���̑�ւƂ��ׂ��ł͂Ȃ��B���̗��R�́C���ۂɋÌňُ��F�߂�Ǘ�͋ɂ߂Č����Ă��邱�Ƃ�C���̂悤�ȕ��p�ł͗A���P�ʐ����������C�����ǂ̓`�d�⓯��Ɖu�����̊댯�������傷�邩��ł���i�V�N���������̎g�p�w�j�̍����Q�Ɓj�B
�@�Ԍ����Z���t�̓��^�ɂ��C���t����銴���ǂ̓`�d�����Ƃ�����B
�@1�P�ʁi200mL�R���j�̐Ԍ����Z���t���ɂ́C��100mg�̓S���܂܂�Ă���B�l�̂���1���ɔr�������S��1mg�ł��邱�Ƃ���C�Ԍ����Z���t�̕p�^�͑̓��ɓS�̒����𗈂��C�S�ߏ�ǂ���B�܂��CHb1g�̓r�����r��40mg�ɑ�ӂ���C���̂قڔ��ʂ͌��NJO�ɑ��₩�Ɋg�U���邪�C�̏�Q�̂��銳�҂ł́C���^��
�̗V��Hb�̕��ׂ����t�̌����ƂȂ蓾��B
| 3�j |
�A����ڐA�БΏh��a�iGVHD�j�̗\�h�� |
�@�̌���14���ȓ��̐Ԍ����Z���t�̗A���ɂ�锭�ǗႪ����Ă��邱�Ƃ���C�̌���2�T�Ԉȓ��̌��t��p����ꍇ�ɂ́C�a�Ԃɉ����ĕ��ː��Ǝ˂������t���g�p����K�v������
4�j�B
�@���ː��Ǝˌ�̐Ԍ����Z���t�ł́C�ۑ�3���ォ��J���E���C�I�����}�㏸���C�ۑ�2�T�Ԍ�ɂ�1�P�ʁi200mL�R���j���̃J���E���C�I���̑��ʂ͍ō���7mEq�܂ő�������B�}���A�����C��ʗA�����C�t�s�S���҂��邢�͖��n���Ȃǂւ̗A�����ɂ͍��J���E�����ǂɒ��ӂ���B
| 4�j |
�����������t�B���^�[�̎g�p |
�@�p��ɓ��^��K�v�Ƃ��銳�҂ɂ́C���M����n���������⌌���A���s����ԂȂǂ̖Ɖu�w�I�@���ɂ�镛��p�̗\�h�ɔ����������t�B���^�[���g�p���邱�Ƃ����������B
�@ABO���t�^�̎��Ⴂ�ɂ��C�v���I�ȗn�����̕���p�𗈂����Ƃ�����B���^���O�ɂ́C���Ҏ����i�����������҂ł�ID�ԍ���N�����Ȃǁj�E���t�^�E���̑��̎����ɂ��Ă̏ƍ����C�K���e�o�b�O���ƂɍאS�̒��ӂ�����Ŏ��{����i�A���Ö@�̎��{�Ɋւ���w�j���Q�Ɓj�B
| ��1 |
�@American College of Surgeons. Advanced Trauma Life Support Course Manual. American College of Surgeons, 1997 ; 103-112 |
| ��2 |
�@American Society of Anesthesiologists Task Force. Practice guideline for blood component therapy. Anesthesiology 1996 ; 84 : 732-742
|
|
III |
�@�����Z���t�̓K���g�p |
�@�����A���́C�������̌������͋@�\�ُ̈�ɂ��d�Ăȏo���Ȃ����o���̗\�������a�Ԃɑ��āC�����������[���邱�Ƃɂ��~����}��C���͏o����h�~���邱�Ƃ�ړI�Ƃ���B
�@
�Ȃ��C�����Z���t�iPC�Gplatelet concentrate�j�̐��@�Ɛ���ɂ��Ă͎Q�l����1516���Q�ƁB
�@�����A���̓K���́C�������C�o���Ǐ�̒��x�y�э����ǂ̗L���ɂ�茈�肷�邱�Ƃ���{�Ƃ���B
�@���ɁC�������̌����͏d�v�ł͂��邪�C����݂̂�����ՂɈꗥ�Ɍ��肷�ׂ��ł͂Ȃ��B�o���Ȃ����o���X�����������̌������͋@�\�ُ�ɂ����̂ł͂Ȃ��ꍇ�i���Ɍ��Ǒ����j�ɂ́C�����A���̓K���Ƃ͂Ȃ�Ȃ��B
�@
�Ȃ��C�{�w�j�Ɏ����ꂽ�������̐ݒ�͂����܂ł��ڈ��ł����āC���ׂĂ̏Ǘ�ɍ��v������̂ł͂Ȃ����Ƃɗ��ӂ��ׂ��ł���B
�@�����A�����s���ꍇ�ɂ́C�K�����O�Ɍ������𑪒肷��B
�@�����A���̓K�������肷��ɓ������āC�������Əo���Ǐ�̑嗪�̊W�𗝉����Ă����K�v������B
�@��ʂɁC��������5��/��L�ȏ�ł́C���������ɂ��d�Ăȏo����F�߂邱�Ƃ͂Ȃ��C���������Č����A�����K�v�ƂȂ邱�Ƃ͂Ȃ��B
�@��������2�`5��/��L�ł́C���ɏo���X����F�߂邱�Ƃ�����C�~������ȏꍇ�ɂ͌����A�����K�v�ƂȂ�B
�@��������2��/��L�����ł͂����Ώd�Ăȏo�����݂邱�Ƃ����邽�߁C�����A�����K�v�ƂȂ�ꍇ������B
�@�������C�����Ɍo�߂��Ă��錌�������ǁi�Đ��s�ǐ��n���Ȃǁj�ŁC���ɏo���X���𗈂������ǂ��Ȃ��C�����������肵�Ă���ꍇ�ɂ́C��������5��`1��/��L�ł����Ă��C�����A���Ȃ��ŏd�Ăȏo���𗈂����Ƃ͂܂�Ȃ��Ƃ���C�����A���͋ɗ͔�����ׂ��ł���(4�D3)f�D�i2�j�Q��)�B
�@�Ȃ��C�o���X���̌����́C�P�Ɍ������̌����݂̂ł͂Ȃ����Ƃ���C�K�v�ɉ����ċÌŁE���n�n�̌����Ȃǂ��s���B
�@���������ɂ��d�ĂȊ������o����F�߂�ꍇ�i���ɖԖ��C�����_�o�n�C�x�C�����ǂȂǂ̏o���j�ɂ́C�������̎��Â��\���ɍs���ƂƂ��ɁC��������5��/��L�ȏ�Ɉێ�����悤�Ɍ����A�����s���B
�@�ҋ@�I��p���҂��邢�͍��Ő��h�C�d���O�����C�o�C�ǎx�����C�̐����Ȃǂ̐N�P�����u�ł́C�p�O���邢�͎{�s�O�̌�������5��/��L�ȏ゠��C�ʏ�͌����A����K�v�Ƃ��邱�Ƃ͂Ȃ��B
�܂��C�������h�┲���ȂNjǏ��̎~�����e�ՂȎ�Z�͌�������1�`2��/��L���x�ň��S�Ɏ{�s�ł���B���W���̎�p�̂悤�ɋǏ��ł̎~��������ȓ���ȗ̈�̎�p�ł́C7�`10��/��L�ȏ�ł��邱�Ƃ��]�܂����B
�@��������5��/��L�����ł́C��p�̓��e�ɂ��C�����Z���t�̏������͏p���O�̌����A���̉ۂf����B���̍ہC�������̌����𗈂���b����������C�p�O�ɂ��̎��Â��s���B
�@�����̐t����̑��̎����ŏo���X�������҂ł́C��p�ɂ���ʂ̏o�����݂邱�Ƃ�����B�o���X���̌������\���Ɍ������C�K�v�ɉ����Č����Z���t�̏������͏p���O����C�����A�����l������B
| c�D |
�l�H�S�x�g�p��p���̎��p���Ǘ� |
�@�S����p���҂̏p�O��Ԃɂ��ẮC�ҋ@�I��p���҂Ɠ��l�ɍl���đΏ�����B�l�H�S�x�g�p���ɂ݂��錌�������́C�ʏ�l�H�S�x�̎g�p���ԂƔ�Ⴗ��ƌ����Ă���B�܂��C���������͏p��1�`2���ōŒ�ƂȂ邪�C�ʏ��3��/��L�����ɂȂ邱�Ƃ͂܂�ł���B
�@�p���E�p���ʂ��Č�������3��/��L�����ɒቺ���Ă���ꍇ�ɂ́C�����A���̓K���ł���B
�������C�l�H�S�x���E��̗��_�v���^�~�����^��Ɍ��Z�y�ыÌŔ\��K�X�����C���f���Ȃ���C�K�v�ɉ�����5���^��L���x��ڏ��Ɍ����A���J�n���l������B
�@�Ȃ��C���G�ȐS�匌�ǎ�p�Œ����ԁi3���Ԉȏ�j�̐l�H�S�x�g�p��C�Ď�p�ȂǂōL�͂Ȗ���������v�����C�y�і����̐t����̑��̎����ŏo���X�����݂��̒��ɂ́C�l�H�S�x�g�p��Ɍ����������邢�͋@�\�ُ�ɂ��ƍl������~������ȏo���ioozing�Ȃǁj���݂邱�Ƃ�����B
�Ìň��q�̌��R�킸�C���̂悤��
�a�Ԃ�悷���ꍇ�ɂ́C��������5��/��L
�`10��/��L�ȏ��ɂȂ�悤�Ɍ����A�����s���B
�@�}�������ɂ��24���Ԉȓ��ɏz���t�ʑ�����
�C����2�{�ʈȏ�̑�ʗA�����s����ƁC���t�̊�߂ɂ�茌�����̌�����@�\�ُ�̂��߂ɁC���ǐ��̏o���𗈂����Ƃ�����B
�@�~������ȏo���Ǐ�ƂƂ��Ɍ���������F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�B
| e�D |
�d�퐫���Ǔ��ÌŁidisseminated intravascular coagulation;DIC�j |
�@�o���X���̋��������\���̂���DIC�i��b�����������a�C���C�Y�ȓI�����C�d�NJ����ǂȂǁj�ŁC���������}����5��/��L
�����ւƒቺ���C�o���Ǐ��F�߂�ꍇ�ɂ́C�����A���̓K���ƂȂ�BDIC�̑��̎��ÂƂƂ��ɁC�K�v�ɉ����ĐV�N�������������p����B
�@�Ȃ��C�����ɂ�鑟��Ǐ��������DIC�ł́C�����A���ɂ͐T�d�ł���ׂ��ł���B
�@����DIC�ɂ��ẮC�����A���̓K���͂Ȃ��B
�@�iDIC�̐f�f��ɂ��Ă͎Q�l����1���Q�Ɓj
�@�p��E���ʂ̌����A����v����ꍇ���������Ƃ���C����R�̂̎Y����\�h��������K�v�Ƃ���B
�@�}�������a�E���������p��Ȃǂ̊����Ö@�ɂ����ẮC�}���Ɍ��������ቺ���Ă���̂ŁC����I�Ɍ������𑪒肵�C�����̏ꍇ1�`2��/��L�ȏ�Ɉێ�����悤�ɁC�v��I�Ɍ����A�����s���B
�Ƃ��ɁC�}�������a�iM3�������j�ɂ����ẮC���肵����ԁi���M��d�NJ����ǂȂǂ��������Ă��Ȃ��j�ł���C��������1��/��L�ȏ�Ɉێ�����Ώ\���Ƃ����B�T�j�`�V�j
�@
�RHLA�R�̂����݂��Ȃ��Ƃ��C���M�C�����ǁC�B���CDIC�C�Ɖu�����̂Ȃǂ̑��݂���ꍇ�ɂ́C�����̗A���������E�������͒ቺ����
�B�]������������2��/��L�ȏ�ɕۂ��߂ɂ́C���p�邢�͑�ʂ̌����A����K�v�Ƃ��邱�Ƃ��������C���ɂ͌����A���s����ԂƂȂ邱�Ƃ�����B
| �@�i2�j |
�Đ��s�ǐ��n���E�����ٌ`���nj�Q |
�@�����̎����ł́C���������͖����Ɍo�߂��邱�Ƃ������C��������5��/��L�ȏ゠���ďo���Ǐ牺�o�������x�̌y���ȏꍇ�ɂ́C�����A���̓K���Ƃ͂Ȃ�Ȃ��B�����R�̂̎Y�����l�����C���ՂɌ����A�����s���ׂ��ł͂Ȃ��B
�@�������C��������5��/��L�O��Ȃ�������ȉ��ɒቺ����ꍇ�ɂ́C�d�Ăȏo�����݂�p�x�������Ȃ�̂ŁC�����A���̓K���ƂȂ�B�����A�����s��,��������1��/��L�ȏ�ɕۂ悤�ɓw�߂邪�C�ێ�������Ȃ��Ƃ�����B
�@�Ȃ��C�����ǂ��������Č������̌������݂�ꍇ�ɂ́C�o���X�����������邱�Ƃ������̂ŁC�i1�j�́u�������ᇁv�ɏ����Č����A�����s���B
�@���������������������a�iidiopathic thrombocytopenic purpura;ITP�j�́C�ʏ�͌����A���̑ΏۂƂ͂Ȃ�Ȃ��BITP�ŊO�ȓI���u���s���ꍇ�ɂ́C�A���ɂ�錌�����̑����͊��҂ł��Ȃ����Ƃ������C�܂��X�e���C�h�܂��邢�͐Ò��p�̖Ɖu�O���u�������܂̎��O���^���s���B�����̖�܂̌��ʂ��s�\���ő�ʏo���̗\�������ꍇ�ɂ́C�����A���̓K���ƂȂ�C�ʏ��葽�ʂ̗A����K�v�Ƃ��邱�Ƃ�����B
�@�܂��CITP�̕�e���琶�܂ꂽ�V�����ŏd�ĂȌ��������ǂ��݂�ꍇ�ɂ́C�����A��
�̂ق��C���t�玿�X�e���C�h���͖Ɖu�O���u�������܂̓��^�ƂƂ��Ɍ����A����K�v�Ƃ��邱�Ƃ�����B
�@�������ٍR���̕ꎙ�ԕs�K���ɂ��V��������Ɖu�����������ǁineonatal alloimmune thrombocytopenia;NAIT�j�ŁC�d�ĂȌ����������݂�ꍇ�ɂ́C�������ٍR�����^�̌����A�����s���B���̂悤�Ȍ����Z���t�����肵���Ȃ��ꍇ�ɂ́C��e�R���̌����̗A�����L���ł���B
�@�A���㎇���a�iposttransfusion purpura;PTP�j�ł́C�����A���̓K���͂Ȃ��C�������ٍR�����^�̌����A���ł������ł���B
�Ȃ��C���������Ö@���L���Ƃ̕�����B
| �@�i4�j |
���𐫌��������������a�ithrombotic thrombocytopenic purpura, TTP�j����їn�����A�ŏǏnj�Q�iHemolytic Uremic Syndrome, HUS�j |
�@TTP
��HUS�ł́C�����A���ɂ��Ǐ�̈������݂邱�Ƃ�����̂ŁC�����Ƃ��Č����A���̓K���Ƃ͂Ȃ�Ȃ��B
�@�����@�\�ُ�ǁi�������͏ǁC�R�����Ö@�Ȃǁj�ł̏o���Ǐ�̒��x�͏Ǘ�ɂ���ėl�X�ł���C�܂��C��������R�̎Y���̉\�������邱�Ƃ���C�d�Ăȏo���Ȃ����~������ȏꍇ�ɂ̂����A���̓K���ƂȂ�B
| �@�i6�j |
���̑��F�w�p�����N�������������ǁiHeparin induced thrombocytopenia:HIT�j |
�@
�����A���͋֊��ł���
�@�Ō`��ᇂɑ��ċ��͂ȉ��w�Ö@���s���ꍇ�ɂ́C�}���Ɍ��������������邱�Ƃ�����̂ŁC
�K�v�ɉ����ēK�X�������𑪒肷��B
�@��������2��/��L�����Ɍ������C�o���X����F�߂�ꍇ�ɂ́C��������
1�`2��/��L�ȏ�ɂȂ�悤�Ɍ����A�����s���B
�@���w�Ö@�̒��~��ɁC���������A���̂��߂ł͂Ȃ�2��/��L�ȏ�ɑ��������ꍇ�ɂ́C���ɓ��������̂ƍl�����邱�Ƃ���C����ȍ~�̌����A���͕s�v
�ł����B
| h�D |
�������זE�ڐA�i�����ڐA���j |
�@
���퍜���ڐA���邢�͎��ȑ������זE�ڐA���������זE�ڐA���ɍ����@�\������܂ł̊��Ԃ́C�v��I�Ɍ����A�����s���āC��������
1�`2��/��L�ȏ�ɕۂB
�@�o���Ǐ���Ό����A����lj�����B
| �� |
�@�o���\�h�̊�{�I�ȓK���
�@�����@�\�����x�ɒቺ������O���u��p�����������זE�ڐA��́C����������������̂ŁC�o���\�h�̂��߂Ɍ����Z���t�̗A�����K�v�ƂȂ�B�����Z���t�̓K���͌������ƗՏ��Ǐ���Q�l�Ɍ��߂�B�ʏ�C�o���\�h�̂��߂ɂ͌�������1�`2��/��L�����̏ꍇ�������Z���t�̓K���������A���̓K�����Ȃ�B�������C�����ǁC���M�C�d�퐫���Ǔ��ÌłȂǂ̍����ǂ�����ꍇ�ɂ͏o���X���̑������邱�Ƃ�����̂ŁC�������𑪒肵�C���̌��ʂɂ�蓖���̌����Z���t�̓K���f���邱�Ƃ��]�܂����i�g���K�[�A���j�B�������C�A���̍̌��ɂ�銳�҂ւ̕��S���l�����C�܂��C��^�I�ȑ������זE�ڐA�ł͌���������������Ԃ�������x�\���ł���̂ŁC�T�P�ʂł̌����Z���t�̗A�����v��ł���ꍇ�������B���̏ꍇ�́C1�T�Ԃ�2�`3��̕p�x�ŗA�����s���C1��̗A���ʂƂ��Ă�10�P�ʂ���������Ă���B |
| i�D |
�����A���s����ԁiHLA�K�������A���j |
�@�����A����Ɍ������̑������Ȃ���Ԃ������A���s����ԂƂ����B
�@�������̑������Ȃ������ɂ́C����R�̂Ȃǂ̖Ɖu�w�I�@���ɂ����̂ƁC���M�C�����ǁCDIC�C�B���Ȃǂ̔�Ɖu�w�I�@���ɂ����̂Ƃ�����B
�@�Ɖu�w�I�@���ɂ��s����Ԃ̑啔����
�RHLA�R�̂ɂ����̂ŁC�ꕔ�Ɍ������ٍR�̂��֗^������̂�����B
�@
�RHLA�R�̂ɂ�錌���A���s����Ԃł́CHLA�K�������Z���t��A������ƁC�������̑������݂邱�Ƃ������B�����a�C�Đ��s�ǐ��n���ȂǂŒʏ�̌����Z���t��A�����C�A�������̌������̑������݂��Ȃ��ꍇ�ɂ́C�A�������̌������𑪒肵�C������2��ȏ�ɂ킽���ĂقƂ�ǔF�߂�ꂸ�C
�RHLA�R�̂����o�����ꍇ�ɂ́CHLA�K�������A���̓K���ƂȂ�B
�@�Ȃ��C
�RHLA�R�̂͌o�ߒ��ɉA�������C�ʏ�̌����Z���t���L���ƂȂ邱�Ƃ�����̂ŁC�o���I�Ɍ������邱�Ƃ��]�܂��B
�@HLA�K�������Z���t�̋����ɂ͓���̋����҂ɑ���ȕ��S���ۂ����Ƃ���C���̓K���ɓ������Ă͓K���T�d�Ȕ��f���K�v�ł���B
�@��Ɖu�w�I�@���ɂ�錌���A���s����Ԃł́C�����Ƃ���HLA�K�������A���̓K���͂Ȃ��B
�@HLA�K�������Z���t�����肵���Ȃ��ꍇ�△���̏ꍇ�C���邢�͔�Ɖu�w�I�@���ɂ�錌���A���s����Ԃɂ���C�o����F�߂�ꍇ�ɂ́C�ʏ�̌����Z���t��A�����Čo�߂��݂�B
�@���҂̌������C�z���t�ʁC�d�Ǔx�Ȃǂ���C�ړI�Ƃ��錌�����̏㏸�ɕK�v�Ƃ���铊�^�ʂ����߂�B�����A������̗\�������������i/��L�j�͎����ɂ��Z�o����B
| �@ |
�\������������(�^��L)
| �@ |
�� |
�A����������
|
�~ |
2
|
| �z���t��(mL)�~103 |
3 |
�i2�^3�͗A�����ꂽ�������B���ɕ⑫����邽�߂̕�W���j
�i�z���t�ʂ�70ml/kg�Ƃ���j
|
�@�Ⴆ�C�����Z���t5�P�ʁi1�D0�~10
11�ȏ�̌������ܗL�j���z���t��5,000mL�i�̏d65kg�j�̊��҂ɗA������ƁC����ɂ͗A���O�̌��������13,500/��L�ȏ㑝�����邱�Ƃ������܂��B�Ȃ��C
�̏d25kg�ȉ��̏����ł�10�P�ʂ�3�`4���Ԃ����ėA������B
�@�����A�����{��ɂ́C�A�����ʂɂ��ėՏ��Ǐ�̉��P�̗L���y�ь������̑����̒��x��]������B
�@�������̑����̕]���́C�����A����
��1���Ԗ���
������24���Ԍ��̕�����������icorrected count increment, CCI�j�ɂ��s���BCCI�͎����ɂ��Z�o����B
| �@ |
CCI(�^��L)
| �@ |
�� |
�A������������(�^��L)�~�̕\�ʐ�(m2)
|
| �A���ʌ�������(�~1011) |
|
�@�ʏ�̍����ǂȂǂ̂Ȃ��ꍇ�ɂ́C�����A����
��1���Ԃ�CCI�́C���Ȃ��Ƃ�7,500/��L�ȏ�ł���B
�܂��C��������24���Ԍ��CCI�͒ʏ큆4,500/��L�ł���B
�@�������������A�����J��Ԃ��s���ꍇ�ɂ́C�Տ��Ǐ�ƌ������Ƃ̕]���Ɋ�Â��ĈȌ�̗A���v��𗧂Ă邱�ƂƂ��C���R�ƌp���I�Ɍ����A�����s���ׂ��ł͂Ȃ��B
�@�������҂ɑ��ẮC���҂�
���R�ӎv�d���C�P�Ȃ��������u�͍T����Ƃ����l������
�e�F����
����B�A���Ö@�Ƃ����ǂ����̗�O�ł͂�
���C���҂̈ӎv�d���Ȃ��P�Ȃ鎞�ԓI�����̂��߂̓��^�͍T����ׂ��ł���B
�@�����Z���t���g�p����ꍇ�ɂ́C
�������A���Z�b�g���g�p���邱�Ƃ��]�܂����B
�@�Ԍ����⌌�����܂̗A���Ɏg�p�����A���Z�b�g���������������A���Ɏg�p���ׂ��ł͂Ȃ��B
| �@�i2�j |
�����������t�B���^�[ |
�@
����16�N10��25���ȍ~�C�����̌��R�������Z���t�͑S�Ĕ������������܂ƂȂ��Ă���C�x�b�h�T�C�h�ł������Z���t�p�̔����������t�B���^�[�̎g�p
�͕s�v�ł���B�A���C�Ԍ����Z���t���g�p����ꍇ�́C�Ԍ����Z���t�p�̔����������t�B���^�[���g�p���ėA�����邩�C�����������Ԍ����Z���t���g�p����B
�@�A����ڐA�БΏh��a�iPT-GVHD�j�̔��ǂ̊댯��
���l�����C���ː����Ǝˁi15�`50Gy�j���������Z���t���g�p
���ׂ��ł���C�Ԍ����Z���t�p����ꍇ�ɂ����l�̔z����K�v�Ƃ���B
| �@�i4�j |
�T�C�g���K���E�C���X�iCMV�j�R�̉A�������Z���t |
�@CMV�R�̉A���̔D�w�C���邢�͍R�̉A���̔D�w���琶�܂ꂽ�ɏ����n���Ɍ����A��������ꍇ�ɂ́CCMV�R�̉A���̌����Z���t���g�p����B
�@�������זE�ڐA���Ɋ��҂ƃh�i�[�̗��҂�CMV�R�̉A���̏ꍇ�ɂ́CCMV�R�̉A���̌����Z���t���g�p����B
�@
CMV�����̗\�h�ɂ́C�����������t�B���^�[�̎g�p���L���ȏꍇ�������Ȃ��C���݁C�ۑ��O���������������Z���t����������Ă���CCMV�ɂ��L�p�Ƃ���Ă����B
| �@�i5�j |
HLA�K�������Z���t |
�@3���@�Ɏ��������A���s����Ԃɑ��ėL���ȏꍇ�������B
�@�Ȃ��C�����A���s����Ԃɂ́C�������ٍR�̂ɂ����̂�����B
| �@�i6�jABO���t�^�ERh�^�ƌ����K�������i�Ԍ����j |
�@�����Ƃ��āCABO���t�^�̓��^�̌����Z���t���g�p����B
�@���҂�Rh�A���̏ꍇ�ɂ́CRh�A���̌����Z���t���g�p���邱�Ƃ��]�܂����C���ɔD�P�\�ȏ����ł͐��������B�������C�Ԍ������قƂ�NJ܂܂Ȃ��ꍇ�ɂ́CRh�z���̌����Z���t���g�p���Ă��悢�B���̏ꍇ�ɂ́C���͉��RRh�l�Ɖu�O���u�����iRHIG�j�𓊗^���邱�Ƃɂ��C�RD�R�̂̎Y����\�h�ł���ꍇ������B
�@�ʏ�̌����A���̌��ʂ��Ȃ��C
�RHLA�R�̂��F�߂���ꍇ�ɂ́CHLA�K�������Z���t���g�p����B���̏ꍇ�ɂ��CABO���t�^�̓��^�̌����Z���t���g�p���邱�Ƃ������Ƃ���B
�������CABO���t�^�s�K���̌����Z���t���g�p���Ȃ���Ȃ�Ȃ��ꍇ�C�����Z���t���̍RA�C�RB�R�̉��ɒ��ӂ��A�n���̉\�����l������B�܂��C���҂̍RA�C�RB�R�̉����ɂ߂č����ꍇ�ɂ́CABO���t�^�s�K�������A���������̂��Ƃ������̂ŁC���ӂ��ׂ��ł���B
�@
�Ȃ��C�Ԍ������قƂ�NJ܂܂Ȃ������Z���t���g�p����ꍇ�ɂ́C�Ԍ����̌����K���������ȗ����Ă��悢�B
| �@�i7�j |
ABO���t�^�s�K���A�� |
�@
ABO���t�^���^�����Z���t�����荢��ŁCABO���t�^�s�K���̌����Z���t���g�p���Ȃ���Ȃ�Ȃ��ꍇ�C�����Z���t���̍RA�C�RB�R�̉��ɒ��ӂ��A�n���̉\�����l������B�܂��C���҂̍RA�C�RB�R�̉����ɂ߂č����ꍇ�ɂ́CABO���t�^�s�K�������A���������̂��Ƃ������̂ŁC���ӂ��ׂ��ł���B
�@
�Ȃ��C�Ԍ������قƂ�NJ܂܂Ȃ������Z���t���g�p����ꍇ�ɂ́C�Ԍ����̌����K���������ȗ����Ă��悢�B
����
| 1) |
British Committee for Standards in Haematology, Blood Transfusion Task Force : Guidelines for the use of platelet transfusions. Br J Haematol 122 : 10-23, 2003 |
| 2) |
C. A. Schiffer, K. C. Anderson, C. L. Bennett, S. Bernstein, L. S. Elting, M. Goldsmith, M. Goldstein, H. Hume, J. J. McCullough, R. E. McIntyre, B. L. Powell, J. M. Rainey, S. D. Rowley, P. Rebulla, M. B. Troner, and A. H. Wagnon : Platelet�@Transfusion for Patients With Cancer : Clinical Practice Guidelines of the American Society of�@Clinical Oncology. J Clin Oncol 19 : 1519-1538, 2001 |
| 3) |
A Report by the American Society of Anesthesiologists Task Force on Blood Component Therapy : Practice Guidelines for Blood Component Therapy. Anesthesiology 84 : 732-747, 1996 |
| 4) |
�����ȖǁF�������܂̓K���g�p�ɂ��āD1994 |
| 5) |
Wandt H, Frank M, Ehninger G, Schneider C, Brack N, Daoud A. Fackler-Schwalb I, Fischer J, Gackle R, Geer T, Harms P, Loffler B, Ohl S, Otremba B, Raab M, Schonrock-Nabulsi P, Strobel G, Winter R, Link H. Safety and cost effectiveness
of a 10�~10 (9) / L trigger for prophylactic platelet transfusions compared with the traditional 20�~10 (9) / L trigger : a prospective comparative trial in 105 patients with acute myeloid leukemia. Blood. 91 : 3601-6, 1998 |
| 6) |
Rebulla P, Finazzi G, Marangoni F, Avvisati G, Gugliotta L, Tognoni G, Barbui T,�@Mandelli F, Sirchia G. The threshold for prophylactic platelet transfusions in adults with acute myeloid leukemia. Gruppo Italiano Malattie Ematologiche Mallgne dell'Adulto. N Engl J Med 337 : 1870-5, 1997 |
| 7) |
Heckman KD, Weiner GJ, Davis CS, Strauss RG, Jones MP, Burns CP. Randomized study of prophylactic platelet transfusion threshold during Induction therapy for adult acute leukemia : 10,000 / microL versus 20,000 / microL. J Clin�@Oncol 15 : 1143-9, 1997 |
|
IV |
�@�V�N���������̓K���g�p |
�@�V�N���������ifresh frozen plasma�FFFP�j�̓��^�́C
�������q�̌��R�ɂ��a�Ԃ̉��P��ړI�ɍs���B���ɁC�Ìň��q���[���邱�Ƃɂ��C�o���̗\�h��~���̑��i���ʁi�\�h�I���^�Ǝ��ÓI���^�j�������炷���Ƃɂ���B
�@
�Ȃ��C�V�N���������iFFP�j�̐��@�Ɛ���ɂ��Ă͎Q�l����16 17���Q�ƁB
�@�Ìň��q�̕�[�ɂ�鎡�ÓI���^����ړI�Ƃ���B
���R�o�����C�O�����̏o�����̎��ÂƊό��I���u���s���ۂɓK���ƂȂ�B�ό��I���u����������FFP�̗\�h�I���^�̈Ӗ��͂Ȃ��C�����܂ł����̎g�p��
�����I���^�Ɍ��肳���B���^�ʂⓊ�^�Ԋu�͊e�Ìň��q�̕K�v�Ȏ~�����x���C���̓��̔������������Ȃǂ��l�����Č���
���C���Ì��ʂ̔���͗Տ�������
�ÌŊ����̌������ʂ𑍍��I�Ɋ��Ă��čs���BFFP�̓��^�́C���Ɉ��S�Ō��ʓI�Ȍ������搻�܂��邢�͑�ֈ��i�i���R���r�i���g���܂Ȃǁj���Ȃ��ꍇ�ɂ̂݁C�K���ƂȂ�B���^�ɓ������ẮC���^�O�Ƀv���g�����r�����ԁiPT�j�C�����������g�����{�v���X�`�����ԁiAPTT�j
�𑪒肵�CDCIIC���̑�ʏo���ł��t�B�u���m�Q���l
����������B�܂��CFFP�̗\�h�I���^�́C�Ìň��q���R�ɂ��o���̋���̂��銳�҂̊ό��I���u���������C���̗L�����͏ؖ�����Ă��Ȃ��i�{�������m���n�u�o���ɑ���A���Ö@�v���Q�Ɓj�B���������āCFFP�̓K���͈ȉ��Ɏ����ꍇ�Ɍ��肳���B
| �@�i1�j |
PT����с^�܂���APTT���������Ă���ꍇ�i(1)PT���i�@�j�e��Ë@�ւɂ������̏����1.5�{�ȏ�INR 2.0�ȏ��C�i�A�j4530���ȉ��C�i�B�jINR 1.6�ȏ��^(2)APTT�́i�@�j�e��Ë@�ւɂ������̏����2�{�ȏ�C�i�A�j25���ȉ��Ƃ���j |
| �� |
�@�̏�Q�F�̏�Q�ɂ�蕡���̋Ìň��q�������ቺ���C�o���X���̂���ꍇ�ɓK���ƂȂ�BFFP�̎��Ì��ʂ�PT��APTT�Ȃǂ̋ÌŌ������s���]�����邪�C�����l�̐��퉻��ڕW�Ƃ���̂ł͂Ȃ��Ǐ�̉��P�ɂ�蔻�肷���B�������C�d�NJ̏�Q�ɂ�����~���n�ُ̈�́C�Ìň��q�̎Y���ቺ����ł͂Ȃ��C�������̌������R�Ìň��q�C���n���q�C�R���n���q�̎Y���ቺ�C�ԓ��n�̋@�\�̒ቺ�Ȃǂ������ƂȂ蓾�邱�Ƃɗ��ӂ���B�܂��C�}���̕s�S�ɂ����ẮC�����Ώ���Ìŏ�Q�ɂ��FFP�̕K�v���^�ʂ���������B�e�ʂ̉ߕ��ׂ����O�����ꍇ�ɂ́C���������Ö@�i1�`1.5�~�z������/��j�p�����i�A�t�F���V�X�̊֘A�����́C�Q�l16 14���Q�Ɓj�B
�@�Ȃ��CPT�������1.5�{�ȏ�INR 2.0�ȏ��i4530���ȉ�����INR 1.6�ȏ��j�ŁC���ό��I���u���s���ꍇ��������FFP�̗\�h�I���^�̓K���͂Ȃ��B�������C��p�ȊO�̊ό��I���u�ɂ�����d��ȏo���̔����́C�Ìŏ�Q������Z����Ȍ����ƂȂ�ƍl�����Ă��邱�Ƃɗ��ӂ���B
|
| �� |
�@L-�A�X�p���M�i�[�[���^�֘A�F�̑��ł̎Y���ቺ�ɂ��t�B�u���m�Q���Ȃǂ̋Ìň��q�̌����ɂ��o���X�����݂邱�Ƃ����邪�C�A���`�g�����r���Ȃǂ̍R�Ìň��q����n���q�̎Y���ቺ�����������Ƃ���C�����ǂ��݂�ꍇ������B�����̏����q���ɕ⋋���邽�߂ɂ�FFP��p����B�A���`�g�����r���̉��������́C�A���`�g�����r�����܂p����B
�@�~���n�ُ̈�̒��x�Əo�����������ɂ��L-�A�X�p���M�i�[�[�̓��^�v��̒��~�Ⴕ���͕ύX����������B
|
| �� |
�@�d�퐫���Ǔ��ÌŁiDIC�j�FDIC�i�f�f����Q�l����1���Q�Ɓj�̎��Â̊�{�́C�����̏����i��b�����̎��Áj�ƃw�p�����Ȃǂɂ��R�ÌŗÖ@�ł���BFFP�̓��^�́C�����̏��u��O��Ƃ��čs����ׂ��ł���B���̍ۂ�FFP���^�́C�Ìň��q�Ƌ��ɕs�����������I�ÌŁE���n�j�Q���q�i�A���`�g�����r���C�v���e�C��C�C�v���e�C��S�C�v���X�~���C���q�r�^�[�Ȃ��j�̓����⋋��ړI�Ƃ���B�ʏ�C(1)PT�́i�@�j�e��Ë@�ւɂ������̏����1.5�{�ȏ�INR 2.0�ȏ��C�i�A�j4530���ȉ��C�i�B�jINR 1.6�ȏ��^(2)APTT�́i�@�j�e��Ë@�ւɂ������������2�{�ȏ�C�i�A�j25���ȉ�,�t�B�u���m�Q���l��100mg/dL�ȉ��̏ꍇ��FFP�̓K���ƂȂ��i�Q�l����1 DIC�̐f�f��Q�Ɓj�B
�@�Ȃ��C�t�B�u���m�Q���l��100mg/dL���x�܂Œቺ���Ȃ����PT��APTT���������Ȃ����Ƃ�����̂Œ��ӂ���B�܂��C�����A���`�g�����r���������ቺ����ꍇ�́CFFP�����S�����ʓI�ȃA���`�g�����r���Z�k�������搻�܂̎g�p����ɍl������B
|
| �� |
�@��ʗA�����F�ʏ�C��ʗA�����Ɋ�ߐ��Ìŏ�Q�ɂ���~���������N���邱�Ƃ�����C���̏ꍇFFP�̓K���ƂȂ�B�������Ȃ���C��ߐ��Ìŏ�Q���F�߂��Ȃ��ꍇ���CFFP�̓K���͂Ȃ��i�}1�j�B�O���Ȃǂ̋~�}���҂ł́C����Ìŏ�Q���������Ă��邩���������C�Ìň��q���R�ɂ��o���X��������Ɣ��f���ꂽ�ꍇ�Ɍ���CFFP�̓K��������BFFP�̗\�h�I���^�͍s��Ȃ��B |
| ii�D |
�Z�k���܂̂Ȃ��Ìň��q���R�� |
| �� |
�@���t�Ìň��q���R�ǂɂ͂��ꂼ��̔Z�k���܂�p���邱�Ƃ������ł��邪�C���t�Ìő�V�C��XI���q���R�ǂɑ���Z�k���܂͌��݂̂Ƃ��닟������Ă��Ȃ��B���������āC�����̗����q�̂����ꂩ�̌��R�ǂ܂��͂������܂ޕ����̋Ìň��q���R�ǂł́C�o���Ǐ�������Ă��邩�C�ό��I���u���s���ۂ�FFP���K���ƂȂ�B��VIII���q�̌��R���i���F�aA�j����`�q�g�݊����^���܂܂����Z�k���܁C��IX���q���R���i���F�aB�j�ɂ͔Z�k���܁C��XIII���q���R�ǂɂ͔Z�k���܁C��V�����t�B�u���m�Q�����ǂɂ͔Z�k�t�B�u���m�Q�����܁C��VII���q���R�ǂ��͈�`�q�g�݊���������VII���q���ܖ����Z�k�v���g�����r�������̐��܁C�v���g�����r�����R�ǁC��X���q���R�ǂɂ͔Z�k�v���g�����r�������̐��܁C����Ƀt�H�����B���u�����h�a�ɂ́C�t�H�����B���u�����h���q���܂�ł����VIII���q�Z�k���܂ɂ�鎡�Â��\�ł��邱�Ƃ���C�������FFP�̓K���Ƃ͂Ȃ�Ȃ��B |
| iii�D |
�N�}�����n��܁i�����t�@�����Ȃǁj���ʂً̋}��iPT��1.5�{�ȏ�INR 2.0�ȏ��i4530���ȉ�����INR 1.6�ȏ��j�j |
| �� |
�@�N�}�����n��܂́C�̂ł̑�II�CVII�CIX�CX���q�̍����ɕK�{�ȃr�^�~��K�ˑ����y�f�������j�Q�܂ł���B�����̋Ìň��q�̌��R��Ԃɂ�����o���X���́C�r�^�~��K�̕⋋�ɂ���ʏ�P�����ȓ��ɉ��P���F�߂���悤�ɂȂ�B����\�Ȍ���u�Z�k�v���g�����r�������̐��܁v���g�p���������悢�Ȃ��C���ً}�ȑΉ��̂��߂�FFP�̓��^���K�v�ɂȂ邱�Ƃ��H�ɂ��邪�C���̏ꍇ�ł������Ɏg�p�\�ȏꍇ�ɂ́u�Z�k�v���g�����r�������̐��܁v���g�p���邱�Ƃ��l�������B
|
| �@�i2�j |
��t�B�u���m�Q�����ǁi100mg/dL�����j |
�@�䂪���ł͔Z�k�t�B�u���m�Q�����܂̋������\���łȂ��C�܂��N���I�v���V�s�e�[�g���܂���������Ă��Ȃ����Ƃ���C�ȉ��̕a�Ԃւ̃t�B�u���m�Q���̕�[�ɂ́CFFP��p����B
�@�Ȃ��C�t�B�u���m�Q���l�̒ቺ�̒��x��PT��APTT�ɕK���������f����Ȃ��̂Œ��ӂ���i�O�q�j�B
| �� |
�@�d�퐫���Ǔ��ÌŁiDIC�j�F�i�O��i�uDIC�v���Q�Ɓj |
| �� |
�@L-�A�X�p���M�i�[�[���^���F�i�O���@�@L�]�A�X�p���M�i�[�[���^�֘A�Q�� |
| 2�j |
�Ìőj�Q���q����n���q�̕�[ |
| �� |
�@�v���e�C��C�C�v���e�C��S��v���X�~���C���q�r�^�[�Ȃǂ̋ÌŁE���n�j�Q���q���R�ǂɂ����錇�R���q�̕�[��ړI�Ƃ��ē��^����B�v���e�C��C��v���e�C��S�̌��R�ǂɂ����錌���ǂ̔��ǎ��ɂ̓w�p�����Ȃǂ̍R�ÌŗÖ@�p���C�K�v�ɉ�����FFP�ɂ�茇�R���q���[����B������ɂ͌o���R�ÌŗÖ@�ɂ�茌���ǂ̔�����\�h����B�A���`�g�����r���ɂ��Ă͔Z�k���܂𗘗p����B�܂��C�v���e�C��C���R�ǂɂ����錌���ǔ��ǎ��ɂ͊����^�v���e�C��C�Z�k���܂ɂ�鎡�Â��\�ł���B�v���X�~���C���q�r�^�[�̌��R�ɂ��o���Ǐ�ɑ��Ă̓g���l�L�T���_�Ȃǂ̍R���n��p���C���ʂ��s�\���ȏꍇ�ɂ�FFP�𓊗^����B |
| 3�j |
�������q�̕�[�iPT�y��APTT������ȏꍇ�j |
| �� |
�@���𐫌��������������a�iTTP�j�F���Ǔ���זE�ŎY������镪�q�ʂ��������傫���iunusually large�j�t�H�����B���u�����h���q�}���`�}�[�iUL-VWFM�j���C�����z�Ō��������������C�{�ǂǂ����ƍl�����Ă���B�ʏ�CUL-VWFM�͓��זE���猌���ɕ��o�����ۂɁC�̑��ŎY�������VWF���ٓI���^���v���e�A�[�[�i�ʖ�ADAMTS13�j�ɂ��C�{���̎~���ɕK�v�ȃT�C�Y�ɕ��������B�������C��V��TTP�ł͂��̍y�f�ɑ��鎩�ȍR�́i�C���q�r�^�[�j���������C���̊������������ቺ����B�]���āC�{�ǂɑ���FFP��u���t�Ƃ������������Ö@�i1�`1.5�z������/��j�̗L�p���́i1�j���C���q�r�^�[�̏����C�i2�j���y�f�̕⋋�C�i3�jUL-VWFM�̏����C�i4�j�~���ɕK�v�Ȑ���T�C�YVWF�̕⋋�C��4�_�ɏW���B����C��V��TTP�ł́C���̍y�f�����̌����Ɋ�Â��̂ŁCFFP�̒P�Ɠ��^�ŏ[���Ȍ��ʂ�����5�j�B
�@�Ȃ��C���Ǐo�����咰��O�]157�F0H7�����ɑ�\������V���n�����A�ŏǏnj�Q�iHUS�j�ł́C���̑������O�L�y�f�����Ɉُ��F�߂Ȃ����߁CFFP��p�������������Ö@�͕K�������L���ł͂Ȃ�6�j�B |
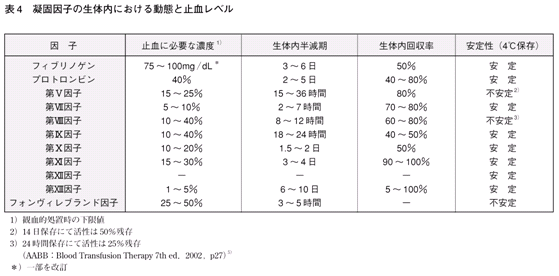
�@�����I�Ȏ~�����ʂ����҂��邽�߂̋Ìň��q�̍ŏ��̌��������l�́C����l��20�`30�����x�ł���i�\4�j�B
�@�z�����ʂ�40mL/kg�i70mL/kg�i1-Ht/100�j�j�Ƃ��C��[���ꂽ�Ìň��q�̌����������
�ړI�Ƃ���Ìň��q�ɂ��قȂ邪�C100���Ƃ���C�Ìň��q�̌������x�����20�`30���㏸������̂ɕK�v��FFP�ʂ́C
���_�I�ɂ�8�`12mL/kg�i40mL/kg��20�`30���j�ł���B���������āC�̏d50kg�̊��҂ɂ�����FFP�̓��^�ʂ�400�`600mL�C���Ȃ킿��5�`7�P�ʁiFFP��1�P�ʂ�80mL�j�ɑ������邱�ƂɂȂ�B���҂̑̏d��Ht�l�i�n�����j�C�c�����Ă���Ìň��q�̃��x���C��[���ׂ��Ìň��q�̐��̓��ւ̉�����┼�����i�\4�j�C���邢�͏���Ìŏ�Q�̗L���Ȃǂ��l�����ē��^�ʂⓊ�^�Ԋu�����肷��B
�Ȃ��C�X�̋Ìň��q���R�ǂɂ����鎡�ÓI���^��ό��I���u���̗\�h�I���^�̏ꍇ�C���ꂼ��̋Ìň��q�̈��S�Ȏ��È惌�x�������Ă��ē��^�ʂⓊ�^�Ԋu�����肷��B
�@���^�̑Ó����C�I���������^�ʂ̓I�m�����邢�͕���p�̗\�h��ȂǂɎ����邽�߁CFFP�̓��^�O�ɂ́C���̕K�v���m�ɔc�����C�K�v�Ƃ���铊�^�ʂ��Z�o����B���^��ɂ͓��^�O��̌����f�[�^�ƗՏ������̉��P�̒��x���r���ĕ]�����C����p�̗L�����ώ@���Đf�Ø^�ɋL�ڂ���B
| 1�j |
�z�����ʌ����̉��P�ƕ�[ |
�@�z�����ʂ̌������Ă���a�Ԃɂ́CFFP�Ɣ�r�����P���Z�����������C�����S�Ȑl�H�P���t���邢�͓����A���u�~�����܂̓K���ł���B
�@�A���ɂ���[���ꂽ�����`�����i�听���̓A���u�~���j�̓A�~�m�_�ɂ܂Ŋɏ��ɕ�������C���̑����͔M���Ƃ��ď����Ă��܂��C���҂̒`�������Ƃ͂Ȃ�Ȃ��B���̖ړI�̂��߂ɂ́C���S�Ö��h�{�@��o���h�{�@���K���ł���i�A���u�~���̎g�p�w�j�F6-1�j�u�`�������Ƃ��Ẳh�{�⋋�v�̍����Q�Ɓj�B
�@�n���̎����Ɋ֗^���錌���`�����Ƃ��ẮC�}���������`�����ł���t�B�u���m�Q���C
��XIII���q�C�t�B�u���l�N�`���C�t�H�����B���u�����h���q�Ȃǂ��l�����Ă���B�������Ȃ���CFFP�̓��^�ɂ��C������⋋���Ă��C�n�����������i�����Ƃ�����w�I�����͂Ȃ��B
�@
�������҂ɑ��ẮC���҂̎��R�ӎv�d���C�P�Ȃ鉄���[�u�͍T����Ƃ����l�������e�F�������B�A���Ö@�Ƃ����ǂ��C���̗�O�ł͂Ȃ��C���҂̈ӎv�d���Ȃ��P�Ȃ鎞�ԓI�����̂��߂̓��^�͍T����ׂ��ł���B
�@�d�NJ����ǂ̎��ÁCDIC��Ȃ��M���̎��ÁC�l�H�S�x�g�p���̏o���\�h�C��㏞���̍d�ςł̏o���\�h�Ȃǂ�FFP���^�̓K���Ƃ͂Ȃ�Ȃ��B
�@�g�p���ɂ�30�`37���̍P�������ŋ}���ɗZ�����C���₩�i3���Ԉȓ��j�Ɏg�p����B
�@�Ȃ��C�Z�����ɍP������
���̔�ŋۂ̉��������ڃo�b�O�ɕt�����邱�Ƃ������ƂƂ��ɁC�o�b�O�j���ɂ��ۉ������N�����\��
������̂����l�������C�K��
�����h�~�p���r�j�[���܂ɓ����B�Z����ɂ�ނ��ۑ�����ꍇ�ɂ́C�퉷�ł͂Ȃ�4���ۗ̕�ɓ��ɕۊǂ���B�ۑ�����ƕs����ȋÌň��q�i��V�CVIII���q�j�͋}���Ɏ������邪�C���̑��̋Ìň��q�̊����͔�r�I�����ԕۂ����i�\4�j�B
�@�Ȃ��C�����Z���t4�P�ʁi����80mL���܂ށj���ɂ͕s����ȋÌň��q��������FFP1�P�ʂɑ�������Ìň��q�������܂܂�Ă���B
�@FFP�̓A���u�~���Ȃǂ̌������搻�܂Ƃ͈قȂ�C�E�C���X�̕s�������s���Ă��Ȃ����߁C���t����銴���ǂ̓`�d���N�����댯��������B
| 3�j |
�N�G���_���Łi��J���V�E�����ǁj |
�@��ʓ��^�ɂ��J���V�E���C�I���̒ቺ�ɂ��Ǐ�i��w�̂��т�C�q�C�Ȃǁj��F�߂邱�Ƃ�����B
�@FFP��1�P�ʓ��^���邱�Ƃɂ��C��0.8g�̉����i�g���E���iNaCl�j�����ׂ����B
�@���ɃA�����M�[���邢�̓A�i�t�B���L�V�[�������N�������Ƃ�����B
�@�g�p���ɂ͗A��
�Z�b�g���g�p����B
| �m���n |
�P���Z�����ɂ����o���ɑ���A���Ö@ |
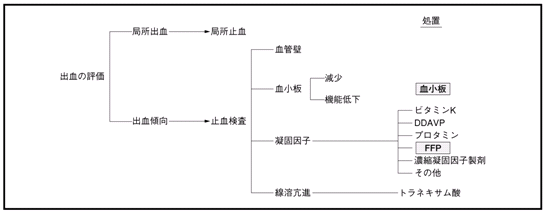
�@���̂̎~���@�\�́C�ȉ���4�̗v�f���琬�藧���Ă���C����炪�����쓮���Ď~������������B�����̂����ꂩ�ُ̈�ɂ��a�I�ȏo�����N����B�A���p���t�ɂ���[�Ö@�̑ΏۂƂȂ�̂͌����ƋÌň��q�ł���B
| a. |
���ǕǁF���k�\ |
| b. |
�����F���������`���i�ꎟ�~���j�C���Ȃ킿�����̔S���E�ÏW�\ |
| c. |
�Ìň��q�F�ÌŌn�̊������C�g�����r���̐����C�����ōŏI�I�ȃt�B�u���������`���i�~���j |
| d. |
���n���q�F�v���X�~���ɂ�錌���̗n���i�@�ۑf�n���j�\ |
�@�V�N���������̎g�p�ɂ͎��ÓI���^�Ɨ\�h�I���^������B������Ìň��q�Ȃǂ̎~�����q�̕s���ɋN�������o���X���ɑ��鎡�ÓI���^�́C��ΓI�K���ł���B����C�o���̊댯���͌������C�o�����ԁCPT�CAPTT�C�t�B�u���m�Q���Ȃǂ̌����l����͕K�������\���ł��Ȃ��B�~�������l���ُ�ł������Ƃ��Ă��C���ꂪ�y�x�ł���C���Ƃ��ό��I���u���s���ꍇ�ł�FFP��\�h�I�ɓ��^������K�v�͂Ȃ��B�ό��I���u���̗\�h�I���^�̖ڈ��͌�������5��/��L�ȉ��CPT
���e��Ë@�ւ���߂Ă����l�̏����1.5�{�ȏ�INR 2.0�ȏ��i4530���ȉ�
����INR 1.6�ȏ��j�CAPTT���e��Ë@�ւ���߂Ă����l�̏����
2�{�ȏ�
�i25���ȉ��j�C�t�B�u���m�Q����100mg/dL�ȉ��ɂȂ����Ƃ��ł���B
�@�o�����Ԃ͌������̂̊��x�Ɠ��ِ����Ⴍ�C�p�O�̎~�������Ƃ��Ă͓K���ł͂Ȃ��C�{�������p�O�ɕK���s���K�v�͂Ȃ��B�ނ���C�o���̊������C���p���Ă����܂Ȃǂɑ��鐳�m�Ȗ�f���s�����Ƃ��K�v�ł���B
�@�o�������Ōy�x�ُ̈킪���銳�ҁi�y�x�̌��������ǁC�̏�Q�ɂ��Ìňُ�Ȃǁj�ŋǏ��I�ȏo�����N�������ꍇ�ɁCFFP���1�I���Ƃ��邱�Ƃ͌��ł���C�\���ȋǏ��I�~�����u���ł��L���ł���B�}2�̃t���[�`���[�g�Ŏ����Ƃ���CFFP�ɂ��~���\�ȏo���ƋǏ��I�ȏ��u�ł����~�������Ȃ��o�������݂��C���̊ӕʂ��ɂ߂ďd�v�ł���B
�@�܂��C�V�N���������̓��^�ɑ����֎��Â���ɍl������B�Ⴆ�C�|�_�f�X���v���V���iDDAVP�j�͌y�ǂ�
���F�aA���t�H���r���u�����h�a
�itypeI�j��
�o�����̎~���Ö@�����O�ȓI���u�̍ۂ̏o���\�h�ɗL���ł���B
| �}3 |
�@�o���ɑ���A���Ö@�Ǝ��Ö@�̃t���[�`���[�g |
 ����
����
| 1�j |
�ĉ�V�@���DMAP���Z���Ԍ����̐����ƒ����ۑ������D���A���37�F404-410�C1991 |
| 2�j |
���쎠�@���D�����ۑ�MAP���Z���Ԍ����̗L�����ɂ���-Survival study-�@���A�������������37�F411-413�C1991 |
| 3�j |
Lundsgaard-Hansen P,et al.
Component therapy of surgical hemorrhage : Red cell concentrates, colloids and crystalloids. Bibl Haematol. 46 : 147-169, 1980
|
| 4�j |
���{�A���w��u�A����GVHD�ψ���v��.
�A���ɂ��GVHD�\�h�̂��߂̌��t�ɑ�����ː��Ǝ˃K�C�h���C��IV�D���{�A���w��VII�C���A���45�i1�j�F47-54�C1999 |
| 5�j |
�����g���DVWF�ؒf�y�f �iADAMTS13�j�̓��ԉ�͂ɂ��TTP/HUS�f�f�@�̐i���D���{���Ȋw��G��93�i3�j�F451-459�C2004
|
| 6�j |
Mori Y et al. Predicting response to plasma exchange in patients with thrombotic thrombocytopenic purpura with measurement of vWF-cleaving protease activity. Transfusion 42�i5�j: 572-580, 2002
|
| 7�j |
AABB. Blood Transfusion Therapy ; A Physician's Handbook (5th ed.), 1996, p.26 |
| 8�j |
���{�����Ȋw�V�����ψ����.
���n�������n���ɑ���A���K�C�h���C���ɂ��āD������99�F1529-1530�C1995 |
|
V |
�@�A���u�~�����܂̓K���g�p |
�@�A���u�~�����܂𓊗^����ړI�́C�����P���Z�������ێ����邱�Ƃɂ��z�����ʂ��m�ۂ��邱�ƁC����ё̍o���t��g�D�ԉt�����Ǔ��Ɉڍs�����邱�Ƃɂ���Ď��Ò�R���̏d�x�̕�������Â��邱�Ƃɂ���B
�@
�Ȃ��C�A���u�~���̐��@�Ɛ���ɂ��Ă͎Q�l����1718���Q�ƁB
�@�}���̒�`�����ǂɊ�Â��a�ԁC�܂����̎��Ö@�ł͊Ǘ�������Ȗ�����`�����ǂɂ��a�Ԃɑ��āC�A���u�~�����[���邱�Ƃɂ��ꎞ�I�ȕa�Ԃ̉��P��}�邽�߂Ɏg�p����B�܂��P���Z�����̉��P�C�z�����ʂ̐�������ȓK���ł���C�ʏ�O�҂ɂ͍����A���u�~�����܁C��҂ɂ͓����A���u�~�����܂��邢�͉��M�l����
�`�������iPPF�j��p����B
�Ȃ��C�{�g�p�w�j�ɂ����ē��ɋK�肵�Ȃ��ꍇ�́C�����A���u�~�����܂ɂ͉��M�l���������܂ނ��ƂƂ���B
�@�o�����V���b�N�Ɋׂ����ꍇ�ɂ́C�z���t�ʂ�30���ȏオ�r�������ƍl������B�������ÂƂ��ẮC�זE�O�t
��[�t�i���_�����Q���t�C�|�_�����Q���t�Ȃǁj�̓��^�����I���ƂȂ�B�܂��l�H�P���t�̕��p�����������B�z���t�ʂ�50���ȏ�̑��ʂ̏o�����^����ꍇ�⌌���A���u�~���Z�x��3.0g/dL�����̏ꍇ�ɂ́C�����A���u�~�����܂̕��p���l������B�z�����ʂ̕�[�ʂ́C�o�C�^���T�C���C�A�ʁC���S�Ö�����
�x��
���������C�����A���u�~���Z�x�C����ɉ\�ł�����P���Z�������Q�l�ɂ��Ĕ��f����B�����C�t�@�\��Q�ȂǂŐl�H�P���t�̎g�p���s�K�ƍl������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B�܂��C�l�H�P���t��1,000mL�ȏ�K�v�Ƃ���ꍇ�ɂ��C�����A���u�~�����܂̎g�p���l������B
�@�Ȃ��C�o���ɂ��s���������̑��̌��t�����̕�[�ɂ��ẮC�e�������܂̎g�p�w�j�ɂ��Ώ�����i���Ɂu�p���̗A���v�̍����Q�ƁG�}1�j�B
| 2�j |
�l�H�S�x���g�p����S����p |
�@�ʏ�C�S����p���̐l�H�S�x�̏[�U�ɂ́C
��Ƃ����זE�O�t�n�A�t�g�p�����B
�Ȃ��C�l�H�S�x���{���̌��t��߂ŋN��������A���u�~�����ǂ́C�����A���u�~���̑r���ɂ����̂ł͂Ȃ��ꎞ�I�Ȃ��̂ł���C���A�ɂ��p�㐔���Ԃʼn��邽�߁C�A���u�~�����܂𓊗^���ĕ����K�v�͂Ȃ��B�������C�p�O��茌���A���u�~���Z�x�܂����P���Z�����̍��x�Ȓቺ�̂���ꍇ�C���邢�͑̏d10kg�����̏����̏ꍇ�Ȃǂɂ͓����A���u�~�����܂��p�����邱�Ƃ�����B
�@
�Ȃ��C�l�H�S�x���{���̌��t��߂ŋN��������A���u�~�����ǂ́C�����A���u�~���̑r���ɂ����̂ł͂����ꎞ�I�Ȃ��̂ł����C���A�ɂ��p�㐔���Ԃʼn��邽�߁C�A���u�~�����܂𓊗^���ĕ����K�v�͂Ȃ��B
| 3�j |
�̍d�ςɔ�����������ɑ��鎡�� |
�@�̍d�ςȂǂ̖����̕a�Ԃɂ���A���u�~�����ǂ́C���ꎩ�̂ł̓A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ��B�̍d�ςł̓A���u�~���̐������ቺ���Ă�����̂́C���̓��������͑㏞�I�ɉ������Ă���B���Ƃ��A���u�~���𓊗^���Ă��C�������ăA���u�~���̍������}������C���������i�����B��ʁi4L�ȏ�j�̕������h���ɏz�����ʂ��ێ����邽�߁C�����A���u�~�����܂̓��^���C�l�������
���B�܂��C���Ò�R���̕����̎��ÂɁC�Z���I�i1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂p���邱�Ƃ�����B
| �@�� |
Runyon BA. Management of Adult Patients with Ascites due to Cirrhosis.
Hepatology 2004;39:841-856 |
| 4�j |
����̕���C�x������l�t���[�[�nj�Q |
�@�l�t���[�[�nj�Q�Ȃǂ̖����̕a�Ԃ́C�ʏ�A���u�~�����܂̓K���Ƃ͂Ȃ�Ȃ��B�ނ���C�A���u�~���𓊗^���邱�Ƃɂ���ăX�e���C�h�Ȃǂ̎��Âɒ�R���ƂȂ邱�Ƃ��m���Ă���B�������C�}�����d�ǂ̖���������邢�͔x����ɑ��ẮC���A��ɉ����ĒZ���I�i1�T�Ԃ����x�Ƃ���j�ɍ����A���u�~�����܂̓��^��K�v�Ƃ���ꍇ������B
| 5�j |
�z���Ԃ��s����Ȍ��t���͓��̑̊O�z�{�s�� |
�@���t����
���Ɍ����̈��肪����
�ꍇ�������āC���ɓ��A�a���������Ă���ꍇ��p��ȂǂŒ�A���u�~�����ǂ̂���ꍇ�ɂ́C���͂ɍۂ��ጌ����V���b�N���N�������Ƃ����邽�߁C�z�����ʂ�������ړI�ŗ\�h�I���^���s�����Ƃ�����B
�@
�z���Ԃ̕s����Ȍ��t���͓��ɂ����āC�ꎞ�I�ɏz�����ʂ�������ړI�ŁC�̊O�z�J�n�ɍۂ��ė\�h�I���^���s�����Ƃ�����B�������ʏ�́C�K�ȑ̊O�z�̕��@�̑I���ƁC���̖Ö@�őΏ����邱�Ƃ���{�Ƃ���B
| 6�j |
�Ìň��q�̕�[��K�v�Ƃ��Ȃ����ÓI���������Ö@ |
�@
���ÓI���������Ö@
�ɂ́C���ݗl�X�̕��@������B�L�Q���������肳��Ă��āC�I��I�Ⴕ���͏��I��I�L�Q���������̕��@���m������Ă���ꍇ�ɂ́C���̕��@��D�悷��B����ȊO�̔�I��I�L�Q����������C�L�p������[�̕��@�Ƃ��āC���������Ö@������B
�@�M�����o���[�nj�Q�C�}���d�Njؖ��͏ǂȂNjÌň��q�̕�[��K�v�Ƃ��Ȃ��Ǘ�ł́C�u���t�Ƃ��ē����A���u�~�����܂��g�p����B�A���u�~�����܂̎g�p�́C�̉����ǂȂǂ̗A������p�̊댯���قƂ�ǂȂ��C�V�N�����������g�p���邱�ƂƔ�r���Ă����S�ł���B
�@
�P���Z������ۂ��߂ɂ́C�ʏ�́C�����A���u�~���������͍����A���u�~����d�����t�Ɋ�߂��Ēu���t�Ƃ��ėp����B�����A���u�~���Z�x���Ⴂ�ꍇ�ɂ́C�����A���u�~���ɂ��u���́C�x�������\�����L��̂ŁC�u���t�̃A���u�~���Z�x�߂��铙�̒��ӂ��K�v�ł���BPPF���M�l���������́C�܂�Ɍ����ቺ���������̂ŁC�����Ƃ��Ďg�p���Ȃ��B��ނ��g�p����ꍇ�́C���Ɍ����̕ϓ��ɗ��ӂ���B1��̌����ʂ́C�z�����ʂ̓��ʂȂ���1.5�{�ʂ���Ƃ���B�J�n���́C�u���t�Ƃ��Đl�H�P���t���g�p���邱�Ƃ��\�ȏꍇ�������i���������̒u���t�Ƃ���FFP���p������ꍇ�ɂ��ẮCFFP�̍��Q�ƁB�܂��C���ÓI���������Ö@�Ɋ֘A���闯�ӎ����ɂ��ẮC�Q�l1614���Q�Ɓj�B
�@�M����C�ʏ�
18���Ԉȓ��͌����Ƃ��čזE�O�t
��[�t�őΉ����邪�C18���Ԉȓ��ł����Ă�
�����A���u�~���Z�x��1.5g/dL�����̎��͓K�����l������B
�@�M�����ʂ��̕\�ʐς�50���ȏ゠��C�זE�O�t
��[�t�ł͏z�����ʂ̕s�������邱�Ƃ�����ȏꍇ�ɂ́C�l�H�P���t���邢�͓����A���u�~�����܂őΏ�����B
| 8�j |
��`�����ǂɋN������x����邢�͒����ȕ���F�߂���ꍇ |
�@�p�O�C�p�゠�邢�͌o���ێ�s�\�ȏd�ǂ̉����Ȃǂɂ���`�����ǂ����݂��C���Ò�R���̔x����邢�͒����ȕ���F�߂���ꍇ�ɂ́C���A��ƂƂ��ɍ����A���u�~�����܂̓��^���l������B
| 9�j |
�z�����ʂ̒����Ȍ������}���X���Ȃ� |
�@�}���X���C���ǂȂǂŏz�����ʂ̒����Ȍ������V���b�N���N�������ꍇ�ɂ́C�����A���u�~�����܂��g�p����B
�@���^�ʂ̎Z��ɂ͉��L�̌v�Z����p����B���̂悤�ɂ��ē���ꂽ�A���u�~���ʂ����҂̕a��ɉ����āC�ʏ�2�`3���ŕ������^����B
�@�K�v���^��
�ig�j=
�@�@���ҏ㏸�Z�x�ig/dL�j�~�z�����ʁidL�j�~2.5
�@�������C���ҏ㏸�Z�x�͊��Ғl�Ǝ����l�̍��C�z�����ʂ�0.4dL/kg�C���^�A���u�~���̌��Ǔ��������4/10�i40���j�Ƃ���B
�@���Ƃ��C�̏d��kg�̊��҂̌����A���u�~���Z�x��0.6g/dL�㏸���������Ƃ��ɂ́C
0.6g/dL�~�i0.4dL/kg
�~��kg�j�~2.5=0.6�~�ԁ~1=0.6��g�𓊗^����B
�@���Ȃ킿�C�K�v���^�ʂ͊��ҏ㏸�Z�x�ig/dL�j�~�̏d�ikg�j�ɂ��Z�o�����B
�@����C�A���u�~��1g�̓��^�ɂ�錌���A���u�~���Z�x�̏㏸�́C�̏d��kg�̏ꍇ�ɂ́C
�m�A���u�~��1g�~���Ǔ�������i4/10�j�n�ig�j/�m�z�����ʁn�idL�j���Ȃ킿�C
�u1g�~0.4/�i0.4dL/kg�~��kg�j=1/�ԁig/dL�j�v�C
�܂�̏d�̋t���ŕ\�킳���B
�@�A���u�~�����܂̓��^�O�ɂ́C���̕K�v���m�ɔc�����C�K�v�Ƃ���铊�^�ʂ��Z�o����B���^��ɂ͓��^�O��̌����A���u�~���Z�x�ƗՏ������̉��P�̒��x���r���Č��ʂ̔�����s���C�f�Ø^�ɋL�ڂ���B���^��̖ڕW�����A���u�~���Z�x�Ƃ��Ă͋}���̏ꍇ��3.0g/dL�ȏ�C�����̏ꍇ��2.5g/dL�ȏ�Ƃ���B
�@���^���ʂ̕]����3���Ԃ�ړr�ɍs���C�g�p�̌p���f���C���R�Ɠ��^�������邱�Ƃ̂Ȃ��悤�ɒ��ӂ���B
�@�Ȃ��C�P���Z�����̌v�Z���ɂ��Ă͖{�������ɋL�ڂ��Ă���B
�@���^���ꂽ�A���u�~���͑̓��Ŋɏ��ɑ�Ӂi�������͖�17���j����C���̂قƂ�ǂ͔M���Ƃ��ď����Ă��܂��B�A���u�~�����A�~�m�_�ɕ�������C�̑��ɂ�����`�����̍Đ����̌����ƂȂ�̂͂킸���ŁC���p�����ɂ߂ĒႢ���Ƃ�C�K�{�A�~�m�_�ł���g���v�g�t�@���C�C�\���C�V���y�у��`�I�j�����ɂ߂ď��Ȃ����ƂȂǂ���C�h�{�⋋�̈Ӌ`�͂قƂ�ǂȂ��B��p��̒�`�����ǂ∫����ᇂɎg�p���Ă��C�ꎞ�I�Ɍ����`���Z�x���㏸�������P���Z�������ʂ������ȊO�ɁC�h�{�w�I�ȈӋ`�͂قƂ�ǂȂ��B�h�{�⋋�̖ړI�ɂ́C���S�Ö��h�{�C�����Ö��h�{�ɂ��A�~�m�_�̓��^�ƃG�l���M�[�̕⋋���h�{�w�I�ɒ`�����̐����ɗL���ł��邱�Ƃ�����ƂȂ��Ă���B
�@�]�������삠�邢�̓N�������o����̌��ǝ��k�ɑ���C�l�H�P���t���邢�̓A���u�~�����܂̓��^�ɂ��C�]�g�D�̏�Q���h�~�����Ƃ���
��w�I�����͂Ȃ��C�g�p�̑ΏۂƂ͂Ȃ�Ȃ��B
| 3�j |
�P�Ȃ錌���A���u�~���Z�x�̈ێ� |
�@�����A���u�~���Z�x��2.5g/dL�`3g/dL�ł́C�����̕���Ȃǂ̗Տ��Ǐ��悳�Ȃ��ꍇ�������C�����A���u�~���Z�x�̈ێ��⌟���l�̐����݂̂�ړI�Ƃ������^�͍s���ׂ��ł͂Ȃ��B
| 4�j |
�������҂ւ̃A���u�~�����^ |
�@�������҂ɑ���A���u�~�����^�ɂ�鉄�����ʂ͖��炩�ɂ���Ă��Ȃ��B
�@���������̊ϓ_������s�K�v�ȓ��^�͍T����ׂ��ł���B
�@�e���ܒ��̃i�g���E���ܗL�ʁm3.7mg/mL�i160mEq/L�j�m�n�ȉ��͓����ł��邪�C�����A���u�~�����܂̑�ʎg�p�̓i�g���E���̉ߑ�ȕ��ׂ��������Ƃ�����̂Œ��ӂ��K�v�ł���B
�@�����A���u�~�����܂̎g�p���ɂ͋}���ɏz�����ʂ���������̂ŁC�A�����x�߂��C�x����C�S�s�S�Ȃǂ̔����ɒ��ӂ���B�Ȃ��C20���A���u�~������50mL�i�A���u�~��10g�j�̗A���͖�200mL�̏z�����ʂ̑����ɑ�������B
�@���M�l����
�`�������iPPF�j�̋}���A���i10mL/���ȏ�j�ɂ��C�����̋}���Ȓቺ���������Ƃ�����̂Œ��ӂ���B
�@���A��ړI�Ƃ���Ƃ��ɂ́C���A��p����B
�@�����̕a�Ԃɑ���g�p�ł́C�A���u�~���̍����\�̒ቺ���������Ƃ�����B���Ɍ����A���u�~���Z�x��4g/dL�ȏ�ł͍����\���}�������B
�@�P���Z�����i
���j��pH�C���x�C�\������`�����̎�ނɂ��e������邽�߁C�����l�̕����M���ł��邪�C�������̒`���Z�x���Z�肷����@������B�����A���u�~���iAlb�j�Z�x�C�������`���iTP�j�Z�x����̎Z�o�ɂ͉��L�̌v�Z����p����B
| 1�D |
�����A���u�~���l�iCg/dL�j���̌v�Z���F
�@��=2.8C+0.18C2+0.012C3 |
| 2�D |
�������`���Z�x�iCg/dL�j���̌v�Z���F
�@��=2.1C+0.16C2+0.009C3 |
�v�Z��F
| 1�D |
�A���u�~�����^�ɂ��Alb�l��0.5g/dL�㏸�����ꍇ���P���Z�����̏㏸�i1�����j�C
�@��=2.8�~0.5+0.18�~0.52+0.012�~0.53
�@�@=1.45mmHg |
| 2�D |
TP�l��7.2g/dL�̏ꍇ���P���Z�����i2�����j�C
�@��=2.1�~7.2+0.16�~7.22+0.009�~7.23
�@�@=26.77mmHg |
|
VI |
�@�V�����E�����ɑ���A���Ö@ |
�@����
�Ƃ��ɐV�����Ɍ��t���܂𓊗^����ۂɁC���l�̌��t���܂̎g�p�w�j��K�p���邱�Ƃɂ͖�肪����C�����ɓ��L�Ȑ����@�\���l�������w�j�����肷��K�v������
�B�������Ȃ���C������ʂɑ��錌�t���܂̓��^��ɂ��ẮC���܂��\���ȃR���Z���T�X�������Ă���Ƃ͌�����ɂ��邱�Ƃ���C���n���ɂ��Ă̑����n���ւ̐Ԍ����Z���t�̓��^���@�C�V�����ւ̌����Z���t�̓��^���@�y�ѐV�����ւ̐V�N���������̓��^���@�Ɍ��肵�Ďw�j�����肷�邱�ƂƂ����B
| 1�D |
���n�������n���ɑ���Ԍ����Z���t�̓K���g�p |
�@���n�������n���̎傽�錴���́C���������@�\�̖��n���ɂ���C����1�`2�������ɔF�߂���V�����̕n���������I�͈͂������̂Ƃ�������B�o�����̑̏d�����Ȃ��قǑ����C������������B�S�܂ɂ͔������Ȃ��B�G���X���|�G�`���̓��^�ɂ����P�ł���Ǘ�
������B�������Ȃ���C�o���̏d�����������Ȃ��ꍇ�C���x�̕n���𗈂��ĐԌ����A�����K�v�ƂȂ�
���Ƃ������B
�@�Ȃ��C�����ł̗A���̑Ώێ��́C�o����28���ȍ~4�����܂łł���C�Ԍ����Z���t�̗A���͈ȉ��̎w�j�ɏ������邪�C���n���͑��l�ȕa�Ԃ��������ߌX�̏Ǘ�ɉ������z�����K�v�ł���B
| �@�i1�j |
�ċz��Q���F�߂��Ȃ����n�� |
| �@�D |
Hb�l��8g/dL�����̏ꍇ
�ʏ�C�A���̓K���ƂȂ邪�C�Տ��Ǐ�ɂ���Ă͕K�������A���̕K�v�͂Ȃ��B |
| �A�D |
Hb�l��8�`10g/dL�̏ꍇ
�n���ɂ��ƍl�����鎟�̗Տ��ǏF�߂���ꍇ�ɂ́C�A���̓K���ƂȂ�B
�������̕p���C�������̑��ċz�C���ċz�E�������ċz�C�s�����C�M�����̈Ք�J�C�̏d�����s�ǁC���̑� |
| �@�i2�j |
�ċz��Q���������Ă��関�n�� |
�@��Q�̒��x�ɉ����ĕʓr�l������B
�@�̌���2�T�Ԉȓ���MAP���Ԍ����Z���t�iMAP��RCC�j���g�p����B
| �@�D |
���������S�s�S���F�߂��Ȃ����n�� |
�@1��̗A���ʂ�10�`20mL/kg�Ƃ��C1�`2mL/kg/���Ԃ̑��x�ŗA������B�������C�A�����x�ɂ��Ă͂���ȊO�̑��x�i2mL/kg/���Ԉȏ�j�ł̌����͏\���ɍs���Ă��Ȃ��B
| �A�D |
���������S�s�S���F�߂��関�n�� |
�@�S�s�S�̒��x�ɉ����ĕʓr�l������B
| �@�D |
�����������t�B���^�[�̎g�p�� |
�@���t�o�b�O����������������C�����A���ŋz������Ɨn���̌����ɂȂ�B���������āC���t�����R�ɗ��������邩�C�z�����č̎悷��ꍇ�ɂ͊ɘa�ȉA���ɂ��s���B
�@�V�����ɑ���̌���2�T�Ԗ�����MAP���Ԍ����Z���t�̈��S���͊m������Ă��邪�C2�T�Ԉȍ~��MAP���Ԍ����Z���t����ː��Ǝˌ�ɔ����������t�B���^�[��ʂ��Ă���24G���ׂ����ːj��p���ėA���|���v�ʼn������ėA������ƁC�n�����N�����댯��
������̂ŁC�A�����x��x�����C�n���̏o���ɏ\���Ȓ��ӂ��K�v�������B
�@
���t�o�b�O�J�����6���Ԉȓ��ɗA������������B�c�]���͔j������B1��ʂ̌��t��A������̂�6���Ԉȏ��v����ꍇ�ɂ́C�g�p���t�ۓI�ɕ������ėA�����C���g�p�̕������͎g�p���܂�4���ɕۑ�����B
| �@�i3�j |
�����ғ�������@���̌� |
�@
�@���̌�����������Ȃ�����w�I�ɓK��������C�u�A���Ö@�̎��{�Ɋւ���w�j�v��XII�̂Q�́u�K�v�ƂȂ�ꍇ�v�Ɍ���s���ׂ��ł��邪�C����g�p���{����ꍇ�́C�̌���i���S�Ȍ��t���܂̊m�ۓ��Ɋւ���@���{�s�K���j�ɏ]�����ƂƂ��C�Ƃ�킯�A����ڐA�БΏh��a�ɗ��ӂ���K�v������C���ː��Ǝ˂�15�`50Gy�͈̔͂Ƃ���B�Ȃ��܂��C���̏ꍇ���������̕���p���N����ꍇ�����邱�Ƃ������ӂ���K�v������B
| 2�D |
�V�����ւ̌����Z���t�̓K���g�p |
| �@�i1�j |
���ǐ��̎����݂̂Ȃ����́C�o���Ǐ݂�ꂸ�C�S�g��Ԃ��ǍD�ȏꍇ�́C��������2��/��l�ȏ�Ɉێ���3��/��l�����̂Ƃ��Ɍ����Z���t�̓��^���l������B |
| �@�i2�j |
�L�ĂȎ����Ȃ����͎����ȊO�ɂ����炩�ȏo���i�@�o���C���o���o���C�����Ǐo���C���W���o���Ȃǁj��F�߂�ꍇ�ɂ́C������5��/��l�ȏ�Ɉێ�����B |
| �@�i3�j |
�̑��̖��n���Ȃǂɂ��Ìň��q�̒������ቺ���ꍇ�ɂ́C��������5��/��l�ȏ�Ɉێ�����B |
| �@�i4�j |
�N�P�I���u���s���ꍇ�ɂ́C��������5��/��l�ȏ�Ɉێ�����B |
| 3�D |
�V�����ւ̐V�N���������̓K���g�p |
�@
�r�^�~��K�̓��^�ɂ�������炸�CPT����с^���邢��APTT�̒����ȉ���������C�o���Ǐ��F�߂邩�N�P�I���u���s���ꍇ
| �@�i2�j |
�z���t�ʂ�1/2����Ԍ����Z���t�A���� |
| �@�i3�j |
Upshaw-Schulman�nj�Q�i��V�����𐫌��������������a�j |
�@
�i1�j�Ɓi2�j�ɑ��ẮC10�`20mL/kg�ȏ��K�v�ɉ�����12�`24���Ԗ��ɌJ��Ԃ����^����B
�@
�i3�j�Ɋւ��Ă�10mL/kg�ȏ��2�`3�T�Ԗ��ɌJ��Ԃ����^����B
�@
�V���������ǂɑ��镔�������A���ɂ́C�]���C�V�N�����������g�p����Ă������C�قƂ�ǂ̏ꍇ�͐����H�����ő�։\�ł���B
������
�@����̎g�p�w�j�̌�������5�`10�N�Ԃ�ł��邪�C���̊Ԃɂ�����A����w���܂ވ�w�̊e�̈�ɂ�����i�����W�͖ڊo�����C�܂��C�u���S�Ȍ��t�̈���m�ۓ��Ɋւ���@���v�̐���Ɓu�@�v�̉������s���C���t���ƂƗA���Ö@�݂̍�����@�I�Ɉʒu�Â���ꂽ���Ƃ܂��Ẳ����ł���B�g�p�w�j�ł͍ŐV�̒m���Ɋ�Â����������s�����ق��C�v����쐬���C�`���Ɏ����ƂƂ��ɁC�a�ԕʂɓK�����������C�����Ɏ������B����ɁC�V�����ւ̗A���̍���݂��邱�Ƃɂ����B
�@�{�w�j���ł��邾�����}�ɁC���L�͂ɐZ������悤�C�W�Ҋe�ʂ̌䋦�͂����肢�������B����́C���ɐV���Ȏ��ؓI�Ȓm��������ꂽ�ꍇ�ɂ́C�{�w�j�𑬂₩�ɉ������Ă����\��ł���B
| �Q�l1 |
�@�����n���i�������זE�ڐA�j |
�Ԍ����A��
��{�I�ȓK���
�@
�������זE�ڐA��̑����͑O���u�̋��x�ɂ���ĈقȂ�B�����@�\�����x�ɒቺ������O���u��p����ꍇ�́C�ʏ�C����������܂łɈڐA��2�`3�T�Ԃ�v����B���̊ԁC�w���O���r���iHb�j�̒ቺ��F�߂邽�߂ɐԌ����A�����K�v�ɂȂ�B���̏ꍇ�C�ʏ�̖����n���Ɠ��l��Hb�l�̖ڈ��Ƃ���7g/dL���ێ�����悤�ɁC�Ԍ����Z���t�iRCC�j��A������B���M�C���������S�s�S�C���邢�͑�ӂ̘��i���Ȃ��ꍇ�͈��Âɂ��Ă���C������ႢHb�l�ɂ��ς�����̂ŁC�Տ��Ǐ�⍇���ǂ��l����RC�̓K�������肷��B
�����������Ԍ����Z���t
�@
�A���p���t���̓��픒�����ɂ��C���M�����C����R�̎Y���C�T�C�g���K���E�C���X�icytomegalovirus;CMV�j�����Ȃǂ̗L�Q���ۂ�������̂ŁC�����̗\�h�̂��߂Ɍ����I�ɔ����������Ԍ�����p����B���Ɋ��҂��RCMV�R�̉A���̏ꍇ�ł��C�����������A���ɂ��RCMV�R�̉A���̌����҂���̗A���Ƃقړ����ɗA���ɂ��CMV������\�h�ł���B
�����A��
��{�I�ȓK���
�o���\�h
�@
�����@�\�����x�ɒቺ������O���u��p�����������זE�ڐA��́C���Ҍ���������������̂ŁC�o���\�h�̂��߂Ɍ����Z���t�iplatelet concentrate;PC�j�̗A�����K�v�ɂȂ�BPC�̓K���͌������ƗՏ��Ǐ���Q�l�ɂ���B�ʏ�C�o���\�h�̂��߂ɂ͌�������1�`2��/��L�ȉ��̏ꍇ��PC�̓K���ɂȂ�B�������C�����ǁC���M�C�d�퐫���Ǔ��ÌłȂǂ̍����ǂ�����ꍇ�͏o���X������������̂Œ��ӂ���B�������𑪒肵�C���̌��ʂœ�����PC�̓K�������肵�A�����邱�Ƃ��]�܂��B�������C�A���̍̌��ɂ�銳�҂ւ̕��S���l�����C�܂��C��^�I�ȑ������זE�ڐA�ł͌���������������Ԃ�\���ł���̂ŁC�T�P�ʂł�PC�A�����v��ł���ꍇ�������B���̏ꍇ�́C1�T�Ԃ�2�`3��̕p�x��1��̗A���ʂƂ��Ă�10�P�ʂ����������B
�o������
�@
�o���Ǐ畆�̓_��o���⎕���o���ȂǁC�y�x�̏ꍇ�́C�o���\�h�ɏ�����PC��A������B�����Ǐo���C�x�o���C���W���o���C�o�����N�����Ȃǂɂ��d�Ăȏo���Ǐ���ꍇ�͌�������5��/��L�ȉ��̏ꍇ��PC�̓K���ɂȂ�B
HLA�K�������Z���t�̓K��
�@
�RHLA�R�̂ɂ�錌���s����Ԃ�����ꍇ�́C��ʓI��HLA�K�������̓K���ɏ�����B
���������������Z���t�̓K��
�@
�����I�ɐԌ����A���Ɠ��l�ɔ���������PC��p����B�������C���{�ԏ\���Ђ��狟�������PC��p����ꍇ�͔���������1�o�b�O������1�~106�ȉ��ł���悤�ɒ�������Ă���̂ŁC�g�p���ɂ͔����������t�B���^�[��p����K�v�͂Ȃ��B
�V�N��������
�@
�ʏ�̐V�N���������̓K���Ɠ��l�ł���B�����I�Ȍ��t�Ìň��q�̒ቺ�C�y�ь��𐫌��������������a�����������ꍇ�ɓK���ɂȂ�B
�A���u�~��
�@
�ʏ�̃A���u�~�����܂̓K���Ɠ��l�ł���B
�Ɖu�O���u����
�@
�ʏ�̖Ɖu�O���u�����̓K���Ɠ��l�C�R��������R�E�C���X�܂̎��Â��s���Ă����ʂ��R���������ǂɑ��K���ɂȂ�C�R�������ƕ��p���p����B
�A���p���t���܂̌��t�^�̑I��
�@
���푢�����זE�ڐA�ɂ����āC���Ҍ��t�^�Ƒ������זE�ҁi�h�i�[�j�̌��t�^�������ꍇ�ƈقȂ�ꍇ������B�����1�D���t�^��v�imatch�j�C2�D��s�K���imajor
mismatch�j�C3�D���s�K���iminor mismatch�j�C4�D�啛�s�K���imajor and minor mismatch�j�C�ɕ��ނ����B1�͊��Ҍ��t�^�ƃh�i�[�̌��t�^������ł���ꍇ�C2�͊��҂Ƀh�i�[�̌��t�^�R���ɑ���R�̂�����ꍇ�C3�̓h�i�[�Ɋ��҂̌��t�^�R���ɑ���R�̂�����ꍇ�C4�͊��҂Ƀh�i�[�̌��t�^�R���ɑ���R�̂�����C���h�i�[�Ɋ��҂̌��t�^�R���ɑ���R�̂�����ꍇ�ł���B
�@
�ڐA��C���҂̌��t�^�͑����̉ɔ����h�i�[���t�^�ɕω����Ă����̂ŁC����ABO���t�^�Ŋ��҂ƃh�i�[�ňقȂ�ꍇ�ɂ́C�A���p���t���܂̓K�Ȍ��t�^��I������K�v������B�ȉ��Ɍ��t�^�I���̂��߂̊�������B
�@
�Ԍ����C�����C�����Ƃ��Ɍ����I�Ɋ��Ҍ��t�^�Ɠ��^�̌��t�^��I������B
| 2�D |
��s�K���imajor mismatch�j |
�@
���҂̍R�̂ɂ���ăh�i�[�R���̐Ԍ����������x������댯��������̂ŁC�����\�h���邽�߂Ɍ����C�����̓h�i�[���t�^�R���ɑ���R�̂��Ȃ����t�^��I������B�Ԍ����͊��҂̍R�̂ɔ������Ȃ����t�^��I������B
| 3�D |
���s�K���iminor mismatch�j |
�@
�h�i�[�����p�����ڐA��C���Ҍ��t�^�ɑ���R�̂��Y�����C���ҐԌ����Ɣ�������\��������̂ŁC�Ԍ����̓h�i�[�̍R�̂Ɣ������Ȃ����t�^��I������B�����ƌ����͊��ҐԌ����Ɣ�������R�̂��Ȃ����t�^��I������B
| 4�D |
�啛�s�K���imajor and minor mismatch�j |
�@
�����C�����̓h�i�[�̐Ԍ����ɑ���R�̂��Ȃ����t�^��I�����C�Ԍ����̓h�i�[�̍R�̂Ɣ������Ȃ����t�^��I������B���������āCABO���t�^�啛�s�K���̏ꍇ�́C�����C������AB�^�C�Ԍ�����O�^�ɂȂ�B����ɁC�ڐA��h�i�[�̌��t�^�ɑ���R�̂����o�ł��Ȃ��Ȃ�h�i�[�̌��t�^�̐Ԍ����Z���t���C���҂̌��t�^�̐Ԍ��������o�ł��Ȃ��Ȃ���h�i�[�����t�^�̌����Z���t�C�V�N����������A������B
�@
Rho�iD�j�R�������҂ƃh�i�[�ňقȂ�ꍇ�ɂ́C�RRho�iD�j�R�̗̂L���ɂ���ĈقȂ邪�C���҂�Rho�iD�j�R���A���̏ꍇ�ɂ͍RRho�iD�j�R�̂�������̂Ƃ��āC���邢�͎Y�������\����������̂Ƃ��čl������B�܂��C�h�i�[��Rho�iD�j�R���A���̏ꍇ�ɂ��RRho�iD�j�R�̂�������̂Ƃ��čl������B
�@
���҂ƃh�i�[��ABO���t�^���邢��Rho�iD�j�R�����قȂ�ꍇ�̐��������A���Ö@��\�ɂ܂Ƃ߂Ď����B
�@
�ڐA��C�������h�i�[�^�ɕω�������ɁC�Ĕ�����s�S�ȂǂŗA�����K�v�ɂȂ�ꍇ�́C�h�i�[�^�̗A���Ö@���s���B
�@
�ڐA�O�ォ�瑢���܂ł̗A���ɂ����鐻�ܕʂ̑I�����ׂ����t�^�������B
| �\ |
�@���t�^�s�K���������זE�ڐA����̗A���Ö@ |
| ���t�^ |
�s�K�� |
���t�^ |
�A�� |
| �h�i�[ |
���� |
�Ԍ��� |
�����C���� |
| ABO���t�^ |
��s�K�� |
A |
O |
O |
A�i�����Ȃ����AB���j |
| B |
O |
O |
B�i�����Ȃ����AB���j |
| AB |
O |
O |
AB |
| AB |
A |
A�i�����Ȃ����O���j |
AB |
| AB |
B |
B�i�����Ȃ����O���j |
AB |
| ���s�K�� |
O |
A |
O |
A�i�����Ȃ����AB���j |
| O |
B |
O |
B�i�����Ȃ����AB���j |
| O |
AB |
O |
AB |
| A |
AB |
A�i�����Ȃ����O���j |
AB |
| B |
AB |
B�i�����Ȃ����O���j |
AB |
| �啛�s�K�� |
A |
B |
O |
AB |
| B |
A |
O |
AB |
| Rho�iD�j�R�� |
��s�K�� |
D�{ |
D�| |
D�| |
D�{ |
| ���s�K�� |
D�| |
D�{ |
D�| |
D�{ |
�ڐA�O�ォ�瑢���܂ł̗A���ɂ����鐻�ܕʂ̑I�����t�^�������B
�@
�p�O�̕n���C�p���y�яp��o���ʂ⊳�҂̕a�Ԃɉ����āCSBOE�Ȃǂɏ]���p�O�A���������s���B�p�O���Ȍ��������\�Ȋ��҂ł́C�p�O�������s�����Ƃ����������B�������C���Ȍ��̉ߏ�Ȓ����͊��҂݂̂Ȃ炸�C�A�����̕��S�ƂȂ�C���Ȍ��̔p���ɂ��Ȃ���B�\�z�o���ʂɉ������������s���K�v������B
�@
�d�ĂȐS�x�����⒆���_�o�n�������Ȃ����҂ɂ����āC�A�����J�n����Hb�l�i�A���g���K�[�l�j��Hb7�`8g/dL�Ƃ���B�z���t�ʂ�20���ȓ��̏o���ʂł���Hb�l���g���K�[�l�ȏ�ɕۂ���Ă���ꍇ�ɂ́C���_�����Q���t��|�_�����Q���t�C�����H���t�Ȃǂ̍זE�O�t�n�A�t�܂ɂ��z���t�ʂ�ۂ悤�ɂ���B�זE�O�t�n�A�t�܂͏o���ʂ�3�`4�{�������C�S�����Ȃǂ̃o�C�^���T�C����C�A�ʁC���S�Ö����Ȃǂ��Q�l�ɓ��^����B�o���ʂ��z���t�ʂ�10�����邢��500mL����悤�ȏꍇ�ɂ́C�q�h���L�V�G�`���f���v���Ȃǂ̌�����p�܂𓊗^���Ă��悢�B�������C�q�h���L�V�G�`���f���v���͑�ʓ��^�ɂ�茌���ÏW�}�����N�����\��������̂ŁC���^�ʂ�20mL/kg���邢��1000mL�ȓ��ɗ��߂�B�z���t�ʂ�50���ȏ�����ʂ��o��������C�^����ꍇ�������A���u�~���Z�x��2.53.0g/dL�����̏ꍇ�ɂ́C5�������A���u�~���n�t���������^���p���l������B
�@
�Ԍ����A�����s���O�ɍ̌����s���CHb�l��Ht�l�Ȃǂ𑪒肷��ƂƂ��ɁC�A����͂��̌��ʂ��m�F���邽�߂ɍĂэ̌����s��Hb�l��Ht�l�̏㏸���m�F����K�v�������B
�A���ʂɂ�����{�݊ԍ�
�@
�S�����ǎ�p�ɂ�����A���g�p�ʂ͎{�݊ԍ����傫���B����͊O�Ȏ�Z�̍��ɂ����̂̂ق��C�A���ɑ���l�����̍��ɂ��Ƃ��낪�傫��1�B����́C���Ȃ��A���ʂł��C���҂̗\��ɉe�����邱�ƂȂ��S���O�Ȏ�p���s���Ă���{�݂����邱�Ƃ��玦�������B�l�H�S�x��p���Ȃ�off-pump�������o�C�p�X�p�ɂ����ẮC��ʂɏo���ʂ����Ȃ��C�p���Ɏ��Ȍ�������s���ꍇ���������߁C�A���ʂ����Ȃ��B�������C�l�H�S�x��p������C����̉��z��~��v����悤�ȑ匌�ǎ�p�ɂ�����A���ʂƂȂ�Ǝ{�݊ԍ����傫���Ȃ�B����́C�Ìň��q�s���⌌�����s���C�����@�\�ُ�Ȃǂɂ��o���X���ɑ��Ď��Â��s����̂ł͂Ȃ��C�P�Ȃ錌�����̐���ȉ��ւ̌����C�l�H�S�x���g�p���邱�Ƃɂ�錌���@�\��Ìň��q�������N����Ƃ����������l�C���邢�͗��_�I���ɑ��ėA�����s����ꍇ���������邩��ł��낤�ƍl������B���̂��߂ɁC�O�ȓI�ȏo���̏��u�ɐ旧���āC�Ìň��q�⌌����[���s���Ă���ꍇ����������B
�@
�l�H�S�x�g�p���ɂ͌��t��߂��N����B�l�H�S�x����Hb�l�ɂ��Ă�����y�������͖��炩�ł͂Ȃ��B�l�H�S�x���Hb�l��7�`8g/dL�ȏ�i��10g/dL�j�ɂȂ�悤�ɂ��邱�Ƃ������B
�@
18�`26���̒�̉��ɂ�茌�����͌�������B��Ƃ��Ė喬�n�Ɍ������ߑ�sequestration����邱�Ƃɂ��B80���ȏ�̌����͕����ƂƂ��ɏz���t���ɖ߂�2�B���������āC��̉����̌����������̉��߂ɂ͒��ӂ�v����B�܂��C��̉��ɂ��g�����{�L�T�������y�f�j�Q�ɂ��g�����{�L�T��A�Q�Y���ቺ���N����C�����ÏW�\�͑傫���ቺ����ق�3�C4�C���Ǔ���זE��Q���N����B�����ɂ�茌���ÏW�\�͉��邪�C���S�ȉɂ͎��Ԃ�������B�ŋ߂悭�p������퉷�l�H�S�x�ł͌����ÏW�\�ቺ�͂Ȃ�5�B
�@
�l�H�S�x��p������p�ɂ����āC���������Ɋ�Â����A�����s�����ƂŁC�o���I�ȕ��@�ɔ�o���ʂ������邱�ƂȂ��C�V�N���������⌌���Z���t�Ȃǂ̗A���ʂ����������邱�Ƃ��o�����ƕ���Ă���6�B
�@
�~���̂��߂ɂ͌�������5�`10��/��L�C�Ìň��q�������20�`40������Ώ\���ł��邱�Ƃ��悭�F������K�v������B�����A����V�N���������𓊗^����ꍇ�C���킠�邢�͂��������悤�ȕ�[�͕s�v�ł��邱�Ƃ��悭�F�����ׂ��ł���B
�p�O�̖Ö@���L���ȕn���̐���
�@
�S����p�ɂ����āC�p�O�̕n���͓��파�A����K�v�Ƃ���d�v�Ȉ��q�ł���B�t�s�S��C�S���R���n���������݂���8�B�܂��C�p�O�Ɋ��������e�������҂ł͕n���ɂȂ�₷���̂Œ��ӂ��K�v�ł���B�܂��C�S���R���n�������݂���̂ŁC�S�܂Ȃǂɂ�鎡�Â��K�v�Ȃ��Ƃ�����B
�����Z���t��V�N���������̗\�h�I���^�̔ے�
�@
�l�H�S�x�Ǘ�ɂ����錌���Z���t��V�N���������̗\�h�I���^�͊��߂��Ȃ��B
�o���ʂɊW������q
�@
�����S���O�Ȏ�p�ɂ����ẮC��̉��l�H�S�x���̊j�S���x���o���ʂƊW����ƕ���Ă���B1�Έȏ�̏����S���O�Ȏ�p�ł́C�Ď�p�C�p�O����̐S�s�S�C�����Ԃɂ킽��l�H�S�x���Ԃ��o���ʂƓ��파�A���ʂ̑����ƊW���Ă���9�B
���파�A��������������̂ɗL�p�ȖÖ@
�@
�A�v���`�j����g���l�L�T���_�Ȃǂ̖�p���邱�Ƃɂ��C�S����p�ɂ����铯�파�A�������������邱�Ƃ��ł���10�B�A�v���`�j�����^�ɂ�蓯�파�A������������ق��C�o���ɑ���ĊJ��������������ƕ���Ă���11�B�A�v���`�j���̗L�p���́C�l�H�S�x��p�����p�ɂ����Ă���������Ă���12�B�A�v���`�j���͊������o�C�p�X�p�̍Ď�p��ɂ�����o���ʂ�����������ƕ���Ă���13�C14�B�������C����̉��z��~�@��p�����ꍇ�ɂ́C�A�v���`�j���ɂ��o���ʌ������ʂ͊��҂ł��Ȃ�15�B��-�A�~�m�J�v�����_���S����p�ɂ�����o���ʂ�����������16�B
�@
���파�A���ʂ̌����ɂ́C�p���̋ÌŌ����̃`�F�b�N���L�p�ł���B���G�ȐS����p�ɂ����āC�g�����{�G���X�g�O�����iTEG�j�����파�A��������������̂ɗL�p�ł���ƕ���Ă���17�B
�@
�x�؏��p�̑����͋��o�����ɍs���悤�ɂȂ����B�x�O�Ȏ�p�ɂ����Ă͈�ʂɏo���ʂ�̉t�V�t�g����r�I���Ȃ��B�x�؏��p��x�S�E�p�ɂ����Ă��CHb�l��8.5�`10g/dL�ł悢�ƍl������18�B
�@
�H���S�E�p�y�шݒ��ǂ�p�����H���Č��ł́C�����Ώo���ʂ������Ȃ�ق��C�̉t�̃T�[�h�X�y�[�X�ւ̈ڍs�ȂǑ傫�ȑ̉t�V�t�g���N����B�A�������ʂ́C���҂̕a�ԁC�̊i�C�p�OHb�l�C�p������яp��o���ʂȂǂ��l�����Č��肷��B
�@
�p�O�̉h�{��Ԃ��ǍD�ŁC�n�����Ȃ����҂ł͎��Ȍ��������l������B���파�A����p�������Ȍ��A���݂̂ŊǗ������Ǘ�ł́C���̍Ĕ������ቺ���C�Ĕ���̐������Ԃ������Ȃ�Ƃ��������������ɂ�������19�B���Ȍ��A�����s���������Ɖu�@�\���ۂ���C�p�㊴�����Ⴂ�Ƃ���������20�C21�B�A�����K�v�ł��������҂ł́C�A�������Ȃ��������҂ɔ�ח\�オ�s�ǂł������Ƃ���������22�B
�@
�H�������҂͂�������ł��邪�C�S�g��Ԃ��ǍD�Ȋ��҂ɂ�����A�����J�n����Hb�l�i�A���g���K�[�l�j�́CHb�l7�`8g/dL�Ƃ���B�����������Ȃǂ̐S����������z�\���͂������������҂�C�����ǐ��x�����Ȃǂ̔x�����ɂ��p��̌��t�_�f���������\�z����銳�ҁC�����ɂ����錌���Y���\�͂��ቺ���Ă��銳�҂ł́C�A���g���K�[�l�͂�荂�����̂Ƃ���̂��Ó��ł���B�������C10g/dL��荂���ݒ肷��K�v�͂Ȃ��B
�@
�G�ߑS�u���p��ҊߑS�u���p�ɂ����āC���e�ϐ����t��߁C�p�����t����C����ɑ̉��̐ϋɓI�ێ��ɂ�蓯�파�A���ʂ����������邱�Ƃ��ł���Ǝ�������Ă���23�B�ߏ�A���ɒ��ӂ��K�v�ł���24�B
�@
�G�ߑS�u���p�ɂ����ẮC�p���̓^�[�j�P�b�g���g�p���邽�߂ɁC�p���o���͔�r�I���Ȃ����p��o���ʂ������B�p���ɓ��e�ϐ����t��߂ɂ�莩�Ȍ����̎悵�C�p��ɕԌ�������25�C�p��h���[������Ԍ�����Ƃ������Ȍ��A���ɂ���Ă����파�A���ʂ����������邱�Ƃ��ł���26�B
�@
�ҒŊO�Ȏ�p�ɂ����Ă͂����Ώo���ʂ������Ȃ�C�Ԍ����Z���t�̂ق��C�����Z���t��V�N���������Ȃǂ��K�v�ɂȂ�ꍇ������B�K�X�C�v���g�����r�����ԁCINR�C�����g�����{�v���X�`�����Ԃ̑�����s���C�g�p�w�j�ɏ]���Ď��{����27�B
�@
��̉��ɂ�錌���@�\��Q��ÌŌn�}�����N���邪�C�y�x��̉��ł��ҊߑS�u���p�ł͏o���ʂ���������ƕ���Ă���29�B�O�ȓI�~���ɉ����C��̉��̂悤�ȏo���ʂ�������v���ɂ��Ă����ӂ��K�v�ł���B
�@
�]�_�o�O�Ȏ�p�́C�]��ᇎ�p�C�]����ᎃN���b�s���O���������؏��p�Ȃǂ̌��ǎ�p�C�]������d���O����C�]�O����p�ȂǑ���ɓn��B�܂��C���`�O�ȂƂ̋��E�̈�ł��邪�C�Ґ���p���܂܂��B
�@
�]�_�o�O�Ȏ�p�̊�{�́C���W���a�ς̎��ÂƁC�����̕a�ςɂ�铪�W�����㏸�Ȃǂɂ��N����I�ȑ�����h�����Ƃɂ���B���������āC�]�_�o�O�Ȏ�p�ɂ����ẮC�܂��z���t�ʂ𐳏�ɕۂ����ό����y�є]���������\���ɕۂ��Ƃ��d�v�ł���B�������C�]�_�o�O�Ȏ�p�ɂ����ẮC�z���t�ʕ]������������ł���B�]�Ґ��t��p��̐��t�̂��߂ɁC�z���ʂ�K�[�[�d�ʂ𑪒肵�Ă��C�����Ώo���ʂ̎Z�肪����B�܂��C�]����̗\�h�⎡�ÁC�]�Ґ��t�Y���ʌ����̂��߂Ƀ}���j�g�[����t���Z�~�h�̂悤�ȗ��A���p���邽�߂ɁC�A�ʂ��z���t�ʂf���Ȃ��B�܂��C�]�����}�����邽�߂ɁC�����Z����������h�����Ƃ��d�v�ł���B���파���Z������295��
Osm/L�ł���̂ɑ��C���_�����Q���t��|�_�����Q���t�Ȃǂ͂��ᒣ�t�ł���B�����H������308��Osm/L�ƍ����ł��邪�C��ʓ��^�ɂ�荂���f����Ӑ��A�V�h�[�V�X���N�����̂Œ��ӂ��K�v�ł���B
�@
�]�����h�����߂��P���Z�������d�v�ł���Ƃ����ΐM�����Ă��邪�C����������Ȋw�I�؋��͖R�����B�قƂ�ǂ̊J����p�ł��P���t�̓��^�͕s�v�ł���B�������C�]�O����]����᎔j��C�]���Ǒ����Ȃǂɂ��o���ʂ������Ȃ����ꍇ�i���Ƃ��Ώz���t�ʂ�50���ȏ�j�ɂ́C�q�h���L�V�G�`���f���v���Ȃǂ̐l�H�P���t��C�A���u�~���n�t���^���K�v�Ȃ��Ƃ�����B�������C�q�h���L�V�G�`���f���v����ʓ��^�ł͋Ìň��q��߂ɉ����C�����ÏW�}���C�Ìő�VIII���q�����̂ւ̍�p�ɂ��o���X�����N�����\��������B
�@
�n���ƂȂ�ƁC�]�_�f����ʂ��������邽�߂ɁC�]���NJg�����N����]�����ʂ���������B�]���NJg���ɂ�蓪�W�����t�ʂ���������ƁC���W�������㏸����B���W���R���v���C�A���X���ቺ�������҂ł́C�킸���ȓ��W�����t�ʑ����ɂ���Ă����W�������傫���㏸���C�]�w���j�A���N�����\��������B���������āC���W���R���v���C�A���X���ቺ�������҂ł́C�n���̐�����ϋɓI�ɍs���K�v������B
�@
�����I�O���B�؏��p�ɂ����ẮC�p�O���Ȍ��������邢�́C�p���̓��e�ϐ����t��߂ɂ�蓯�파�A���̓��^�ʂ����������邱�Ƃ��ł���30�B�������C���^���͂ł́C���t��ߖ@�ɂ�铯�파�A���̌����ɂ��ẮC�^�₪������Ă���31�B
�@
�����I�O���B�؏��p�ɂ����āC�p���̐S�؋�������́C�p��p����Ht�l��28�������ł͑��������Ƃ���������32�B
| �Q�l9 |
�@��ʏo����}���o���ɑ���Ώ� |
�@
��ʏo���͏z���t�ʂ���24���Ԉȓ��ɂ�����o���ʂ������ꍇ�������B�������C�O�Ȏ�p�̏ꍇ�C���ɊO���ɑ����p�ł́C�����ԂƂ����Z���Ԃ̊Ԃɏz���t�ʂ���悤�ȏo����C�}���ɏz���t�ʂ�1/3�`1/2����悤�ȏo�����N����ꍇ������B
�@
�A�������̎��ԓI�]�T������ꍇ�ɂ́C�����K�������ƕ��ː��Ǝ˂��s�����Ԍ����Z���t�𓊗^����B�܂��C��ʗA�����̓K�����ɂ��ẮC�u�A���Ö@�̎��{�Ɋւ���w�j�v��V��3���Q�ƁB
�@
�}����ʗA���ł͑�Ӑ��A�V�h�[�V�X�⍂�J���E�����ǂ��N����\��������B���J���E�����ǂ́C�A�����x��1.2mL/kg/min�����ꍇ�ɋN����33�B���݁C�A���|���v������o�b�O����������t�������u�Ȃǃe�N�m���W�[�̐i���ɂ�荂���x�̗A�����\�ɂȂ�C�S��~�������悤�ȍ��x�̍��J���E�����ǂ��N����\��������34�C35�B�z�s�S�Ȃǂɂ���Ӑ��A�V�h�[�V�X�����J���E�����ǂ�������v���ƂȂ�B
�@
��ʏo�����҂ł͒�̉��ɂȂ�₷�����C���ɗA�t�܂�A���p���t���܂̉������s�\���ȏꍇ�ɂ͂���ɒ�̉��ƂȂ�₷���B��̉��͏p��̃V�o�����O�Ƃ���ɂ��_�f����ʂ̏d��ȑ������N���������łȂ��C�����ǂ̑����Ȃǂ��N�������Ƃ���������Ă���B�}���E��ʗA�����s���ꍇ�ɂ́C�Η����A�t�E�A��������Ȃnj����̂悢��������g�p����K�v������B���̑��C�����Η��������u�����P�b�g�Ȃǂ̎g�p�ɂ���̉���h���悤�w�͂���ׂ��ł���B
�@
MAP��RCC��V�N���������ɂ̓N�G���_���܂܂�Ă��邽�߁C�}���A���ɂ��ꎞ�I�ɒ�J���V�E�����ǂ��N����\��������36�B�������C��J���V�E�����ǂ͈ꎞ�I�Ȃ��̂ł���C�Տ��I�ɏd��ȉe���������Ƃ͏��Ȃ��B��ʗA�����Ɍ����ቺ�C�S���k������������ꍇ��C�C�I�����J���V�E���Z�x����ɂ���J���V�����ǂ����炩�ȏꍇ�ɂ́C�����J���V�E����O���R���_�J���V�E���Ȃǂɂ��J���V�E����[���s���B
�@
�z���t�ʈȏ�̏o�����N�����ꍇ�C�V�N���������ɂ��Ìň��q��������C�����A���ɂ�茌����₤�K�v���͑�������37�B�z���t�ʈȏ�̏o�����N���Ă��C�V�N�����������o���X���\�h�̂��߂ɓ��^���邱�Ƃ̗L�p���͔ے肳��Ă���38�B�����A���ɂ������ẮC�������������l����ABO�K�������Z���t��p���邱�Ƃ��]�܂����BABO�s�K�������Z���t���g�p�͉\�ł��邪�C�����������ABO�K�������Z���t�ɔ�גႭ�Ȃ邱�Ƃɒ��ӂ��K�v�ł���B
�@
�Տ��I�o�����F�߂��Ȃ��ꍇ�C�o���X����f�f���邱�Ƃɂ�����v���g���r�����Ԃ╔���g�����{�v���X�`�����Ԃ̓��ٓx�⊴�x�͒Ⴂ�Ƃ���Ă���39�B���������āC�Տ��I�o����o���X�����F�߂��Ȃ��ꍇ�ɂ́CPT��APTT�݂̂��Q�l�ɐV�N���������̓��^�͍s���ׂ��ł͂Ȃ��B����́C��ʏo���ɔ����o���X�����C�Ìŏ�Q�ɂ����̂����łȂ��C�d�ĂȒጌ��40�C�����z�s�S�ɂ���Ӑ��A�V�h�[�V�X�C��̉��Ƃ��������܂��܂Ȉ��q�ɊW���Ă��邽�߂ł��邩������Ȃ�41�B
�@
�z�\���\���������������҂ɂ����āC���l�̏o���ʂɂ��A���J�n��Ă͂߂邱�Ƃ͖��ɂȂ�ꍇ������C�o�����\�z�����ً}��p�p�O�̕n���i�Wg/dL�����j���Ԍ����A���̑ΏۂƂ��čl������B�܂��C�O���E�p���o���ɂ��z���t�ʂ�15�`20���̑r���̏ꍇ���Ԍ����A�����l������B������̏ꍇ���C�Տ���Ԃ���A���J�n�̔��f�����ׂ��ł���B
| �Q�l11 |
�@�����n�����҂ɂ�����㏞���� |
�@
�O�Ȏ�p���҂ɂ����Ă͂����Ώp�O�ɕn�����F�߂���B�����̖����n�����҂ɂ����ẮC�Ԍ����ʂ͌������Ă��邪�C�����ʂ͂ނ��둝�����Ă���C�z���t�ʂ͐���ɕۂ���Ă���BHt�l�ቺ�ɔ������t�S�������ɂ�茌�ǒ�R���������邽�߁C1�o�ʂ͑������C�S���o�ʂ͑�������B���̂��߁C���t�_�f�ܗʂ͌���������̂́C�S���o�ʑ����ɂ��㏞����邽�߁C�����g�D�ւ̌��t�_�f�^���ʂ͌������Ȃ��B�g�D�ɂ�����_�f�ێ旦�͏㏸����B�������C�S����������S�@�\��Q�����銳�҂⍂��҂ł́C�n���ƂȂ��Ă��S���o�ʂ̑㏞�I�������N���ɂ����B
�@
�����n���ł�2�C3-DPG�������ɂ��_�f�𗣋Ȑ��̉E���V�t�g���N���邽�߁C�����g�D�ɂ����錌�t����g�D�ւ̎_�f�n���͑��i�����42�BMAP��RCC���̂Q�C�R-DPG�ʂ͌������Ă��邽�߁C�����A�����s���w���O���r���Z�x���㏸�������t�_�f�ܗʂ������Ă��C�g�D�ւ̎_�f�����ʂ͑������Ȃ����߁C���҂��ׂ����ʂ��݂��Ȃ����Ƃ����邱�Ƃɒ��ӂ���43�B
| �� |
2�C3-DPG�F2.3�|�W�z�X�z�O���Z�����_ |
| �Q�l12 |
�@��p�����S�Ɏ{�s����̂ɕK�v�ƍl������Ht�l��Hb�l�̍Œ�l |
�@
�S�g��Ԃ��ǍD�ȍ���҂̐��`�O�Ȏ�p�ɂ����āCHt�l��41������28���Ɍ��������Ă��C�S���o�ʑ������N���Ȃ������Ƃ�����44�͂��邪�CHt�l��27�`29���Ƃ��Ă���N�҂Ǝ�p���S���͕ς��Ȃ������Ƃ���������45�B�z���t�ʂ��ۂ����Ȃ�CHt�l��45������30���܂ŁC���邢��40������28���Ɍ��������Ă��C�_�f�^���ʂ͌������Ȃ��ƕ���Ă���46�B
�@
����ȏ�Ԃł͑S�g�_�f�����ʂ͑S�g�_�f����ʂ������Ă���B�������C�S�g�_�f�����ʂ��������Ă���ƁC�S�g�_�f����ʂ��������Ă���B���̂悤�ȏ�Ԃł͌��C�I��ӂ��N�����Ă���B���̎��_�ł̎_�f�����ʂ�critical
oxygen delivery�iDO2crit�j�Ƃ����B�������������҂ł�DO2crit��330mL/min�ł���ƕ���Ă���47�B��p����500�`2000mL�o����Ht�l��24���ȉ��ɂȂ������҂ł́C���S�������������Ƃ���������48�B�}���S�؍[�ǂ��N����������҂ł�Ht�l��30�������Ŏ��S�����㏸���邪�C�A���ɂ��Ht�l��30�`33���ɏ㏸������Ǝ��S�������P����Ƃ���������B�܂��C�����I�O���B�؏��p�ɂ����āC�p���̐S�؋�������́C�p��p����Ht�l��28�������ł͑��������Ƃ���������49�B�������C�}�����nj�Q�ɂ����ėA���������҂ł́C�S�؍[�ǂɈڍs��������30�����S�����������Ƃ�����Ă���50�B
�@
�������������҂ɂ����ẮC���x�̕n���͔�����ׂ��ł��邪�C����CHb�l��Ht�l���㏸����������̂��댯�ł���\��������BHb�l10g/dL�CHt�l30�����x��ڕW�ɗA�����s���̂��K���ł���ƍl������51�B
�@
�S�g��Ԃ��ǍD�Ȏ�N�҂ł͏z���t�ʂ�����ɕۂ���Ă���CHt�l��24�`27���CHb��8.0�`9.0g/dL�ł����Ă���肪�Ȃ��ƍl������52�C53�C54�B�����w�I�ɂ�Hb��6.0�`7.0g/dL�ł����Ă����̂͑ς�����ƍl�����邪�C�o����S�@�\�ቺ�Ȃǂ��N�����ꍇ�ɑΏ��ł���\���\�́C���ɏ��Ȃ��Ȃ��Ă���ƍl����ׂ��ł���B
�@
���p���̗A���ɂ�����w�W��K�C�h���C���ɂ��ẮC�č��a���w���č������Ȋw��iASA�j���A���ɑ���K�C�h���C�����߂Ă���55�C56�C57�B���ہCHb�l��10g/dL�ŗA�����邱�Ƃ͏��Ȃ��Ȃ��Ă���58�B
| �Q�l13 |
�@�p���̏o���R���g���[���ɂ��� |
�@
�o���ʂ̑����͂���ɂ���C��p�ɂ��o���͕K���N����B�o���ʂ�����������ɂ́C�O�ȓI�~���̂ق��C�o���ʂ���������ȓI�v���ɑΏ�����K�v������57�B
�@
�o���̃R���g���[���ɂ́C���ǂ̌��F��N���b�v�ɂ�錌�ǕǁC�d�C�ÌłȂǂɂ��m���ȊO�ȓI�~���̂ق��C���x�̋Ìň��q�s���ɑ��Ă͐V�N���������A���C���x�̌��������ǂ⌌���@�\�ُ�ɑ��Ă̌����Z���t���^�Ȃǂ��K�v�ɂȂ�B�A�v���`�j����g���l�L�T���_�Ȃǎ~�����ʂ����̓��^���L�p�ȏꍇ������B
�@
�܂��C�o������������悤�Ȉ��q���������邱�Ƃ��K�v�ł���B���`�O�Ȏ�p�Ȃǂł͒ጌ�������i�l�דI�ጌ���j�ɂ�錌���̃R���g���[�����L�p�ȏꍇ������B�܂��C��̉��͌y�x�̂��̂ł����Ă��p���o����������댯������̂ŁC���҂̕ۉ��ɂ��\���ɓw�߂Ȃ���Ȃ�Ȃ��B
�@
�s�K�ȗA���Ö@��h�����߂ɂ́C��t�̗A���Ɋւ���ċ�����d�v�ł���58�B
�Q�l1614 |
�@�A�t�F���V�X�Ɋ֘A���鎖���ɂ��� |
| �P�j |
�d�ĂȊ̕s�S�ɑ��āC��Ƃ��ĕ����I�ȋÌň��q�̕�[�̖ړI�ōs���錌�������Ö@
�@�ۑ��I���Â������́C�̈ڐA�ɂ���ĕa���P����܂ł̈ꎞ�I�ȕ⏕�Ö@�ł���CPT����30���ȉ����J�n�̖ڈ��Ƃ���B�K�v�ɉ����āC���t�h�ߓ��͓��p����B�������ɑ��閾�m�Ȏ��Õ��j�Ɋ�Â��C�{�s�������̕K�v���ɂ��ď�ɕ]�����邱�ƁB�������̉��P��ړI�Ƃ��鎡�Â����{�ł��Ȃ��a�Ԃɂ����ẮC���������Ö@�̓K���͂Ȃ��B
�@�d�ĂȊ̏�Q�ɂ����āCFFP��p�����������������͂ɍs���ꍇ�C�N�G���_�i�g���E���ɂ��C��Ӑ��A���J���[�V�X�C���i�g���E�����ǂ�C�P���Z�����̋}���ȕω��𗈂����ꍇ������̂ŁC�o���I�ώ@���s���C�K�ȑΉ����s�����ƁB
|
| �Q�j |
��������̏�Q���d�ĂŁC���������~���n�����q�̌����Z�x�̂��݂₩�ȉ����҂ł��Ȃ��ꍇ�B |
| �R�j |
�o���X���������͌����X�����������C�ꎞ�I�Ȏ~���n�����q�̌����Z�x�̒ቺ���댯���Ɨ\�z�����ꍇ�B���̂悤�ȏꍇ�CFFP���u���t�Ƃ��ėp�����邪�C�a��ɂ��K�������u���t�S�̂�FFP�Ƃ���K�v�͂Ȃ��C�J�n���́C�����A���u�~����C�l�H�P���t��p���邱�Ƃ��\�ȏꍇ������B |
| �S�j |
���𐫌��������������a�iTTP�j���E�n�����A�ŏǏnj�Q�iHUS�j:TTP�ł͌��Ǔ���זE�R���́C�ʏ�������q�ʂ̑傫��Von Willebrand Factor���C�����z�Ō��������������C�{�ǂ̔��ǂɊ֗^���Ă���B�܂��CVon Willebrand Factor Cleaving Protease�iVWF-CP-ADAMTS13�j�̒�����j�Q���q�̏o������v�ȕa���Ƃ���CFFP��u���t�Ƃ��Č��������Ö@���s���CVWF-CP���[���j�Q���q���������Ƃ��ł��L���ł���B���������Ö@���s����ꍇ��C��`����VWF-CP�̌��R��F�߂�ꍇ�CVWF-CP�̌������[���邽�߂ɁCFFP�̒P�Ɠ��^�����ʂ�����ꍇ������B�ꕔ�̗n�����A�ŏǏnj�Q�ɂ����Ă��CFFP��p�������������⌌���A�����L���ȏꍇ������B
| �� |
BCSH.Guideline Guidelines on the Diagnosis and Management of the Thrombotic Microangiopathic Haemolytic Anemias. British Journal of Haematology 2003;120:556-573 |
|
�Q�l1415 |
�@�Ԍ����Z���t�̐��@�Ɛ��� |
�@���ݕp�p����Ă��錌�t�ۑ��t�ɂ́CACD-A�t�iacid-citrate-dextrose:�N�G���_�i�g���E��22.0g/L�C�N�G���_8.0g/L�C�u�h�E��22.0g/L�j�y��CPD�t�icitrate-phosphate-dextrose:�N�G���_�i�g���E��26.30g/L�C�N�G���_3.27g/L�C�u�h�E��23.20g/L�C�����_�f�i�g���E���a��2.51g/L�j������C�Ԍ����ۑ��p�Y���t�Ƃ��Ă�MAP�t�imannitol-adenine-phospate:D�}�j�g�[��14.57g/L�C�A�f�j��0.14g/L�C�����_�f�i�g���E���a��0.94g/L�C�N�G���_�i�g���E��1.50g/L�C�N�G���_0.20g/L�C�u�h�E��7.21g/L�C�����i�g���E��4.97g/L�j������B
MAP���Ԍ����Z���t�iMAP��RCC�j
�@MAP���Ԍ����Z���t�iMAP��RCC�j�́C�q�g���t200mL�ɂ�ACD-A�t30mL���������č̌��������t�������S�i200mL�̌���4,000G�E6���ԁC400mL�̌���4,600G�E6���ԁj���Č����ƌ����E�������w�i�o�b�t�B�[�R�[�g�j�������C�w�}�g�N���b�g�iHt�j�l���90���ɂ����Ԍ������w�ɁC200mL�̌���MAP�t���46mL�C400mL�̌���MAP�t���92mL�Y�����Ē����������̂ł���B
�@MAP���Ԍ����Z���t�iMAP��RCC�j�̍ŏI�e�ʂɂ́C200mL�S���R���i1�P�ʁj�̖�140mL��400mL�S���R���i2�P�ʁj�̖�280mL��2��ނ�����BHt�l�͖�60���ŁC�w���O���r���iHb�j�ܗL�ʂ�200mL�S���R����29�}2.7g�ł���BCPD���Ԍ����Z���t�iCPD��RCC�j�Ɣ�r�����ꍇ�C�����ƃ����p���͖�1/10�C���������͖�1/10�����܂܂�Ă��Ȃ����C�������͖�60���O��܂܂�Ă���B
�@MAP���Ԍ����Z���t�iMAP��RCC�j�̈ꕔ�̐����͕ۑ����Ɍo���I�ȕω�������(�\1)
1�j�C2�j�B
�@���{�ԏ\���Ђł́CMAP���Ԍ����Z���t�iMAP��RCC�j�u���ԁv�̐������F�擾���ɂ͗L�����Ԃ�42���Ƃ��Ă������C�G���V�j�A�ۍ����̉\�������邽�߁C���݂͗L�����Ԃ�21���ԂƂ��Ă���B
�@
�Ȃ��C���{�ԏ\���Ђ�MAP���Ԍ����Z���t�iMAP��RCC�j��Ԍ���M�EA�EP�u���ԁv�Ƃ��Ĉ�Ë@�ւɋ������Ă���B
�\1
�Q�l1516 |
�@�����Z���t�̐��@�Ɛ��� |
�@�����Z���t�̒����@�ɂ́C�̌������S���������ɕۑ������܉�������@�ƁC�P�ꋟ���҂��琬���̌����u���g�p���Ē���������@�����邪�A�킪���ł͌�҂���ʓI�ł���B
�@200mL�S���̌����璲�����ꂽ�����Z���t�́C������20mL����0.2�~10
11�ȏ�̌������܂ށB�����1�P�ʐ��܂Ə̂���B400mL�S���̌��R���̌����Z���t��2�P�ʁi0.4�~10
11�ȏ�j����B
�@�����̌��R���̌����Z���t�ɂ́C5�P�ʁi�����ʖ�100mL�C������1.0�~10
11�ȏ�2.0�~10
11�����j�C10�P�ʁi�����ʖ�200mL�C������2.0�~10
11�ȏ�3.0�~10
11�����j�C15�P�ʁi�����ʖ�250mL�C������3.0�~10
11�ȏ�4.0�~10
11�����j�C�y��20�P�ʁi�����ʖ�250mL�C������4.0�~10
11�ȏ�j�̊e���܂�����B
�@HLA�K�������Z���t�ɂ́C�����̌��R����10�C15�C20�P�ʂ̊e���܂�����B
�Ȃ��C�����̌����Z���t�̒��ɂ͏��ʂ̐Ԍ����₲���킸���̔��������܂܂�Ă���B
�Ȃ��C����16�N10�����C�ۑ��O�����������Z�p���K�p���ꐻ�ܒ��̍������������̓o�b�O������1�~106�����ƂȂ����B
�@�������ꂽ�����Z���t�́C�A������܂Ŏ����i20�`24���j�Ő����UṂ��Ȃ���ۑ�����B
�@�L�����Ԃ͍̌���72���Ԃł��邪�C�����̉ߒ��Ŗ��ە���H�ɂ�鑀�삪�s���Ȃ������ꍇ�ɂ́C�̌���24���Ԃł���B
�Q�l1617 |
�@�V�N���������iFFP�j�̐��@�Ɛ��� |
�@�S����蕪�����ꂽ�������邢�͐����̌��ɂ��̎悳�ꂽ�������̌���6���Ԉȓ���-20���ȉ��ɒu���C���₩�ɓ����������̂ł���B���̗e�ʂ́C��80mL�i1�P�ʁj�C��160mL�i2�P�ʁj�y�і�450mL�i5�P�ʁj������B�L�����Ԃ͍̌���-20���ȉ��̓����ۑ���1�N�Ԃł���B
�@FFP�̑g���́C�̌����ɍ����������t�ۑ��t�i�S���t�R����ACD-A�t����CPD�t�C�����̌��R����ACD-A�t���g�p�j�ɂ��قȂ�i�\3�j�B�ܗL�����͌��t�ۑ��t�ɂ���߂���āC�P�ʗe�ϓ�����̔Z�x�͐��파���Ɣ�r���āC���悻10�`15���ቺ���Ă���B�Ⴆ�C�A���u�~���Z�x�͖�4.0g/dL�i�S�ʖ�3g
/�P���j�ƒႭ�Ȃ��Ă���B
�@�܂��C�������̋Ìň��q�����̌l���͑傫�����CFFP���ł��قړ��l�ȋÌň��q�������܂܂�Ă���B�������C�s����Ȉ��q�ł���Ìő�V�CVIII���q�����͂킸���Ȃ���ቺ����B����C�i�g���E���Z�x�͌��t�ۑ��t���̃N�G���_�i�g���E���̓Y���ɂ�葝�ʂ��Ă���B�������ɂ͏��ʂ̌����C�Ԍ����y�є����������݂��Ă��邪�C�����Z���ɂ��قƂ�ǂ̍זE�͔j���B
�Ȃ��C���파��1mL���Ɋ܂܂��Ìň��q������1�P�ʁi100���j�Ƃ����B
�@
�܂��C�V�N�������������߂Ƃ���
�A���p���t���܂́C�������̕a���̂ɑ���s�����������Ȃ���Ă��Ȃ����Ƃ���C�A�������ǂ�`�d����댯����L���Ă��邱�Ƃɗ��ӂ���K�v������B
�@�Ȃ��C�����Z���t
4 10�P�ʁi
����80 200mL
���܂��j���ɂ͕s����ȋÌň��q��������FFP
1 2.5�P�ʂɑ�������Ìň��q�������܂܂�Ă���B
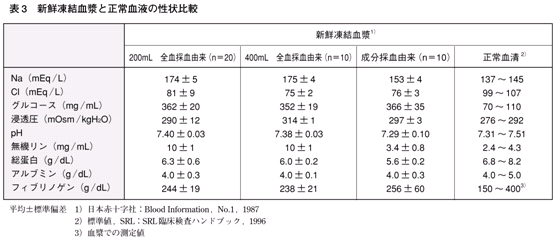
�Q�l1718 |
�@�A���u�~���̐��@�Ɛ��� |
�@�A���u�~�����܂́C���l�����̌������v�[�����āC��G�^�m�[���@�ɂ�蕪�悳�ꂽ�`�������ł���B�ܗL�`������96���ȏオ�A���u�~���ł��鐻�܂�l�����A���u�~���Ƃ����C
���파���Ɠ����������i���파�����P���Z�������������j��5���n�t�ƍ�����20�C25���n�t�Ƃ�����B�܂��C
�������܂ɂ��A���u�~���Z�x��4.4w/v���ȏ�ŊܗL���`������80���ȏオ�A���u�~��
�ł��鐻���i�ꕔ�̃O���u�������܂ށj
���ł������M�l����
�`�������iplasma protein fraction;PPF�j�Ƃ����C���파���Ɠ��Z�����i�����j�����܂�����B�����̐��܂͂������60��10���Ԉȏ�̉t����M�������Ȃ���Ă���C�G���x���[�v�����̉��E�C���X�iHBV�CHCV�Ȃǁj��q�g�Ɖu�s�S�E�C���X�iHIV�j�Ȃǂ̊��m�̃E�C���X�������̓`�d�̊댯�͂قƂ�ǂȂ��B�������Ȃ���C
����܂łɊ�����͂̕Ȃ����̂��G���x���[�v�̂Ȃ�A�^�̉��E�C���X�iHAV�j�C
�q�g�p���{�E�C���XB19 E�^�̉��E�C���X�iHEV�j�Ȃ�
�̕s�����͕s�\���ł���C�܂��ŋ߁C���v���I��
���̊����̉\��
������莋�����悤�ɂȂ��Ă����ɂ��Ă͍�����������Ă����K�v�������B
�@�A���u�~����585�̃A�~�m�_����Ȃ镪�q�ʖ�66,500�_���g���̒`�����ł���B
�A���u�~���ɂ��P���Z�����̒��ߋ@�\������C���파�����P���Z�����̂���80�����A���u�~���ɂ���Ĉێ������
����B�܂������C�A���u�~��1g�͖�20mL�̐�����ێ�����B�A���u�~���̐��̓������ʂ͐��l�j���ł͖�300g�i
4.6g/kg�̏d�j�ł���C�S�̖̂�40���͌��Ǔ��ɁC�c���60���͌��NJO�ɕ��z���C���݂Ɍ������Ȃ��畽�t��Ԃ�ۂ��Ă���B�����͎�Ɋ́i
0.2g/kg/���j�ōs����B���̐����̓G�l���M�[�ێ�ʁC�����A�~�m�_�ʁC�z�������Ȃǂɂ�蒲�߂���C����Ɍ��NJO�A���u�~���ʁC�����P���Z�����Ȃǂ��֗^����B�A���u�~���̐����͌��NJO�A���u�~���ʂ̒ቺ�Ř��i���C�����ŗ}������C�܂��P���Z�����̏㏸�Ő����͗}�������B���̕����͋ؓ��C�畆�C�́C�t�Ȃǂōs���C1���̕��𗦂͐��̓������ʂ̂ق�4���ł���B�܂����̓��ł̃A���u�~���̔������͖�17���ł���B
����
| 1�j |
�ĉ�V�@���DMAP���Z���Ԍ����̐����ƒ����ۑ������D���A���37�F404-410�C1991 |
| 2�j |
���쎠�@���D�����ۑ�MAP���Z���Ԍ����̗L�����ɂ���-Survival study-�@���A���37�F411-413�C1991 |
| 3�j |
Lundsgaard-Hansen P,et al.
Component therapy of surgical hemorrhage:Red cell concentrates, colloids and crystalloids. Bibl Haematol. 46 : 147-169, 1980 |
| 4�j |
���{�A���w��u�A����GVHD�ψ���v�D
�A���ɂ��GVHD�\�h�̂��߂̌��t�ɑ�����ː��Ǝ˃K�C�h���C��IV�D���{�A���w��VII�C���A���45�i1�j�F47-54�C1999 |
| 5�j |
Kwaan HC �� Soff GA.
Management of TTP/HUS. Seminars in Hematol. 34 : 159-166, 1997
|
| 6�j |
AABB. Blood Transfusion Therapy ; A Physician's Handbook (5th ed.), 1996 p.26 |
| 7�j |
���{�����Ȋw�V�����ψ����.
���n�������n���ɑ���A���K�C�h���C���ɂ��āD������99�F1529-1530�C1995 |
| 1 |
�@Stover EP, Siegel L, Parks R, et al: Variability in transfusion practice for coronary artery bypass surgery persists despite national consensus guidelines. Anesthesiology 1998;88:327-333 |
| 2 |
�@Hessel EA, Schmer G, Dillard DH: Platelet kinetics during deep hypothermia. Journal of Surgical Research 1980;28:23-34 |
| 3 |
�@Valeri CR, Feingold H, Cassidy G, et al: Hypothermia-induced reversible platelet dysfunction. Annals of Surgery 1987;205:175-81 |
| 4 |
�@Michelson AD, MacGregor H, Bamard MR, et al: Reversible inhibition of human platelet activation by hypothermia in vivo and in vitro. Thrombosis and haemostasis 1994;71:633-40 |
| 5 |
�@Boldt J, Knothe C, Welters I, et al: Normothermic versus hypothermic cardiopulmonary bypass: do changes in coagulation differ- Annals of Thorac Surg 1996;62:130-135 |
| 6 |
�@Nuttall GA, Oliver WC, Santrach PJ, et al: Efficacy of a simple intraoperative transfusion algorithm for nonerythrocyte component utilization after cardiopulmonary bypass. Anesthesiology 2001;94:773-81 |
| 7 |
�@Nuttall GA, Oliver WC Jr, Santrach PJL: Coagulation tests predict bleeding after cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1997;11:815-23 |
| 8 |
�@Karski, JM., Mathieu, M, Cheng D, et al: Etiology of preoperative anemia in patients undergoing scheduled cardiac surgery. Can J Anesth 1999 ;46
:979-982 |
| 9 |
�@Williams, GD, Bratton SL: Factors associated with blood loss and blood product transfusions: A multivariate analysis in children after open-heart surgery. Anesth Analg 1999; 89:57-64 |
| 10 |
�@Laupacis, A, Fergusson, D, MHA for The International Study of Peri-operative Transfusion �iISPOT�j Investigators: Drugs to minimize perioperative blood loss in cardiac surgery: Meta-analyses using perioperative blood transfusion as the outcome Anesth Analg 1997; 85:1258-67 |
| 11 |
�@Hardy, J-F:Pharmacological strategies for blood conservation in cardiac surgery: erythropoietin and antifibrinolytics Can J Anesth 2001;48 /:S24-S31 |
| 12 |
�@Mongan, PD,Brown, RS, Thwaites BK.:Tranexamic acid and aprotinin reduce postoperative bleeding and transfusions during primary coronary revascularization Anesth Analg 1998; 87:258 |
| 13 |
�@Sedrakyan A, Treasure T, Elefteriades JA: Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials. J Thorac Cardiovasc Surg 2004;128:442-8 |
| 14 |
�@Levy JH, Pifarre R, Shcaff HV, et al:A multicenter, double-blind, placebo-controlled trial of aprotinin for reducing blood loss and the requirement for donor-blood transfusion in patients undergoing repeat coronary artery bypass grafting Circulation. 1995;92:2236-44. |
| 15 |
�@Mangano CTM, Neville MJ, Hsu PH, et al: Aprotinin, blood loss, and renal dysfunction in deep hypothermic circulatory arrest. Circulation 2001;104:I-276 |
| 16 |
�@Munoz JJ, Birkmeyer NJO, Birkmeyer JD, et al: Is ��-aminocaproic acid as effective as Aprotinin in reducing bleeding with cardiac surgery. Circulation 1999;99:81-9 |
| 17 |
�@Shore-Lesserson, L, Manspeizer, HE,DePerio, M, et al: Thromboelastography-guided transfusion algorithm reduces transfusions in complex cardiac surgery. Anesth Analg 1999; 88:312-9 |
| 18 |
�@Dougenis D, Patrinou V, Filos KS, et al: Blood use in lung resection for carcinoma: perioperative elective anaemia does not compromise the early outcome. Eur J Cardiothorac Surg 2001;20:372-7 |
| 19 |
�@Motoyama S, Okuyama M, Kitamura M, et al: Use of autologous instead of allogeneic blood transfusion during esophagectomy prolongs disease-free survival among patients with recurrent esophageal cancer. J Surg Oncol 2004;15:26-31 |
| 20 |
�@Kinoshita Y, Udagawa H, Tsutumi K, et al: Usefulness of autologous blood transfusion for avoiding allogenic transfusion and infectious complications after esophageal cancer resection. Surgery 2000;127:185-92 |
| 21 |
�@Takemura M, Osugi H, Takada N, et al: Immunologic effects of allogeneic versus autologous blood transfusion in patients undergoing radiacal oesophagectomy. Eur Surg Res 2003;35:115-22 |
| 22 |
�@Dresner SM, Lamb PJ, Shenfine J, et al: Prognostic significance of peri-operative blood transfusion following radical resection for oesophageal carcinoma. Eur J Surg Oncol 2000;26:492-7 |
| 23 |
�@Schmied, H; Schiferer, A, Sessler, DI., et al: The effects of red-cell scavenging, hemodilution, and active warming on allogenic blood requirements in patients undergoing hip or knee arthroplasty. Anesth Analg 1998; 86:387-91 |
| 24 |
�@McSwiney, MM., O'Farrell D, Joshi, GP et al: Blood transfusion in total hip arthroplasty: guidelines to eliminate overtransfusion. Can J Anaesth 1993 ;40: 3:222-6 |
| 25 |
�@Olfsger D, Fredman B, Goldstein b, et al: Acute normovolemic haemodilution decreases postoperative allogenic blood transfusion after total knee replacement. Br J Anaesth 1997;7:79:317-21 |
| 26 |
�@Thomas, D, Wareham, K., Cohen, D, et al: Autologous blood transfusion in total knee replacement surgery. Br. J. Anaesth. 2001; 86:669-673 |
| 27 |
�@Horlocker, TT, Nuttall GA, Dekutoski, MB, et al: The accuracy of coagulation tests during spinal fusion and instrumentation. Anesth Analg 2001; 93:33-8 |
| 28 |
�@Neilipovitz, DT,Murto, K, Hall, L, et al: A Randomized trial of tranexamic acid to reduce blood transfusion for scoliosis surgery. Anesth Analg 2001; 93:82-7 |
| 29 |
�@Shmied H, Kurz A, Sessler DI, et al: Mild hypothermia increases blood loss and transfusion requirements during total hip arhtroplasty. Lancet 1996;347:289-92 |
| 30 |
�@Monk, TG, Goodnough, LT, Brecher ME, et al: Acute normovolemic hemodilution can replace preoperative autologous blood donation as a standard of care for autologous blood procurement in radical prostatectomy.�@Anesth Analg 1997; 85:953-8 |
| 31 |
�@Bryson GL, Laupacis, A,�@Wells A, et al: Does acute normovolemic hemodilution reduce perioperative allogeneic transfusion- A meta-analysis. Anesth Analg 1998; 86:9 |
| 32 |
�@Hogue CW Jr, Goodnough LT, Monk TG: Perioperative myocardial ischemic episodes are related to hematocrit level in patients undergoing radical prostatectomy. Transfusion. 1998 ;38:924-31 |
| 33 |
�@Linko K, Saxelin I: Electrolyte and acid-base disturbances caused by blood transfusion. Acta Anaesthesiolo Scand 1986;30:139-44 |
| 34 |
�@Brown KA, Bissonnette B, McIntyre B: Hyperkalemia during rapid blood transfusion and ohpovolaemic cardiac arrest in children. Can J Anaesth 1990;73:747-54 |
| 35 |
�@Jameson LC, Popic PM, Harms BA: Hyperkalemic death during use of a high-capacity fluid warmer for massive transfusion. Anesthesiology 1990;73:1050-2 |
| 36 |
�@Rock G, Tittley P, Fuller V: Effect of citrate anticoagulations on factor VIII levels in plasma. Transfusion 1988;28:248-52 |
| 37 |
�@Murray DJ, Olson J, Strauss R, et al: Coagulation changes during packed red cell replacement of major blood loss. Anesthesiology 1988;839-45 |
| 38 |
�@Consensus Conference: Fresh frozen plasma. Indications and risks.�@JAMA 1985;253:551-3 |
| 39 |
�@Counts RB, Haisch C, Simon TL, et al: Hemostasis in massively transfused trauma patients. Ann Surg 1979;190:91-9 |
| 40 |
�@Harke H, Rahman S: Haemostatic disorders in massive transfusion. Bibl Haematol 1980;46:179-88 |
| 41 |
�@Ferrara A, McArthur JD, Wright HK, et al: Hypothermia and acidosis worsen coagulopathy in the patient requiring multiple transfusion. Am J Surg 1990;160:15-8 |
| 42 |
�@Sunder-Plessman L, Kessier M, Jesch F, et al: Acute normovolemic hemodilution: change in tissue oxygen supply and hemoglobin-oxygen affinity. Bibl Haematol 1975;41:44-53 |
| 43 |
�@Shah DM, Gottlieb ME, Rahm RL, et al: Failure of red blood cell transfusion to increase oxygen transport or mixed venous PO2 in injured patients. J Trauma 1982;22:741-6 |
| 44 |
�@Rosberg B, Wulff K: Hemodynamics following normovolemic hemodilution in elderly patients. Acta Anaesthesiolog Scand 1981;25:402-6 |
| 45 |
�@Vara-Thorbeck R, Guerrero-Femandez Marcote JA: Hemodynamic response of elderly patients undergoing major surgery under moderate normovolemic hemodilution. Eur Surg Res 1985;17:372-6 |
| 46 |
�@Messmer K: Hemodilution. Surg Clin North Am 1975;55:659-78 |
| 47 |
�@Shibutani K, Komatsu T, Kubal K, et al: Critical levels of oxygen delivery in anesthetized man. Crit Care Med 1983;11:640-3 |
| 48 |
�@Carson JL, Spence RK, Poses RM, et al: Severity of anaemia and operative mortality and morbidity. Lancet 1988;1:727-9 |
| 49 |
�@Hogue CW Jr, Goodnough LT, Monk TG�FPerioperative myocardial ischemic episodes are related to hematocrit level inpatients undergoing radical prostatectomy.Transfusion1998;38:924-31. |
| 50 |
�@Rao SV, Jollis JG, Harrington RA, et al: Relationship of blood transfusion and clinical outcome in patients with acute coronary syndromes. JAMA 2004;292:1555-62 |
| 51 |
�@Wu WC, Rathore SS., Wang Y, et al: Blood transfusion in elderly patients with acute myocardial infarction. N Engl J Med 2001;345:1230-6 |
| 52 |
�@Stehling L, Simon TL: The red blood cell transfusion trigger. Arch Pathol lab Med 1994;118:429-34 |
| 53 |
�@Spence RK: Emerging trends in surgical blood transfusion. Semin Hematol 1997;34:48-53 |
| 54 |
�@Task force on blood component therapy: Practice guidelines for blood
component therapy. A report by the American Society of Anesthesiologists task force on blood component therapy. Anesthesiology 1996;84:732-47 |
| 55 |
�@College of American Pathologists: Practice parameter fro the use of fresh-frozen plasma, crypprecipitate, and platelets. JAMA 1994;271:777-81 |
| 56 |
�@Simon A, Alverson D, AuBuchon J, et al: Practice parameter for the use of red blood cell transfusions. Arch Pathol Lab Med 1998;122:130-8 |
| 57 |
�@American Society of Anesthesiologists Task Force on Blood Component Therapy. Practice guidelines for blood component therapy: A report by the American Society of Anesthesiologists Task Force on blood component therapy. Anesthesiology 1996; 84:732-47 |
| 58 |
�@Nuttall GA, Stehling LC, Beighley CM, et al: Current transfusion practices of members of the American Society of Anesthesiologists: A survery. Anesthesiology 2003;99:1433-43 |
| 59 |
�@van Klei WA, Moons KGM, Rheineck-Leyssius�@AT, et al: Validation of a clinical prediction rule to reduce preoperative type and screen procedures. Br. J. Anaesth. 2002; 89:221-225 |
| 60 |
�@van Klei WA, Moons KGM, Leyssius ST, et al: A reduction in Type and Screen: preoperative prediction of RBC transfusions in surgery procedures with intermediate transfusion risks. Br. J. Anaesth. 2001; 87:250-257 erative haemoglobin concentration. Using a simple prediction rule, preoperative type |
| 61 |
�@Obelman AJ, Barnes BA, Friedman BA: The risk of abbreviating the major crossmatch in urgent or massive transfusion. Transfusion 1978;18:137 |
| 62 |
�@Gombotz H, Meltzier H, List WF: Methods for reduction of perioperative bleeding. Br J Anaesth 1998;82�isuppl 1�j:62-6 |
| 63 |
�@Wilson K, MacDougall L, Fergusson D, et al: The effectiveness of interventions to reduce physician's levels of inappropriate transfusion: What can be learned from a systematic review of the literature.�@Transfusion 2002;42:1224-9 |
| �Q�l����1 |
�@DIC�f�f��|1988�N�����\ |

�Q�l����2









