| 第17回社会保障審議会医療保険部会 | 資料3 |
| 平成17年7月29日 |
|
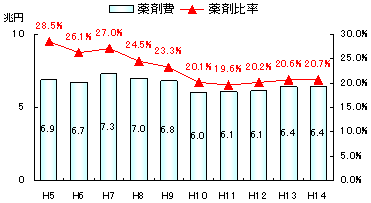
薬剤比率と薬剤費の推移
|
|
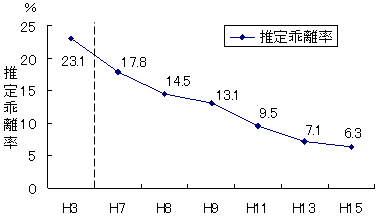
薬価差の推移
|
|
| 最近の薬価改定の経緯 |
| 薬価収載品目数 | 改定率 | 備考 | ||
| 薬価ベース | 医療費ベース | |||
| H4 | 13,573 | ▲8.1% | ▲2.4% | R幅15% |
| H6 | 13,375 | ▲6.6% | ▲2.0% | R幅13% |
| H8 | 12,869 | ▲6.8% | ▲2.6% | R幅11% |
| H9 | 11,974 | ▲4.4% | ▲1.3% | R幅10% (長期収載品8%) |
| H10 | 11,692 | ▲9.7% | ▲2.7% | R幅5% (長期収載品2%) |
| H12 | 11,287 | ▲7.0% | ▲1.6% | 調整幅2% |
| H14 | 11,191 | ▲6.3% | ▲1.3% | 調整幅2% |
| H16 | 11,993 | ▲4.2% | ▲0.9% | 調整幅2% |
|
後発医薬品の使用状況
|
出典:社会医療診療行為別調査 |
|||||||||||||||||||||||||||||||||||||||||
|
各国の後発医薬品シェア
|
| 国名 | 後発医薬品シェア(単位:%) | |
| 数量 | 金額 | |
| 日本(2003年度) | 16 | 5 |
| アメリカ(2004年) | 53 | 12 |
| ドイツ(2004年) | 41 | 23 |
| イギリス(2003年) | 55 | 24 |
| フランス(2004年) | 10 | 7 |
| (出典) | 日本:医薬工業協議会 米:Generic pharmaceutical association 英、独、仏:European generic medicines association |
<参考:欧米における事情>
|
|
我が国において後発医薬品の使用が促進されない理由
|
| (1) | 医療機関が後発医薬品を使用しない理由 |
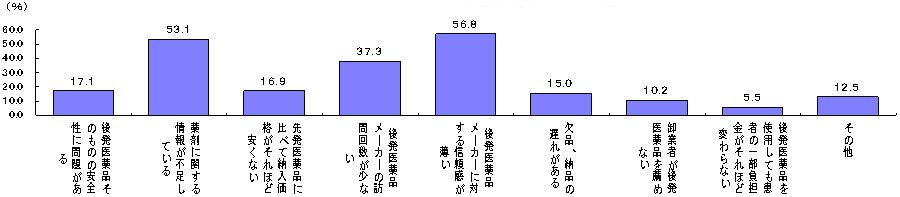
| (2) | 今後、医療機関が積極的に後発医薬品を使用する理由 |
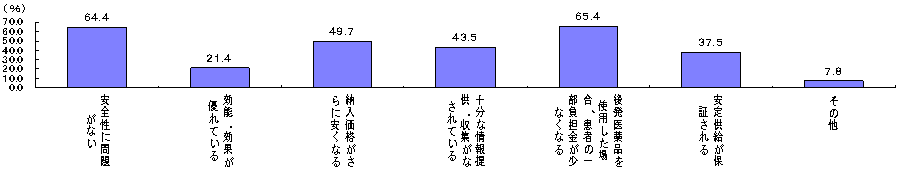
| (出典) | 厚生労働省「医薬品産業実態調査」(2000年) |
|
| これまでの後発医薬品使用促進のための取組み |
<診療報酬におけるインセンティブ>
| ○ | 後発医薬品を処方した場合、処方せん料に2点評価 |
<調剤報酬におけるインセンティブ>
| ○ | 後発医薬品を調剤した場合、調剤料に2点評価 |
| ○ | 一般名処方の場合において、後発医薬品に関する情報を文書で患者に提供し、患者の同意を得て後発医薬品を調剤した場合に情報提供料として10点評価 |
|
|
| 現行の後発医薬品上市時の薬価算定ルール |
<後発医薬品が薬価収載された場合の先発品の薬価引下げ>
最初の後発医薬品が薬価収載された後の最初の薬価改定に該当する先発医薬品(希少疾病用医薬品等を除く。)については、基本的なルールによる改定後の薬価から、さらに4〜6%引下げ。
|
|
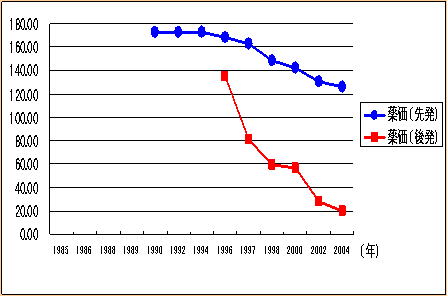
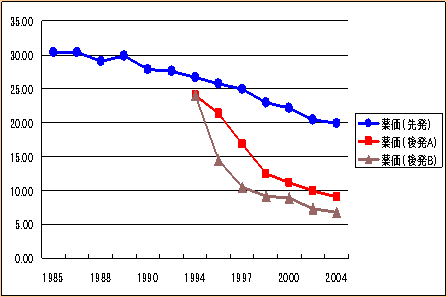
| 先発医薬品・後発医薬品の薬価の推移例 |
|
|
|
| 類似薬効比較方式による新薬の薬価算定方式 |
| ○ | 同じ効果を持つ類似薬がある場合には、市場での公正な競争を確保する観点から、新薬の1日薬価を既存類似薬の1日薬価に合わせる。 |
|
| ○ | 当該新薬について、類似薬に比し高い有用性等が認められる場合には、上記の額に補正加算(画期性加算、有用性加算及び市場性加算)を行う。 |
|
| 現行の加算ルール |
|
+ |
|
|
| 加算ルールの適用状況 |
|
|||||||||||||||||||||||||||||||||||
| (平成14年6月〜17年4月) | |||||||||||||||||||||||||||||||||||
| * | 原価計算方式及び規格間調整により算定された収載品は除く |
|