| 資料3 |
尿由来製品における変異型クロイツフェルトヤコブ病(vCJD)感染のリスクに関する文献検索と当社の尿由来製品ヒュメゴン/プレグニールにおけるリスクに関する考察
平成17年5月24日
日本オルガノン株式会社
日本オルガノン株式会社
<緒言>
平成17年4月22日付にてオランダ厚生当局はオランダにおいて最初のvCJD患者が発見されたことを報告いたしました。これに伴い,現在オランダ人尿由来の二製品を販売している弊社は直ちにこの事実を日本厚生当局に報告すると共に,当該患者がこれら製品の尿提供者であったか否かを調査いたしました。その結果,オランダ当局の調査により当該患者(平成17年5月3日に死亡)は弊社二製品の尿提供者でなかったことが確認されております1)。 更に,日本厚生当局の指示を受け,弊社において,尿由来製品のvCJDに関する感染リスクを検討する目的で文献検索並びに調査を開始いたしました。また,弊社のこれらの製品の製造工程におけるプリオンクリアランスの可能性についても検討し,vCJDに関するリスクについても考察したのでここに報告いたします。
<文献調査の概要>
1.尿中の感染性プリオンPrPscの存在について
1)感染性を有さない正常プリオン(PrPc)と病的感染性プリオン(PrPsc)はアミノ酸の一次構造上相同であるが,プロテアーゼK等の蛋白分解酵素に対する抵抗性,界面活性剤への不溶性及び感染性の有無により両者は区別される。また,PrPcのβシート型構造が全体の3%以下であるのに対し,PrPscでは40%以上と著増しており,蛋白高次構造上の変化が上記の特性の差の背景にあると考えられている2)。
2)Moudjouら3)は,PrPcは種々の細胞,例えば血液系の細胞や腎臓の細胞にも認められることを報告している。
3)Shakedら4)はTSE感染ハムスター・ウシ・ヒトにおいて,一次抗体に抗マウスプリオン抗体3F4を用いたウエスタンブロット法を用いて尿中にプロテアーゼ抵抗性プリオン(UPrPsc)を検出したこと(プロテアーゼ処理後,プリオン抗体に反応するバンドを検出したこと)を報告した。
4)更にMiyazawaら5),6)は上記Shakedらと同様の方法を用い,孤発性または家族性CJD患者の尿中にPrPscを検出したことを報告した。しかし,Miyazawaらの報告6)では,3症例の比較対照群にもPrPscが検出されたことを報告し,CJD患者特異的でないことものべている。
5)一方,上記のShakedらの報告に関しては,反論の報告が多くなされている。即ち,Furukawaら7)はShakedらが報告した尿由来PrPscのバンドとされる32kDaに認められたプロテアーゼ抵抗性のバンドを検出することができなかったこと,その代わりに,抗プリオン抗体である3F4を用いてプロテアーゼ抵抗性の37kDaの蛋白のバンドを検出したことを報告した。しかしこの蛋白は,二次抗体である抗マウスIgG抗体単独でも検出され,非特異的な反応であると考えられた。この蛋白の構造解析の結果,これが細菌の細胞外膜蛋白であることが判明し,プリオン病患者の多くが全身症状の悪化から尿路感染のハイリスク群にあり,偽陽性を呈した2例も膀胱カテーテルによる処置を受けていたことから尿路感染した細菌の一部を見ていたものと考えられる8),9)。
また,Serbanら10)もFurukawaらと同様にプロテアーゼ抵抗性の蛋白のバンドが二次抗体である抗マウスIgG抗体のみで検出されることを報告し,マススペクトルを用いた構造解析の結果このバンド中にIgG軽鎖の存在を同定し,Shakedらによって報告された尿由来PrPscのバンドが二次抗体とのIgG軽鎖等との交叉反応性に起因するものであり,PrPscに起因するものではないことを示唆した。
6)一方,Narangら11)はイオン吸着・固相抽出処理後,ウエスタンブロットを用いる簡便かつ迅速なPrPcの検出法を確立したと報告している。著者らはShakedらとは異なりプリオン蛋白のC末端を認識する抗体を用い健康人尿中にμg/LレベルのPrPcを検出したと報告している。しかし,彼らの実験でもN末端を認識する3F4抗体ではPrPcは検出されなかった。またスクレピー感染脳由来のPrPscを尿にスパイクした実験において,この測定方法により尿中に脳由来のPrPscを検出しており,本法で尿中のPrPscが検出可能である可能性を示唆しているが,患者尿中のPrPscの検出についてはまだ報告されていない。
7)更にShakedらのグループのKariv-Inbalら12)は上述のFurukawaら,Serbanらの反論に基づき再解析を行い,Serbanらと同様に二次抗体のみのウエスタンブロットにより染色される,プロテアーゼ抵抗性IgG軽鎖(いわゆるBence Jones蛋白)の存在を認め,これがCJD患者に特異的であったと報告している。また,ビオチン標識したBence Jones蛋白がプリオン病由来尿とインキュベーションすることによりプロテアーゼ抵抗性を獲得したことから,プリオン蛋白またはグリコサミノグリカン(例えばヘパラン硫酸)のような物質が核となり,これにBence Jones蛋白が凝集しプロテアーゼ抵抗性を獲得するのではないかという仮説を提唱している。しかし,健康人及びプリオン感染尿由来蛋白の構造決定において,彼らはまだプリオン蛋白を同定していないことも合わせて報告している。
(総括)
これらの文献検索の結果から,vCJDを含むプリオン病患者尿中における感染性プリオン蛋白PrPscの存在は,これまで用いられた方法(抗プリオン抗体を用いたウエスタンブロッティング,マススペクトルによるアミノ酸解析等)からは証明されていないと考えられる。しかしながら,これはPrPscが尿中に全く存在しないためか,これまでの測定方法の検出感度に起因するものかは明らかではない。
2.尿の感染性について
1)Tateishiら13)はある特定のCJD患者の尿をマウス脳内に投与することにより感染が成立したことを報告している。感染はこの患者からの尿の脳内投与おいてのみ認められ,その他の患者や感染動物尿の投与では認められなかった。しかし,その後の研究においてはこの結果を再現することに成功しておらず,研究室内における人為的なクロスコンタミネーションによるものではないかと疑問視されている14),15)。
2)上述のShakedらの報告4)では,TSE感染ハムスターの尿由来PrPscを非感染ハムスターに接種しても,接種後270日まで臨床症状の発現は認められなかったと,一方感染動物脳由来PrPscを接種した場合は接種後80日において致死的な臨床症状が発現したことを報告している。また,剖検された一匹のハムスターにおいては接種後120日にごく低濃度のPrPscを脳内に検出したことから,著者らは尿由来PrPscの接種は脳由来接種と異なり,サブクリニカルな,或いはキャリアー状態程度の感染を引き起こす可能性があるのではないかと考察している。Reichlら15)はこの結果に関し,尿由来PrPsc精製の目的でShakedらが用いた透析操作や陰イオン性界面活性剤の処理は一過性に可溶性のPrPscアイソフォームを生成させた可能性も否定できないとし,透析操作なしに生成された尿由来PrPscを用いて感染実験を追試する必要があるだろうとコメントしている。
3)これまでの疫学的な考察において尿由来製品からのプリオン病の感染リスクを示唆する証拠は認められていないと考えられる。尿由来製品特にゴナドトロピンが広く利用されてきた過去25年間に得られた疫学的証拠からは,孤発性CJDに起因するリスクは示されていない(CHMP見解書)16)。
4)Wardら17)は英国における調査において総計143名のvCJD患者のうち63名が女性であり,そのうち1名が1998年から1999年にかけて不妊治療歴を有しており,ヒュメゴン・プレグニールを含む尿由来薬剤の投与を受けていたことを報告している。しかし,この患者においてはこの不妊治療からvCJD 臨床症状発現までの潜伏期間は20ヶ月と大変短く,より強い感染性を有していると考えられる下垂体由来ヒト成長ホルモンの投与により感染したCJD の潜伏期間の4.5年と比較しても大変短いものであった。最大20ヶ月間の不妊治療による感染性はもしあったとしても大変低いものと考えられ,感染性物質の投与量と発症までの潜伏期間には逆相関の関係があることを併せ考えると,この患者において不妊治療がvCJD発症の原因であった可能性は極めて低いと著者は考察している。更に,孤発性CJDに関しては,英国での169例の女性孤発性CJD患者において,不妊治療を受けた症例あるいは尿由来ゴナドトロピン製剤を投与された症例は報告されていないことにも言及している。孤発性CJD患者は平均年齢が67歳であり,これらの患者が(妊娠時或いは閉経後)尿由来製品のドナーであった可能性は否定できないものの,尿由来製品が40年以上も広く使用されてきたことを勘案すると,vCJD或いは孤発性CJDが尿由来ゴナドトロピン製剤により感染することを強く示唆する証拠は無いと結論している。
(総括)
これらの文献検索の結果から,尿及び尿由来製品からのプリオン病の感染に関しては明確な証明がなされておらず,尿からの感染のリスクは極めて低い事が示唆されていると考えられる。
3.ヒュメゴン・プレグニールの製造工程とプリオン不活化の可能性について
以下に両製剤の製造工程について述べる。ヒト下垂体性性腺刺激ホルモン(hMG)は閉経後婦人尿,ヒト絨毛性性腺刺激ホルモンは妊婦尿を原料に,フローチャート1及び2に示す類似した方法により製造されている。
<尿提供者の選択基準>
ヒュメゴン原料尿
| (1) | 55歳以上の閉経後婦人 |
| (2) | 尿提供者は書面情報(選択した地域におけるダイレクトメール,尿提供者の友人への手紙,地方紙への広告など)によって募集されている。 |
| (3) | 尿提供を受諾する前に,新規の尿提供者は,尿収集の目的及び健康であることの重要性について,会社代理人から十分な説明を受けている。 |
| (4) | すべての尿提供者は,登録カードへの記入を求められ,クロイツフェルト-ヤコブ病に関して,尿提供者が1980年から1996年の間に英国に合計181日以上滞在したことがないかを確認する。この期間に英国に181日以上滞在していた場合,その婦人の尿は収集されない。 |
| (5) | 尿提供者は,病気あるいは服薬時には尿収集を行わないように強く要請されている。尿提供者には尿提供への対価は支払われない。このことにより,尿収集において不適切な提供者からの尿が混入するリスクを最小限に抑えている。 |
| (6) | ヒュメゴンの原料となる尿はオランダ国内で,SOPに従って収集されている。尿収集システムは監査部門により監査が行われる。 |
| (7) | 今後は脳外科手術,輸血経験者及び臓器移植者も尿提供者から除外される。 |
プレグニール原料尿
| (1) | 妊娠6〜16週の妊婦 |
| (2) | 尿提供者は書面情報(選択した地域におけるダイレクトメール,尿提供者の友人への手紙,地方紙への広告など)によって募集されている。 |
| (3) | 尿提供を受諾する前に,新規の尿提供者は,尿収集の目的および健康であることの重要性について,会社代理人から十分な説明を受けている。 |
| (4) | すべての尿提供者は,登録カードへの記入を求められ,CJDに関し,尿提供者が1980年から1996年の間に英国に合計181日以上滞在したことがないかを確認する。この期間に英国に181日以上滞在していた場合,その婦人の尿は収集されない。 |
| (5) | 尿提供者は,病気あるいは服薬時には尿収集を行わないように強く要請されている。尿提供者には尿提供への対価は支払われない。このことにより,尿収集において不適切な提供者からの尿が混入するリスクを最小限に抑えている。 |
| (6) | 本薬の原料となる尿はオランダ国内で,SOPに従って収集されている。尿収集システムは監査部門により監査が行われる。 |
| (7) | 今後は脳外科手術,輸血経験者及び臓器移植者も尿提供から除外される。 |
<製造工程のプリオンクリアランス>
ヒュメゴン及びプレグールの原薬製造工程は,フローチャート1及び2に示したように,カラム吸着,限外濾過による濃縮や無機塩との共沈などの多段階の工程からなる。
プリオン蛋白或いは組織結合PrPscの除去に関しては,古典的なCohn分画を行う間に血漿からプリオン蛋白は共沈することが報告されている18),19)。特に,38%エタノール濃度に調整し,沈殿した蛋白を遠心分離で除くことにより,3 log以上のクリアランスがあることが示されている。このクリアランスは,プリオンの性質に依存せず,膜結合型及び遊離PrPscともに同じ挙動を示し20),エタノール濃度上昇に伴い,更に共沈量が増加する傾向が認められる。
ヒュメゴン及びプレグールの原薬製造工程中においては,上記の工程と類似したものとして無機塩との沈殿工程が存在する。製造中溶液のエタノール濃度を調整し,無機塩を沈殿させる。これにより溶液中に存在するほとんどのプリオン蛋白は無機塩と共沈する。生成した沈殿は遠心分離後,上清を濾過し除去される。無機塩との沈殿及びそれに続く濾過工程は,2回繰り返す。上記文献から,この無機塩との沈殿工程のクリアランスは,4 logが期待できる。
ヒュメゴン及びプレグールの原薬製造工程には,プリオンクリアランスに有効と考えられる工程が少なくとも2工程含まれており,理論的には 8 logのトータルクリアランスが期待される。尚,現在スパイク実験によるプリオンクリアランス試験を実施中であり,結果が判明次第日本厚生当局に報告の予定である。
<プール尿での希釈>
原薬製造には,膨大な人数の提供者から尿を収集するため,万一感染者の尿が混入したとしても,尿をプールした段階で大幅に希釈され,その感染のリスクは更に大きく低下すると推察される。
フローチャート1
ヒト下垂体性性腺刺激ホルモン( human Menopausal Gonadotrophin)の製造法
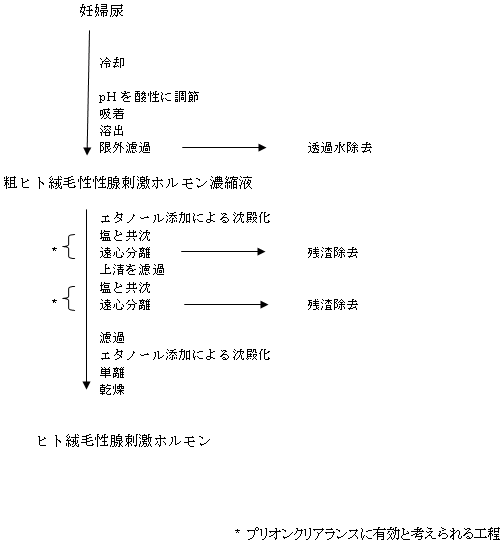

フローチャート2
ヒト絨毛性性腺刺激ホルモン( human Chorionic Gonadotrophin)の製造法


4.他国の規制状況
| 4 | −1 弊社二製品に対する規制
1)オランダ厚生当局の状況 本件に関し,オランダ厚生当局はこれら製剤の使用については何の規制も必要が無いこととしており,それを保証する当局からの公的文書1)を弊社は入手している。 2)英国当局の状況 英国当局は欧米で唯一尿由来製品の規制21)を行い,vCJDが1例以上発生した国由来の尿の使用を禁止している。しかし,本件についても日本と同様に当局に報告した。現在までのところ,本件に対して英国当局からの特別の規制・措置の通知は受けていない。 3)その他の国の状況 その他の国についてもCHMPの見解書に従い判断がなされ,本件に関し特段の措置を必要としている国はこれまでのところ無い。 |
4−2 ヒト尿由来製品全般に関する各国の規制
欧米及びオセアニア主要各国厚生当局における尿由来製品の規制状況に関する弊社の検索結果を以下に示す。上述のように英国以外において尿由来製品に関する規制を実施している国は見当らなかった。
| 国名 | 規制内容 | ||
| 英国 | UK’s Committee on the Safety of Medicines (CSM), 14 March 2003 Sourcing of Plasma and Urinary Derived Medicinal Products
|
||
| フランス | afssaps, Feb. 2004, Analysis of the Risk of Transmission of the Variant Ctreutzfeldt-Jakob Disease by Medicinal Products of Human Origin and Labile Blood Products.
|
||
| ドイツ |
|
||
| イタリア |
|
||
| オランダ |
|
||
| 欧州委員会 | Official Journal of the European Union (2004/C 24/03)
Note for guidance on minimizing the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products (EMEA/410/01 Rev. 2 - October 2003) adopted by the Committee for Proprietary Medicinal Products (CPMP) and by the Committee for Veterinary Medicinal products (CVMP)
|
||
| 欧州医薬品庁 | CHMP Position Statement on Creutfeldt-Jakob Disease and Plasma-Derived and Urine-Derived Medicinal Products, 23 June 2004
|
||
| FDA | Guidance for Industry Revised Preventive Measures to Reduce the Possible Risk of Transmission of Creutzfeldt-Jakob Disease (CJD) and Variant Creutzfeldt-Jakob Disease (vCJD) by Blood and Blood Products, January 2002
|
||
| カナダ |
|
||
| オーストラリア | Supplementary Requirements for Therapeutic Goods for Minimizing the Risk of Transmitting Transmissible Spongiform Encephalopathies (TSEs), December 2004
|
||
| ニュージーランド |
|
<結論>
以上のような文献検索及び弊社尿由来製品の製造工程に関する考察の結果から,尿からのvCJD感染のリスクは極めて低いこと,更に弊社の尿由来製剤であるヒュメゴン・プレグニールの感染リスクは更に低く,ほぼ無視し得る程度であろう事が示唆されると考えられました。
以上を勘案し,弊社といたしましては,今後の対応について以下のように考えております。
1)ヒュメゴンについてはより安全な遺伝子組み換え型FSH製剤であるフォリスチム注への一刻も早い切り替えを行います(本年6月に排卵誘発の効能に関し申請予定)。
2)プレグニールについては安全国であるブラジル尿由来製品への一刻も早い切り替えを行います。
3)また,上述のような考察から,上記の切り替えが完了するまでの間,これら両製剤が市場に流通したとしても,vCJDのリスクを増加させるものではないと考えております。
今回の文献検索の結果は,上記について特に3)に関し,科学的なリスク分析の観点から,その妥当性を指示するものであると考えております。加えて,本邦における弊社製品の高い市場占有率(ヒュメゴンで約35%)を勘案すると,市場での無用の混乱を避ける意味でもこのような対応は妥当なものであろうと考えております。
<引用文献>
1)2005年5月10日付オランダ厚生当局よりの陳述書
2)金子清俊. Creutzfeldt-Jakob病(CJD), 変異型CJD(variantCJD:vCJD)−BSE関連を含めて:日本臨床, 61(Suppl3), 9-16(2003)
3)Moudjou,M., Frobert, Y., Grassi, J. and La Bonnadiere, C: Cellular prion protein status in sheep: tissue-specific biochemical signatures. J. Gen. Virol., 82, 2017-2024(2001)
4)Shaked, G.M.., Shaked, Y., Kariv-Inbal, Z., Halimi, M., Avraham, I. and Gabizon, R.: A protease resistant prion protein isoform is present in urine of animals and humans affected with prion diseases. J. Biol. Chem., 276, 31479-31482 (2001)
5)Miyazawa, K., Shiga, Y., Matsuzaki, M., Takeda, A., and Itoyama, Y.: The detection of a Protease-Resistant Prion Protein Isoform in Urine of Creutzfeldt-Jakob Diseases: Annals of Neurology S54(Suppl 1) 2002
6)Shiga, Y., Miyazawa, K.., Takeda, A., Arai, H., Dohura, K. and Itoyama, Y.: Laboratory and Imaging studies for the diagnosis of prion disease. Clinical Neurology (Japan) 43(11), 810-812, 2003
7)Furukawa, H., Dohura, K., Okuwaki, R., Shirabe, S., Yamamoto, K., Udono, H., Ito, T. Katamine, S. and Niwa, M.: A Pitfall in Diagnosis of Human Prion Diseases Using detection of Protease-Resistant Prion Protein in Urine. J. Biol. Chem. 279(22), 23661-23667, 2004
8)袖山信幸,水澤英洋. プリオン病:最近の進歩:日本内科学雑誌,93(10),169-176,2004
9)古川ひさ子他. プリオン病及び遅発性ウイルス感染に関する調査研究 尿中プリオン蛋白検出によるプリオン病診断の問題点:プリオン厚生労働科学研究補助金 難治性疾患克服研究事業 プリオン及び遅発性ウイルス感染に関する調査研究班 平成15年度研究報告書,58-66(2004)
10)Serban, A., Legname, G., Hansen, K., Kovaleva, N., and Prushner S.B.: Immunoglobulins in urine of hamsters with scrapie. J. Biol. Chem., 279, 48817-48820(2004)
11)Narang, H.K., Dagdanova, A., Xie, Z., Yang Q. and Chen, S.G.: Sensitive Detection of Prion Protein in Human Urine. Experimental Biology and Medicine, 230(5) 343-349(2005)
12)Kariv-Inbal, Z., Halimini, M., Dayan, Y., Engelstein R., and Gabizon, R.: Characterization of light chain immunoglobulin in urine form animals and humans infected with prion diseases. Journal of Neuroimmunology, 162, 12-18(2005)
13)Tateishi, J.: Transmission of Creutzfeldt-Jakob disease from human blood and urine into mice. Lancet, ii, 1074(1985)
14)Baron, H.: In Prushner S.B.(ed). Prion Biology and Disease. Cols Spring Harbor Lab Press, USA, Chapter 17(1999)
15)Reichl, H., Balen, A., and Jansen, C.A.:Prion transmission in blood and urine:what are the implications for recombinant and urinary-derived gonadotrophines? Human Reprodusction, 17(10), 2501-2508(2992)
16)CHMP Position Statement on Creutzfeldt-Jakob Disease and Plasma-Derived and Urine-Derived Medicinal Products, June 23(2004)
17)Ward, H.J.T., Balen, A. and Will, R.G.: Creutzfeldt-Jackob disease and urinary gonadotrophine. Human Reprodunstion, 19(5), 1236-1237(2004)
18)Foster, P.R. et al: Studies on the removal of abnormal prion protein by processes used in the manufacture of human plasma products. Vox. Sacng, 78(2), 86-95(2000)
19)Cai, K. et al.: Solvent-dependent precipitation of prion protein. Biochem. Biophys. Acra, 1597, 28-35(2002)
20)Vey, M. et al.: Purity of spiking agent affects partition of prion in plasma protein purification. Biologicals, 30, 187-196(2002)
21) Sourcing of Plasma and Urinary Derived Medicinal Products. CSM, March 14(2003)