| 資料4 |
一般用医薬品の相対的リスクの評価方法(案)
|
【リスク評価の指標及びその区分】
| (1) | 「B 相互作用」
| ||||||
| (2) | 「C 重篤な副作用のおそれ」
| ||||||
| (3) | 「E 患者背景(既往歴、治療状況等)(重篤な副作用につながるおそれ)」
| ||||||
| (4) | 「F 効能・効果(症状の悪化につながるおそれ)」
| ||||||
| (5) | 「G 使用方法(誤使用のおそれ)」
| ||||||
| (6) | 「H スイッチ化等に伴う使用環境の変化」
|
【リスクの評価】
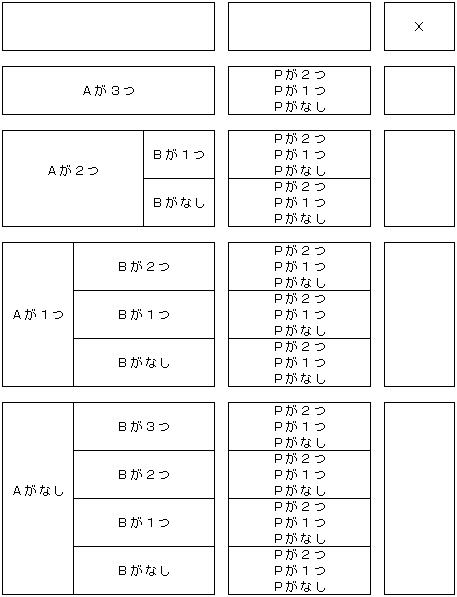
| ○ | (1)〜(3)の組み合わせにおいて、Aの数を優先し、次にBの数に基づき分類。 |
| ○ | 上記組み合わせに基づく分類ごとに、Pの数に基づき分類。 |
| ○ | (6)Xが付いた場合、他項目の評価にかかわらず上位に分類。 |
|
【リスク評価の指標及びその区分】
| (1) | 「B 相互作用」
| ||||
| (2) | 「C 重篤な副作用のおそれ」
| ||||
| (3) | 「E 患者背景(既往歴、治療状況等)(重篤な副作用につながるおそれ)」
| ||||
| (4) | 「F 効能・効果(症状の悪化につながるおそれ)」
| ||||
| (5) | 「G 使用方法(誤使用のおそれ)」
| ||||
| (6) | 「H スイッチ化等に伴う使用環境の変化」
|
【リスクの評価】
| ○ | (1)〜(3)の組み合わせにおいて、Aの数を優先し、次にBの数に基づき分類。 |
| ○ | 上記組み合わせに基づく分類ごとに、Pの数に基づき分類。 |
| ○ | (6)Xが付いた場合、他項目の評価にかかわらず上位にランク。 |
|
【リスク評価の指標及びその区分】
| (1) | 「B 相互作用」
| ||||
| (2) | 「C 重篤な副作用のおそれ」
| ||||
| (3) | 「E 患者背景(既往歴、治療状況等)(重篤な副作用につながるおそれ)」
| ||||
| (4) | 「F 効能・効果(症状の悪化につながるおそれ)」
| ||||
| (5) | 「G 使用方法(誤使用のおそれ)」
| ||||
| (6) | 「H スイッチ化等に伴う使用環境の変化」
|
【リスクの評価】
| ○ | (1)〜(3)の組み合わせにおいて、Aの数を優先し、次にBの数に基づき分類。 |
| ○ | 上記組み合わせに基づく分類ごとに、Pの数に基づき分類。 |
| ○ | (6)Xが付いた場合、他項目の評価にかかわらず上位にランク。 |
|
【リスク評価の指標及びその区分】
| (1) | 「B 相互作用」
| ||||||||
| (2) | 「C 重篤な副作用のおそれ」
| ||||||||
| (3) | 「E 患者背景(既往歴、治療状況等)(重篤な副作用につながるおそれ)」
| ||||||||
| (4) | 「F 効能・効果(症状の悪化につながるおそれ)」
| ||||||||
| (5) | 「G 使用方法(誤使用のおそれ)」
| ||||||||
| (6) | 「H スイッチ化等に伴う使用環境の変化」
|
【リスクの評価】
| ○ | (1)〜(3)の組み合わせにおいて、Aの数を優先し、次にBの数に基づき分類。 |
| ○ | 上記組み合わせに基づく分類ごとに、Pの数に基づき分類。 |
| ○ | (6)Xが付いた場合、他項目の評価にかかわらず上位にランク。 |
リスク評価(分類)のイメージ[方法(1)の場合]