| 社保審―医療保険部会 | 資料3-(2) |
| 第12回 (H17.1.26) |
| いわゆる「混合診療」問題について |
平成16年12月15日
厚生労働省
| いわゆる「混合診療」問題についての基本的考え方 |
|
| 「なぜ、いわゆる『混合診療』の解禁が主張されるのか。」 | |
| 現行制度では、患者の切実な要望に的確に対応し切れていない。 | |
患者の立場から個別に見れば、保険外の負担が過大な事例あり。
|
| 1 国内未承認薬の使用 |
| 「国内で承認されるまでに時間がかかり、 欧米で承認されているのに、 全額自己負担でないと使えない。」 |
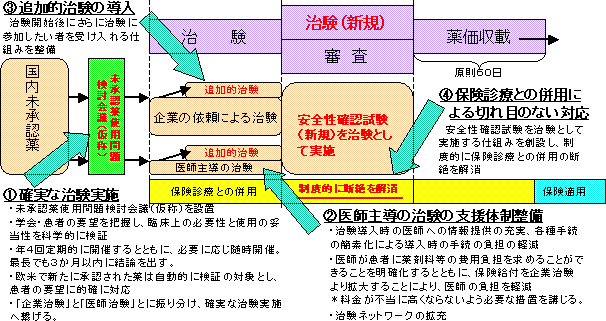
確実な治験実施に繋げ、制度的に 切れ目なく保険診療との併用が 可能な体制を確立 |
| 2 医療技術 |
「高度先進医療として認められるまでに時間がかかる。高度先進医療以外の技術については、保険導入のための手続がよく分からない。」
| 必ずしも高度でない先進技術について、保険導入の前段階として、保険診療との併用を認めるとともに、高度先進医療も含め、保険導入手続を透明化・迅速化 |
| * | 各技術の有効性・安全性、効率性等を確認の上、併用を認める。 |
| * | 厚生労働大臣の設置に係る専門家会議による検討を踏まえ、厚生労働大臣が医療技術ごとに医療機関に求められる一定の水準の要件を設定し、該当する医療機関は届出により実施可能な仕組みを新たに設ける。 |

| 「一定水準以上の医療機関に包括的に混合診療を解禁すべき」との意見について |
|
|
||||||||||
|
|
||||||||||
|
医療技術ごとに医療機関の水準を設定して、約100技術、約2,000医療機関に拡大可能 実質的に「一定水準以上」の医療機関への拡大に対応できる上に、技術によってはむしろより広い範囲の医療機関で実施可能 |
||||||||||
|
|
||||||||||
| 事前確認を経ない場合には、安全性に関し、重大な問題を引き起こすおそれあり。事後検証方式は無理 また、例えば大学病院であれば、本来、研究費で行うべき先端的・学術的診療も、大学病院自らの判断により、保険料財源からの支出を受けながら行うことが可能となってしまう。 |
例えば大学病院であれば、大半の医療技術について、一定水準の要件を満たす。 (いわば、有効性・安全性を確保した上での無理のない解禁」) |
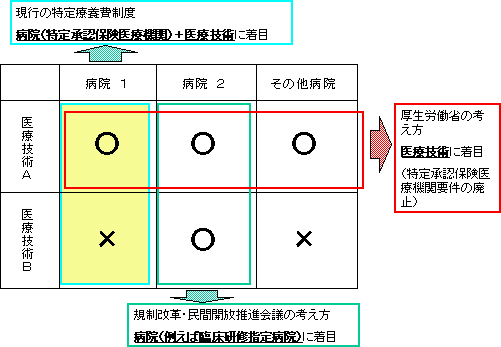
| 「医療技術を個別承認する仕組みは、医療技術の進歩に遅れ、かつ不透明」との意見について |
|
| 3 制限回数を超える医療行為 |
| 「もう1回検査等をしてほしいが、全額自己負担でないと、制限回数以上は受けられない。」(具体例: 腫瘍マーカー検査、追加的リハビリテーション) |
| 適切なルールの下に、保険診療との併用を認める。ただし、医学的な根拠が明確なものについては、保険導入を検討する。 |
例) 腫瘍マーカー検査は、月1回に限り算定できる。
《現行》
|
《見直し後》
|
|
| 4 規制改革・民間開放推進会議の主張する具体例に対する対応状況 |
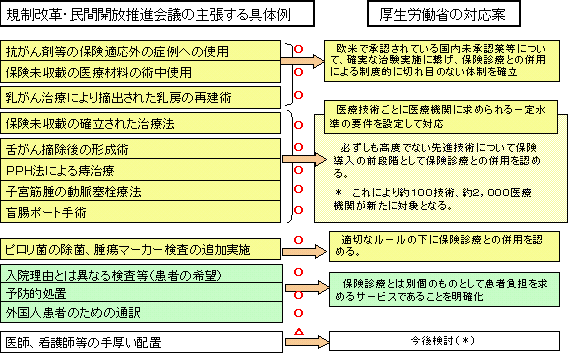
| * | 患者が保険外負担として多額の差額を求められていた付添看護の廃止(平成6年実施、平成9年完全実施)前の状況に戻ることが危惧されることから、慎重な検討が必要 |
| II 改革の手順 |
| ○ | 提起されている具体的事例については、まず現行制度の枠組みの中で対応 |
| ○ | さらに、現行制度について、将来的な保険導入を前提としているものであるかどうかといった観点から、名称も含め、法制度上の整備を行う。 |
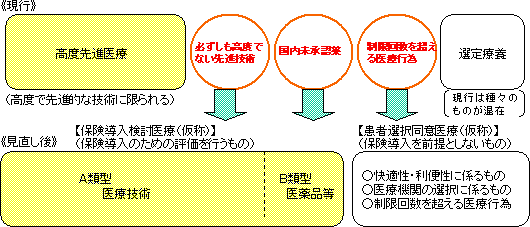
| 改革の考え方 |
| ○ | 「将来的な保険導入のための評価を行うものであるかどうか」の観点から現行制度を抜本的に見直し、「特定療養費制度」を廃止し、「保険導入検討医療(仮称)」と「患者選択同意医療(仮称)」とに新たな枠組みとして再構成する。 |
| ○ | このような改革により、より分かりやすい制度となるとともに、保険診療と保険外診療との併用に関する具体的要望については、今後新たに生じるものについても、おおむねすべてに対応することができる。 |
|