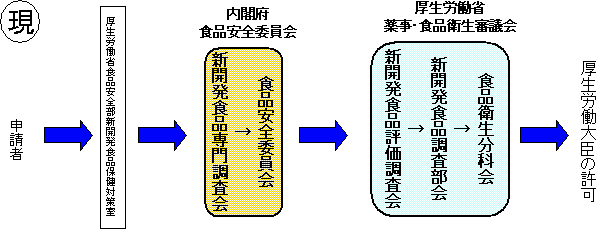
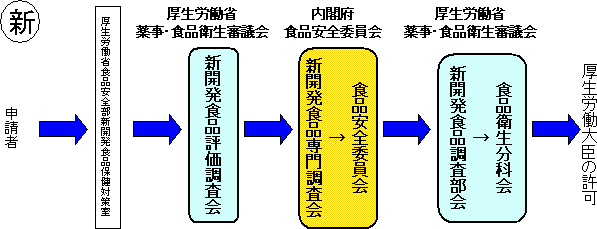
【規格基準型特定保健用食品】現行の特保において許可されている食品の中で、許可実績が十分である等科学的根拠が蓄積されているもののうち、薬事・食品衛生審議会・食品安全委員会において個別審査を行わなくても許可できるものについて、規格基準を定め、事務局において適合するか否かの審査を行うこととする。
【疾病リスク低減表示】特保の許可表示の一つとして、関与成分と疾病リスク低減効果の関係が医学的・栄養学的に確立されていることが示された場合、疾病リスク低減表示を認めることとする。 |
<規格基準型特保について>
○既許可の特保のうち、以下のスクリーニング基準を満たすものについて、順次研究班で規格基準の作成を検討していくこととする。※疾病リスク低減表示は対象外。
| (1)保健の用途の許可数が合計100件を超えている、(2)関与成分の最初の許可から6年を経過している
(3)複数の企業が当該保健の用途を持つ当該関与成分について許可を取得している |
○今回、(1)〜(3)を満たし、研究班において現在、規格基準の作成を検討している関与成分は、「おなかの調子を整える」等の表示をする以下の10成分である。
|
┌
│
│
└ |
難消化性デキストリン・ポリデキストロース・小麦ふすま・グァーガム分解物・大豆オリゴ糖・フラクトオリゴ糖・乳果オリゴ糖・ガラクトオリゴ糖・キシロオリゴ糖・イソマルトオリゴ糖 |
┐
│
│
┘ |
<疾病リスク低減表示について>
○現時点において科学的根拠が確立されており、特保の許可対象として認める必要性があると考えられるものは、提言で指摘されている「カルシウムと骨粗鬆症」・「葉酸と神経管閉鎖障害」の2つである。
○カルシウムが疾病リスク低減効果を発現する目安量を300〜700mgとする。
(下限値=(食事摂取基準の目安量)−(同平均摂取量)、上限値=医薬品の目安量上限値)
○葉酸が疾病リスク低減効果を発現する目安量を400〜1000μgとする。
(下限値=食事摂取基準において摂取が望まれるとされている量、上限値=同上限量)
| ※ | 規格基準型、カルシウム及び葉酸に係る疾病リスク低減表示については、いずれも、ヒト摂取試験、国立健康・栄養研究所等による許可試験等については従来通り。 |
|