| 資料F−2 |
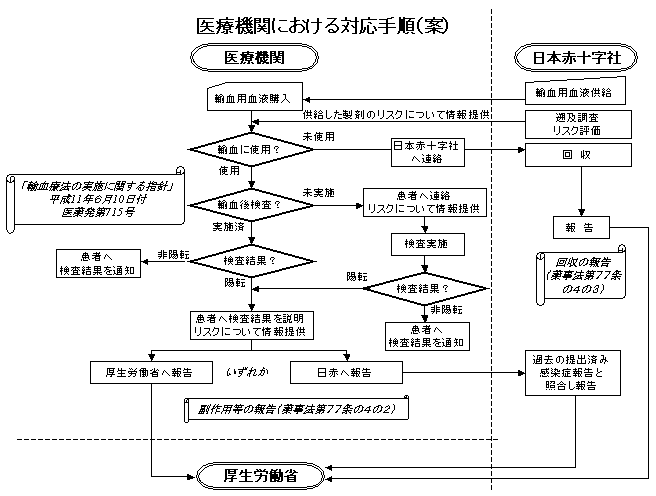
| ○ | 医療機関における対応手順(案) |
| ○ | 遡及調査における輸血用血液製剤のリスク評価法(案) |
| (参考) 血液製剤の使用指針及び輸血療法の実施に関する指針について(抄) (平成11年6月10日付け医薬発第715号) 薬事法(昭和35年法律第145号)(抄)(現行規定) 生物由来製品による感染症被害救済制度の創設 |
|
| リスク:高 「感染のリスクが高い輸血用血液製剤」 遡及調査の結果、個別NAT検査で陽性となった血液から製造された 輸血用血液製剤。 |
| リスク:中 「感染のリスクがある輸血用血液製剤」 遡及調査の結果、ウインドウ期間内であることがほぼ確実な血液から 製造された輸血用血液製剤。 |
| リスク:低 「感染のリスクが否定できない輸血用血液製剤」 遡及調査の対象となった血液から製造された輸血用血液製剤のうち、 「リスク:高」及び「リスク:中」以外のもの。 |
| 1.基本的考え方 |
| ○ | ヒトの細胞組織等に由来する医薬品・医療機器等(生物由来製品)については、感染因子を伝播するおそれがあることから、先の薬事法改正において、その特質に応じた安全性確保のための措置を講じたところである。これを受け、生物由来製品を通じた健康被害の発生の防止について、今後とも努力していくものである。 |
| ○ | しかしながら生物由来製品については、最新の科学的知見に基づく安全対策を講じたとしても、感染症を伝播するおそれは完全には否定できない。 |
| ○ | このため、本年3月29日に取りまとめられた「ヒト細胞組織等に由来する医薬品等による健康被害の救済問題に関する研究会」の報告書を踏まえ、今後生じ得る生物由来製品による感染等の健康被害について救済制度を創設する。 |
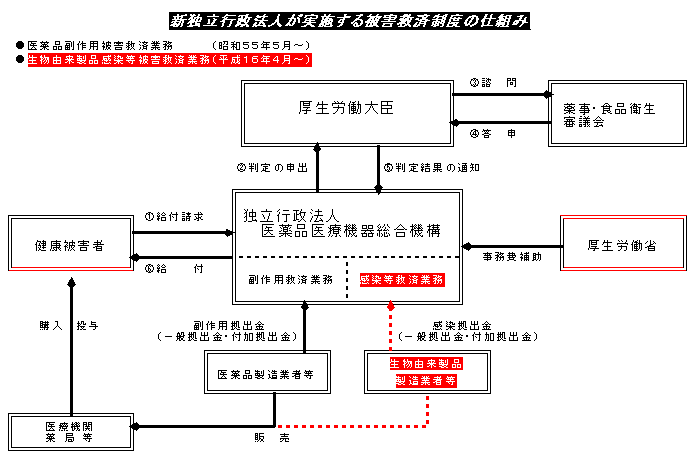
| 2.感染被害救済制度の概要 |
| (1)実施主体 |
| (2)概要 |
| (1) | 生物由来製品を介した感染による疾病、障害又は死亡について、医薬品副作用被害救済制度に準じて、医療費、医療手当、障害年金、障害児養育年金、遺族年金、遺族一時金及び葬祭料の給付を行う。 |
| (2) | 独立行政法人がこれらの給付を行うに当たっては、医学的薬学的事項について厚生労働大臣に判定を申し出るものとし、厚生労働大臣は、薬事・食品衛生審議会の意見を聴いて判定を行う。 |
| (3) | 生物由来製品の製造業者及び輸入販売業者は、本制度に要する経費に充てるため、独立行政法人に拠出金を納付する。 |
| 3.スケジュール |
| (1) | 新独立行政法人の業務の1つとして規定。 |
| (2) | 独立行政法人の設立にあわせ拠出金の徴収及び救済開始。(平成16年4月予定) |
| (3) | 平成16年4月以降に使用された生物由来製品について適用。 |