新しい血液法の概要
薬事法及び採血及び供血あつせん業取締法
の一部を改正する法律のポイント
【 薬事制度の見直し 】
【背景及び必要性】| ○ | 薬事法は、医薬品・医療機器等の品質、有効性及び安全性確保の観点から、企業が行う製造・販売等に関して必要な規制を行う法律。 |
| ○ | 国際的な整合性や、科学技術の進展、企業行動の多様化等、社会経済情勢の変化を踏まえ、逐次適切な見直しが必要。 |
| ○ | 前回改正(医療機器:平成6年、医薬品:平成8年)から5〜7年が経過しており、見直しの時期。 |
|
【 新たな血液事業に係る法的枠組みの制定 】
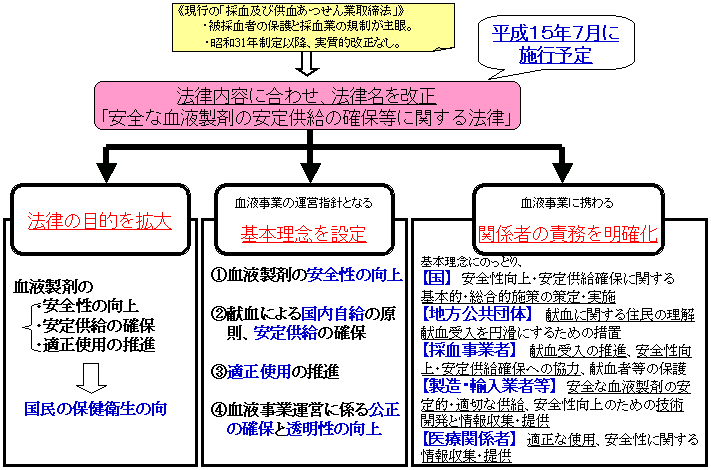
【背景及び必要性】| ○ | 血液製剤について、安定的供給を確保するとともに、一層の安全性向上を図るため、「採血及び供血あつせん業取締法」の見直しが必要。 |
|
薬事法及び採血及び供血あつせん業取締法の一部を改正する法律の概要
(各論)
| I 医療機器に係る安全対策の抜本的な見直し |
| 1 | 医療機器のリスクに応じたクラス分類制度の導入
|
|||||||||||
| 2 | 低リスクの医療機器に係る第三者認証制度の導入
|
|||||||||||
| 3 | 高リスク医療機器等の販売業・賃貸業への許可制の導入
|
|||||||||||
| 4 | その他
|
| II 「バイオ・ゲノムの世紀」に対応した安全確保対策の充実 |
| 1 | 生物由来製品の定義と感染リスクに応じた分類
|
||||||
| 2 | 生物由来製品・特定生物由来製品の特性を踏まえた安全確保措置
|
| III 市販後安全対策の充実と、承認・許可制度の見直し |
| 1 | 元売行為と市販後安全対策に着目した許可体系の構築
|
||||||
| 2 | 元売承認制度の導入等承認制度の見直し
|
| IV その他の見直し事項 |
|
| V 採血及び供血あつせん業取締法の見直し |
| 1 | 見直しに当たっての問題意識
|
||||||||||
| 2 | 新しい枠組みの考え方
|
| VI 施行期日 |
| 【薬事法】 | 公布日から3年以内(II、IV(1)(薬物に係るもの)、IV(3)は、公布日から1年以内)。 |
| 【血液法】 | 公布日から1年以内。 等 |
血液事業に関する新たな法的枠組みの骨格等について
|
┐ | | | | | | | | | | | | | | | | | | ┘ |
献血及び血液製剤に固有の部門として位置づけられる部分
|
||||||||||||||||||||
|
┐ | | | | | | | | | | | ┘ |
生物由来製品に共通の課題として位置づけられる部分 → 薬事法を改正 |
||||||||||||||||||||
(参考)
|
┐ | | | ┘ |
医薬関係の新独立行政法人において、今後生じ得る生物由来製品を介した感染被害に関し、救済制度を実施するため、「独立行政法人医薬品医療機器総合機構法」を制定。 | ||||||||||||||||||||
新しい血液法の概要

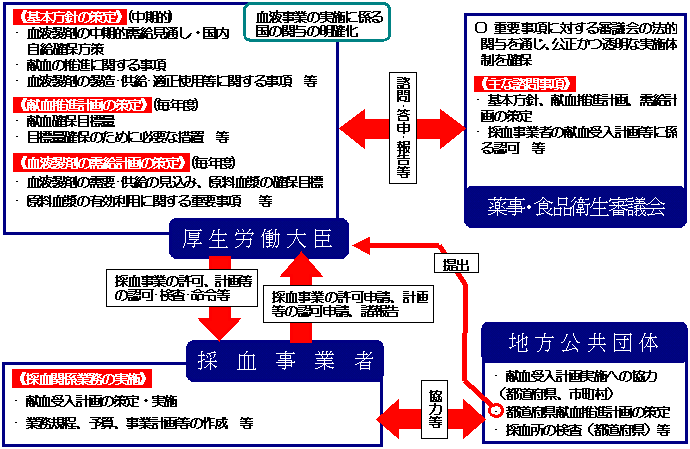
血液事業の実施フローと国の関与等について