「指針」作成をめぐっての所感
岐阜大学医学部公衆衛生学講座 清水 弘之
1.はじめに
「疫学的手法を用いた研究等における生命倫理問題及び個人情報保護の在り方に関する調査研究班」(略称丸山班)では、平成12年度に「疫学の研究等における生命倫理問題及び個人情報保護の在り方に関する指針(案)」を作成した。私は、その一員(研究協力者)として参加したが、基本的な知識が不足したまま、疫学研究を実際に行う現場の一研究者の立場から、1年にわたり、法律・倫理関係のメンバーに質問をしながら注文をつけただけというのが実状である。
年度の終わりに当たり、研究報告とはほど遠いが、2、3の所感を述べ、責めを塞ぎたい。
2.指針の対象範囲
班の名称の一部である「疫学的手法を用いた研究」の定義が曖昧であった。当初、班内では、その定義をめぐっていくつかの議論があったが、臨床研究の多くは疫学的手法を用いており、「疫学的手法を用いた研究」といえばかなりの医学・医療研究が含まれるのではないかとの見方が強かったと思っている。しかし、結局疫学あるいは疫学的手法に対する班員の認識が若干ずれたまま議論が進行した、というのが私の印象である。
そして、年度の途中で、指針の対象が当初の計画から大幅にずれ、厚生省ならびに上位の委員会である「疫学的手法を用いた研究等における個人情報保護等の在り方に関する専門部会」の指示で、疫学研究(疾病登録事業等を含む)に限定されることとなった。むしろ人を対象とした医学研究(この定義も明確とは言えないが、疫学の定義に比べれば指針を読む者の理解は一致しやすいと思っている)とするなどとして、現在の医学・医療の研究分野が直面している倫理・個人情報の扱いに関する指針を提示すべき絶好の機会であったが、問題を先送りにした感が極めて強い。
臨床研究はもちろん、実験室での研究においても人由来の試料を対象とすることは極めて多く、また患者は医師を前にして対等な立場を維持しにくい現実を考えると、むしろ指針作成を急ぐべきはこれらの領域に対してではないかと思った。疫学研究が1回に扱う対象者数は臨床研究や実験室での研究の対象者数より多いのが普通であるが、わが国の医学研究の中に占める疫学研究の数は極めて少なく、また地位も低い。なぜここで疫学研究のみを指針に従わせようとするのか、その基本方針が最後まで理解できなかった。
3.個人情報保護と自己決定権
わが国の過去の疫学研究が常に研究対象者の自己決定権を尊重し、インフォームドコンセントを得てきたかと言えば、残念ながら肯定はできない。ここ数年は倫理審査委員会で研究デザインの承認を受け、対象者からインフォームドコンセントを得ている疫学研究が増えてはいるが、全疫学研究のどの程度の割合かは不明である。
疫学研究の倫理・個人情報保護の指針が出されると、全国の疫学者はそれに従おうとするにちがいない。あくまで推測であるが、これまでの疫学研究者の言動をみると、研究対象者の多くが健康な一般人であることから、対象者本人または代表者・代理を通して一定の手続きを踏み、またそれなりの敬意が払われてきていたと思われる。またそうでなければ、対象者からの協力が得られなかった。一部、対象者と顔を合わせないまま本人には無断で書類上のデータなどを利用することが行われてきたが、その利用に際しての倫理的・法的手続の方法を示せば、これまで倫理面への配慮が不足していたことに気付き、今後は指針に従った研究が行われるようになると予想される。
ただし、実際に疫学研究を行う者として、今回まとまった指針(案)でいまだに釈然としない部分がある。それが丸山班会議の議論の中心であったと思うので、現場の疫学者の声として以下に私見を記す。
1)個人情報の扱いに関する自己決定権
患者(健康者、あるいは研究対象者および対象候補者を含む)が自分の情報をどう扱われるかを自分で決めることができるという基本的な権利(情報自己決定権)が医学研究の自由という基本的な権利より優位にあるということは感覚的に理解できた。憲法(法律)上も、患者本人の承諾あるいは法律による明確な規定がない限り患者の情報を研究に用いてはならない、と規定されていると解釈した。この場合、患者の個人情報漏洩の問題とは別に扱われる。すなわち、知り得た患者の情報を外へ漏らすことが一切なくても(統計処理をした結果を図表の形で発表する場合などは外へ漏らしたと考えないものとする)、研究の対象とすることを禁ずるというわけである。もちろん、患者情報を知っている研究者が頭の中で(時にはコンピューターなどを使って)それらを整理・統合してある仮説を組み立てるということも起こり得るが、それは一定の計画に従った作業ではないので、研究とは呼ばないことにする。すなわち、この作業は自由に行ってよいことになる。(ただし、この仮説設定こそが研究に値し、仮説に基づいてデータを揃えるのは作業に過ぎないという見方のあることは十分認識している。)
患者の情報自己決定権が医学研究の自由より優位にあるとしても、公益性の優越との関係は別に論ずる必要があろう。個人は、集団の中で生活し、情報に依存して生きている。よって個人の情報は一部社会のものとして扱われて然るべきではないかと、私は思う。例えば、ある種の感染症と思われる疾患(研究結果が出るまでは感染症かどうかは不明である、よってその疾患の扱いに関する法律は制定されていないとする)の蔓延を防ぐために、某集団(例えば国家)が対策を立てようとして、国家公務員である某研究者に依頼(場合によっては命令)したとする。その研究者はその学問がしたいという自由意志というより、社会防衛のための国の要請に従って研究を行うわけであるが、患者の個人情報が外部には漏れず、また研究に必要な個人情報が既に収集されていて(カルテ情報など)患者に再び接触する必要がないとしても、必ず患者個人のインフォームドコンセントを得なければならないのか、というのが私の疑問である。
2)インフォームドコンセントについて
前述のような例に遭遇すると、指針にはインフォームドコンセントを得ることが不可能な場合にいくつかの緩和要件を設けてあるから柔軟な対応ができるというのが班のメンバーの大方の見解であったように思う。しかし、小心な疫学者はインフォームドコンセントを得ることが不可能な場合(緩和がなければ、実際上、研究が実施し得ない)というのを真正面から受け止め、困難ではあるが時間と費用をかければ不可能ではないと考えてしまう恐れがある。その辺を臨機応変に対処する(実際上という言葉の解釈を広くとる)との考えが社会の一般常識かもしれないが、それなら指針など不要となるわけで、近い将来この指針が政府から示されたときに現場でどう対応しようかと、迷いが残っている。
合わせて、インフォームドコンセントの成立要件がいまだに納得できずにいる。現実問題として、疫学研究を実施する際には、研究対象候補者に対し、口頭ならびに書面で研究の目的、方法、予測される危険性などについて説明はするが、どの程度納得してもらったかの確認は行っていない。専門家以外の者が研究の内容を正しく理解するのは至難であり(例えば、DNAを扱う研究の場合、DNAの意味を正しく理解できる対象者が多いとは思えない)、どの程度の理解が得られれば可とするのか指針を示してもらいたいと、現場の一研究者は思っている。
4.がん登録事業
前項で述べた感染症を疑う疾患に対する社会防衛的な意味合いは強くないが、わが国の死亡原因の第一位を占めるがんについての登録事業は社会的に大きな意味を持つ。しかし、がん登録も普通の疫学研究と同じに扱われて、この指針の対象にされることとなった。倫理審査委員会での承認をもってインフォームドコンセントが免除され得ると解釈でき、がん登録事業は実施可能であるとの見方が班の大勢を占めた。しかし、指針からは報告元の全医療機関で倫理審査委員会の承認を得なければならないとも解釈でき、報告(登録)を積極的に拒否する施設が出てくる可能性がある。
事業は事業として、情報の収集・管理方法に対して一定の要件を満たさなければ実施を許さず、逆に条件を満たしたなら法律の保護のもとに登録事業を推進するという方向の可否について、議論を展開すべきであると思い続けた。しかし、丸山班の使命はそこにないという理由で、がん登録の今後のあり方についての議論がほとんどなされなかったのは残念であった。保健医療関係者からの声の高まりと政府によるがん登録事業に対する積極的取り組みに期待したいところであり、そのための議論が広く行われて欲しいと思っている。
なお、がん登録は事業であるが、その情報を利用しての分析は研究として位置づけられると、私は思っている。
疫学研究と倫理
名古屋大学大学院医学研究科予防医学/医学推計・判断学 玉腰 暁子
記述疫学
疾病の発生、有病状況を観察し、その頻度、分布、推移を明らかにする。その目的は、当該疾患に関する基礎的資料(対策の必要性の検討など)の作成とともに疾病関連要因に関する仮説設定にある。国レベルでは、人口動態統計、患者調査、国民栄養調査などがあげられる。これら、国の指定統計として実施される調査は、既に定められていることから、基本的には個人個人に対するインフォームド・コンセントのプロセスを経ることなく行われている。もちろん、その結果を指定された目的以外の研究に用いようとすれば、所定の手続きが必要である。一方、研究者が中心となって一定の地域、病院などで疾病の発生や有病状況を観察することがある。国レベルで行うものに較べ、規模は小さくなるが、詳細な情報を得ることも可能である。人手・費用がかかることにはかわりがない。このような調査の中には、患者登録、有病率調査、治療成績、薬の副作用報告などが含まれる。
分析疫学
大きく分けて、ある病気の患者とその対照者(疾患を持たない人)で過去の曝露要因を比較する症例対照研究とある要因を持つ人々と持たない人々の情報を収集しておきその後の病気の発生/死亡状況を比較検討するコホート研究がある。いずれも疾患と関連する要因(危険因子、予防因子、予後因子など)を明らかにすることにより、病気を予防したり悪化を防ぐことを目的とする。
介入研究
疾病に関連を疑われる要因を負荷(予防要因の場合)あるいは除去(危険要因の場合)する群とその対照群を追跡比較することにより、ヒトを対象として疾病関連要因を明らかにする研究手法である。疾病の発生に関連する未知の要因の偏りを除去するため、通常無作為割付を行う。薬の開発のために行われる治験もその一つである。
・その集団を対象としなくてはならない
・第三者機関により研究の科学性、倫理性が審査されている
・対象者に対する十分な説明と自発的な同意が得られている
・個人情報などの保護対策に十分配慮をしている
疫学的手法を用いた観察研究と対象者の人権の調整
東京大学大学院医学系研究科内科学 永井 良三
はじめに
個人情報保護基本法は疫学研究のみならず臨床医学研究の進め方にも大きな影響をもたらすと予想される。平成12年10月にIT戦略本部より公表された「個人情報保護基本法制に関する大綱」では基本原則として、(1)利用目的による制限、(2)適正な方法による取得、(3)内容の正確性の確保、(4)安全保護措置の実施、(5)透明性の確保、の5原則をあげている。疫学的手法を用いた研究において同意を得ずに個人情報を利用すると、(1)利用目的による制限、(2)適正な方法による取得、および(5)透明性の確保、について抵触する。対象者の人権を保護するためには、あらゆる資料を同意の下に利用すべきであるが、対象者の同意を前提とした観察研究は、単に研究の実施を困難とするだけでなく、社会のあり方や市民の自律的行動の基盤に多大な影響をもたらす可能性のあることに留意が必要である。これは、班会議および拡大メイリングリストにおいても議論が多くなされた点でもあるので、論点を整理しておきたい。
1 医学における観察研究の重要性
疫学研究(臨床疫学を含む)は介入研究と観察研究に大別される。治療や検査などの処置を受けた集団と非処置の集団で効果を比較するのは介入研究であり、当該処置の有効性の評価に重要である。介入研究においては対象者の同意が必要であることは自明である。一方、ある地域で特定の疾病の発症が多いか、あるいは血清コレステロール値の違いによって虚血性心疾患の発症率の違いがあるか、などを明らかにするのが観察研究である。治療後の生存率を調査するのも観察研究に属する。観察研究は公衆衛生や臨床医学の基本となる資料を提供するものである。疫学的事実は母集団の構成員すべてを調査すれば明らかとなるが、その実施は現実的に困難なことが多いため母集団から無作為に対象者を選択して解析が行われる(無作為抽出)。抽出された集団がどの程度の高い信頼度で母集団を反映するかは、データ分布の偏りを統計学的に解析することによって判断する。実際は95%以上の信頼度で抽出集団が母集団を反映すると考えられたときに初めて、この無作為抽出標本によって行う観察研究が、母集団の構成員すべてで行う観察研究の代用とみなしうる。例えば、日常摂取する食品や飲料水によって健康障害が発生していないかを明らかにするには、まず特定地域と比較対照する母集団から一定数の対象者を無作為に抽出する。その上で、それぞれの対象者が母集団を高い信頼度で反映することが明らかになったときに、両群における差が意味をもつことになる。したがって、母集団から対象を抽出する際にはあくまでも無作為抽出であることが大前提となる。
2 観察研究における同意取得によって生ずる統計学上の問題点
個人情報を同意なしに疫学研究に利用することは、個人情報保護法における目的外使用の制限に抵触する。しかしながら、個人情報保護により過度の制約を疫学研究に課することは、一方で新たな問題を惹起する。そもそも、介入研究においては同意は必須であり、処置群と非処置群への割付を無作為におこなうことによって両群間にバイアスが生ずることはない。しかし観察研究においては同意を必須とすると、研究実施が困難となるだけでなく、対象者にバイアスを生じ統計学的解析の前提である無作為抽出の原則が成立しえなくなる。また、意図的に望む結果を導くように研究をデザインすることも可能となるため、良心的に実施された調査すら信頼性を喪失する恐れがある。例えば環境問題が発生したときに、健康被害の存在を認めたくない人たちを対象に多く含めれば、結果に大きな影響を生ずるのは当然である。同様に治療に成功した症例を多く含めて同意を得れば、治療成績を意図的に向上させることも可能である。しかもこれらの作為を第三者が看破することは不可能である。
3 疫学研究における「学問の自由」の意味
疫学や臨床医学の研究成果は社会に還元されることを本来の目的としている。すなわち研究によって明らかにされた真実(母集団)、もしくは真実を高い信頼性で反映するデータは、市民が自らの行動を自律的に決定する上で極めて重要な資料となる。「報道の自由」に関しては、これが単に「報道する自由」だけでなく、市民の「知る権利」と一体化して成立することは広く認知されている。すべての学術研究について「報道の自由」と同様に扱うことはできないが、市民の健康に関する情報を提供する疫学および臨床研究に関しては、特別の配慮が望まれる。例えば、健康被害の推測される食品を摂取すべきか否かを、新聞報道や噂ではなく科学的根拠に基づいて自律的に判断し行動することは、市民の権利でもある。また社会がこのことを可能とするシステムを備えておくことは、民主主義社会における不可欠の原則といえる。
4 個人情報の暗号化による研究への利用
個人情報の研究利用にあたっては、外部へ個人情報が漏洩しないようにすることは当然である。しかしながら、研究者が匿名化された資料を同意を得ずに研究資料とすることができるか否かについては議論が残されている。今回の「疫学の研究等における生命倫理問題及び個人情報保護の在り方に関する指針」においては、匿名化かつ(不可逆的に)同定不可能な資料以外は指針が適用される。しかしながら、これは2000年12月に発表された、米国保健社会福祉省の「個人特定可能医療情報のプライバシー基準(最終版)」とは大きく立場を異にする。すなわち、同基準ではsafe harborという概念を導入し、資料を一定の手続で匿名化することによって(de-identification)研究利用することを奨励している(文献3、4)。その詳細は必ずしも明らかでないが、匿名化は必ずしも不可逆的である必要はないと読みとることができる(文献5)。すなわち欧米における個人情報の扱い方の状況についてさらなる調査が必要と考えられる。
おわりに
疫学研究のガイドライン策定にあたって、留意すべき事項についてまとめた。最後に、ヘルシンキ宣言A5は「被験者の福利は科学や社会の利益に優先する」とし、B22ではいかなる医学研究においてもインフォームドコンセントを前提としている(文献7)。一方、ヘルシンキ宣言A6は医学研究の推進を謳っており、暗号化された個人情報を用いた観察研究を否定しているとは考えがたい。疫学研究のみならず個人情報を用いた医学研究ガイドラインの策定にあたっては、暗号化された個人情報をどのように取り扱うかについて、同宣言の解釈を明確にする必要があると考えられる。
1 戸波江二「学問・科学技術と憲法」、講座憲法学 4 権利の保障(2)、樋口陽一編、日本評論社、1994
2 von Hans-Heinrich Trute, Die Forschung zwischen grundrechtlicher Freiheit und staatlicher Institutionalisierung: Das Wissenschaftsrecht als Recht kooperativer Verwaltungsvorgaenge. J.C.B. Mohr, Tuebingen, 1994
3 Standards for Privacy of Individually Identifiable Health Information; Proposed Rule (http://aspe.hhs.gov/admnsimp/), Section 164.502(d) --Creation of Deidentified Information, p.82499
4 同上, Section 164.514 Other procedural Requirements relating to Uses and Disclosure of Protected Health Information, p.82542
5 同上 Re-identification、p.82712
6 Quantin C, Bouzelat H, Allaert F, Benhaminche AM, Faivre J, Dusserre L Automatic record Hash coding and linkage for epidemiological follow-u data con-fidentiality, Meth Inform Med 37: 271-277, 1998
7 WORLD MEDICAL ASSOCIATION DECLARA-TION OF HELSINKI, Ethical Principles for Medical Research Involving Human Subjects (52nd WMA General Assembly, Edinburgh, Scotland, October 2000) (http://www.wma.net/e/policy/17-c_e.html)
人を対象とする研究は、科学的かつ倫理的でなくてはならない。人を対象とした研究をする以上、生命倫理と個人情報保護に配慮を払うのは自明のことである。一方で、その成果を健康増進、医学の発展に生かすためには当然科学的な研究を行う必要があるが、個人の自己決定権を重視することで研究が偏り、結果が科学的でなくなるおそれが生じる場面がある。個人の人権尊重と社会的利益(得られる成果)の間に衝突が起こるのである。そこで、疫学研究をその研究手法によりわけ、生じてくる倫理問題について概観してみる。
さて、このような疾患の頻度と分布を観察しようとする場合にインフォームド・コンセントのプロセスを経て、拒否者を対象から除外すれば、自己決定権を認め倫理的といえるであろうか。拒否者が全く偏りがないランダム集団である場合は別にして、何らかの特性を持った集団に拒否者が偏るとすれば、拒否者を除外して得られたデータには偏りが生ずることになる。そのようにして得られた調査結果に基づき、対策を立てるべき疾患の優先順を決めることもあるだろうが、拒否者を除外した結果を比較して意味があるのであろうか。否、である。対象者に対して倫理的であろうとするために研究が科学的でなくなり、その結果倫理的でない研究を実施することになってしまう。それではどうしたらよいのであろうか。一つの解決策は、国会レベルでの審議を経て法の下で調査を行うことであろう。今一つは、情報漏洩対策を徹底した上で、地道な広報啓発活動により、健康情報が利用され得ることを伝えていくことであろう。もちろん、どのような状況下であれ、原則的には各個人の情報が無断で勝手に使われることが正当化されるわけではなかろう。したがって、問い合わせ先、拒否の機会の保障は必要であるが、病院に受診した場合、健診を受診した場合などには、個人情報を保護した形で研究に利用され得ることが常識化することが望まれる。一方で、きちんと向き合って説明をした場合にどれほどの方が拒否するものなのか、拒否する方に偏りがあるのか否か、経験を積み重ねて行くことも必要なことと思われる。
コホート研究では、目的とする疾患、要因により対象集団の規模が異なる。発生率の低い疾患や多疾患を目的としたコホート研究は規模が大きく、10万人単位のものも実際日本で実施されている。健康人を対象としたコホート研究では健診の場が利用されることも多いが、対象者数が多いためにインフォームド・コンセントに時間をかけにくい上、参加者は健診受診を目的としているため長時間拘束されることを嫌う傾向がある。このこと自体は研究の科学性とは関係しないが、ボランタリーに参加をしてもらうためにも日ごろの啓発活動が重要と考えられる。また、インフォームド・コンセントの手続きにかかる費用を見込んだ研究費取得が今後重要となるであろう。
臨床現場でよく行われる患者集団を対象に予後を検討する研究もコホート研究であるが、この場合は基礎資料を得るためにカルテ情報が使われることが多い。診療あるいは治療目的で採取した血液や組織が使われる場合もある。また症例対照研究でも過去の資料が利用されることがある。本来収集された目的を越えて各個人の情報が研究に利用される場合は、利用に関する同意を確認することが必要であろう。これは、自己の情報のコントロール権であり、『個人情報の保護に関する法律(案)』でも原則に目的外利用の制限が謳われている。当然、カルテ情報にしろ、採取保管されている血液や組織にしろ、本人の預かり知らぬところで研究に利用してよいことはない。しかし、費用、人手をかけ常に再同意のプロセスを踏むことが倫理的といえるであろうか。既に死亡したり連絡の取れない方の資料の扱いはどのようにすればよいのであろうか。この点については、得られる研究成果の大きさと情報が無断で使われる、あるいは新たな解析により個人の情報が増加/漏洩するリスクなどとのバランスを考える必要があろう。また、研究のデザインにも依存するであろうが、一人一人への再同意を行わない場合でも、拒否の機会は可能な限り保障することは重要である。当然、拒否の機会を保障するためには何らかの通知がなされなければならず、その有効な方法の検討が待たれるところである。いずれにしてもそのような形で研究を行うことが適切かどうかは研究者だけの判断に頼らず、第三者機関で審査することになる。このための倫理審査委員会が適切に運営されるようなシステム作りも今後の大きな課題である。なお、過去に取られた検体を利用しての遺伝子解析に関しては、平成13年3月29日に策定された『ヒトゲノム・遺伝子解析研究に関する倫理指針』(文部科学省,厚生労働省,経済産業省)に従えば、基本的には再同意、あるいは連結不可能匿名化の手続きが要求される。
利用可能な資料が存在するにもかかわらず、新たな情報収集を時間、費用をかけて始めることは、社会資源の面から考えた場合、必ずしも適切とは言えまい。ある研究が緊急に必要となる場合もあろう。問題点の整理と必要な手続きを行った上で、既存資料を研究に用いることも非倫理的と断定はできないと考える。ただし、個人情報の保護と自己の情報コントロール権に対する十分な配慮、その方法の確立が前提である。
無作為割付を行う場合、対象者は関連が疑われるものの確実ではない要因の負荷/除去群、対照群いずれにあたるか、分からない状態で研究参加を了解することが原則となる。また多くの場合、対象者本人への直接のメリットは少なく、対象者の所属する集団へ後に成果が還元されるに過ぎない。したがって、インフォームド・コンセントの手続きは基本的に必須であろう。しかし、対象者は研究全体を見渡して判断できることは少ないので、インフォームド・コンセント以前に研究の科学性、倫理性について、第三者機関で検討することを省略してはならない。
多くの場合、介入研究では対象者の除外基準がある。高齢であるとか、基礎疾患があるなどの理由でそもそも研究対象とならない方がある。また、拒否者も当然除外される。したがって、様々な理由により研究対象者は必ずしも一般集団を代表しない。しかし、そのために研究結果が一般化できないとしたら、その研究は科学的に意義があるといえるのであろうか。研究者は研究を立案する過程において、研究対象者の代表性について十分検討を行う必要があろう。また、介入を行う要因については、疾病発生/予防に対するその効果が不確実なものに限定されるべきで、確実に疾病発生/予防に関連することが確認されているのであれば、そもそもヒトを対象としてその要因の効果を検討する介入研究を実施すること自体が倫理的でないことは当然である。
以上、疫学研究の種類別に倫理性について簡単に私見を述べた。基本的には、ヒトを対象とする研究を実施する以上、
ことが原則であろう。
疾病の発生率や有病率、治療成績や副作用の発生状況を調査する場合などを除けば、必ずしも集団全体が対象となっていなければ疫学研究が実施できないわけではない(ただし代表性については、常に検討が必要である)。集団全体を対象としなくてはならないような種類の調査研究については、社会全体の了解を得るような努力が今後ますます重要となろう。その他の研究についてもそもそも疫学研究とはどのようなもので、何を目的とし、どのような方法で実施され、どのような成果が得られてきたのか、伝えていくことが重要である。それが、結果的には科学的、倫理的な疫学研究を実施する道と考える。
観察研究は医療政策や患者の受療行動の決定にも大きな貢献をなす。例えばある治療薬がイベント発症率を低下させる結果が国外で得られたとする。その治療薬は確かに有効であっても、その治療法をわが国に導入するためには、わが国におけるイベント発症率を十分に評価しておかなければならない。仮に欧米におけるイベントが対象患者の1%に発症し、これをその治療薬が0.7%に低下させたとする。この場合、相対危険率は30%低下したことになるが、1例のイベント発症を防止するためには333人が治療を受ける必要がある。しかしわが国におけるイベント発症率が欧米の約5分の1と低い場合を想定すると、わが国では0.2%に発症することになる。たとえ治療によって相対危険率が30%低下しても、この場合は1例のイベント発症の防止に1666人が治療を受けなければならない計算となる。副作用の発現や医療経済を考慮すると、薬物が有効であっても直ちに医療に導入するのではなく、まず集団における発症頻度に基づいて判断しなければならない。その意味でも、対象者のプライバシーを保護しつつ、信頼性の高い観察研究を実施できる体制を整備する必要がある。
疫学的事象の発生頻度が極めて低い場合は、抽出調査の実施は不可能であり、全数調査が必須である。従来知られていない新しい疾患が出現したとき、あるいは既知の疾患でも発症頻度の低い場合の調査がこれに該当する。このことはHIV感染症や狂牛病の勃発した際の状況を想起すれば理解しやすい。同意を得ずに全数調査を実施することは対象者の人権(対象となるか否かを自己決定する権利)からは問題が残るが、一方で、同意の得られた症例のみを対象として疫学調査を実施すると、このような疾病が急速に蔓延した際に適切な対応が立ち遅れることも懸念される。このため公益と対象者の人権の間で、現実的な調整作業が必要となる。
わが国では「学問の自由」をこのような論点からとらえることは少なく、むしろ国家による思想統制などの介入に対して主張されてきた。しかしながら、「学問の自由に関する憲法論は1950年代の議論の域に留まり、現実の科学技術の進展に適応しているとはいえない」という指摘も存在する(文献1)。ドイツには、「学問を制度として国が保障することの基礎」を、(1)学問を文化として定着させること、(2)福祉国家的根拠(学問の成果を社会で活用すること)、(3)学問が法治国における合理性の保証者となること、の3点から説明している論文を見出すことができる。第3点に関して同論文は、「特定の事象を継続的に観察し、得られた知見を提供するための研究機関を設置することは、国の決定の基礎を合理的なものにするのみならず、社会の個人や組織の行為能力にも資し、その行為を方向づけられるようにする」と述べている(文献2)。
「学問の自由」は、単に「学問研究をする自由」とのみ理解すべきでなく、その社会的意義まで含めて理解しなければならない。すなわち、疫学や臨床医学研究の規制にあたっては、「学問研究をする自由だけでなく、市民が研究成果を思想、信条、政治行動の判断資料として享受する権利も同時に認められて初めて、本来の学問のありかたが保障される」ということを常に考慮する必要がある。
暗号化した個人情報を研究利用することは、疫学研究の意義と対象者の人権を調整する一つの方策である。この場合、研究者あるいは研究機関がHASH関数などを用いて暗号化して管理する方法が知られている(文献6)。HASH関数は生年月日やID番号から作成される数字の羅列で、個人情報とHASH値の対応表をネットワークから切り離した状態で管理して研究に利用する(図)。
HASH値と個人識別情報の中間に別の関数を設定しないと、HASH値といえども安全ではない。しかしながら個人識別情報からHASH値への変換において、各施設毎に異なる乱数表を用いたシステムを導入することによって、解読を不可能とすることができ、HASH関数は個人情報の保護手段として極めて高い信頼性を獲得する。すなわち、現在でも使用可能な個人情報の暗号化通信システムを導入することにより個人情報の管理と保護は可能であり、疫学研究にも応用できる。
このようなシステムを観察研究における同意取得不要の条件として容認するかは慎重な議論が必要であるが、対象者の人権と疫学研究の意義を調整する手段として、今後考慮に値する。
文献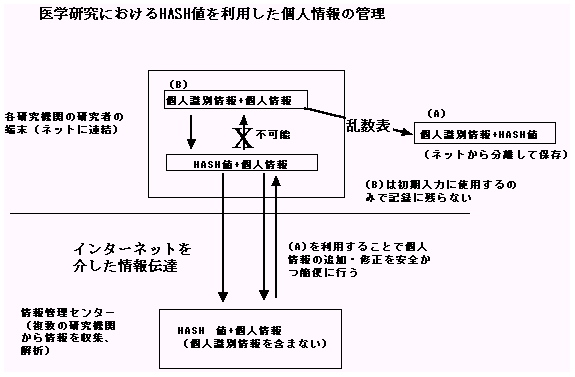
トップへ
戻る