戻る
医薬品・医療機器の適正な使用により
より安心のできる医療の提供を
〜本年7月30日より
新しい薬事法・血液法が施行されます〜 |
厚生労働省
薬事法と医療機関
| ・ |
薬事法は、「有効」で「安全」な「高品質」の医薬品・医療機器などを「正しく」使っていただくため、企業が行う製造・販売や医療機関における業務等に関して必要な安全対策を行うための法律です。 |
|
医療機関の業務との関連では、例えば、
(1)医薬品等の取り扱い
(2)添付文書の記載内容
(3)治験の実施
などが薬事法には定められています。 |
薬事法は医薬品、医療機器、医薬部外品、化粧品などの有効性、安全性、品質等の確保を目的として、一定の基準や取り扱いを定め、必要な規制を行うための法律です。
その規制の対象は製品を製造する企業だけではなく、製品を取り扱う医療機関・医療関係者も対象となっています。
医療機関での日々の業務に目を向けてみると、医薬品・医療機器等の取り扱いや、添付文書の記載事項、治験を実施する上でのルールなどが薬事法には定められていることから、医療関係者にとって、業務を行ううえで非常に重要なものであります。
薬事法と血液法の関係
| ・ |
今回の法改正では、薬事法と併せて採血及び供血あつせん業取締法が改正され、安全な血液製剤の安定供給の確保等に関する法律(血液法)となりました。 |
| ・ |
生物由来製品のうち血液製剤については、それぞれ安全対策については薬事法、安定供給と適正使用については血液法に基づいて、施策が講じられることになります。 |
|
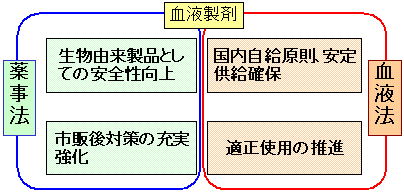
今回の法改正では、薬事法と併せて採血及び供血あつせん業取締法が改正され、「安全な血液製剤の安定供給の確保等に関する法律(血液法)」となりました。
生物由来製品のうち血液製剤については、それぞれ
| |
・ |
安全対策については薬事法、 |
| ・ |
安定供給と適正使用については血液法 |
に基づいて、施策が講じられることになります。
平成14年薬事法改正の骨子
薬事法は、国際的な整合性や、科学技術の進展、企業行動の多様化等、社会情勢の変化を踏まえて、適宜見直しが必要。
┌
|
|
└ |
| 平成6年改正 |
|
医療機器の特質に応じた安全性確保 |
| 平成8年改正 |
|
医薬品の治験から承認審査、市販後までに至る安全性確保 |
|
|
| − |
今回の改正は「 21世紀=ライフサイエンスの世紀」のニーズに合わせた薬事制度の見直し
| ・ |
バイオ・ゲノムの技術の進展と応用 |
| ・ |
産業活動等のグローバル化と国際的な整合性 |
|
|
平成14年7月31日公布。
平成15年から平成17年にかけて段階的に施行 |
→ 平成15年分 7月30日施行
医療分野においては、国際的な整合性や、科学技術の進展、企業行動の多様化等、日々変化し続けています。
このような社会情勢の変化を踏まえて、薬事法も逐次適切な見直しが必要なものであります。
近年、医薬品分野では、バイオ・ゲノムといった技術を駆使した創薬が数多く開発され、医療機器の分野においても、バイオ・ゲノムのほか、ナノテク等の様々な産業技術・科学技術の応用による多種多様な製品が提供されてきています。
また、IT化の進展等に伴い、国民生活も、産業活動も、そして行政活動も、より一層世界と直結したものとなり、今後ますます国際的整合性が求められることになります。
そこで、施行以来、数回に渡る改正を経て、現在の制度体系が構築されるに至っている薬事法について、制度の大幅な見直しが昨年行われれました。
改正薬事法は国会審議を経て、平成14年7月に公布され、その一部が本年の7月に施行されることとなっています。
(なお、残りの部分については平成17年の施行予定であります。)
薬事制度見直しの理念
| |
− |
医薬品以上に多様な技術・素材が用いられる医療機器の特性に対応 |
| 3. |
市販後安全対策の充実と承認・許可制度の見直し |
| |
− |
企業の安全対策責任の明確化 |
| − |
国際整合性を踏まえた製造承認制度の見直し |
|
平成15年7月30日から
改正薬事法に基づく新たな医療機関の取組とは? |
| 1. |
医療関係者による、生物由来製品の安全性確保 |
| 2. |
医療機関が、医薬品の副作用、医療機器の不具合やこれらによる感染症などについて厚生労働省に報告 |
| 3. |
医療機関が主体となって実施する治験 |
|
今回の薬事法の改正は、具体的には、
(1)医療機器に係る安全対策、
(2)生物由来製品への対応、
(3)製造承認制度の見直し、
を中心に、21世紀のニーズを踏まえた制度改正が行われます。
これに伴って、平成15年7月30日より医療機関・薬局においては次のような取組を行っていただくこととなります。
一つ目は、「医療関係者による、生物由来製品の安全性の確保」
二つ目は、「医療機関が、医薬品の副作用、医療機器の不具合やこれらによる感染症などについて厚生労働省に報告」
そして三つ目が、「医療機関が主体となって実施する治験」
です。
以下、それぞれについて説明をいたします。
トップへ
戻る

