戻る
次に、新しい血液事業の構築のための医療機関の取組について御説明いたします。
血液製剤とは…
| ・ |
人血液を分離し、若しくは人血液中の血漿たん白を分画精製して製造した医薬品です。 |
| ・ |
人血液を主成分とした、感染症のリスクの高い医薬品については、特定生物由来製品に指定されています。 |
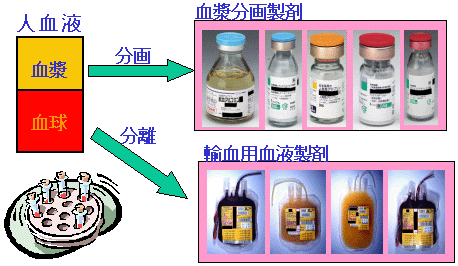
血液製剤は、大きく分けて輸血用血液製剤と血漿分画製剤があります。
輸血用血液製剤は、人血液若しくは人血液から分離した血球や成分を製剤化したものであり、赤血球製剤、血漿製剤、血小板製剤、全血製剤があります。
血漿分画製剤は、人血液から分離した血漿から、血漿たん白を分画精製したものであり、主にアルブミン製剤、グロブリン製剤、血液凝固因子製剤があります。
このように、人血液を主成分とした、感染症のリスクの高い医薬品については、薬事法上の特定生物由来製品に指定されています。
血液製剤の国内自給の歩み
| ・ |
血液製剤は、倫理的観点及び国際的公平性の観点から、国内の医療に必要な量の製剤を国内の献血でまかなうこと(=国内自給)が望ましいとされています。 |
| ・ |
しかし、国内自給を目指した取組をしておりますが、依然として海外に依存する製剤があります。 |
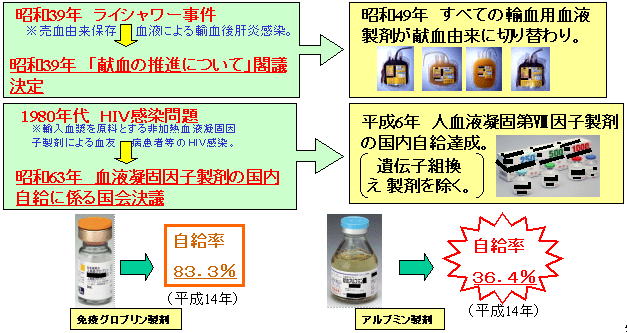
血液製剤は、人の血液を原料としていることから、倫理的観点及び国際的公平性の観点から、国内自給が望ましいとされています。
その実現に向け、関係者の努力が重ねられてきました。
昭和39年にライシャワー駐日大使が暴漢に刺され、輸血を受けたところ、輸血後肝炎に感染した事件を契機とした「献血の推進について」という閣議決定がなされ、その結果、昭和49年にはすべての輸血用血液製剤が献血由来になりました。
1980年代の血漿分画製剤によるHIV感染問題を契機とした国会決議により、平成6年には遺伝子組換え製剤を除く人血液凝固第VIII因子製剤が国内自給を達成しました。
しかしながら、依然として海外に依存する製剤があります。平成14年時点では、免疫グロブリン製剤の国内自給率は83.3%、アルブミン製剤の国内自給率は36.4%です。血液事業に係る関係者の一層の取組が求められています。
従来の法律(採供法)の概要
| ・ |
血液製剤は人の血液を原料とする医薬品であることから、原料の採取段階である採血について「採血及び供血あつせん業取締法」(採供法)を適用し、特別の規制をかけていました。 |
|
 |
|
<採供法の内容>
(1) 採血業は大臣の許可制
(2) 供血者の保護のための採血基準 |
↓ |
|
 |
| 採供法を改正し、血液事業の新たな枠組みとして、「安全な血液製剤の安定供給の確保等に関する法律」(血液法)が制定されました。(平成14年7月公布) |
血液事業の推進は、これまでは先ほどの閣議決定と採血及び供血あつせん業取締法に基づいて行われてきました。
しかしながら、昭和31年に制定された「採血及び供血あつせん業取締法」は、血液製剤が人の血液を原料とする医薬品であることから、原料の採取段階である採血について特別の規制をかけるものであり、その内容は、(1)採血業の許可制、(2)採血基準の策定に留まっていました。
このため、採供法を改正し、血液事業の新たな枠組みとして、「安全な血液製剤の安定供給の確保等に関する法律」(血液法)が平成14年7月に制定されました。
新しい血液法の概要
法律の目的を拡大
血液製剤の
┌
|
└ |
・安全性の向上
・安定供給の確保
・適正使用の推進 |
↓
国民の
保健衛生の向上
|
|
血液事業の運営指針となる
基本理念を設定
| (1) |
血液製剤の
安全性の向上
|
| (2) |
献血による
国内自給の原則、
安定供給の確保
|
| (3) |
適正使用の推進
|
| (4) |
血液事業運営に
係る公正の確保と
透明性の向上 |
|
|
血液事業に携わる
関係者の責務を明確化
基本理念にのっとり、
【国】 安全性向上・安定供給確保に関する基本的・総合的施策の策定・実施
【地方公共団体】 献血に関する住民の理解、献血受入を円滑にするための措置
【採血事業者】 献血受入の推進、安全性向上・安定供給確保への協力、献血者等の保護
【製造・輸入業者等】 安全な血液製剤の安定的・適切な供給、安全性向上のための技術開発と情報収集・提供
【医療関係者】 適正な使用、安全性に関する情報収集・提供 |
|
この図は、新たな血液法の概要を示したものです.
新たな血液事業の推進に当たり、法律の目的が拡大され、
血液製剤の安全性の向上、安定供給の確保、適正使用の推進によって、国民の保健衛生の向上を図ることとされました。
また、血液事業の運営指針となる基本理念が設定されました。
(1)安全性の向上、(2)国内自給原則、安定供給の確保、(3)適正使用の推進、(4)公正の確保と透明性の向上です。
さらに、血液事業に関わる関係者の責務が明確化されました。
国、地方公共団体、採血事業者、製造・輸入業者、医療関係者のそれぞれについて、責務が定められています。
血液法における医療関係者の責務とは
| ・ |
血液法では、医療関係者の責務を以下のとおり定めています。 |
|
| ・ |
血液法第8条(医療関係者の責務)
医師その他の医療関係者は、基本理念にのつとり、血液製剤の適正な使用に努めるとともに、血液製剤の安全性に関する情報の収集及び提供に努めなければならない。 |
| ・ |
血液法第9条(基本方針)
厚生労働大臣は、血液製剤の安全性の向上及び安定供給の確保を図るための基本的な方針(以下「基本方針」という。)を定めるものとする。 |
| 2 |
基本方針は、次に掲げる事項について定めるものとする。(抄)
六 血液製剤の安全性の向上に関する事項
七 血液製剤の適正な使用に関する事項 |
|
| ・ |
基本方針では、医療関係者の責務とされた安全性の向上や適正使用の取組について、その基本的な方向を明らかにしています。 |
| ・ |
基本方針は、平成15年7月に、血液法と同時に施行されます。 |
|
医療関係者の責務は、血液法第八条に定めるとおり、
| ・ |
基本理念にのっとり、血液製剤の適正な使用に努めること |
| ・ |
血液製剤の安全性に関する情報の収集及び提供に努めること |
であります。
また、血液法第9条に基づく基本方針では、医療関係者の責務とされた安全性の向上や適正使用の取組について、その基本的な方向を明らかにしています。
基本方針は、平成15年7月に、血液法と同時に施行されます。
血液製剤について
医療関係者が行うことは?(1)
| 特定生物由来製品である血液製剤の感染症に関する使用時の安全確保と適正使用を推進するため、以下の取組をより入念に行って頂くことになります。 |
| 血液製剤を使用する際には、製品のリスクとベネフィットについて患者(又はその家族)に説明を行い、理解を得るようにして下さい。 |
| ※ |
血液製剤と代替性のある遺伝子組換え製剤(遺伝子組換え型血液凝固第VIII因子製剤と遺伝子組換え活性型血液凝固第VII因子製剤)については、血液製剤と同様に取 り扱ってください。
|
医療関係者においては、
まず、特定生物由来製品である血液製剤を使用する際にリスクとベネフィットについて患者(又はその家族)に説明を行うことが求められます。
血液製剤と代替性のある遺伝子組換え製剤(遺伝子組換え型血液凝固第VIII因子製剤と遺伝子組換え活性型血液凝固第VII因子製剤)については、血液製剤と同様に取り扱ってください。
| 感染症に関する使用時の安全確保、万が一、感染症が発生した場合の遡及調査を容易に行うため、以下の取組を行ってください。 |
| ※ |
現在、通知で定めている血液製剤の管理簿が法制化されました。 |
| 血液製剤を使用した場合、情報を記録し、医療機関で使用日から少なくとも20年間保管します。 |
| ※ |
血液製剤と代替性のある遺伝子組換え製剤(遺伝子組換え型血液凝固第VIII因子製剤と遺伝子組換え活性型血液凝固第VII因子製剤)については、血液製剤と同様に取り扱ってください。 |
具体的には、管理簿等を作成することとなります。製薬企業等から提供される製品のシール等が活用できます。
 |
記録する情報:
製品名、
製造番号(製造記号)、
患者の方の氏名、住所、
投与日 |
|
 |
|
さらに、血液製剤を使用した場合の情報を記録し、医療機関で少なくとも20年間保管することが義務づけられます。
具体的には管理簿等を作成し保管することとなるわけですが、
記録すべき事項は、
(1)製品名
(2)製造番号(ロット番号)
(3)患者の氏名、住所
(4)投与日
です。
血液製剤と代替性のある遺伝子組換え製剤(遺伝伝子組換え型血液凝固第VIII因子製剤と遺伝子組換え活性型血液凝固第VII因子製剤)についても、同様の記録が必要となります。
患者情報記録のための管理簿の一例
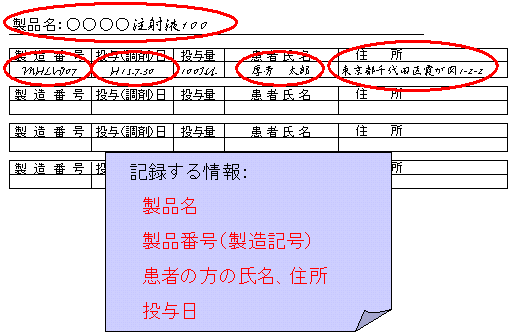
管理簿等を作成する際には、製品名、製造番号、患者氏名、住所、投与日を把握できるようにしてください。
電子媒体で保存する際には、常に紙媒体で確認できるよう留意してください。また、電子媒体の情報が失われないことについても確保するべきであります。
血液製剤の適正使用について((1))
<現状分析>
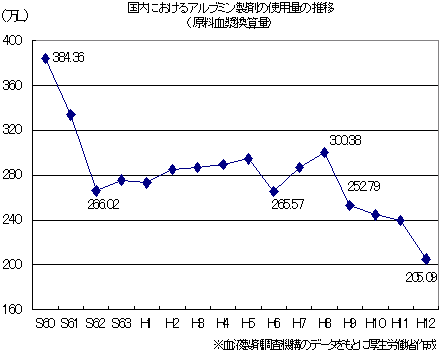
| 国内自給率の低いアルブミン製剤の使用量は、適正使用指針及び実施指針の普及により、減少傾向にあります。 |
 |
|
| しかし、国際的に使用量は多く、地域間格差もあることから、さらなる適正化が可能と見込まれます。 |
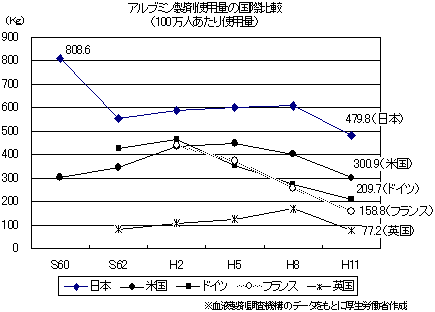
都道府県別アルブミン製剤使用量
(1,000病床当たり)(平成14年度)
| 最多 |
|
66.3Kg |
| 全国平均 |
|
38.3Kg |
| 最少 |
|
15.3Kg |
|
|
血液製剤の適正使用については、
国内自給率の低いアルブミン製剤の使用量は、減少傾向にあります。
しかし、国際的に見ても使用量が多く、その使用量は地域によって大きく異なることから、さらなる適正化が可能と考えられます。
血液製剤の適正使用について((2))
−基本方針(案)より−
| ・ |
適正使用指針及び実施指針の一層の普及に御協力をお願いします。 |
| ・ |
血液製剤の適正使用を進めるための院内体制の整備をお願いします。 |
| ・ |
厚生労働省は、血液製剤の使用状況を定期的に評価するなど、適正使用のためのよりよい方法を検討し、その普及に努めます。 |
|
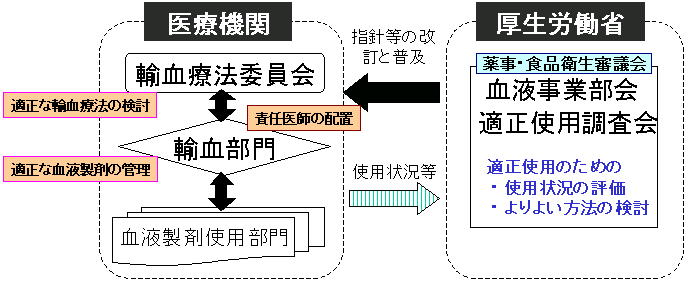
適正使用を推進するため、
| ・ |
「血液製剤の使用指針」及び「輸血療法の実施に関する指針」の一層の普及と、 |
| ・ |
血液製剤の使用を管理し、適正使用を進めるための院内体制の整備 |
が必要です。
平成10年度の調査では、血液製剤の使用実績のある一般病院のうち、輸血療法委員会は16.5%で設置されているに留まっています。輸血部門については、薬剤部(46.6%)や検査部(36.2%)が血液製剤の管理を行っている医療機関もありますが、輸血部が設置されている医療機関は3.0%に過ぎません。適正使用の推進のためには、院内体制の整備が重要です。積極的な取組をお願いします。
また、厚生労働省は、血液製剤の使用状況を定期的に評価し、適正使用のためのよりよい方法を検討し、その普及に努めることとしています。具体的な方法については、薬事・食品衛生審議会血液事業部会の適正使用調査会で審議することとしています。
その他:血液製剤の表示について((1))
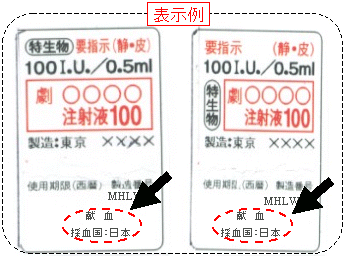
血液製剤と、血液製剤と代替性のある遺伝子組換え製剤(人血液を使用しているもの)には、以下の事項が表示されます。
| |
・ |
原料となる血液の採血国 |
| ・ |
原料となる血液の採取方法として、「献血」又は「非献血」のいずれか |
これは、当該製剤をお使いになる患者又はその家族の選択の機会を確保するためのものです。 |
 |
|
| ※ |
現在(平成15年4月)、国内に流通している血液製剤の採血国は、日本、アメリカ、ドイツ、オーストリア、スウェーデンです。 |
|
|
血液製剤と、遺伝子組換え製剤については、採血国、採血方法として、「献血」又は「非献血」のいずれかが表示されることになっています。これは、血液製剤をお使いになる患者又はその家族の選択の機会を確保するために表示するものです。
現在、国内に流通している血液製剤の採血国は、日本、アメリカ、ドイツ、オーストリア、スウェーデンですので、採血国として表示される国名は、この5か国ですので、国名についてはこの5か国のいずれかが表示されます。ただし、1つの血液製剤に複数の国の血液が使われている場合は、使われている血液が採取された国名がすべて表示されます。
その他:血液製剤の表示について((2))
<献血・非献血の区別>
「献血」とは、「自発的な無償の供血」を意味します。
自発的な無償の供血とは、供血者が血液、血漿、その他の血液成分を自らの意思で提供し、かつそれに対して、金銭または金銭の代替と見なされる物の支払いを受けないことをいう。この支払いには休暇も含まれるが、供血及び移動のために合理的に必要とされる休暇は含まれない。少額の物品、軽い飲食物や交通に要した実費の支払いは、自発的な無償供血と矛盾しない。(1991年国際赤十字・赤新月社決議) |
※採血方法を示すものであり、安全性の優劣を示すものではありません。
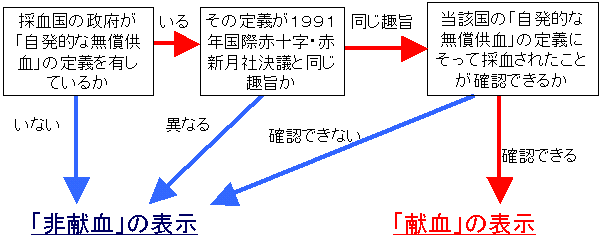
献血・非献血の区別は、以下の手順に沿って行われます。
「献血」とは、「自発的な無償供血」を意味します。
採血国の政府が「自発的な無償供血」の定義を有しており、その定義が、1991年国際赤十字・赤新月社決議と同じ趣旨であり、当該国の「自発的な無償供血」の定義にそって採血されたことが確認できる場合、「献血」と表示されます。
「献血」・「非献血」の区別は、採血方法を示すものであり、血液製剤等の安全性の優劣を示すものではありません。
献血とは、それぞれの国の歴史、社会、文化などを背景とした考え方です。それぞれの国において何を献血とみなしているのか、というその国の考え方を尊重するため、その国の献血の定義を踏まえて表示を行うものです。
このような「献血」・「非献血」の考え方について、十分に御理解ください。
トップへ
戻る









