戻る
医療機関が、医薬品の副作用、医療機器の
不具合やこれらによる感染症などについて
厚生労働省に報告する制度 |

|
次に医療機関が、医薬品の副作用、医療機器の不具合やこれらによる感染症などについて厚生労働省に報告する制度について説明します。
医療機関からの副作用等報告制度とは
| ・ |
改正薬事法第77条の4の2 第2項
薬局開設者、病院、診療所若しくは飼育動物診療施設の開設者又は医師、歯科医師、薬剤師、獣医師その他の医薬関係者は、医薬品又は医療用具について、当該品目の副作用その他の事由によるものと疑われる疾病、障害若しくは死亡の発生又は当該品目の使用によるものと疑われる感染症の発生に関する事項を知つた場合において、保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、その旨を厚生労働大臣に報告しなければならない。 |
|
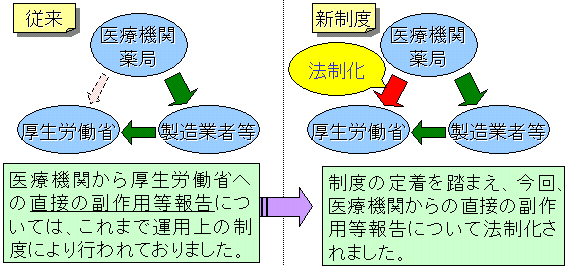
これまでは医療機関からの副作用等の報告に関しては、法律上は製薬企業に対してのみに求められており、医療機関においては運用上の制度により行われてきましたが、制度が周知されてきたことに伴い、このたび医療機関から厚生労働大臣(厚生労働省)への副作用等報告について、法制化されました。
今後、医療機関においても、医薬品、医療機器により、その関連が疑われる副作用・感染症で、死亡など生命に重篤な影響があると思われる場合は直接厚生労働省まで報告することになりましたのでご協力をお願いします。
企業や医療機関からの報告件数の推移
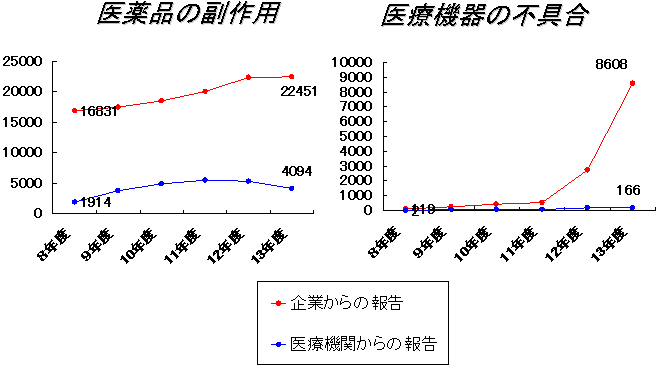
参考として医薬品、医療機器に関する副作用、不具合報告件数の推移をお示ししました。
医療機関からの副作用等報告制度の概要
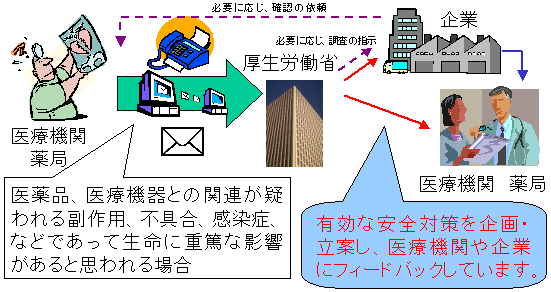
| 医療機関で得られた医薬品・医療機器の使用による副作用、感染症、不具合等の情報を適正使用に生かし、速やかな安全対策を行うための制度です。 |
 |
| → 厚生労働省にご報告を! |
医療機関・薬局においては、医薬品、医療機器との関連が疑われる副作用、不具合、感染症、死亡など、生命に重篤な影響があると思われる場合には厚生労働省に直接報告します。
厚生労働省では報告をもとに有効な安全対策を企画・立案し、現在と同様に医療機関や薬局、企業にフィードバックし安全性の向上につとめます。
例えば、こんな時には
厚生労働省までご報告を!(1) |
|
医薬品の使用により
| ○ |
死亡、障害、治療のための入院又はその延長が起こったとき |
| ○ |
使用対象者の子に先天異常が認められたとき |
| ○ |
感染症が起こったとき |
| ○ |
添付文書に記載されていない事象が起こったとき |
| など |
〜ご協力をお願いします〜
| 引き続き、製薬企業等が収集する副作用等の情報収集活動にもご協力をお願いします。 |
|
|
具体的にどのような場合に報告をするのかについての例を挙げております。
基本的には現在製薬企業等の報告義務となっている事項を参考にしてください。
医薬品においては
| ○ |
死亡、障害、治療のため、入院又は入院の延長が起こったとき |
| ○ |
患者の子に先天異常が認められたとき |
| ○ |
感染症が起こったとき |
また、
| ○ |
重篤でなくとも、添付文書に記載されていない事項であれば、軽微なものを除き報告することとなっています。 |
引き続き、製薬企業等が収集する副作用等の情報収集活動にもご協力をお願いします。
例えば、こんな時には
厚生労働省までご報告を!(2) |
|
医療機器の不具合により
| ○ |
死亡、障害、治療のための入院又はその延長が起こったとき、又はそのおそれがあるとき |
| ○ |
感染症が起こったとき |
| ○ |
添付文書に記載されていない事象が起こったとき |
| など |
〜ご協力をお願いします〜
| 引き続き、医療機器企業等が収集する不具合等の情報収集活動にもご協力をお願いします。 |
|
|
副作用等報告様式

副作用・不具合が起こった際の報告様式の案をお示しします。
トップへ
戻る



