戻る
まずは医療関係者による、生物由来製品の安全性を確保するための対策について説明します。
生物由来製品・特定生物由来製品の概念図
今回の薬事法の改正では、「生物由来製品」「特定生物由来製品」という概念を新しく定義し、その特性に応じて安全対策を行うことになりました。
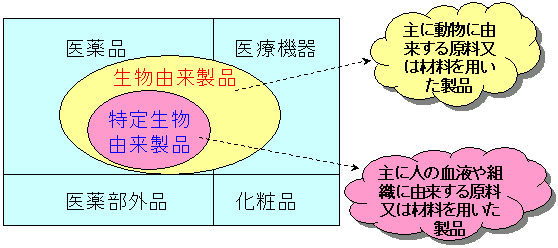
今回の薬事法の改正では「生物由来製品」と「特定生物由来製品」という枠組みを新しくもうけ、その特性に応じた安全対策を行うことになりました。
概念図をお示ししてありますが、各製品を使用した際の感染症に対するリスクを基に、主に動物に由来する原料又は材料を用いた製品を生物由来製品として位置付け、その中でも特に注意すべきものとして、特定生物由来製品を位置付けることになります。
生物由来製品の特性に応じた安全対策の充実
-
| ○ |
人その他の生物(植物を除く。)の細胞、組織等に由来する原料又は材料を用いた製品のうち、保健衛生上特別の注意を要するもの
| (例) |
血液製剤、ワクチン、細胞培養/遺伝子組換え製剤、細胞組織医療機器等 |
|
| ○ |
主な特徴
|
| 1. |
未知の感染性因子を含有している可能性が否定できない場合がある。 |
| 2. |
不特定多数の人や動物から採取されている場合、感染因子混入のリスクが高い。 |
| 3. |
感染因子の不活化処理等に限界がある場合がある。 |
|
本制度の背景としましては、ヒトや動物の細胞組織等に由来する医薬品・医療機器等については、その他の一般の医薬品・医療機器等と同様に、市販にいたるまでの各段階において品質や、安全性に関する様々な対策がなされているところではありますが、その特徴として、
| (1) |
未知の感染性因子を含有している可能性が否定できない場合があること、 |
| (2) |
不特定多数の人や動物から採取されている場合、感染因子混入のリスクが高いこと、 |
| (3) |
感染因子の不活化処理等に限界がある場合があること、 |
から、感染因子を伝播するおそれが完全には否定できないため、薬事法の改正において、その特質に応じた安全性確保のための措置を講じることになりました。
特定生物由来製品に係る安全確保対策の概要
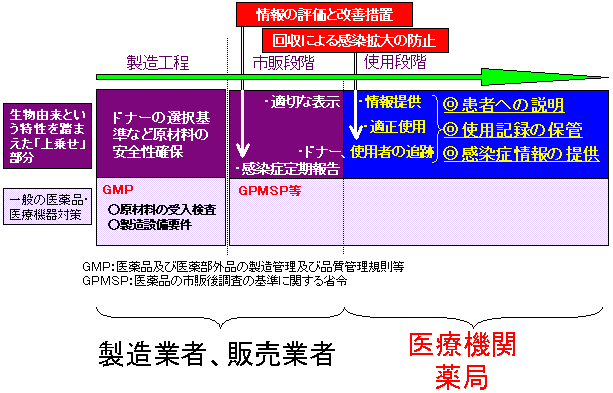
従来、医薬品の品質、安全性等の確保のためには、GMPやGPMSPなど、製造工程から市販後まで様々な安全対策が取られてきていましたが、今回、生物由来製品という枠組みを設け、その中でも特にリスクが高いものとされる製品である特定生物由来製品については安全対策を上乗せすることになりました。
企業においては製造時にはドナーの選択基準など原材料の安全性確保を、市販後においては製品・添付文書への適切な表示、ドナー記録・販売記録の保管、感染症の定期報告が義務づけられることとなります。
一方、医療機関、薬局においては
| (1) |
「特定生物由来製品」を患者に使用する際に、使用に係るリスクとベネフィットの説明を行うこと |
| (2) |
「特定生物由来製品」を使用する際に、患者(使用の対象者)・使用製品の記録を作成し保存すること |
また感染症発生時等で、危害の発生、拡大を防止するために必要がある場合に、患者等の利益になるときに限り、
| (3) |
「特定生物由来製品」の製造業者及び輸入販売業者に対し、患者や使用製品の記録を提供することがあげられます。 |
生物由来製品・特定生物由来製品の定義
| 生物由来製品に関する規定は平成15年7月30日から施行されます。 |
| ・ |
改正薬事法第2条第5項
生物由来製品とは、人その他の生物(植物を除く。)に由来するものを原料又は材料として製造(小分けを含む。以下同じ。)をされる医薬品、医薬部外品、化粧品又は医療用具のうち、保健衛生上特別の注意を要するものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。 |
| ・ |
改正薬事法第2条第6項
特定生物由来製品とは、生物由来製品のうち、販売し、賃貸し、又は授与した後において当該生物由来製品による保健衛生上の危害の発生又は拡大を防止するための措置を講ずることが必要なものであつて、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。 |
|
| ○ |
生物由来製品・特定生物由来製品は、製品の感染症の伝播のリスクに応じて指定されます。 |
| 生物由来製品は、ワクチン、遺伝子組換え製品、動物成分抽出医薬品などが、特定生物由来製品は、主として凝固因子製剤のような血液製剤が対象です。 |
もう一度繰り返しにもなりますが、法律上の定義では、「生物由来製品」とは、改正薬事法においては、「人その他の生物(植物を除く。)に由来するものを原料又は材料として製造される医薬品、医薬部外品、化粧品又は医療機器(用具)のうち、保健衛生上特別の注意を要するものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するもの」と定義されており、各々の製品の感染症の伝播のリスクに応じて指定されます。
さらに生物由来製品のなかでも、製品における感染症の発生リスクが理論的にも、かつ、経験的にもより高いものを「特定生物由来製品」として位置付け、さらに厳しい安全対策措置を行うこととなっています。
では、実際どのようなものが生物由来製品になるのかについてですが、
生物由来製品には…
例えば
| ・ |
ワクチン、トキソイド |
| ・ |
遺伝子組換え製剤 |
| ・ |
動物成分抽出製剤 |
| ・ |
動物由来心臓弁 |
等があります。 |
|
 |

| → |
|
製品に由来すると疑われる感染症等が発生した場合には厚生労働省への報告が必要です。 |
|
具体例を挙げますと、生物由来製品(特定生物由来製品を除く)には例えばワクチンや一部の遺伝子組換え製剤、動物成分抽出医薬品、医療用具でいいますとブタ心臓弁、ヘパリンコーティングカテーテルなどがあげられます。
生物由来製品に関しては、医療機関においては感染症が起こった際に厚生労働省に報告を行うことになっています。
特定生物由来製品には…
例えば
| ・ |
輸血用血液製剤
血液凝固因子
人血清アルブミン
人免疫グロブリン
などの血液製剤 |
| ・ |
人胎盤抽出物 |
等があります。 |
|
 |

| → |
|
| (1) |
患者への適切な説明 |
| (2) |
使用記録の作成、保管 |
| (3) |
感染症等情報の報告 |
|
が必要です。 |
|
|
一方、特定生物由来製品には血液製剤や、人組織由来の医薬品などの感染症の発生リスクが高い製品があげられます。
具体的には、血液凝固因子、人血清アルブミン、人免疫グロブリン、輸血用血液のような血液製剤や、人胎盤抽出物などがあります。
これらの製品に関して、医療機関・薬局では患者さんへ製品のリスク・ベネフィットなどの説明や、使用記録の作成・保管、そして感染症発生時の情報提供を行うことになります。
特定生物由来製品について
医療機関・薬局が行うことは?(1) |
| 感染症に関する使用時の安全確保のため、以下あの取組みをより入念に行って頂くことになります。 |
特定生物由来製品を使用する際には、製品のリスクとベネフィットについて患者(又はその家族)に説明を行い、理解を得るようにして下さい。
|
具体的に特定生物由来製品に関して医療機関で行うことについて説明いたします。
「特定生物由来製品」に関しては、他の製品よりもより厳しい安全対策が課されることとなり、医療機関においては、
まず、製品を使用する際にリスクとベネフィットについて患者(又はその家族)に適切に説明を行うことが求められます。
特定生物由来製品について
医療機関・薬局が行うことは?(2) |
| 万が一、感染症が発生した場合、使用対象となった患者の特定を容易に行うため、特定生物由来製品を使用した患者の記録を作成し保管することとなりました。 |
| ※ |
現在、ガイドラインで示している血液製剤の管理簿(現行保存期間10年)が法制化され、記録の保存期間が20年になります。 |
特定生物由来製品を使用した場合の情報を記録し、医療機関で使用日から少なくとも20年間保管します。
具体的には、管理簿等を作成することとなります。製薬企業等から提供される製品のシール等が活用できます。
 |
記録する情報:
製品名、
製造番号(製造記号)、
患者の方の氏名、住所、
投与日 |
|
 |
|
さらに、特定生物由来製品を使用した場合の情報を記録し、医療機関で少なくとも20年間保管することが義務づけられます。
この制度は、万が一感染症が発生した場合、使用対象となった患者さんを容易に特定するためにおこなうものです。
具体的には管理簿等を作成し保管することになるわけですが、
記録の内容としては、
(1)製品名
(2)製造番号(ロット番号)
(3)患者の氏名、住所
(4)投与日
等を記録することとなります。(なお、記録は紙媒体である必要はありません。)
患者情報記録のための管理簿の一例
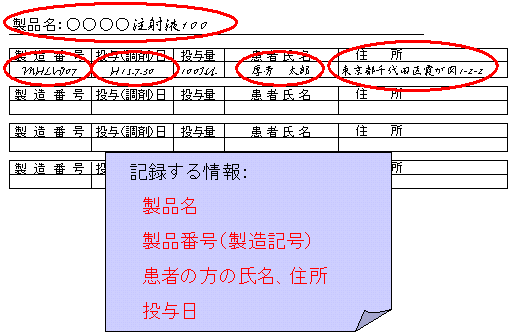
管理簿等を作成する際には、製品名、製造番号、患者氏名、住所、投与日を把握できるようにしてください。
電子媒体で保存する際には、常に紙媒体で確認できるよう留意してください。また、電子媒体の情報が失われないことについても確保するべきであります。
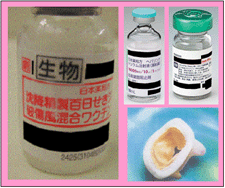
生物由来製品には
次のようなラベル表示がされています
| ・ |
直接の容器包装に白地、黒枠、枠囲い黒字をもって「生物」と表示されています。 |
| ・ |
製造番号・記号も合わせて表示されています。 |
|
生物由来製品(例)
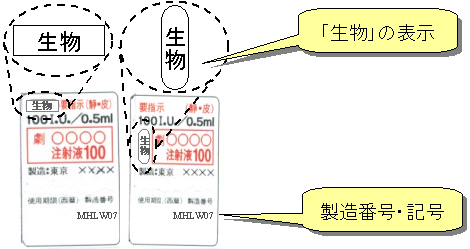 |
生物由来製品にはこのようなラベル表示がされています。
直接の容器包装には白地、黒枠、枠囲い黒字をもって「生物」と表示がされています。
また、製造番号・記号についても表示がされています。
特定生物由来製品には
次のようなラベル表示がされています
| ・ |
直接の容器包装に白地、黒枠、枠囲い黒字をもって「生物」と表示されています。 |
| ・ |
製造番号・記号も合わせて表示されています。 |
|
特定生物由来製品(例)
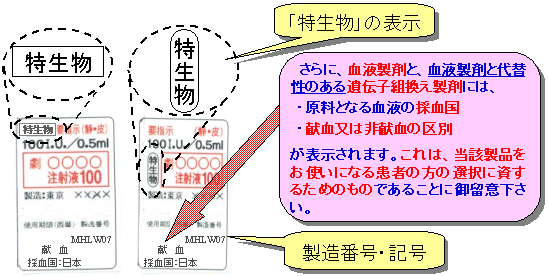 |
特定生物由来製品はこのようなラベル表示がされています。
直接の容器包装には白地、黒枠、枠囲い黒字をもって「特生物」と表示がされています。
また、製造番号・記号についても表示がされています。
さらに、血液製剤と、血液製剤と代替性のある遺伝子組換え製剤のうち特定生物由来製品に指定されているもの(人血液成分を使用しているもの)には、
| |
・ |
原料となる血液の採血国 |
| ・ |
採血方法として、「献血」又は「非献血」の区別 |
が表示されます。
トップへ
戻る









