平成19年2月1日(木)
(照会先)
医薬食品局安全対策課
課長 伏見 環
担当 丈達(内2748)
TEL 03-5253-1111(代)
|
|
平成18年度第2回薬事・食品衛生審議会医薬品等安全対策部会
安全対策調査会における検討の結果について
本日、開催された標記会議における検討の結果について、別紙のとおりお知らせします。
(別紙)
平成19年2月1日 |
 |
薬事・食品衛生審議会 |
 |
| 医薬品等安全対策部会 |
| 安 全 対 策 調 査 会 |
ゲフィチニブに係る第III相試験の結果及び
ゲフィチニブ使用に関する当面の対応に関する意見
本調査会において、企業から提出された「1又は2レジメンの化学療法治療歴を有する、進行/転移性(IIIB期/IV期)又は術後再発の非小細胞肺癌患者を対象にゲフィチニブとドセタキセルの生存期間を比較する多施設共同非盲検無作為化並行群間比較第III相市販後臨床試験」(以下「第III相試験」という。)の結果について検討を行った。
第III相試験の結果及びゲフィチニブ使用に関する当面の対応に関する意見は、次のとおりである。
| 第1 第III相試験の結果について |
| 1 |
結果の信頼性について |
| |
第III相試験については、無作為化が正しく機能し、群間の比較可能性は確保されていると考えられた。
なお、第III相試験は、ゲフィチニブの承認条件として国内で実施された試験であることから、その結果の信頼性について確認を行う必要があると考えられた。 |
| 2 有効性について |
| (1) |
第III相試験の主要評価項目である全生存期間については、市販後臨床試験実施計画書に基づき、Cox回帰分析が行われた。 |
| (2) |
企業から、上記(1)の解析の結果、 |
| [1] |
全生存期間におけるゲフィチニブ群のドセタキセル群に対する非劣性を示すことはできなかった(ハザード比=1.12(95%信頼区間0.89〜1.40))、 |
| [2] |
全生存期間において両群間に統計的に有意な差があることは示されなかった、 |
| [3] |
全生存期間に与える後治療注)の影響を評価することは困難であった、
|
等の報告があった。
注)別添参照 |
| (3) |
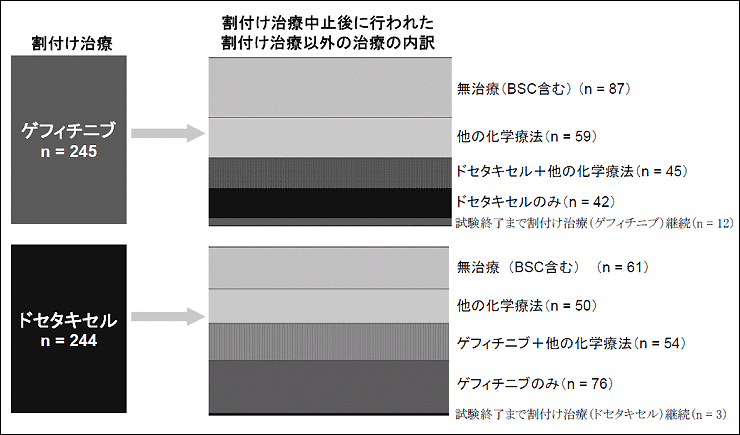
上記(1)の解析は、全生存期間におけるドセタキセル群に対するゲフィチニブ群の効果が時間の経過にかかわらず一定であることを前提としているが、第III相試験においては、当該効果が時間依存的に変化するという結果が出ており、その前提が成り立っているとは言い難い結果であった。また、後治療として、ゲフィチニブ群については87例(36%)にドセタキセルの投与が、ドセタキセル群については130例(53%)にゲフィチニブの投与が行われていることが、結果の解釈を難しくしていると考えられた。 |
| (4) |
(3)のことから、第III相試験の主要評価項目である全生存期間について、ドセタキセル群に対するゲフィチニブ群の治療効果が時間依存的に変化する現象を捉えることを目的として、時点ごとの生存率を評価指標として治療効果を時点ごとに推測する解析を行った。その結果、投与初期における生存率については、ドセタキセル群がゲフィチニブ群よりも優れていることが示唆され、また、投与24ヶ月時点前後における生存率については、その信頼区間が広いため、この時点前後においてゲフィチニブ群がドセタキセル群よりも優れているということは積極的には言い難いが、治療効果の点推定値の結果からはゲフィチニブ群がドセタキセル群よりも良かった。
上記の結果及び臨床家の意見を踏まえると、1又は2レジメンの化学療法歴(少なくとも1レジメンは白金製剤を含む。)を有する手術不能又は再発非小細胞肺癌の患者の治療に際し、一般的に、ドセタキセルに優先してゲフィチニブの投与を積極的に選択する根拠はないと考えられた。
なお、上記の結果については、患者背景、後治療の影響などが考えられるが、今回の解析結果からは、その理由を明らかにすることができなかったことから、これらの影響などについて、更に詳細な解析を実施する必要があると考えられた。 |
| 3 |
安全性について |
| |
第III相試験における急性肺障害・間質性肺炎の発現頻度及び死亡率を含むゲフィチニブの副作用の発現状況については、最新の添付文書等に記載されているものと同程度であると考えられた。 |
| 第2 ゲフィチニブ使用に関する当面の対応について |
| 1 |
上記第1の3のとおり、ゲフィチニブの副作用の発現状況については、最新の添付文書等に記載されているものと同程度であることを考慮すると、安全性に関しては、引き続き、少なくとも投与開始後4週間は入院又はそれに準ずる管理の下で、間質性肺炎等の重篤な副作用発現に関する観察を十分に行うなど、添付文書に記載されている安全対策を継続しつつ、肺癌化学療法に十分な経験をもつ医師による使用を徹底するなど、現在の安全対策を継続することが適当である。 |
| 2 |
また、上記第1の2(4)の投与初期における生存率についてはドセタキセル群がゲフィチニブ群よりも優れていることが示唆されたという第III相試験の解析結果を踏まえると、厚生労働省は、下記3の詳細な解析の結果が報告されるまでの間、予防的な対応として、1又は2レジメンの化学療法歴(少なくとも1レジメンは白金製剤を含む。)を有する手術不能又は再発非小細胞肺癌の患者の治療に際し、一般的に、ドセタキセルに優先してゲフィチニブの投与を積極的に選択する根拠はない旨について、第III相試験の結果とともに、患者に十分な説明が行われるよう、企業に対し、医薬関係者に速やかに情報提供するよう指導することが適当である。 |
| 3 |
ゲフィチニブの臨床的有用性を評価するためには、上記第1の2(4)で示唆された結果を確認するとともに、患者背景、後治療の影響、未整理のデータなどについて更に詳細な解析を行い、その結果について検討する必要があると考えられることから、厚生労働省は、統計専門家に対し、第III相試験の結果のうち有効性に係る詳細な解析を依頼し、その結果を当調査会に報告することが適当である。また、企業に対しても、同様に詳細な解析を行い、その結果を当調査会に報告するよう指導することが適当である。 |
| 4 |
上記3の詳細な解析を行う上で、第III相試験に係る資料の信頼性が確保されていることが重要であることから、厚生労働省は、当該資料が、「医薬品の市販後調査の基準に関する省令」に従って収集され、かつ、作成されたものであることを速やかに確認することが適当である。 |
| 5 |
患者情報の把握、ゲフィチニブの有効性と関係するEGFR遺伝子変異の解明等については、平成17年3月24日に開催されたゲフィチニブ検討会における当面の対応についての意見を踏まえ、企業は、随時、医薬品等安全対策部会に対応状況の報告を行ってきているが、より一層の取組みを図ることが適当である。 |
別添
第III相試験における後治療について
第III相試験のプロトコール上、増悪以外の理由により、割り付けられた薬剤(ゲフィチニブ又はドセタキセル)の投与を中止した症例では、投与中止後「固形がんの治療効果判定のための新ガイドライン」により増悪を確認するまでは後治療を開始しないとされている。
また、後治療として、割り付けられた薬剤の再投与又は割り付けられなかった方の薬剤を含む治療を実施しない(ただし、患者の希望がある場合は、その限りではない。)こととされている。
その他の後治療に関しては、制限しないこととされている。
|
|
《企業提出資料より抜粋(平成19年2月1日安全対策調査会)》
|
|