及ぼす影響を防止するための指針 | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||

| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||

| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
|
参考1
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
|
参考2
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| No. | 医薬品等 | 対策 | 情報の概要 |
|---|---|---|---|
| 1 | 骨セメント使用時における重篤な健康被害について | 骨セメントの使用に伴い,血圧低下,ショックなどが発現することについては,これまで,平成4年9月発行「医薬品副作用情報
No.116」,平成10年3月発行「医薬品等安全性情報 No.147」及び平成13年3月発行「医薬品・医療用具等安全性情報
No.165」により,重篤症例や添付文書の「使用上の注意」の改訂内容の紹介を行うなど,注意を喚起してきた。 その後も骨セメントの使用については,リスクの高い患者への使用,麻酔医の監視がない状況での使用等により,血圧低下,ショック,肺塞栓症などを発症し,死亡した症例が報告されていることから,本号において,改めて医療関係者へ使用に当たっての注意喚起を図るものである。 | |
| 2 | 新方式携帯電話端末及びRFID機器による植込み型医用機器(心臓ペースメーカ及び除細動器)への影響について | 携帯電話端末等による植込み型心臓ペースメーカ及び植込み型除細動器(以下「植込み型医用機器」という)への影響については,医薬品副作用情報において過去3回の注意喚起を行い,盗難防止装置等による植込み型医用機器への影響については,医薬品等安全性情報等において過去4回の注意喚起を行ってきたところである。 総務省において,平成16年度に実施した,新方式携帯電話端末から発射される電波が植込み型医用機器へ及ぼす影響に関する調査の結果において「携帯電話端末を植込み型心臓ペースメーカ装着部位から22cm程度以上離すこと」などとした現行指針は妥当であることが確認された。 また,RFID機器(据置き型及びモジュール型)から発射される電波が植込み型医用機器へ及ぼす影響については,平成15年度に確認したハンディ型のRFID機器と同様に,22cm以上離せば影響が避けられることが確認された。 今回は当該報告の内容について紹介し,改めて医療関係者等に注意喚起を行うこととした。さらに,総務省より,平成16年度までに得られた,各種電波利用機器についての調査結果に基づき,影響防止のための指針が公表されたので併せて紹介する。 | |
| 3 | バルプロ酸ナトリウム他(2件) | (使) (症) |
前号(医薬品・医療機器等安全性情報No.215)以降に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について,改訂内容,参考文献等とともに改訂の根拠となった症例の概要に関する情報を紹介する。 |
| 4 | カルバマゼピン他(12件) | 使用上の注意の改訂について(その168) | |
| 5 | 市販直後調査対象品目 | 平成17年8月1日現在,市販直後調査の対象品目一覧を紹介する。 |
| 目次へ |
| 一般的名称 販売名(会社名) |
一般的名称 | 販売名(会社名) |
| 骨セメント | エンデュランス ボーンセメント(デピュー・ジャパン) オーソセット ハイビスコシティ ボーンセメント(ライトメディカルテクノロジー インク) オーソセット ロービスコシティ ボーンセメント(ライトメディカルテクノロジー インク) オステオボンド コポリマー ボーンセメント(ジンマー) サージカルシンプレックス(日本ストライカー) ジンマーボーンセメント(ジンマー) セメックス RX(佐多商会) セメックス システム(佐多商会) | |
| 類 別 | 医療用品 4 整形用品 | |
| 適 応 | 人工関節の固定等 | |
| 1) | 心肺血管系疾患のある患者,全身状態不良患者,悪性腫瘍の大腿骨転移患者,高齢者,骨粗鬆症患者,副腎皮質ステロイド剤の投与を受けている患者,循環血液量が減少した状態にある患者,低酸素状態にある患者,肥満のある患者については,血圧低下,特に重篤な循環不全に至るリスクが他の患者と比較して大きいので,骨セメントの使用による有効性がこれらのリスクを上回ると判断される場合にのみ使用すること。 |
| 2) | 循環血液量を十分保ち,できる限りより良好な全身状態のもとに使用すること。 |
| 3) | 急な血圧低下,重篤な循環不全に備えて,緊急対応のできる麻酔医等の監視のもとに使用すること。また,患者の血圧変化等を継続的にモニターするとともに,重篤な循環不全に備えて治療が直ちに行えるよう必要な準備をしておくこと。 |
| 4) | 未重合のモノマーが血管内に吸収され,心筋抑制等を起こすことを予防するため,骨セメントの混合時間を十分とり,ある程度重合するまで充填しないこと。 |
| 5) | 長管骨髄腔(大腿骨等)に使用する場合,塞栓になる可能性のある骨髄の組織(骨髄,骨片及び血液)を十分除去すること。 |
| 6) | セメントガンにより低粘性の骨セメントを大腿骨腔に充填する場合には,未重合のモノマー,髄腔内容物の循環器系への流入を可能な限り少なくするため,髄腔の遠位端を栓でふさぐこと。 |
| 7) | 骨セメント充填時の大腿骨髄腔内圧の上昇が呼吸器,循環器に影響するので,減圧のためのチューブを一時的に挿入するなど,骨髄内圧上昇を最小限にするよう注意すること。 |
| 販売数量 | 報告件数 | |
| 平成13年度 | 約82,000個 | 11件 |
| 平成14年度 | 約94,000個 | 4件 |
| 平成15年度 | 約83,500個 | 10件 |
| 平成16年度 | 約83,800個 | 12件 |
| 1) | 使用目的 全例,大腿骨頸部等の骨折による人工骨頭置換術における大腿骨への置換材料の固定を目的に骨セメントが注入されたものであった。 |
|---|---|
| 2) | 年齢等 患者の年齢は69〜96歳であり,平均年齢は約83歳であった。また性別については,女性30例,男性1例,不明1例であった。 |
| 3) | 受傷日から手術日までの期間 8例において受傷日から手術日までの期間が確認されており,その期間は3〜9日間であった。 |
| 4) | 既往歴 32症例中には,添付文書の警告欄において注意喚起している心肺血管系疾患12例(胸部大動脈瘤,心臓弁膜症,心筋梗塞,狭心症など),骨粗鬆症11例,リウマチ3例及び肥満(高血圧及び糖尿病の既往歴あり)1例などが含まれていた。 |
| 5) | 麻酔医による監視 32症例中麻酔医の監視のもとで,手術の実施が確認できた症例は25例であり,4例が麻酔医不在,3例が調査不能のため不明であった。 |
| 6) | 血圧の変動について 全例に血圧降下を認めており,術前の血圧値及び骨セメント注入後の血圧値ともに調査できた症例のほとんどが,注入直後に測定不能を含めた急激な血圧下降を認めていた。 |
| 7) | 転帰等 解析対象とした32症例中27例が死亡し,3例が意識障害(未回復)と判断された。なお死亡例のうち剖検等により肺等への脂肪または血液による塞栓が確認された症例が7例に認められた。 |
| 8) | 手技等 セメントガン*1は2例を除く全症例で使用されていた。セメントプラグ*2の使用については,未使用1例及び不明1例を除き全症例で使用されていた。ベントチューブ*3の使用については,使用5例及び不明5例を除く22例が未使用であった。またセメント圧を高めるためのプレッシャライザー*4の使用については,使用4例及び不明5例を除く23例で未使用であった。髄腔洗浄の実施については,パルスによる洗浄が12例,シリンジによる洗浄が9例,その他の方法10例,不明2例であった。 |
〈用語の説明〉
*1 セメントガン:シリンジを用いて骨セメントを骨髄腔内に充填する器具。
*2 セメントプラグ:骨髄腔内への過剰な骨セメント充填を防ぐために,骨髄腔遠位端を閉塞する栓。
*3 ベントチューブ:骨セメント充填時に骨髄腔内の空気の排出通路として使用するチューブ。
*4 プレッシャライザー:セメントを間隙なく骨髄腔内に充填するために使用する加圧補助器具。
(概要) FDA等の安全性情報によると,骨粗鬆症などによる脊椎圧迫骨折に対しこの治療法(Vertebroplasty法及びKyphoplasty法)により骨セメントが使用された患者において,骨セメントの漏出に伴う神経根の疼痛,軟部組織の損傷,肺塞栓症,心不全,死亡等が報告されていること,この治療法については,長期の安全性及び有効性を確認できる比較臨床試験等はないなど記載されている。
また,同安全性情報によると,使用される骨セメントにX線画像の鮮明化のために造影剤を混合するが,配合比率などによる骨セメントの硬化時間や強度及び安全性などのガイドラインは確立されておらず,予測不能な危険性が警告されている。
表1-1 不具合報告症例一覧
| 症例/ 項目 |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| 使用目的 | 大腿骨近位部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨骨幹部 骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨頸部 骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨頸部 骨折 | |
| 性別 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | |
| 年齢 | 79 | 82 | 87 | 80 | 92 | 91 | 69 | 82 | 79 | 80 | 91 | |
| 受傷日から手術日までの期間 | 不明 | 不明 | 不明 | 6日目 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | |
| 既往歴 | 心肺血管系疾患 | ○ | ○ | ○ | ||||||||
| 骨粗鬆症 | ○ | ○ | ○ | ○ | ○ | ○ | ||||||
| リウマチ | ○ | |||||||||||
| 脳血管系疾患 | ○ | ○ | ||||||||||
| 糖尿病 | ○ | ○ | ○ | |||||||||
| その他 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ||||
| 体質 | 肥満 | |||||||||||
| 麻酔 | 部位 | 全麻 | 腰麻 | 腰麻 | 腰麻 | 腰麻 | 全麻 | 腰麻 | 不明 | 腰麻 | 不明 | 腰麻 |
| 麻酔医による監視 | あり | 不明 | あり | あり | あり | あり | あり | あり | あり | あり | あり | |
| 血圧 | 術前血圧 | 170/60 | 162/88 | 154/92 | 160/100 | 148/90 | 120/75 | 130/60 | 不明 | 120/65 | 138/80 | 100/55 |
| 骨セメント注入 後の最低血圧 |
測定不能 | 測定不能 | 90/50 | 80/50 | 不明 | 不明 | 130/80 | 不明 | 100/60 | 測定不能 | 48/28 | |
| 不具合 事象 |
血圧低下 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 肺等への塞栓 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | |
| 死亡 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | (意識障害) | ○ | ○ | |
| 手技等 | セメント注入法 | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン |
| セメントプラグ 使用の有無 |
あり | あり | あり | あり | あり | なし | あり | 不明 | あり | あり | あり | |
| ベントチューブ 使用の有無 |
なし | 不明 | 不明 | あり | なし | なし | なし | 不明 | なし | なし | 不明 | |
| プレッシャライザー 使用の有無 |
なし | 不明 | なし | なし | なし | 不明 | なし | 不明 | なし | なし | なし | |
| 髄腔洗浄 | シリンジ | パルス | シリンジ | パルス | スポイト洗浄 | パルス | ブラシ | 不明 | シリンジ | スポイト/ ガーゼ洗浄 |
パルス | |
| 報告者 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | |
表1-2 不具合報告症例一覧
| 症例/ 項目 |
12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | |
| 使用目的 | 大腿骨頸部/ 転子部骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部/ 転子部骨折 |
大腿骨頸部 骨折 | |
| 性別 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 男性 | 女性 | |
| 年齢 | 75 | 86 | 92 | 80 | 83 | 83 | 81 | 80 | 87 | 96 | 82 | |
| 受傷日から手術日までの期間 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | 不明 | |
| 既往歴 | 心肺血管系疾患 | ○ | ○ | ○ | ○ | ○ | ○ | |||||
| 骨粗鬆症 | ○ | ○ | ||||||||||
| リウマチ | ○ | ○ | ||||||||||
| 脳血管系疾患 | ○ | |||||||||||
| 糖尿病 | ○ | |||||||||||
| その他 | ○ | ○ | ○ | ○ | ○ | |||||||
| 体質 | 肥満 | ○ | ||||||||||
| 麻酔 | 部位 | 腰麻 | 不明 | 腰麻 | 全麻 | 腰麻 | 不明 | 腰麻 | 不明 | 不明 | 腰麻 | 腰麻 |
| 麻酔医による監視 | あり | なし | あり | あり | あり | あり | あり | なし | あり | あり | 不明 | |
| 血圧 | 術前血圧 | 152/90 | 130/80 | 160/92 | 不明 | 210/90 | 135/75 | 不明 | 130/60 | 不明 | 110/65 | 120/60 |
| 骨セメント注入 後の最低血圧 |
40/25 | 不明 | 不明 | 不明 | 130/66 | 不明 | 不明 | 85/45 | 不明 | 不明 | 不明 | |
| 不具合 事象 |
血圧低下 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 肺等への塞栓 | 不明 | 不明 | 不明 | ○ | 不明 | 不明 | ○ | 不明 | ○ | 不明 | 不明 | |
| 死亡 | (意識障害) | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | (意識障害) | |
| 手技等 | セメント注入法 | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | マニュアル | セメントガン |
| セメントプラグ 使用の有無 |
あり | あり | あり | あり | あり | あり | あり | あり | あり | あり | あり | |
| ベントチューブ 使用の有無 |
なし | なし | なし | なし | なし | なし | なし | なし | あり | なし | なし | |
| プレッシャライザー 使用の有無 |
あり | なし | なし | なし | なし | なし | なし | なし | なし | なし | なし | |
| 髄腔洗浄 | パルス | パルス | 洗浄 | パルス | 洗浄 | 洗浄 | パルス | 洗浄 | パルス/ シリンジ |
シリンジ | パルス | |
| 報告者 | 企業/医療機関 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | 企業 | |
表1-3 不具合報告症例一覧
| 症例/ 項目 |
23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | |
| 使用目的 | 大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 |
大腿骨頸部 骨折 | |
| 性別 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 女性 | 不明 | 女性 | |
| 年齢 | 88 | 79 | 84 | 85 | 69 | 88 | 88 | 82 | 82 | 86 | |
| 受傷日から手術日までの期間 | 6日目 | 不明 | 不明 | 6日目 | 9日目 | 3日目 | 不明 | 9日目 | 4日目 | 7日目 | |
| 既往歴 | 心肺血管系疾患 | ○ | ○ | ○ | |||||||
| 骨粗鬆症 | ○ | ○ | ○ | ||||||||
| リウマチ | |||||||||||
| 脳血管系疾患 | ○ | ○ | |||||||||
| 糖尿病 | ○ | ○ | |||||||||
| その他 | ○ | ○ | ○ | ||||||||
| 体質 | 肥満 | ||||||||||
| 麻酔 | 部位 | 全麻 | 全麻 | 不明 | 腰麻 | 全麻 | 腰麻 | 不明 | 腰麻 | 全麻 | 腰麻 |
| 麻酔医による監視 | あり | あり | あり | なし | あり | なし | 不明 | あり | あり | あり | |
| 血圧 | 術前血圧 | 126/60 | 120/50 | 不明 | 118/59 | 不明 | 200/60 | 不明 | 不明 | 165/130 | 140/56 |
| 骨セメント注入 後の最低血圧 |
70/35 | 46/15 | 不明 | 69/24 | 130/65 | 不明 | 不明 | 不明 | 80/50 | 測定不能 | |
| 不具合 事象 |
血圧低下 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 肺等への塞栓 | 不明 | ○ | ○ | 不明 | ○ | 不明 | 不明 | 不明 | 不明 | ○ | |
| 死亡 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | |||
| 手技等 | セメント注入法 | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | セメントガン | マニュアル |
| セメントプラグ 使用の有無 |
あり | あり | あり | あり | あり | あり | あり | あり | あり | あり | |
| ベントチューブ 使用の有無 |
なし | なし | あり | あり | なし | あり | 不明 | なし | なし | なし | |
| プレッシャライザー 使用の有無 |
なし | なし | なし | あり | あり | 不明 | 不明 | なし | あり | なし | |
| 髄腔洗浄 | 洗浄 | 洗浄 | シリンジ | シリンジ | 洗浄 | パルス | 不明 | パルス | シリンジ | シリンジ | |
| 報告者 | 企業 | 企業 | 企業 | 企業 | 企業/医療機関 | 企業/医療機関 | 企業 | 企業 | 企業 | 企業 | |
(参考)
FDA
http://www.fda.gov/cdrh/safety/bonecement.html
MDA(現MHRA)
http://www.medical-devices.gov.uk/mda/mdawebsitev2.nsf/webvwSearchResults/33D3E46766AA7E5980256EB5002819E5?OPEN
| 目次へ |
携帯電話端末等による植込み型心臓ペースメーカ及び植込み型除細動器(以下「植込み型医用機器」という)への影響については,医薬品副作用情報No.136(平成8年3月号),No.137(平成8年5月号)及びNo.143(平成9年6月号)において注意喚起を行い,盗難防止装置等による植込み型医用機器への影響については,医薬品等安全性情報No.155(平成11年6月号),医薬品・医療用具等安全性情報No.173(平成14年1月号),No.190(平成15年6月号)及びNo.203(平成16年7月号)において注意喚起を行ってきたところである。
総務省において,平成12年度から電波の医用機器への影響に関する調査を実施しているところであるが,平成16年度に実施した,新たに導入された方式による携帯電話端末(以下「新方式携帯電話端末」という」)から発射される電波が植込み型医用機器へ及ぼす影響に関する調査の結果において,「携帯電話端末を植込み型心臓ペースメーカ装着部位から22cm程度以上離すこと」などとした現行指針「医用電気機器への電波の影響を防止するための携帯電話端末等の使用に関する指針」(平成9年3月,不要電波問題対策協議会(現電波環境協議会))は妥当であることが確認された。
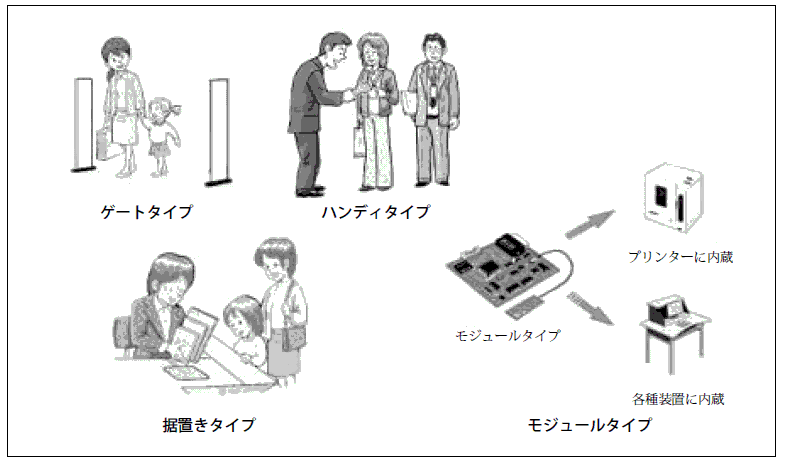
また,RFID機器*1(据置き型及びモジュール型)から発射される電波が植込み型医用機器へ及ぼす影響については,平成15年度に確認したハンディ型のRFID機器と同様に,22cm以上離せば影響が避けられることが確認された。
今回は当該報告の内容について紹介し,改めて医療関係者等に注意喚起を行うこととした。さらに,総務省より,平成16年度までに得られた,各種電波利用機器についての調査結果に基づき,影響防止のための指針として「各種電波利用機器の電波が植込み型医用機器へ及ぼす影響を防止するための指針」が公表されたので併せて紹介する。
| 注: | ここでは,公共施設や商業区域などの一般環境下で使用されるRFID機器として(社)日本自動認識システム協会により選定されたRFID機器を対象としており,工場内など一般人が入ることができない管理区域でのみ使用されるRFID機器(管理区域専用RFID機器)については対象外としている。 |
| ア) | 心臓ペースメーカについては,ペーシングパルスへの影響*2を生じる場合があることが確認された。この影響は,携帯電話端末を遠ざければ正常に復する可逆的なもので,最も遠く離れた位置でこの影響が確認されたときの距離は8cmであった。 |
| イ) | 除細動器のペースメーカ機能*3については,ペーシングパルスへの影響を生じる場合があることが確認された。この影響は,携帯電話端末を遠ざければ正常に復する可逆的なもので,最も遠く離れた位置でこの影響が確認されたときの距離は2cmであった。 また,除細動器の除細動機能*4については,影響は確認されなかった。 |
| ア) | 心臓ペースメーカについては,ペーシングパルスへの影響を生じる場合があることが確認された。この影響は,携帯電話端末を遠ざければ正常に復する可逆的なもので,最も遠く離れた位置でこの影響が確認されたときの距離は1cmであった。 |
| イ) | 除細動器については,ペースメーカ機能及び除細動機能のいずれに対しても影響は確認されなかった。 |
| 注: | 本調査では,植込み型医用機器へ及ぼす影響が最大となるよう,携帯電話端末の送信出力を最大にするなどの厳しい条件で試験をしており,調査結果(最も遠く離れた位置で影響が確認された距離等)を通常の通信状態における携帯電話通話方式間と比較して用いることは適当ではない。 |
| ア) | 心臓ペースメーカについては,ペーシングパルスへの影響を生じる場合があることが確認された。この影響は,据置き型RFID機器から遠ざかれば正常に復する可逆的なものであり,最も遠く離れた位置でこの影響が確認されたときの距離は14cmであった。 |
| イ) | 除細動器のペースメーカ機能については,ペーシングパルスへの影響を生じる場合があることが確認された。この影響は,据置き型RFID機器から遠ざかれば正常に復する可逆的なものであり,最も遠く離れた位置でこの影響が確認されたときの距離は6cmであった。 また,除細動器の除細動機能については,不要除細動ショック*5が発生する場合があることが確認された。最も遠く離れた位置でこの影響が確認されたときの距離は6cmであった。 |
| ア) | 心臓ペースメーカについては,モジュール型RFID機器のアンテナ部に密着させた状態で,ペーシングパルスへの影響を生じる場合があることが確認された。この影響は,モジュール型RFID機器から遠ざかれば正常に復する可逆的なものであった。 |
| イ) | 除細動器については,ペースメーカ機能及び除細動機能のいずれに対しても影響は確認されなかった。 |
2)RFID機器について
今回の調査の結果から,据置き型及びモジュール型のRFID機器については,ハンディ型同様,不用意に植込み型医用機器の22cm以内にRFID機器を接近させないように注意することが必要である。
| *1 | RFID(Radio Frequency
IDentification)機器:電子回路を内蔵したタグとリーダライタとの間で非接触で通信を行うことによりタグのデータを読み書きすることが可能な機器であり,物流,在庫管理や商品等の精算など,さまざまな分野で利用されている。 また,リーダライタの形状から次のような種類がある。 |
| *2 | ペーシングパルスへの影響:外部からの電波の影響により以下の状態が発生すること。 |
| ア) | 心臓ペースメーカ等が設定された周期でペーシングパルスを発生している状態において,外部からの電波の影響を受けたことによりペーシングパルスが抑圧された状態又は設定された周期からのずれが発生してしまった状態。 |
| イ) | 心臓ペースメーカ等のペーシングパルスが抑圧されている状態において,外部からの電波の影響を受けたことによりペーシングパルスが発生してしまった状態。 |
| *3 | 除細動器のペースメーカ機能:植込み型除細動器は,通常,植込み型心臓ペースメーカとして機能しており,このペースメーカ機能のこと。 |
| *4 | 除細動器の除細動機能:植込み型除細動器が心室細動(致死性不整脈の一種であり,心臓が突然痙攣を起こす現象)を検出した場合に,これを止めるために強力な電気ショックを与える機能のこと。 |
| *5 | 不要除細動ショック:心室細動がないにも係わらず,植込み型除細動器の除細動機能が働く現象のことで,可逆的影響であるものの,直ちに患者の病状を悪化させる可能性がある。 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 目次へ |
前号(医薬品・医療機器等安全性情報 No.215)以降に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について,改訂内容,参考文献等とともに改訂の根拠となった症例の概要に関する情報を紹介いたします。
【1】 バルプロ酸ナトリウム
| 販売名(会社名) | エスダブル錠200mg(東洋ファルマー) エピレナート徐放顆粒40%,同錠,同シロップ(藤永製薬) サノテン錠(辰巳化学) セボトボル錠(共和薬品工業) セレニカR顆粒,同R錠200mg(日研化学) セレブシロップ(太田製薬) デパケン細粒200,同細粒400,同錠100,同錠200,同R錠100,同R錠200,同シロップ(協和発酵工業) ハイセレニン細粒20,同細粒40%,同錠100,同錠200(日本オルガノン) バルプラムR顆粒(小林製薬工業) バルプロ酸ナトリウム細粒20%「EMEC」(サンノーバ) バレリン錠100mg,同錠200mg,同シロップ(大日本製薬) |
| 薬効分類等 | 抗てんかん剤,精神神経用剤 |
| 効能効果 | 各種てんかん(小発作・焦点発作・精神運動発作ならびに混合発作)およびてんかんに伴う性格行動障害(不機嫌・易怒性等)の治療 躁病および躁うつ病の躁状態の治療 |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
過敏症症候群があらわれることがあるので,観察を十分に行い,初期症状として発疹,発熱がみられ,さらにリンパ節腫脹,肝機能障害,白血球増加,好酸球増多,異型リンパ球出現等の症状があらわれた場合には投与を中止し,適切な処置を行うこと。なお,発疹,発熱,肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。 抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがあるので,観察を十分に行い,低ナトリウム血症,低浸透圧血症,尿中ナトリウム量の増加,高張尿等があらわれた場合には水分摂取の制限等の適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 販売開始後(約30年間)の関連副作用報告数 (「因果関係が否定できるもの」以外のもので,「因果関係が不明なもの」も含む。) ・過敏症症候群:10例(うち死亡0例) ・抗利尿ホルモン不適合分泌症候群(SIADH):5例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:55万人(平成16年度) |
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 女 20代 |
双極性感情障害[躁うつ病] (なし) |
600mg 17日間 ↓ 800mg 14日間 ↓ (2日間投与なし) ↓ 800mg 3日間 |
|
企業報告 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:炭酸リチウム,塩酸クロルプロマジン,塩酸ビペリデン,エチゾラム,非ピリン系感冒剤 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 男 80代 |
てんかん発作 (糖尿病) |
800mg 約3年7ヵ月間 |
|
企業報告 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:グリクラジド,塩酸ジフェニドール | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 販売名(会社名) | イテオパン錠(東和薬品) エリカプリック錠(シオノケミカル) セスフラン錠(長生堂製薬) ニフラン錠(三菱ウェルファーマ),同シロップ(同仁医薬化工) ノイペインカプセル(日本医薬品工業) プラノプロフェン液1.5%MEEK(小林化工) プランサスシロップ(久光製薬) プランドフェン錠(ニプロファーマ) マブールカプセル(大正薬品工業) ルポック錠(東洋ファルマー) |
| 薬効分類等 | 解熱鎮痛消炎剤 |
| 効能効果 | (錠剤,カプセル剤,液剤) (1)下記疾患ならびに症状の消炎・鎮痛 慢性関節リウマチ,変形性関節症,腰痛症,頸肩腕症候群,歯根膜炎,痛風発作 (2)下記疾患の解熱・鎮痛 急性上気道炎(急性気管支炎を伴う急性上気道炎を含む) (3)外傷後,小手術後ならびに抜歯後の消炎・鎮痛 (シロップ剤) 下記疾患の解熱 急性上気道炎(急性気管支炎を伴う急性上気道炎を含む) |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
間質性肺炎,好酸球性肺炎:間質性肺炎,好酸球性肺炎があらわれることがあるので,発熱,咳嗽,呼吸困難等の症状があらわれた場合には投与を中止し,速やかに胸部X線検査,血液検査等を実施し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 販売開始後(約25年間)の関連副作用報告数 (「因果関係が否定できるもの」以外のもので,「因果関係が不明なもの」も含む。) ・間質性肺炎,好酸球性肺炎:6症例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:約170万人(平成16年4月1日〜平成17年3月31日) |
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | ||||||||||||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||||||||||||
| 1 | 女 50代 |
感冒 (頸椎症,高脂血症,高血圧) |
225mg 6日間 |
|
企業報告 | |||||||||||||||||||||||||||||||||
臨床検査値
| ||||||||||||||||||||||||||||||||||||||
| 併用薬:ザルトプロフェン,塩酸エペリゾン,ジクロフェナクナトリウム,シサプリド,オフロキサシン,アルプラゾラム,プラバスタチンナトリウム,メチルドパ,ピンドロール,塩酸ラニチジン | ||||||||||||||||||||||||||||||||||||||
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | ||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||
| 2 | 男 40代 |
上気道炎 (なし) |
225mg 3日間 |
|
企業報告 | |||||||||||||||
臨床検査値
| ||||||||||||||||||||
| 併用薬:ヒベンズ酸チペピジン,塩酸セフカペンピボキシル | ||||||||||||||||||||
| 販売名(会社名) | オースギ補中益気湯エキスG(高砂薬業) カネボウ補中益気湯エキス細粒(カネボウ) コタロー補中益気湯エキス細粒(小太郎漢方製薬) サカモト補中益気湯エキス顆粒(阪本漢法製薬) 三和補中益気湯エキス細粒(三和生薬) JPS補中益気湯エキス顆粒〔調剤用〕(ジェ−ピ−エス製薬) ジュンコウ補中益気湯FCエキス細粒医療用(康和薬通) 太虎堂の補中益気湯エキス顆粒,同エキス散(太虎精堂製薬) ツムラ補中益気湯エキス顆粒(医療用)(ツムラ) テイコク補中益気湯エキス顆粒(帝國漢方製薬) 〔東洋〕補中益気湯エキス細粒(東洋薬行) 補中益気湯エキス顆粒T(東亜薬品) ホノミ補中益気湯Nエキス顆粒(剤盛堂薬品) 本草補中益気湯エキス顆粒-M(本草) |
| 薬効分類等 | 漢方製剤 |
| 効能効果 | コタロー補中益気湯エキス細粒 胃腸機能減退し,疲労倦怠感があるもの,あるいは頭痛,悪寒,盗汗,弛緩性出血などを伴うもの。 結核性疾患および病後の体力増強,胃弱,貧血症,夏やせ,虚弱体質,低血圧,腺病質,痔疾,脱肛。 三和補中益気湯エキス細粒 体力が乏しく貧血ぎみで,胃腸機能が減退し,疲労倦怠感や食欲不振あるいは盗汗などあるものの次の諸症 病後・術後の衰弱,胸部疾患の体力増強,貧血症,低血圧症,夏やせ,胃弱,胃腸機能減退,多汗症 ツムラ補中益気湯エキス顆粒(医療用) 消化機能が衰え,四肢倦怠感著しい虚弱体質者の次の諸症 夏やせ,病後の体力増強,結核症,食欲不振,胃下垂,感冒,痔,脱肛,子宮下垂,陰萎,半身不随,多汗症 その他 元気がなく胃腸のはたらきが衰えて疲れやすいものの次の諸症 虚弱体質,疲労倦怠,病後の衰弱,食欲不振,ねあせ |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
間質性肺炎:発熱,咳嗽,呼吸困難,肺音の異常(捻髪音)等があらわれた場合には,本剤の投与を中止し,速やかに胸部X線等の検査を実施するとともに副腎皮質ホルモン剤の投与等の適切な処置を行うこと。また,発熱,咳嗽,呼吸困難等があらわれた場合には,本剤の服用を中止し,ただちに連絡するよう患者に対し注意を行うこと。 |
| 〈参 考〉 | 企業報告 販売開始後(約21年間)の関連副作用報告数 (「因果関係が否定できるもの」以外のもので,「因果関係が不明なもの」も含む。) ・間質性肺炎:5例(うち死亡1例) 年間使用者数:約14万人(平成16年度) |
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | ||||||||||||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||||||||||||
| 1 | 女 80代 |
食欲不振 (気管支喘息,骨粗鬆症) |
7.5g 170日間 |
|
企業報告 | |||||||||||||||||||||||||||||||||
臨床検査値
| ||||||||||||||||||||||||||||||||||||||
血液ガス(02 10L/分)
| ||||||||||||||||||||||||||||||||||||||
免疫血清検査
| ||||||||||||||||||||||||||||||||||||||
| 併用薬:テオフィリン,ビフィズス菌製剤,スクラルファート,メナテトレノン,酸化マグネシウム,乳酸カルシウム,アルファカルシドール | ||||||||||||||||||||||||||||||||||||||
| NO. | 患者 | 1日投与量 投与期間 |
副作用 | 備考 | |||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||
| 2 | 男 80代 |
便秘 (高血圧症,神経因性膀胱,脳血管性痴呆,脳梗塞) |
7.5g 1119日間 |
|
企業報告 | ||||||||||||||||||||||||
臨床検査値
| |||||||||||||||||||||||||||||
| 併用薬:塩酸チクロピジン,ニソルジピン,塩酸イミプラミン,塩酸タムスロシン,フルバスタチンナトリウム,フロセミド | |||||||||||||||||||||||||||||
| 目次へ |
前号(医薬品・医療機器等安全性情報
No.215)以降に改訂を指導した医薬品の使用上の注意(本号の「3 重要な副作用等に関する情報」で紹介したものを除く。)について,改訂内容,主な該当販売名,参考文献等をお知らせいたします。
| 1 | 〈抗てんかん剤,精神神経用剤〉 カルバマゼピン | |
| [販 売 名] | テグレトール細粒50%,同錠100mg,同錠200mg(ノバルティスファーマ)他 |
| [副作用 (重大な副作用)] |
再生不良性貧血,汎血球減少,白血球減少,無顆粒球症,溶血性貧血,赤芽球癆,血小板減少:重篤な血液障害があらわれることがあるので,定期的に血液検査を実施するなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。 過敏症症候群:初期症状として発熱,発疹がみられ,さらにリンパ節腫脹,関節痛,白血球増加,好酸球増多,異型リンパ球出現,肝脾腫,肝機能障害等の臓器障害を伴う遅発性の重篤な過敏症状があらわれることがある。また,発疹,発熱,肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。なお,ヒトヘルペスウイルス6(HHV-6)等のウイルス再活性化を伴うことが多い。このような症状があらわれた場合には投与を中止し,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 2 | 〈鎮けい剤〉 塩酸チザニジン | |
| [販 売 名] | テルネリン顆粒0.2%,同錠1mg(ノバルティスファーマ)他 | |
| [禁忌] |
| |
| [相互作用 (併用禁忌)] |
| |
| 〈参 考〉 | 企業報告 |
| 3 | 〈高脂血症用剤〉 コレスチミド | |
| [販 売 名] | コレバイン顆粒70%,同ミニ83%,同錠500mg(三菱ウェルファーマ) |
| [慎重投与] | 高齢者又は嚥下困難がある患者 |
| [重要な基本 的注意] |
誤って気道に入った本剤が膨潤し,呼吸困難を起こした症例が報告されているので,以下の事項に注意して服用させること。 1)本剤は十分量(200mL程度)の水で服用させること。のどの奥に残った場合には,さらに水を飲み足させること。 2)温水(湯,温かい茶等)にて服用すると膨らんで服用できない場合があるので常温の水又は冷水で服用させること。 3)口中に長く留めていると膨らんで服用できない場合があるので速やかに嚥下させること。 4)錠剤の場合は1錠ずつ服用させること。 |
| 〈参 考〉 | 企業報告 |
| 4 | 〈鎮痛,鎮痒,収斂,消炎剤〉 ブフェキサマク | |
| [販 売 名] | アンダーム軟膏,同クリーム(帝國製薬)他 |
| [副作用 (重大な副作用)] |
接触皮膚炎:本剤使用部位に発現したそう痒感,発赤・紅斑,腫脹,浮腫,水疱・びらん等の皮膚炎症状が全身に拡大し,重篤化することがあるので,異常が認められた場合には直ちに使用を中止し,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 5 | 〈止血剤〉 ポリドカノール | |
| [販 売 名] | エトキシスクレロール1%注射液(堺化学工業) |
| [重要な基本 的注意] |
本剤の投与により食道血腫を形成することがあるので,経過観察を十分に行い,異常が認められた場合には,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 6 | 〈糖尿病用剤〉 塩酸メトホルミン | |
| [販 売 名] | グリコラン錠(日本新薬),メルビン錠(住友製薬)他 |
| [副作用 (重大な副作用)] |
肝機能障害,黄疸:AST(GOT),ALT(GPT),Al-P,γ-GTP,ビリルビンの著しい上昇等を伴う肝機能障害,黄疸があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 7 | 〈漢方製剤〉 小青竜湯 | |
| [販 売 名] | カネボウ小青竜湯エキス細粒(カネボウ)他 |
| [副作用 (重大な副作用)] |
間質性肺炎:発熱,咳嗽,呼吸困難,肺音の異常(捻髪音)等があらわれた場合には,本剤の投与を中止し,速やかに胸部X線等の検査を実施するとともに副腎皮質ホルモン剤の投与等の適切な処置を行うこと。また,発熱,咳嗽,呼吸困難等があらわれた場合には,本剤の服用を中止し,ただちに連絡するよう患者に対し注意を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 8 | 〈合成抗菌剤〉 シプロフロキサシン,塩酸シプロフロキサシン | |
| [販 売 名] | シプロキサン注200mg,同注300mg,同錠100mg,同錠200mg(バイエル薬品)他 | |
| [禁忌] |
| |
| [相互作用 (併用禁忌)] |
| |
| 〈参 考〉 | 企業報告 |
| 9 | 〈抗ウイルス剤〉 リン酸オセルタミビル | |
| [販 売 名] | タミフルカプセル75,同ドライシロップ3%(中外製薬) |
| [副作用 (重大な副作用)] |
出血性大腸炎:出血性大腸炎があらわれることがあるので,血便,血性下痢等の異常が認められた場合には投与を中止し,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 10 | 〈他に分類されない治療を主目的としない医薬品〉 ニコチン | |
| [販 売 名] | ニコチネルTTS30,同20,同10(ノバルティスファーマ) |
| [副作用 (重大な副作用)] |
アナフィラキシー様症状:低血圧,頻脈,呼吸困難,蕁麻疹,血管浮腫等の全身症状を伴うアナフィラキシー様症状があらわれることがある。このような場合には投与を中止するなど,適切な処置を行うこと。 |
| 〈参 考〉 | 企業報告 |
| 11 | 一般用医薬品 ブフェキサマク含有製剤 | |
| [販 売 名] | マックカラミラクリーム(福地製薬),ロマーナクリーム(東光薬品工業) |
| [相談すること] | 次の場合は,直ちに使用を中止し,この文書を持って医師又は薬剤師に相談すること 使用後,次の症状があらわれた場合 まれに下記の重篤な症状が起こることがあります。その場合は直ちに医師の診療を受けること。 接触皮膚炎:塗布部に発疹・発赤,かゆみ,はれ,かぶれ等があらわれ,これらの症状が全身に広がり,重症化することがある。 |
| 〈参 考〉 | 企業報告 |
| 12 | 一般用医薬品 小青竜湯 | |
| [販 売 名] | ツムラ漢方小青竜湯エキス顆粒他 |
| [相談すること] | 次の場合は,直ちに服用を中止し,この文書を持って医師又は薬剤師に相談すること 服用後,次の症状があらわれた場合 まれに下記の重篤な症状が起こることがあります。その場合は直ちに医師の診療を受けること。 間質性肺炎:せきを伴い,息切れ,呼吸困難,発熱等があらわれる。 |
| 〈参 考〉 | 企業報告 |
| 13 | 一般用医薬品 補中益気湯 | |
| [販 売 名] | ツムラ漢方補中益気湯エキス顆粒他 |
| [相談すること] | 次の場合は,直ちに服用を中止し,この文書を持って医師又は薬剤師に相談すること 服用後,次の症状があらわれた場合 まれに下記の重篤な症状が起こることがあります。その場合は直ちに医師の診療を受けること。 間質性肺炎:せきを伴い,息切れ,呼吸困難,発熱等があらわれる。 |
| 〈参 考〉 | 企業報告 |
| 目次へ |
| (平成17年8月1日現在) |
| 一般名
販売名 |
製造販売業者名 | 市販直後調査開始年月日 |
| 塩酸プラルモレリン
注射用GHRP科研100 |
科研製薬(株) | 平成17年2月25日 |
| 硫酸アルミニウムカリウム・タンニン酸
ジオン注無痛化剤付,同注生食液付 |
三菱ウェルファーマ(株) | 平成17年3月15日 |
| 塩酸エピナスチン
アレジオンドライシロップ1% |
日本ベーリンガーインゲルハイム(株) | 平成17年3月23日 |
| エタネルセプト(遺伝子組換え)
エンブレル皮下注用25mg |
ワイス(株) | 平成17年3月30日 |
| オキサリプラチン
エルプラット注射用100mg |
(株)ヤクルト本社 | 平成17年4月6日 |
| タクロリムス水和物
プログラフカプセル0.5mg,同カプセル1mg*1 |
アステラス製薬(株) | 平成17年4月11日 |
| エムトリシタビン
エムトリバカプセル200mg |
日本たばこ産業(株) | 平成17年4月19日 |
| エムトリシタビン・フマル酸テノホビルジソプロキシル配合剤
ツルバダ錠 |
日本たばこ産業(株) | 平成17年4月19日 |
| ロスバスタチンカルシウム
クレストール錠2.5mg,同錠5mg |
アストラゼネカ(株) | 平成17年4月27日 |
| ボセンタン水和物
トラクリア錠62.5mg |
アクテリオン ファーマシューティカルズ ジャパン(株) | 平成17年6月10日 |
| タミバロテン
アムノレイク錠2mg |
東光薬品工業(株) | 平成17年6月13日 |
| トシリズマブ(遺伝子組換え)
アクテムラ点滴静注用200 |
中外製薬(株) | 平成17年6月13日 |
| アデノシン
アデノスキャン注60mg |
第一サントリーファーマ(株) | 平成17年6月21日 |
| ボリコナゾール
ブイフェンド錠50mg,同錠200mg,同200mg静注用 |
ファイザー(株) | 平成17年6月27日 |
| ルリコナゾール
ルリコンクリーム1%,同液1% |
ポーラ化成工業(株) | 平成17年7月20日 |
| 目次へ |
|
|
照 会 先 厚生労働省医薬食品局安全対策課 03-5253-1111(内線)2753