厚生労働科学研究補助金(食品の安全性高度化推進研究事業)
分担研究報告書
分担研究者 堤 智昭 国立医薬品食品衛生研究所
分担研究報告書
| (3) | 食品中ダイオキシン類分析の迅速化・信頼性向上に関する研究 |
| (3-1) | 高速流下加熱抽出装置による市販魚中ダイオキシン類の抽出法の検討 |
分担研究者 堤 智昭 国立医薬品食品衛生研究所
| 研究要旨 高速加熱流下抽出装置(ダイアインスツルメンツ社製SE-100型)を用いた魚試料からのダイオキシン類の抽出法を検討した。抽出条件を検討した結果、溶媒にアセトン−ヘキサン(1:1)混液を使用し、温度30℃、流速6ml/minの条件で1時間抽出を行えば、良好に魚試料からダイオキシン類を抽出できることが判明した。従来法であるアルカリ分解・溶媒抽出法と比較した結果、得られたダイオキシン類異性体の各定量値は従来法と良く一致した(±10%以内)。また、種々の魚試料(n =12)に適用し、従来法の毒性等量濃度と比較した結果、非常に高い相関(r =0.99)が認められた。本抽出法は短時間(約1.5時間)でダイオキシン類を抽出でき、さらに従来法のようにアルカリ溶液を使用しないためダイオキシン類の分解を懸念する必要がない。従って、本抽出法は魚試料中のダイオキシン類分析の迅速化・信頼性の向上に有効であると考えられる。 |
|
研究協力者 国立医薬品食品衛生研究所・食品部 天倉吉章、佐々木久美子 株式会社ダイアインスツルメンツ 伊藤 日本男、栗原 浩 |
| A. | 研究目的 ダイオキシン類の摂取は、そのほとんどが食事経由であり、我が国では魚介類を介した摂取が多い1)。特に鮮魚はダイオキシン類濃度が高いことから、汚染状況を迅速に把握することが、人の健康への影響を防ぐ上で重要な課題となっている。これら食品中のダイオキシン類分析では、試料由来の強力なマトリックスのため、アルカリ溶液によりマトリックスを分解後、溶媒抽出を行う方法が汎用されている。しかし、アルカリ分解中に一部のダイオキシン類の分解が指摘されており、アルカリ分解条件には注意を要する2,3)。また、高濃度のアルカリ溶液を使用するため危険性が高いことや、アルカリ分解に長時間(長い場合で一晩)要する等の問題点もある。そこで、これらの問題点を改善するため、アルカリ溶液を使用しない抽出法である高速加熱流下抽出装置(ダイアインスツルメンツ社製SE-100型)の市販魚試料に対する適用を検討した。 近年開発された高速加熱流下抽出装置は、加温した有機溶媒によりダイオキシン類を迅速に抽出する装置である。試料の抽出をほぼ常圧で行うため、安全性も高い。なお、装置の概要を図1に示した。本装置は土壌、飛灰などの環境試料で、ソックスレー抽出よりも迅速かつ効率よくダイオキシン類を抽出できることが明らかになっている4)。本研究では本装置を用いて、魚試料からのダイオキシン類の抽出条件の検討、及び従来法であるアルカリ分解・溶媒抽出法とのダイオキシン類定量値の比較を行った。 |
| B. | 研究方法 |
| 1. | 試薬、試液及び器具 ジエチルエーテル及び無水硫酸ナトリウムは残留農薬試験・PCB試験用(関東化学(株))を使用した。その他の溶媒は、全てダイオキシン類分析用(関東化学(株))を使用した。多層シリカゲルカラム(ガラス製4層)はジーエルサイエンス(株)を使用した。アルミナはダイオキシン分析用(ICN社)、活性炭は活性炭分散シリカゲル(関東化学(株))を使用し、各カラムは食品のダイオキシン分析暫定ガイドライン5)に従い作製した。ダイオキシン類標準品はWellington社製を使用した。 |
| 2. | 試料 魚試料は、東京都内のスーパーマーケットで購入した。魚試料は筋肉部を採取後、ホモジナイザーで均一化し使用した。 |
| 3. | 装置 ホモジナイザーは(株)日本精機製作所製マルチブレンダーミルを用いた。また、高分解能ガスクロマトグラフ質量分析計(HRGC/HRMS)は日本電子製(JMS-700)を使用した。 |
| 4. | 高速加熱流下抽出 魚試料(20g)をガラス乳鉢に秤とり、無水硫酸ナトリウム(80g)と十分にすりつぶしながら混合した。これを予め無水硫酸ナトリウム(5g)を詰めたSUS製抽出カラム(160ml)に抽出溶媒を満たしながら充填した。さらに試料の上部に無水硫酸ナトリウム(5g)を積層し、抽出管を溶媒で満たした後、抽出装置に装着した。抽出溶媒としてアセトン−ヘキサン(1:1)混液を使用した場合は、恒温槽を30℃に昇温し(昇温後の静置時間15min)、6ml/minで通液し抽出液を得た。また、抽出溶媒としてトルエンを使用した場合は、恒温槽を80℃に昇温し(昇温後の静置時間15min)、6ml/minで通液し抽出液を得た。なお、クリーンアップスパイクは抽出条件を検討する試験では抽出液に、従来法とダイオキシン類定量値の比較を行う試験では抽出カラムに詰めた魚試料に添加した。図2には、本抽出法のフローチャートを示した。 |
| 5. | アルカリ分解・溶媒抽出 平成13年度厚生科学研究費補助金(生活安全総合研究事業)分担研究報告書(1-2)(ダイオキシン類の迅速測定法の開発及び分析の精密化に関する研究)と同様に行った。概略を述べると、魚試料(20g)にクリーンアップスパイクを添加した後、水酸化カリウム水溶液(2mol/L)を加え室温で16時間放置し、アルカリ分解を行った。アルカリ分解後、メタノールを加え、ヘキサンで振とう抽出を行った。その後、抽出液は塩化ナトリウム水溶液により洗浄した。 |
| 6. | クリーンアップ及びHRGC/HRMS分析 食品のダイオキシン分析暫定ガイドライン5)に従い分析した。 |
| 7. | 脂肪含量の測定 魚試料(10g)をガラス乳鉢に秤とり、無水硫酸ナトリウム(40g)と十分にすりつぶしながら混合した。これを分液ロートに入れ、ジエチルエーテル−ヘキサン(1:2)混液(150ml)で3回、10分間振とう抽出した。抽出液はヘキサン洗浄水で2回洗浄した後、無水硫酸ナトリウムで脱水した。溶媒を留去し、デシケーター内で乾燥後、重量を測定した。 |
| C. | 研究結果及び考察 |
| 1. | 高速加熱流下抽出装置における抽出条件の検討 本装置を用いたダイオキシン類の抽出条件を2種の魚試料を用いて検討した。魚試料の選択にあたっては、脂肪含量の多い試料としてブリ(脂肪含量21.8%)、脂肪含有量が少ない試料としてスズキ(脂肪含量0.8%)の2種の魚試料を選択した。図3には両試料を用いて、アセトン−ヘキサン(1:1)混液による抽出液を1時間毎に4時間まで分画し、その後、トルエンによる抽出を行った場合のダイオキシン類累積濃度を示した。その結果、両試料ともアセトン−ヘキサン混液を1時間通液(6ml/min、30℃)すれば、ほぼ完全にPCDD/Fs及びCo-PCBsを抽出できることが判明した。また、本試験で使用した魚試料は比較的高濃度にダイオキシン類を含んでいる試料を選択した。魚試料は高濃度のCo-PCBsに汚染されている場合が多いが、本条件ではこのような試料においても短時間で十分な抽出効率が得られるものと考えられる。 |
| 2. | 本抽出法とアルカリ分解・溶媒抽出法との比較 本抽出法で得られたダイオキシン類異性体の定量値を従来法と比較するため、2種の魚試料を用いて比較試験を行った(表1)。同一の魚試料を3回、本抽出法と従来法で測定した結果、本抽出法で得られたダイオキシン類異性体の平均定量値は従来法と比較して大きな差は認められず(±10%以内)、ダイオキシン類異性体の魚試料からの抽出効率は従来法と同等であることが示唆された。また、本抽出法で得られた定量値の相対標準偏差(RSD)はブリで17.4%以下、スズキで17.6%以下であり、従来法のRSD(ブリで24.2%以下、スズキで26.2%以下)と同等以上であり、良好な分析精度であった。両抽出法により得られたブリのSIMクロマトグラムを図4に示した。このように、本法により得られたクロマトグラムのパターンは従来法とほぼ同一であり、定量ピークに対する夾雑物の妨害ピークは認められなかった。なお、ロックマスの変動は両抽出法のクロマトグラムにおいて認められなかった(データ未掲載)。 さらに種々の魚試料(n =12)に適用し、従来法の毒性等量濃度と比較を行った(図5)。その結果、本法と従来法で得られたPCDD/Fs及びCo-PCBsのTEQ濃度の間には、非常に高い相関(r =0.99)が認められた。また、いずれの場合も回帰直線の傾きは1に近く、切片は0に近い値を示すことから、本抽出法により得られたTEQ濃度は従来法と同等であると示唆された。図6には、比較試験(図5)で得られた本法と従来法のクリーンアップスパイクの回収率の比較を示した。本法の回収率は従来法と比較して同程度であり、全ての異性体についてガイドライン5)で定められている範囲内(40〜120%)であった。 本抽出法は短時間(約1.5時間)でダイオキシン類を抽出でき、従来法の所要時間(長い場合で20時間程度)と比較すると大幅に抽出時間が短縮できた。さらに、アルカリ溶液を使用しないためダイオキシン類の分解を懸念する必要が無く、信頼性・安全性の向上に有効であると考えられる。しかし、従来法と比較すると前処理過程における硫酸処理に若干、時間を要する問題点があった。従来法ではアルカリ分解中に脂質・タンパク質等のマトリックスの分解がある程度行われるため、多少の精製効果が得られる。一方、本法は抽出時にこのような精製効果は期待できないため、前処理過程が若干、煩雑になったと考えられる。本法において、抽出と同時に何らかの精製効果が得られるような工夫が将来必要になると考えられる。 |
| D. | 結論 |
| 1) | 高速加熱流下抽出装置は、市販魚中のダイオキシン類を短時間で抽出することが可能であった。 |
| 2) | 比較試験を行った結果、魚試料からのダイオキシン類の抽出効率は従来法と同等であると考えられた。 |
| 3) | 本抽出法はアルカリ溶液を使用しないためダイオキシン類の分解を懸念する必要が無く、ダイオキシン類分析の迅速化・信頼性の向上に有効であると考えられる。 |
| E. | 参考文献 |
| 1) | Tsutsumi, T., Iida, T., Hori, T., Nakagawa, R., Tobiishi, K., Yanagi, T., Kono, Y., Uchibe, H., Matsuda, R., Sasaki, K., Toyoda, M., Update of daily intake of PCDDs, PCDFs, and dioxin-like PCBs from food in Japan. Chemosphere, 45 (2001) 1129-1137. |
| 2) | 高菅卓三、青野さや香、秋月哲也、中川貴之、渡邊清彦、井上毅:アルカリ分解法を用いたPCB、ダイオキシン分析の課題.第10回環境化学討論会講演要旨集(2001) 28-29. |
| 3) | Tsutsumi, T., Amakura, Y., Sasaki, K., Toyoda, M., Maitani, T., Evaluation of an aqueous KOH digestion followed by hexane extraction for analysis of PCDD/Fs and dioxin-like PCBs in retailed fish. Analytical and Bioanalytical Chemistry, 375 (2003) 792-798. |
| 4) | 加藤みか、浦野紘平、清水優子、小口正弘、伊藤日本男、栗原浩:固体試料からのダイオキシン類等高沸点有機物の「高速流下抽出装置」.第12回環境化学討論会講演要旨集(2003) 616-617. |
| 5) | 厚生省生活衛生局“食品中のダイオキシン類及びコプラナーPCBの測定方法暫定ガイドライン”平成11年10月 |
| F. | 研究業績 |
| 1. | 論文発表 なし |
| 2. | 学会発表
|
図・表(PDF:203KB)
厚生労働科学研究費補助金(食品の安全性高度化推進研究事業)
分担研究報告書
−植物性食品の迅速抽出への応用−
分担研究者 堤 智昭 国立医薬品食品衛生研究所
分担研究報告書
| (3) | 食品中ダイオキシン類分析の迅速化・信頼性向上に関する研究 |
| (3-2) | 食品中ダイオキシン類分析における高速溶媒抽出法の応用に関する研究 |
分担研究者 堤 智昭 国立医薬品食品衛生研究所
| 研究要旨 食品中のダイオキシン類分析方法の迅速化を主たる目的として、高速溶媒抽出法(以下ASE)について検討を行った。平成16年度は植物性食品試料を対象に検討した。国内産乾海苔の粉末を用いてASEと従来法(アセトン・ヘキサン溶媒振とう法)とのダイオキシン類定量値の比較を行った。ASEを使用した場合の定量値の再現性は従来法とほぼ同様であった。一方、各異性体の定量値はASEの方が従来法よりも1.1〜3.2倍の高値を示し、ASEの抽出効率の方が高いと推察された。また、植物性食品21試料におけるASE適用時のダイオキシン類のクリーンアップスパイクの回収率は45〜116%であり、「食品中のダイオキシン類及びコプラナーPCBsの測定方法暫定ガイドライン」の要求事項(40〜120%)に適合していた。以上の結果から、ASEは植物性食品試料におけるダイオキシン類の迅速かつ精密な抽出方法として使用することが可能と考えられる。 |
研究協力者
| 福岡県保健環境研究所 堀 就英、飛石和大、中川礼子、飯田隆雄 |
| A. | 研究目的 環境中のダイオキシン類は食物連鎖を通じて生物濃縮され、最終的には主に食事を介してヒトへ取り込まれる。耐容一日摂取量、すなわちヒトに対する長期間曝露の許容量は、体重1kgあたり4pg(pg(ピコグラム)は一兆分の一グラム)まで、という非常に僅かな量であり、食品汚染に関する分析調査においては、この「極微量」を高い精度で計測することが要求されている。 現在の食品中ダイオキシン類分析の問題点のひとつとして、分析結果を得るまでに長時間を要することが挙げられる。とりわけ抽出操作は煩雑で一度に処理できる試料の数は極めて限られたものとなっており、食品汚染の把握すなわちモニタリングという観点から、迅速で簡便な抽出方法の開発が望まれている。 迅速な分析方法の開発は、健康危機管理という観点からも非常に重要である。環境汚染と食品汚染は密接に関わり、海外では畜産物が汚染飼料を通じて高濃度に汚染され、社会問題となった1)。国内においても農作物の汚染報道をきっかけに起こった風評被害は未だ記憶に新しいところである2)。最近も個別の事業所からの局所的なダイオキシン汚染等、大規模な食品汚染問題に発展しかねない事例が発生しており3)、「食品とダイオキシン」に関わる緊急事態に速やかに対応するため、迅速分析法の確立が待望されている。 そこで本研究では、食品中ダイオキシン類の分析操作、特に抽出操作に着目し、ダイオキシン類の分析方法の効率化・迅速化について検討した。 |
| B. | 研究方法 |
| 1. | 試料 実験に用いた植物性食品はすべて国内の小売店で購入し、可食部をフードプロセッサーで均一化し、分析試料とした。試験法のバリデーションに用いた乾海苔は粉末に加工し、十分に均一化して用いた。 |
| 2. | 抽出 高速溶媒抽出(以下ASE)にはASE-300(DIONEX社製)を用いた。抽出条件は以下の通りである。 抽出セル容量:99ml、捕集バイアル容量:200ml、圧力:1,500psi、加熱時間:7分、静置時間:10分、フラッシュ容積:セル容量の30%、パージ時間:150秒、静置サイクル数:2回、1検体当たりの合計抽出時間:約30分 試料分散剤(珪藻土)はInternational Sorbent Technology 社製BULK ISOLUTE SORBENT ISOLUTE HM-Nを同条件で2回洗浄したものを用いた。 均一化した試料(20g)を200ml容テフロン製遠沈管に正確に量り取り、珪藻土を乾燥試料においては約10g、水分の多い試料では約30g加え、よく混合した。混合物を抽出用セル(99ml)に移し、セルの上端まで珪藻土を加えた後、クリーンアップスパイクを添加し抽出に供した。 アセトン・ヘキサン溶媒振とう抽出は「食品中のダイオキシン類及びコプラナーPCBsの測定方法暫定ガイドライン」(厚生省、1999年)に従って行った。抽出に用いる溶媒量は乾海苔の場合300ml×2(計600ml)、その他の試料では200ml×2(計400ml)とした。 試料の抽出及び精製操作を図1にまとめた。 |
| 3. | 試薬及び測定装置 ダイオキシン類標準品はWellington Laboratories製を、アセトン、n -ヘキサン、トルエン、ジクロロメタン、無水硫酸ナトリウムは関東化学(株)製のダイオキシン類分析用を用いた。多層シリカゲルカラム用の各種充填剤は和光純薬(株)製を用いた。活性炭カラムクロマトグラフィーには、活性炭(ナカライテスク社製)をトルエンで約30時間還流洗浄し、無水硫酸ナトリウムに対して0.1%(w/w)になるよう混合したものを用いた。活性炭シリカゲルカラムには、関東化学社製の活性炭分散シリカゲルを用いた。試料中のPCDDs(7種類)、PCDFs(10種類)、ノンオルトコプラナーPCBs(4種類)の同定・定量には、溶媒除去大容量注入装置(SCLV injection system、SGE社製)を装着したHP 6890GC/Micromass AUTOSPEC ULTIMA型高分解能ガスクロマトグラフ/質量分析計(以下高分解能GC/MS)を用いた。モノオルトコプラナーPCBs(8種類)の測定は高分解能GC/MSを用いてスプリットレスインジェクション方式で行った。 |
| C. | 研究結果及び考察 |
| 1. | 迅速分析方法開発のスキーム 我が国における食品中ダイオキシン類分析方法の標準は「食品中のダイオキシン類及びコプラナーPCBsの測定方法暫定ガイドライン」(以下「ガイドライン」)である。ガイドラインでは、野菜・果実等の植物性食品の試験方法として「アセトン・ヘキサン溶媒振とう抽出法」(以下溶媒振とう抽出)が記載されている。またガイドラインに示された以外の手法でも、ガイドラインの要件を満たすことが実証され、分析精度が十分に確保されていれば、これを使用することができる。 溶媒振とう抽出の難点として、A.抽出に長時間を要する(計2時間)、B.分析一回あたりの試料採取量が多く、抽出に多量の溶媒を必要とする(試料100gに対し400ml)、C.使用するガラス器具のサイズが大きく取り扱いが不便である、等が挙げられる。 ガイドラインが要求する検出下限値は0.01〜1pg/gである。これらの検出下限を達成するためには、従前の測定機器の感度から考察すると、一回の抽出に概ね100g以上の試料が必要である。これは食品のダイオキシン分析が多くの労力、時間を必要とする所以であり、従って測定機器の高感度化は分析操作の迅速・効率化に最も効果的な手段といえる。そこで本研究では、GC/MSに溶媒除去大容量注入装置を装着し、従来の1/5量の20gの食品試料から、従来法と同等またはそれ以上の感度でダイオキシン類を検出・同定できる測定系を用い4,5)、迅速抽出法の検討を行うこととした。 今回、食品中ダイオキシン類の新規抽出方法として採り上げたASEは既に米国公定法EPAメソッド3545にPFE(Pressurized Fluid Extraction)として環境中の多環芳香族化合物等の抽出方法に採用されている。また土壌や底質のダイオキシン類迅速抽出方法として応用が試みられている6,7)。本抽出法の利点は従来法と比較して短時間で溶媒使用量も少なく、自動化が出来るという効率性にある。ASEの食品中ダイオキシン類分析への適用例は国内外で僅かであり8,9)、その適用性を精査した例は殆ど見当たらない。そこで食品試料におけるダイオキシン類の抽出方法としてASEが使用できるか否か、本年度は植物性食品を対象に検討した。 まず同一の食品試料をASEと従来法で抽出し、精製以降は共通の操作を行い、定量値を比較した。食品に含まれるダイオキシン類が試料の内部や表面に強く吸着していると想定した場合、標準品を添加して行う添加回収試験ではその抽出効率を正確に評価することは困難と考えられる。すなわち同等性評価で用いる試料は均質性が高く(液状または粉末状)、多くのダイオキシン同族体を含有している試料が望ましい。そこで過去の個別食品の汚染調査結果から、植物性食品の中でも比較的ダイオキシン類の検出頻度の高い乾海苔を試料として選定した。 さらに種々の植物性食品試料において適切なクリーンアップスパイク(CS)の回収率が得られるか検討し本抽出法の妥当性を検討した。 |
| 2. | 抽出条件の検討 環境試料(底質試料等)ではASEで抽出した場合、抽出条件(特に使用する溶媒)により抽出されるダイオキシン類異性体の組成が異なることが報告されている10)。そこでASEの適用性を検討するにあたり、抽出温度と使用する溶媒について検討を行った。試料は乾海苔粉末20gを対象とし、抽出温度は100℃と150℃、抽出溶媒はn -ヘキサン及びアセトンとn -ヘキサンを等量混合したもの(以下アセトン・ヘキサン)で比較した(n =1)。 表1にダイオキシン類定量値、CS回収率をまとめた。得られた抽出液を濃縮乾固し、残留物の重量を求めたところ、三者に顕著な差は認められなかった。抽出溶媒の極性の違いは、目的成分のみならず夾雑成分(色素、脂肪成分等)の抽出率にも影響を与えるものと考えられる。しかし本実験条件下ではこれらに大差はなく、従って抽出後の硫酸処理や多層シリカゲルカラムクロマトグラフィーにおけるエマルジョンの生成や過度の着色等の障害は、いずれの試行においても認められなかった。 三つの抽出条件における定量値とCS回収率を比較してみると、A.抽出温度150℃の場合OCDD定量値が高い、B.100℃においてモノオルトPCBsの定量値が高い、C.100℃で一部の異性体のCS回収率が低い(PCB77及び81)、D.150℃/ヘキサンにおいてモノオルトPCBsのCS回収率が低い、等の傾向が認められた。また、150℃/アセトン・ヘキサンの試行でPCB 126の定量値が特に高めとなっている。しかし全般的にはTotal TEQ値及び平均のCS回収率は概ね一致した結果となった。 これらの結果より、抽出温度を比較的CS回収率の安定した150℃に設定し、以下の検討を行うこととした。また抽出溶媒については、一般的に殆どの食品が水分を含んでおり、アセトン・ヘキサンで抽出した際は、抽出液が水相と有機相の二相に分離するため脱水処理操作がやや煩雑となるが、食品試料と抽出溶媒との親和性を考慮し、安定した抽出効率を求めて、アセトン・ヘキサンを採用した。 |
| 3. | ASEと溶媒振とう抽出の比較 ASEと溶媒振とう抽出の繰り返し再現性試験を行った。試行数は各抽出方法についてn =4とし、同回数のブランク試験を並行して実施した。結果を表2に示す。 ダイオキシン類定量値の相対標準偏差(RSD)はASEで1〜37%の範囲であり、振とう抽出では1〜17%と、ASEでややバラツキが大きかった。ASEで最もRSDの大きいのはTeCDDであるが、検出限界値付近の低濃度であったためバラツキが大きくなったものと考えられる。このTeCDDを除いた場合、RSDは1〜19%の範囲となり、振とう抽出とよく一致した。 また、各異性体の定量値はASEの方が振とう抽出よりも全般的に高い傾向を示した。特に高塩素化物になるほど両者の差は顕著となった。これは、A.溶媒振とう抽出に対してASEでブランクの寄与が大きい、B.同様にASEの場合に妨害成分が十分に除去されず測定試料中に残存し、定量の精密性が悪化した、C.振とう抽出に対してASEの抽出効率が高く発揮された、などが原因として考えられる。 そこで両者のブランク試験の結果を比較したところ、検出される異性体はPCB77と118に限られ、両手法間でこれらのブランク値に顕著な差は認められかった。また、高分解能GC/MSにおけるクロマトグラム、特にロックマスクロマトグラムにおけるベースラインの変動や妨害ピークの出現はASE及び溶媒振とう抽出のいずれにおいても認められなかった。 図2は乾海苔試料を従来法で処理して得た高分解能GC/MSクロマトグラム(上段、A)、及びその抽出残渣をASEで再抽出して処理した場合のクロマトグラム(下段、B)の一例である。再抽出試料におけるクロマトグラムでは、添加した13CラベルOCDDに相当するピーク強度は非常に弱いものであるのに対し、ネイティブ体のピークは極めて明瞭で、従来法による初回抽出に匹敵する強度で検出された。このように再抽出試料においてダイオキシン異性体が観察されたことは、振とう抽出で目的成分が十分に抽出されていなかったことを示唆している。 但し、ASEの定量値が振とう抽出に対して高めになる傾向は、ほうれん草2検体及び大豆(粉末)1検体を用いて行った追試験では確認できなかった(表3)。乾海苔試料中のダイオキシン類は比較的強固に試料に吸着しているため、振とう抽出で十分に抽出できなかったものと考えられる。従って乾海苔における事例はASEの抽出効率が特に高く発揮された結果であり、ガイドラインに記載されている振とう抽出法の適用性を損なうものではないと考えられる。振とう抽出法は食品中の有機化学物質の抽出方法として一般的な手法のひとつであり、抽出効率に優れる加熱還流抽出と比較され、その抽出効率の同等性が示されている11)。 |
| 4. | 種々の植物性食品におけるCS回収率 ASEを種々の植物性食品試料(10種21試料)について適用し、ダイオキシン類毒性評価対象物質29異性体のCS回収率を求めた。その結果、回収率は45〜116%であり、いずれもガイドラインの要求事項である40〜120%の範囲内であった(表4)。 |
| D. | 結論 乾海苔の粉末を共通試料として、ASEと振とう抽出の定量値を比較した、定量値はASEで高めとなる傾向が認められた。このことは、振とう処理で抽出しにくい試料でも、ASEではダイオキシン類を高効率に、かつ少量の溶媒で迅速に抽出できることを示唆している。さらに、種々の植物性食品に対してASEを適用した結果、良好なCS回収率が得られ、ガイドラインの要求事項を満たしていた。 食品試料の成分組成(含水率、色素の量、脂肪含量等)は多様であるため、多くの種類の食品に当てはまる最適な抽出条件を探索することは容易ではない。従って抽出条件については検討の余地が残されているが、乾海苔を用いた試験で示唆されたように、ASEの優れた抽出効率は、性質の異なる様々な食品試料に対してフレキシブルに対応できるものとして有望である。食品中ダイオキシン類のモニタリング調査を行う上で、短時間(2時間→30分、従来比1/4)かつ少量の溶媒で(400ml→120ml、従来比1/3)抽出操作をすることが可能となり、廃液量の削減による環境負荷の軽減面でも、メリットは大きい。今後は動物性試料に対する適用性の確認が必要である。 |
| E. | 参考文献 |
| 1) | Bernard, A., Fierens, S., The Belgian PCB/dioxin incident: a critical review of health risks evaluations. Int. J. Toxicol. 21 (2001) 333-340. |
| 2) | Watt, J., TV asahi and the dioxin report stir up public anxieties. Lancet,353 (1999) 1337. |
| 3) | 石黒靖尚、岩本眞二:ダイオキシン類による環境汚染−大牟田川における事例−.第6回福岡県保健環境研究所成果発表会講演要旨集 (2001) 1-2. |
| 4) | Hori, T., Tobiishi, K., Ashizuka, Y., Nakagawa, R., Iida, T., Application of accelerated solvent extraction (ASE) and solvent cut large volume injection (SCLV) system for determination of dioxins in foods. Organohalogen compounds,55 (2002) 95-98. |
| 5) | Tobiishi, K., Hori. T., Kurokawa, Y., Ishiguro, Y., Iida, T., Comparison of solvent cut large volume injection (SCLV) system with conventional technique in dioxins analysis by HRGC-HRMS. Organohalogen compounds, 55 (2002) 179-182. |
| 6) | Richter, B. E., Ezzell, J. L., Knowles, D. E., Hefler, F., Extraction of polychlorinated-p-dioxins and poly chlorinated dibenzofurans from environmental samples using accerelated solvent extraction (ASE). Chemosphere, 34 (1997) 975-987. |
| 7) | 岸田真男、山本仁史、服部幸和:高速溶媒抽出を用いた底質中のダイオキシン類の分析、第12回環境化学討論会講演要旨集 (2003) 610-611. |
| 8) | Hashimoto, S., Shibata, Y., Tanaka, H., Yatsu, A., Morita, M., PCDDs and PCDFs contamination in the northern Pacific area reflected on squid liver tissues. Organohalogen compounds, 41 (1999) 413-416. |
| 9) | 氏家愛子、長船達也、佐藤信俊:高速溶媒抽出装置を用いたPCB抽出法の検討.第41回全国衛生化学技術協議会年会講演集 (2004) 74-75. |
| 10) | 飯村文成、佐々木啓行、津久井公昭、吉岡英俊、佐々木裕子:高速溶媒抽出法を応用したダイオキシン類の簡易迅速分析法の検討.東京都環境科学研究所年報 (2003) 145-152. |
| 11) | 豊田正武、堤 智昭、柳 俊彦、河野洋一、内部博泰、堀 就英、飯田隆雄:野菜中ダイオキシン類測定における振とう抽出法と還流抽出法の比較.食品衛生学雑誌、41 (2000) 316-320. |
| F. | 研究業績 |
| 1. | 論文発表
|
↓
|
| 図1 | 食品中ダイオキシン類の抽出及び精製フロー |
| 表1 | 高速溶媒抽出における乾海苔中ダイオキシン類の抽出条件の比較 |
| No. | 1 | 2 | 3 | |||||
| 抽出温度 | 100℃ | 150℃ | 150℃ | |||||
| 抽出溶媒 | アセトン・ヘキサン | アセトン・ヘキサン | ヘキサン | |||||
| TEF | 検出限界 (pg/g) |
定量値 (pg/g) |
CS回収率 (%) |
定量値 (pg/g) |
CS回収率 (%) |
定量値 (pg/g) |
CS回収率 (%) |
|
| 2,3,7,8-TeCDD | 1 | 0.01 | (0.009) | 78 | (0.008) | 76 | 0.011 | 68 |
| 1,2,3,7,8-PeCDD | 1 | 0.01 | 0.017 | 85 | 0.012 | 86 | 0.014 | 87 |
| 1,2,3,4,7,8-HxCDD | 0.1 | 0.02 | ND | 94 | (0.005) | 113 | (0.012) | 103 |
| 1,2,3,6,7,8-HxCDD | 0.1 | 0.02 | (0.015) | 84 | (0.012) | 116 | (0.017) | 111 |
| 1,2,3,7,8,9-HxCDD | 0.1 | 0.02 | 0.020 | 96 | 0.022 | 114 | 0.022 | 109 |
| 1,2,3,4,6,7,8-HpCDD | 0.01 | 0.02 | 0.31 | 79 | 0.34 | 120 | 0.35 | 118 |
| OCDD | 0.0001 | 0.05 | 1.8 | 100 | 2.6 | 117 | 2.6 | 120 |
| 2,3,7,8-TeCDF | 0.1 | 0.01 | 0.037 | 100 | 0.043 | 96 | 0.030 | 89 |
| 1,2,3,7,8-PeCDF | 0.05 | 0.01 | 0.029 | 85 | 0.036 | 83 | 0.021 | 82 |
| 2,3,4,7,8-PeCDF | 0.5 | 0.01 | 0.019 | 79 | 0.017 | 86 | 0.010 | 80 |
| 1,2,3,4,7,8-HxCDF | 0.1 | 0.02 | 0.028 | 87 | (0.019) | 93 | 0.020 | 91 |
| 1,2,3,6,7,8-HxCDF | 0.1 | 0.02 | (0.015) | 77 | (0.014) | 82 | 0.022 | 83 |
| 1,2,3,7,8,9-HxCDF | 0.1 | 0.02 | ND | 87 | ND | 97 | ND | 87 |
| 2,3,4,6,7,8-HxCDF | 0.1 | 0.02 | (0.013) | 84 | (0.016) | 89 | (0.009) | 85 |
| 1,2,3,4,6,7,8-HpCDF | 0.01 | 0.02 | 0.059 | 92 | 0.072 | 110 | 0.065 | 106 |
| 1,2,3,4,7,8,9-HpCDF | 0.01 | 0.02 | ND | 87 | ND | 107 | ND | 104 |
| OCDF | 0.0001 | 0.05 | (0.047) | 100 | 0.061 | 115 | (0.048) | 117 |
| 3,3',4,4'-TeCB(#77) | 0.0001 | 0.1 | 2.5 | 34 | 1.3 | 82 | 1.1 | 75 |
| 3,4,4',5-TeCB(#81) | 0.0001 | 0.1 | 0.40 | 25 | 0.15 | 65 | 0.16 | 68 |
| 3,3',4,4',5-PeCB(#126) | 0.1 | 0.1 | (0.068) | 70 | 0.32 | 73 | (0.059) | 68 |
| 3,3',4,4',5,5'-HxCB(#169) | 0.01 | 0.1 | (0.011) | 72 | (0.025) | 84 | (0.012) | 82 |
| 2,3,3',4,4'-PeCB(#105) | 0.0001 | 1 | (0.26) | 81 | (0.18) | 82 | (0.44) | 53 |
| 2,3,4,4',5-PeCB(#114) | 0.0005 | 1 | 8.8 | 90 | 4.9 | 88 | 4.9 | 69 |
| 2,3',4,4',5-PeCB(#118) | 0.0001 | 1 | (0.48) | 86 | (0.40) | 86 | (0.57) | 73 |
| 2',3,4,4',5-PeCB(#123) | 0.0001 | 1 | 4.0 | 81 | 2.2 | 78 | 2.2 | 72 |
| 2,3,3',4,4',5-HxCB(#156) | 0.0005 | 1 | (0.45) | 66 | (0.14) | 65 | (0.58) | 36 |
| 2,3,3',4,4',5'-HxCB(#157) | 0.0005 | 1 | (0.82) | 69 | (0.27) | 69 | (0.23) | 46 |
| 2,3',4,4',5,5'-HxCB(#167) | 0.00001 | 1 | 1.7 | 69 | (0.59) | 69 | (0.48) | 34 |
| 2,3,3',4,4',5,5'-HpCB(#189) | 0.0001 | 1 | ND | 57 | ND | 57 | ND | 43 |
| * | カッコ内は検出限界未満の当該ピークを参考値として定量化したもので、Total TEQの算出には加えていない。 |
| 表2 | 乾海苔試料を用いた高速溶媒抽出と振とう抽出のダイオキシン類定量値の比較(pg/g)* |
| 化合物 | ASE(n =4) | 振とう抽出(n =4) | a/b | ||||||||
| 範囲 | 平均a | RSD(%) | 範囲 | 平均b | RSD(%) | ||||||
| 2,3,7,8-TeCDD | 0.010 | - | 0.021 | 0.016 | 37 | 0.013 | - | 0.017 | 0.015 | 12 | 1.1 |
| 1,2,3,7,8-PeCDD | 0.011 | - | 0.017 | 0.014 | 19 | (0.009) | - | 0.013 | 0.011 | 17 | 1.3 |
| 1,2,3,4,6,7,8-HpCDD | 0.40 | - | 0.47 | 0.44 | 8 | 0.18 | - | 0.19 | 0.19 | 1 | 2.4 |
| OCDD | 3.1 | - | 3.5 | 3.2 | 6 | 0.95 | - | 1.1 | 1.0 | 7 | 3.2 |
| 2,3,7,8-TeCDF | 0.029 | - | 0.038 | 0.033 | 11 | 0.020 | - | 0.026 | 0.023 | 12 | 1.4 |
| 1,2,3,7,8-PeCDF | 0.023 | - | 0.029 | 0.027 | 9 | 0.017 | - | 0.023 | 0.019 | 15 | 1.4 |
| 2,3,4,7,8-PeCDF | 0.016 | - | 0.018 | 0.017 | 7 | (0.009) | - | 0.012 | 0.011 | 13 | 1.6 |
| 1,2,3,4,6,7,8-HpCDF | 0.075 | - | 0.076 | 0.075 | 1 | 0.033 | - | 0.041 | 0.037 | 10 | 2.1 |
| OCDF | 0.047 | - | 0.057 | 0.051 | 10 | 0.021 | - | 0.026 | 0.023 | 11 | 2.2 |
| 3,3',4,4'-TeCB(#77) | 0.99 | - | 1.0 | 1.0 | 5 | 0.87 | - | 0.90 | 0.88 | 5 | 1.1 |
| 3,4,4',5-TeCB(#81) | 0.15 | - | 0.17 | 0.16 | 2 | 0.12 | - | 0.14 | 0.13 | 1 | 1.2 |
| 2,3,3',4,4'-PeCB(#105) | 1.7 | - | 1.9 | 1.8 | 3 | 1.5 | - | 1.61 | 1.6 | 4 | 1.2 |
| 2,3',4,4',5-PeCB(#118) | 4.2 | - | 4.5 | 4.4 | 3 | 3.6 | - | 3.9 | 3.8 | 3 | 1.2 |
| * | 全ての試行において検出限界未満となった異性体は表示せず、比較していない。 |
| 表3 | 高速溶媒抽出と振とう抽出の同等性に関する追加試験結果(OCDD濃度、pg/g)* |
| 試料 | ASE | 振とう抽出 |
| ほうれん草A | 1.9 | 2.2 |
| ほうれん草B | 0.55 | 0.69 |
| 大豆(粉末) | 1.4 | 1.2 |
| * | 表2に示した比較試験で顕著な違いの認められたOCDD濃度について確認試験を行った。 |
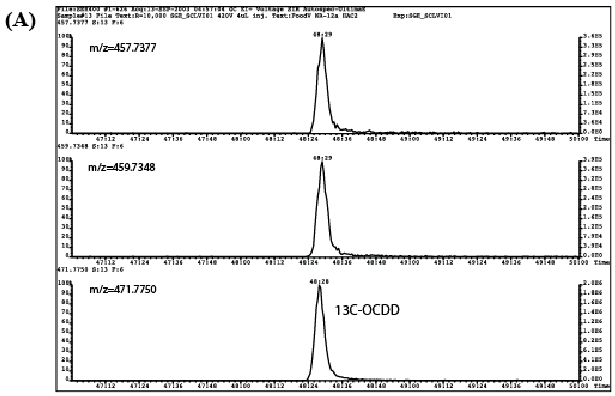
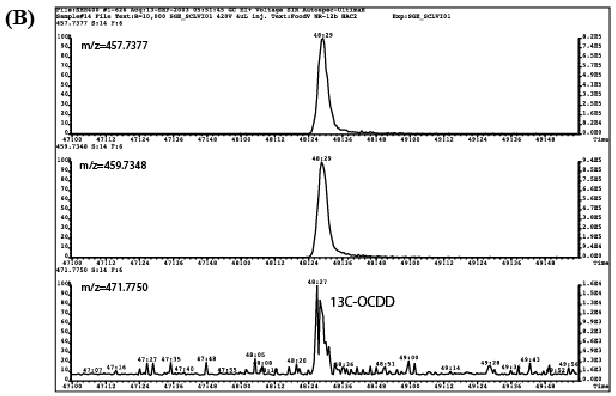
| 図2 | 乾海苔試料の高分解能GC/MSクロマトグラム(OCDD) (A)振とう抽出試料、(B)振とう抽出により得られた抽出残渣を高速溶媒抽出に供した試料 |
| 表4 | 高速溶媒抽出による植物性食品試料中ダイオキシン類のCS回収率(%) |
|