(類型)
| 資料1 |
1.暫定基準の設定
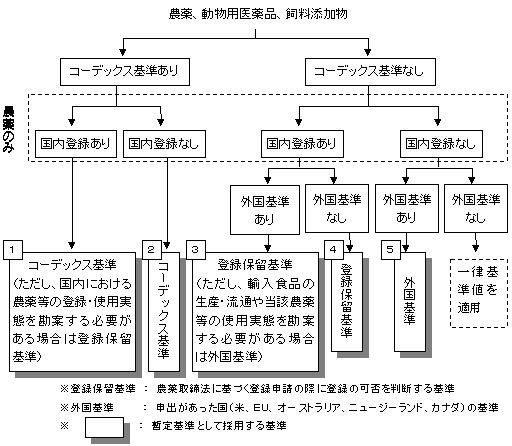
| (1) | 暫定基準の作成 暫定基準の設定にあたっては、(1)国際基準であるコーデックス基準、(2)国内の農薬取締法に基づく登録保留基準及び薬事法に基づく動物用医薬品承認時の定量限界のほか、(3)JMPR(FAO/WHO合同残留農薬専門家会議)及びJECFA(FAO/WHO合同食品添加物専門家会議)で科学的な評価に必要とされている毒性試験結果などのデータに基づき残留基準が設定されている諸外国の基準(米国、カナダ、欧州連合(EU)、オーストラリア、ニュージーランドの5ヶ国(地域))を参考に、別添1の設定フローに基づき、農薬、飼料添加物及び動物用医薬品の暫定基準を作成する。
なお、農薬等に該当するものであって食品に残留する成分が、いわゆる汚染物質等と同じものである場合には、自然に含まれるものについて過剰な規制とならないように必要な措置を講ずる。 その他、暫定基準の設定に際しての留意事項は別添2のとおり。 |
| (2) | 暫定基準の性格
暫定基準は、改正法第11条第1項(現行法第7条第1項)に基づく規格として、ポジティブリスト制の導入(改正食品衛生法公布後3年以内)と同時に施行する。 |
2.参考とした基準に関する情報
基準作成に際し、参考とした基準については以下のとおり。
| 国名(地域)等 | 分類 | 品目数 |
| 日本 | 農薬取締法に基づき登録保留基準が設定されている農薬 | 231品目 (平成15年6月現在) |
| 薬事法に基づき承認されている動物用医薬品等注1) | 132品目 (平成15年6月現在) | |
| コーデックス | 農薬 | 136品目 (平成15年6月現在) |
| 動物用医薬品等 | 43品目 (平成15年6月現在) | |
| 米国 | 農薬 | 327品目 (平成15年4月現在) |
| 動物用医薬品等 | 104品目 (平成14年4月現在) | |
| カナダ | 農薬 | 142品目 (平成15年6月現在) |
| 動物用医薬品等 | 61品目 (平成15年1月現在) | |
| EU | 農薬 | 157品目 (平成15年2月現在) |
| 動物用医薬品等 | 123品目 (平成14年11月現在) | |
| オーストラリア | 農薬・動物用医薬品等注2) | 417品目 (平成15年3月現在) |
| ニュージーランド | 農薬・動物用医薬品等注2) | 154品目 (平成14年12月現在) |
| 注1: | 我が国の薬事法により承認されている動物用医薬品については、承認にあたり、原則として残留しないことをその条件としていることから、暫定基準の設定にあたっては、農林水産省動物用医薬品担当課長から提示された各品目の定量限界値を参考とする。 |
| 注2: | オーストラリア及びニュージーランドにおいて設定している食品中の残留基準については、農薬及び動物用医薬品等の区別はされていない。 |
3.基準設定の具体例
暫定基準設定の際の主な類型は別添1のとおりであり、それぞれの具体例を別添3に示す。
4.基準設定対象食品分類について
従来の農作物分類についても「上記以外の○○○」の中から比較的摂取量が多い作物(1日摂取量が1g以上のもの)(別添3参照)であって、コーデックスにおいて分類があるものについては、分類として独立させるものとする。
なお、分類の追加については、ポジティブリスト制の施行に合わせる。
| [追加分類(摂取量)] | [従来の分類(変更後の摂取量)] | |
| チンゲンサイ(1.37g) | 上記以外のあぶらな科野菜 | ( 3.7g→2.3g) |
| にら(1.74g) | 上記以外のゆり科野菜 | ( 2.5g→0.8g) |
| たけのこ(2.05g) | 上記以外の野菜 | (13.3g→11.3g) |
6.暫定基準の見直し
今回設定する暫定基準については、ポジティブリスト制施行後、5年程度ごとに参考とした基準の変更に伴う見直しを行う。
これに加え、マーケットバスケット調査による農薬摂取量の実態調査等の結果に基づき、優先順位を付した上で、安全性試験成績を収集し、リスク評価に基づく基準の見直しを行うこととする。
7.その他
| (1) | 暫定基準は、上記1により設定するものであるが、意見聴取の段階等において、本基準の設定が要請される場合も想定される。 |
| (2) | 参考とする基準は現段階のものであり、告示までの間に新たな品目の追加・削除及び対象農作物等の追加・削除など、参考とする基準の変更も予想されることから、事務的に可能なもの(WTO通報、パブリック・コメント実施前が目途)については、暫定基準に反映させることとする。 |
| (3) | 平成16年春を目途に農薬等の残留基準設定の要請に関してガイドラインを示し、国外からの要請により、本基準を設定できるよう体制を整備する。 |
| (4) | 現在の抗生物質及び合成抗菌剤の規定(「含有してはならない。ただし、個別に規定されたものを除く。」)はそのまま残すこととするが、対象食品の範囲については整合性を図るものとする。(別添4参照) |
| 1-1 | コーデックス基準と登録保留基準があり、コーデックス基準を採用したの |
| 1-2 | コーデックス基準と登録保留基準があり、登録保留基準を採用したもの |
| 2 | コーデックス基準を採用したもの |
| 3-1 | 登録保留基準と外国基準があり、登録保留基準を採用したもの |
| 3-2-1 | 登録保留基準と外国基準があり、外国基準を採用したもの |
| 3-2-2 | 登録保留基準と外国基準があり、外国基準を採用するが、その平均値につき特別の取扱いをしたもの |
| 4 | 登録保留基準を採用したもの |
| 5-1 | 外国基準を採用したもの |
| 5-2 | 外国基準を採用するが、その平均値につき特別の取扱いをしたもの |
| 6 | 各分類ごとの食品の基準の整合性に配慮したもの |
| (1) | 複数の外国基準を参考とする場合には、その平均値を用いる。なお、数値が1以上のものは整数とし、数値が1未満のものについては、参考とする基準の有効数字に従うこととする。
| ||
| (2) | 複数の外国基準を参考とする場合であって、当該基準に大きな違いがある場合には、単純に平均値を採用するのではなく、そのばらつきを踏まえ適切な値を採用する。ただし、合理的な理由がある場合にはその事情を勘案する。 | ||
| (3) | 他の外国基準がない場合であって、EU等において検出限界値をもって基準を設定していることが明らかなものについては、我が国のポジティブリスト制においては一律基準値を適用することとし、暫定基準を設定しない。 |
4.各分類ごとの食品の基準の整合性について
穀類、あぶらな科野菜等の各分類ごとに、個々の食品等の基準の相互の整合性を考慮する。
| 改正案 | 現行 | ||||||||||||||||
|
|
||||||||||||||||
|
|||||||||||||||||